
7-3. 酸化剤と還元剤
こんにちは、おのれーです。
これまで、「酸化」や「還元」とはどのような反応で、反応の前後で物質自身がどのように変わるのかということに注目をしてきました。
今回は、自分自身ではなくて、物質が相手に対してどのような変化を与えているのかということに注目をして考えてみたいと思います。
■主語を変えると、見えてくるものが逆転する?!
酸化と還元を電子のやりとりに注目して考えたとき、
酸化とは、自らが電子を失うこと
還元とは、自らが電子を受け取ること
だと確認しました。これを、相手目線で言い換えてみると、どのように言い表すことができるでしょうか?
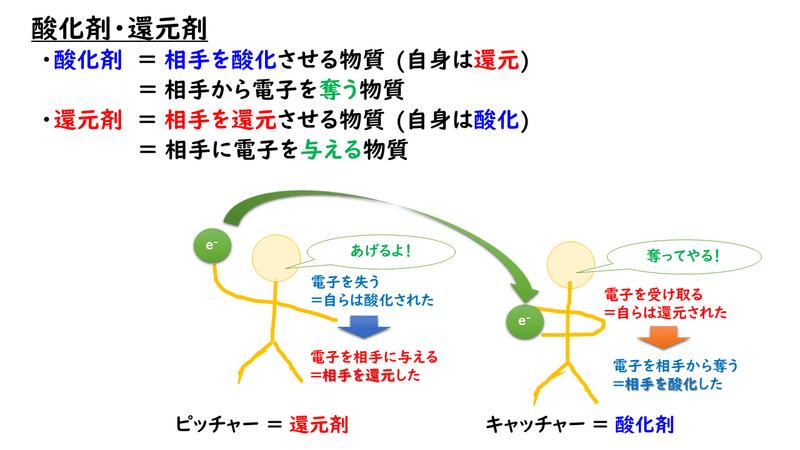
酸化とは、自らの電子を相手に渡すこと
還元とは、相手から電子を奪って自らが受け取ること
と考えることができます。
このように相手に対してどのようなことをしているのか、ということに注目して酸化還元反応を見たとき、相手を酸化した物質を酸化剤、相手を還元した物質を還元剤とよんでいます。
酸化剤は、相手を酸化していますが、自分自身は還元されています。逆に、還元剤は、相手を還元していますが、自分自身は酸化されています。このように、注目する物質を何にするかによって、立場が逆転するので、注意しましょう。
■酸化剤・還元剤の見分け方
酸化還元反応において、どの物質が酸化剤・還元剤としてはたらいているかを調べるためには、それぞれの物質中に含まれる原子の酸化数が、反応の前後でどのように変化しているかを見ればOKです。
その場合、酸化数が増えて(自らが酸化されて)いる物質が還元剤、減って(自らが還元されて)いる物質が酸化剤となります。
例をあげて見てみましょう。
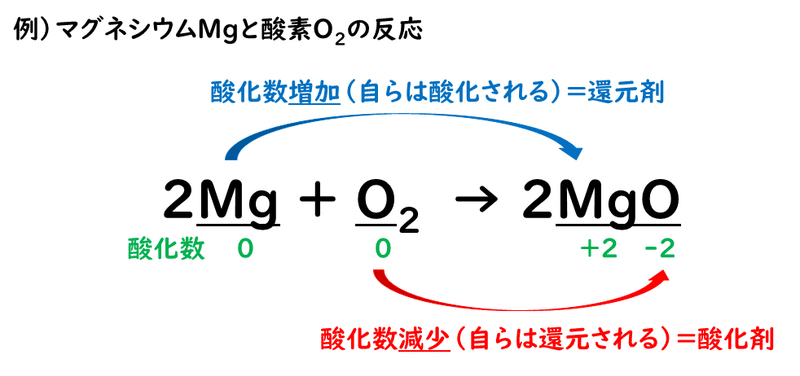
この場合、酸化数が増加した原子を含むMgが還元剤、酸化数が減少した原子を含むO2が酸化剤ということになります。
■酸化剤・還元剤のはたらきを式で表すとどうなるか?
ではここで、酸化剤や還元剤がどのようにはたらくのかを、反応式を使って表す方法を見ていきましょう。
酸化剤や還元剤のはたらきを表した式を半反応式(もしくは、電子を含むイオン反応式)とよびます。
なぜ「半」なのか。
前に学習したように、酸化と還元は同時に起こる反応です。というのも、酸化還元反応は電子のキャッチボールによって起こる反応なので、投げる担当がいれば、受け取る担当も必ずいます。したがって、酸化剤、還元剤単独で反応を完結させることはできないので、酸化剤だけ、還元剤だけ、の反応を表す式は、まだ半人前で1つの反応としては完結されたものではないからです。
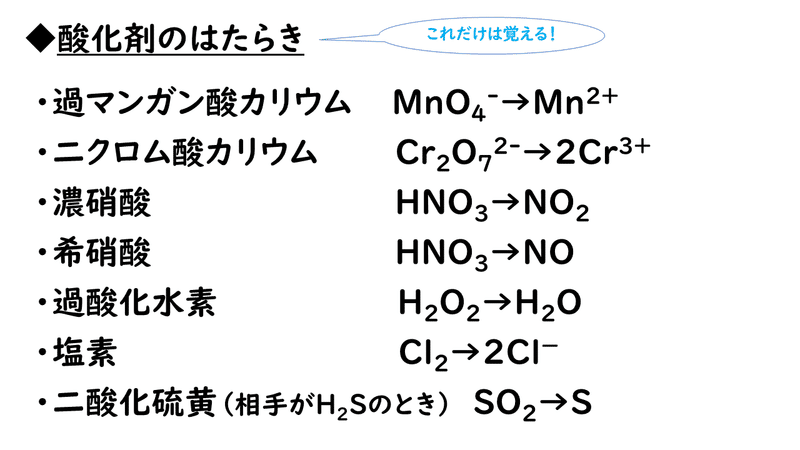
下にあげるのは、代表的な酸化剤・還元剤の半反応式です。酸化剤は電子を奪って自分のものにする物質なので左辺に電子があり、還元剤は電子を放出して相手に与える物質なので右辺に辺に電子があります。


■半反応式はすべて丸暗記する必要はない!
酸化剤・還元剤の半反応式は丸暗記しなくても大丈夫です。ただ、最低限以次にあげる変化は覚え、自分で半反応式をたてられるようにしておくことが必要です。その手順を確認していきましょう。

では、ここまで覚えられたとして、残りの部分はどのように完成させればよいのでしょうか。具体例を使いながら確認していきましょう。


化学は、覚えることは最小限に抑えて、覚えた知識を活用していく練習が大切な科目です。力業で暗記したものは、なかなか記憶に残りづらいと思いますが、理屈を分かって覚えることができたら、記憶に定着しやすいかと思います。このように、覚えなければいけないことと、応用が効くことを区別して学習することが、とても大切だと思います。
今回はここまでです。お疲れさまでした。
この記事が気に入ったらサポートをしてみませんか?
