
7-4. 酸化還元反応の量的関係
こんにちは、おのれーです。
前回は、相手を酸化する物質(酸化剤)と相手を還元する物質(還元剤)が、具体的にどのようなはたらきをするのか、半反応式で表す方法を確認しました。
今回は、酸化剤と還元剤がどのくらいの量ずつ反応するのか、というところに注目をしてみていきたいと思います。
■キャッチボールのボールの数は、過不足なく!
酸化剤 1 molが受け取ることのできる電子e-の数[mol]と、還元剤 1 molがあげることのできる電子e-の数[mol]は、種類によって決まっています。
なので、酸化剤と還元剤が電子のキャッチボールをしようとしたとき、やりとりする電子の数がつり合わないことがあります。
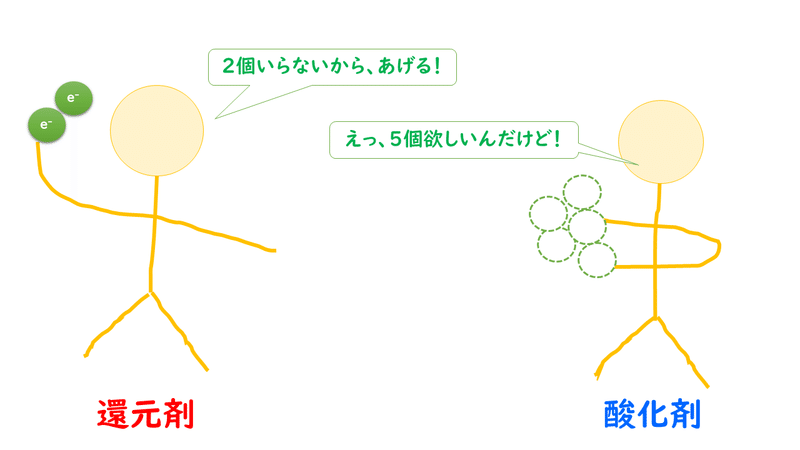
しかし、酸化還元反応とは電子をやり取りする反応ですから、反応が過不足なく起こるときには、還元剤が与える電子の数と酸化剤が受け取る電子の数は等しくなります。
では、どのようにして、やり取りする電子の数をそろえているのでしょうか?
正解は、酸化剤・還元剤のそれぞれを、電子の数が等しくなるように、何個かずつ連れてきているのです。
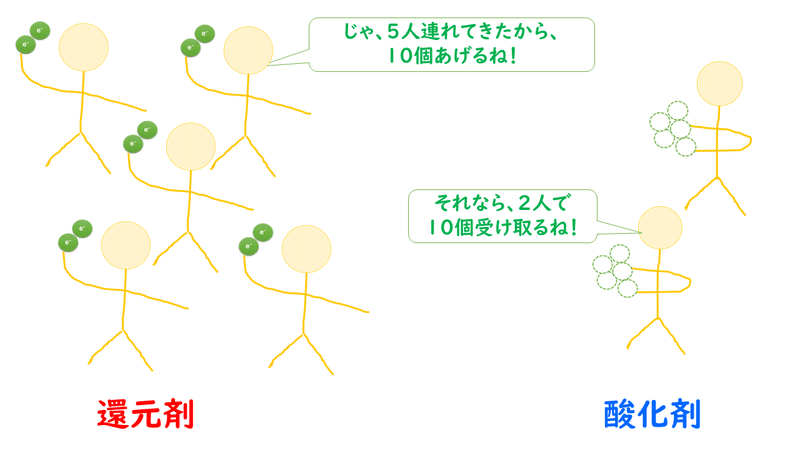
上の図のように、還元剤1個あたりが電子を2個だけあげることができて、酸化剤1個当たりが電子を5個受け取ることができると考えたとき、2と5の最小公倍数は10ですから、やりとりする電子の数が10になるように、酸化剤と還元剤をいくつかずつもってくるのです。
■半反応式+半反応式で、化学反応式を完成させる!
前回学んだ半反応式は、酸化剤・還元剤 単独の反応を表した反応式ですので、それだけでは半人前です。
酸化還元反応全体を表すためには、この半人前の反応式を足し合わせて、一人前の化学反応式にしてあげる必要があります。
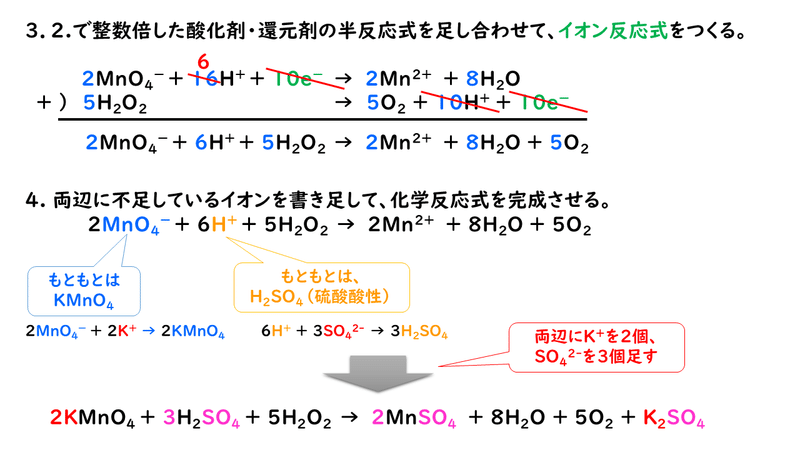
酸化還元反応の化学反応式を完成させるためには、次の3つのプロセスがあります。

では実際に、酸化還元反応の化学反応式を書いてみましょう。

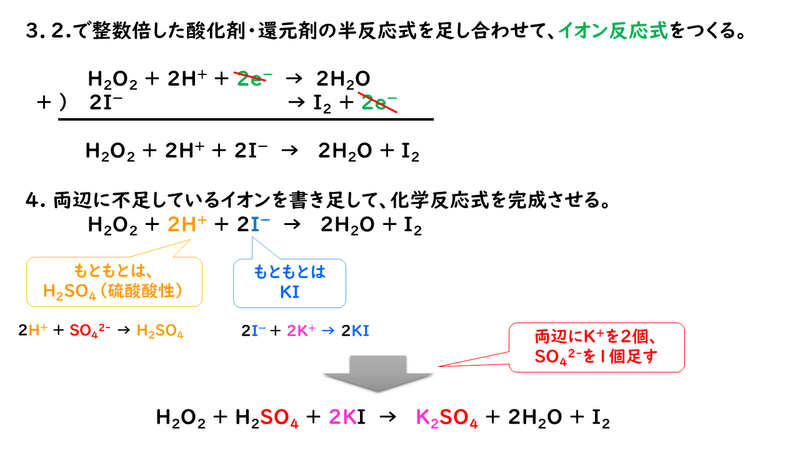
では、もう一題考えてみましょう。

■量的関係は、やっぱり「係数比=mol比」で考える!
このように、酸化還元反応では、酸化剤が受け取った電子e-の物質量と、還元剤が与えた電子e-の物質量は等しいので、この関係を利用して、使用した酸化剤や還元剤の量、または濃度が分からない溶液のモル濃度を求めることができます。このような操作を、酸化還元滴定といいます。
酸化還元滴定の問題は、酸化剤と還元剤の”係数の比”が分かればよいので、イオン反応式までつくってみれば、解くことができます。

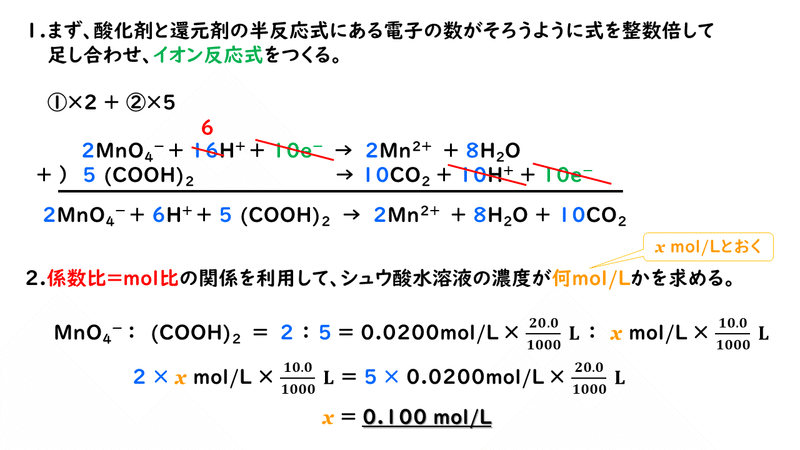
ここでは、イオン反応式をきちんと作ってから解きましたが、実際に試験中などは時間もないと思うので、「①×2+②×5」をするのだなということが分かって、酸化剤と還元剤の係数比が求められればOKです。
では、もう一題考えてみましょう。
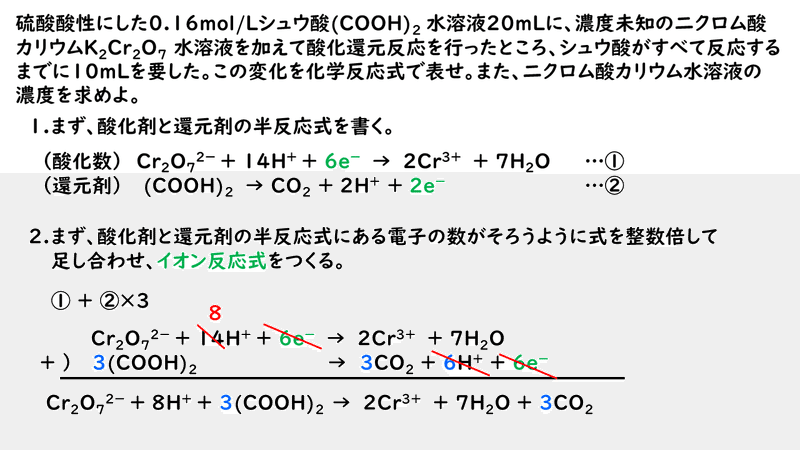

今回はここまでです。
結局のところ、酸化還元反応であっても、反応式の係数比=mol比が基本になるのですね。比で考える方法をマスターしておくと、いざ困った時にも役立つかと思います。
次回は、ちょっと話が変わって「金属イオンがどのようにしてできるのか」ということに注目をしてみたいと思います。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
