
1-5. イオンの生成
こんにちは。おのれーです。
前回は「電子配置」についてということで、電子たちは律義にルールを守る一方、化学変化はやんちゃな電子たちによって引き起こされているのだ、ということを書きました。
今回は、そのやんちゃな電子たちが原子に出たり入ったりすることでどんなことが起きるのかを見ていきたいと思います。
■目指せ!みんなの憧れ、貴ガス原子!
前回の記事で、ヘリウムHe、ネオンNe、アルゴンArなど、「貴ガス(希ガスともいう)」とよばれる元素の原子たちは、閉殻構造とよばれる、とても安定な構造を持っているため、他の原子とは反応しにくいということを書きました。
多くの原子たちにとって、この貴ガスの安定な構造がうらやましくてたまりません。みんな、何とかしてこの閉殻構造になろうとします。その一つの方法として知られているのが「イオンになる」という方法です。
イオンになるには、2つの方法があります。
下の図にあるように、貴ガス以外の原子は、閉殻構造と比べて、電子が余分だったり(左の凸原子)、不足していたり(右の凹原子)します。この余分な電子を外に放出したり、不足分の電子を補ったりすることで、原子が閉殻構造をとるようになった結果生じるのがイオンです。

電子は負電荷をもつ粒子なので、放出したり、もらったりすると、陽子の持っている正電荷とのつりあいがとれなくなり、イオンは全体として電荷を帯びた粒子になります。
では、具体的に見てみましょう。
1.価電子数が少ないの原子
価電子数が少ない(1~3個の)原子は、電子をもらってくるよりも、最外殻電子を全部放出して、内側にある電子殻をむき出しにした方が、手っ取り早く閉殻構造(=最外殻電子数が8個)にすることができます。
下に示すのは原子番号11のナトリウムNa原子がイオンになる様子です。

ナトリウム原子は、K殻に2個、L殻に8個、M殻に1個、全部で11個の電子を持ち、原子核に陽子を11個持っている原子です。このうちM殻の電子1個を放出することで、K殻に2個、L殻に8個、全部で10個の電子を持つナトリウムイオンNa+になるのです。
なぜ「+」になるのかというと、陽子(+)の数が11個なのに対し、電子(-)の数が10個になってしまっているからです。
+11-10=+1
ということで、ナトリウムイオンは全体として+1の電荷をもった粒子になります。このように、電子を放出して正電荷をもつようになった粒子を、陽イオンといいます。
このように、価電子数が少ない原子は、電子を放出して、近い原子番号の貴ガスと同じ電子配置を持つ陽イオンになりやすいという性質があります。
2.価電子数が多い(6~7)の原子
価電子数が多い(6~7個の)原子は、不足している分の電子をもらってきた方が、手っ取り早く閉殻構造(=最外殻電子数が8個)にすることができます。
下に示すのは原子番号17の塩素Cl原子がイオンになる様子です。
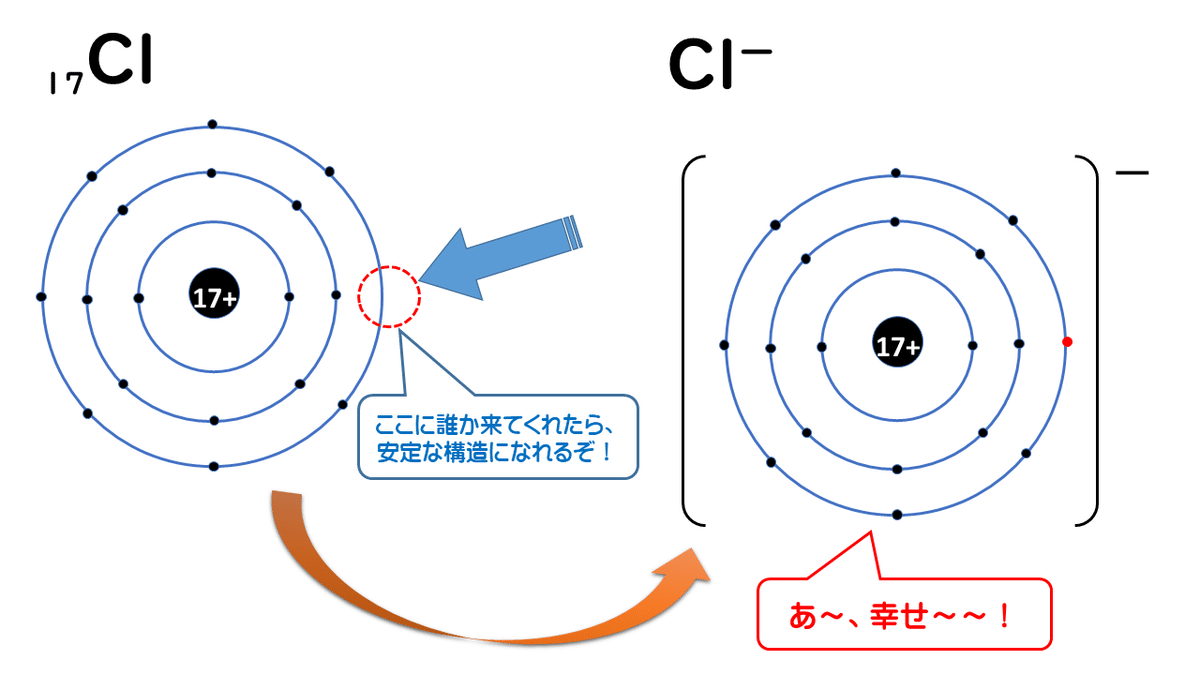
塩素原子は、K殻に2個、L殻に8個、M殻に7個、全部で17個の電子を持ち、原子核に陽子を17個持っている原子です。さらにM殻に電子1個をもらってくることで、K殻に2個、L殻に8個、M殻に8個、全部で18個の電子を持つ塩化物イオンCl-になるのです。
なぜ「-」になるのかというと、陽子(+)の数が17個なのに対し、電子(-)の数が18個になってしまっているからです。
+17-18=-1
ということで、塩化物イオンは全体として-1の電荷をもった粒子になります。このように、電子を受け取って負電荷をもつようになった粒子を、陰イオンといいます。
このように、価電子数が多い原子は、電子を受け取って、近い原子番号の貴ガスと同じ電子配置を持つ陰イオンになりやすいという性質があります。
■イオンを記号で表すには?
イオンを記号で表すときには、イオン式という式をつかいます。
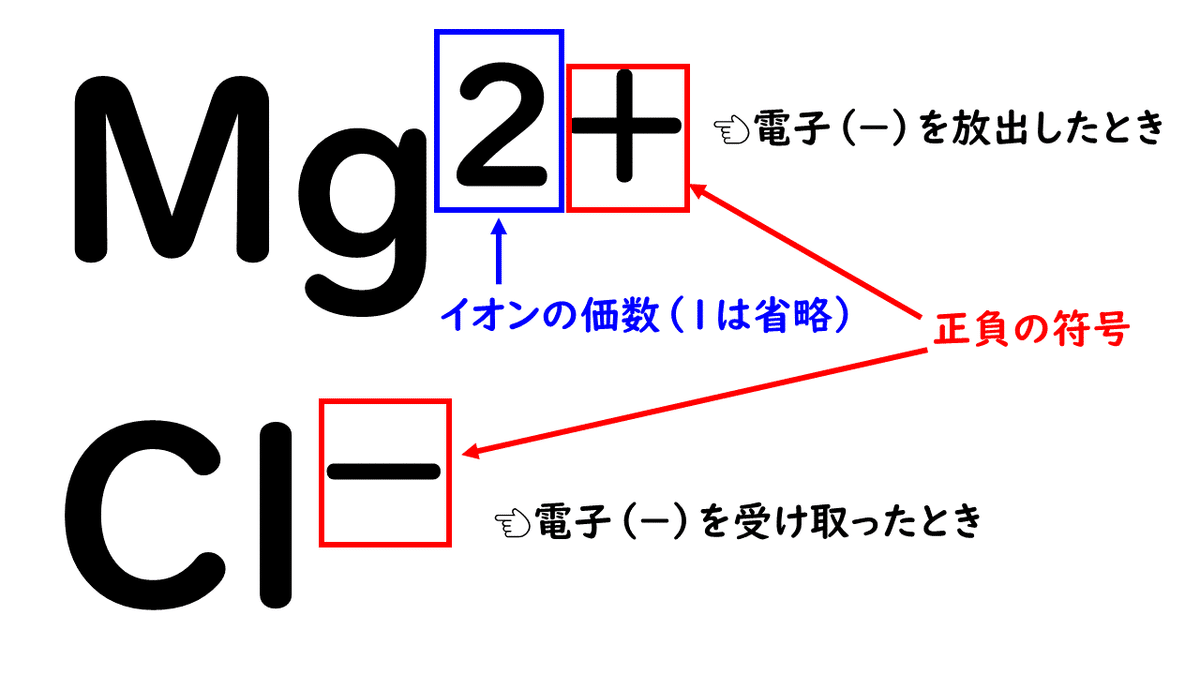
イオン式は、元素記号の右上に、そのイオンのもつ電荷の大きさを書いて表します。イオンの持つ電荷の大きさは、価数とよばれ、イオンができる時にやりとりした電子の数で表します。ただし、1は省略するという約束があるので気をつけましょう!
例えば、1個の電子(-)を受け取ったら、1価の陰イオンになりますし、2個の電子を放出したら、2価の陽イオンになります。
またイオンには、1個の原子が電子をやり取りしてできる単原子イオンと、原子の集まりが全体として電荷をもつようになってできた多原子イオンがあります。下に、よく登場するイオンを紹介しておきます。

ちなみに、イオンの名称についてですが、
・単原子の陽イオンの名称は、元素名に「イオン」をつける
・単原子の陰イオンの名称は、元素名の語尾を「~化物イオン」に変える
という約束があるので、気を付けてください。
■イオンになるためにはエネルギーが必要?!
さて、原子たちが、憧れの貴ガスの電子配置を目指してイオンになることは理解できたでしょうか?
でも、憧れの姿になるには、それなりにエネルギーがいるものです。
まず、原子が陽イオンになるときに注目してみましょう。
原子が陽イオンになるためには、原子核がもつ正電荷による引力を断ち切って、電子が原子の外に出て行く必要があります。このとき、電子はかなり強いエネルギーをもっていないと、外に出ていくことができません。

このように、気体状態の原子から電子1個を取り去って、1価の陽イオンにするために必要なエネルギーのことを、原子の(第1)イオン化エネルギーといいます。
イオン化エネルギーが大きいということは、陽イオンになるために必要なエネルギーがたくさんいるということなので、陽イオンにはなりにくいです。逆に、イオン化エネルギーが小さいということは、陽イオンになるために必要なエネルギーが少なくて済むので、陽イオンになりやすいです。
また、陽イオンになりやすい性質のことを陽性といいます。リチウムLi、 ナトリウムNa、カリウム Kなどの原子は、イオン化エネルギーが小さく、陽性が強い原子です。一方、みんなの憧れである貴ガスの原子は、イオンにわざわざなろうとはしないですから、イオン化エネルギーは大きく、陽性も小さい原子です。
次に、原子が陰イオンになるときに注目してみます。
原子が陰イオンになるためには、外から電子をもらってくる必要があります。電子をもらって閉殻構造に近づくと、原子はより安定な状態になりますので、価電子数が多い原子は、電子が欲しくて欲しくてたまりません。
「電子が欲しい」と思っているときの原子はエネルギーにあふれた状態ですが、電子をもらって安定な状態になると、エネルギーを放出して、落ち着いてしまいます。
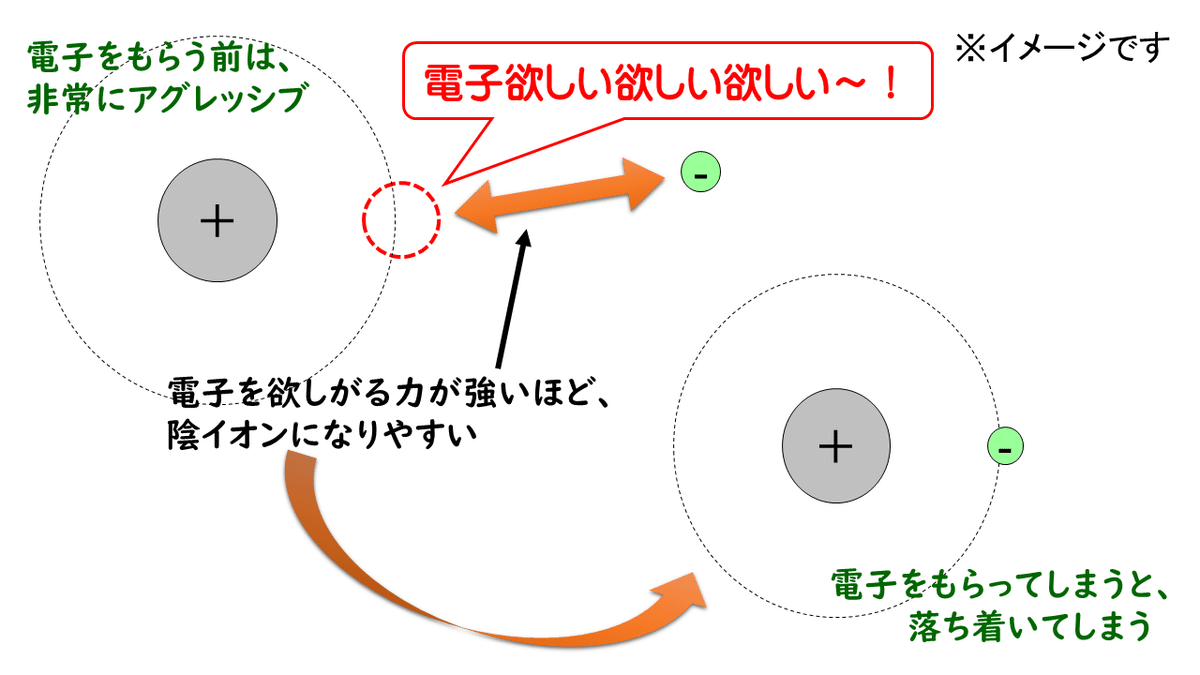
このように、原子が電子1個を受け取って、1価の陰イオンになるときに放出するエネルギーを原子の電子親和力といいます。ちょっと定義が分かりづらいと思うので、とりあえずは電子とどのくらい仲が良いか(親和性があるか)を表す値だと思ってください。
電子親和力が大きいということは、電子と仲が良いということなので、陰イオンになりやすいです。逆に電子親和力が小さいということは、電子と仲が悪いということなので、陰イオンになりにくいと考えてみると分かりやすいと思います。
また、陰イオンになりやすい性質のことを陰性といいます。フッ素F、塩素Cl、臭素Br などの原子は、電子親和力が大きく、陰性が強い原子です。一方、みんなの憧れである貴ガスの原子は、イオンにわざわざなろうとはしないですから、電子親和力はわずかにマイナスになるくらい小さいことが知られています。
今日はここまでです。
最後にワンポイントチェック
1.陽イオンと陰イオンはそれぞれどのようにしてできるか?
2.ここで紹介したイオン式と名称はすべて答えられるか?
3.イオン化エネルギーとは何か?また、イオン化エネルギーが小さい原子にはどのような特徴があるか?
4.電子親和力とは何か?また、電子親和力が大きい原子にはどのような特徴があるか?
さて、次回はこの章の最後、周期表についてです。周期表を理解すると、この先化学を学んでいくときに非常に便利です。それではお楽しみに!
この記事が気に入ったらサポートをしてみませんか?
