
3-3. 分子間力と分子結晶
こんにちは、おのれーです。
前回は、電子を欲しがっている原子どうしが互いに電子を出し合って、お互いの欲望を満たすことで結びつき、分子という粒をつくることを見てきました。
何とも微笑ましい原子たちの関係を見てきたわけですが、今回は、そうしてつくられた分子が集まってできている物質について考えていきたいと思います。
■実は、原子にも力関係が存在した!
前回、原子たちは互いに足りない電子を一緒に使って、助け合って幸せになるのだというお話をしました。これだけ聞くと、原子は平和でとてもいいやつなのですが、そんな原子にも実は力関係があります。
共有結合をしている原子間で、原子が共有電子対を引き寄せる度合いを数値で表したものを電気陰性度といいます。この値が大きいほど共有電子対を引き寄せる力が強いといえます。共有結合をつくったときに、原子間で綱引きをしたとしたら、どちらの方が強いか、という力関係だと考えてみて下さい。
ちなみに電気陰性度は、フッ素F、酸素O、窒素Nが特に強いことが知られています。周期表で考えると、右上にある元素の方が大きく、左下にある元素の方が小さいです。ただし、貴ガス(希ガス)は安定で他の原子と共有結合をつくることはないので、電気陰性度は定められません。
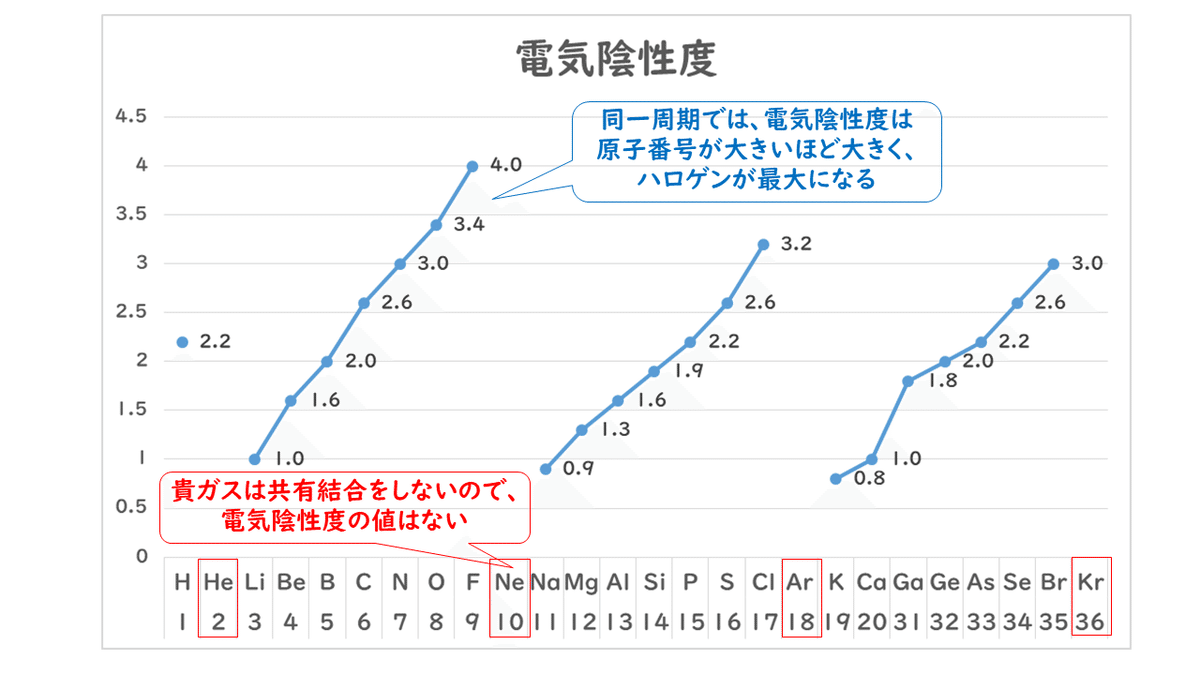
例えば、水素原子Hの電気陰性度は2.2ですが、フッ素原子Fの電気陰性度は4.0ですから、フッ化水素HF分子で考えると、共有電子対はよりフッ素原子の方に引きつけられます。電子は負電荷(-)をもっている粒子ですから、共有電子対(電子のペア)を引きつけたフッ素原子がわずか(δ)にマイナスの電荷を帯び、共有結合をもっていかれてしまった水素原子がわずかにプラスの電荷を帯びるようになります。このように、原子と原子の間で電荷のかたよりが生じていることを、「結合に極性がある」といいます。

■分子には形がある!
分子をつくるときには、原子間で共有結合がつくられます。したがって、分子をつくる原子の組合せによっては、分子内で電荷のかたよりが生じていることも少なくありません。
分子内で電荷のかたよりが生じている分子のことを極性分子、電荷のつり合いがとれている分子のことを無極性分子といいます。
極性分子か無極性分子かどうかは、結合に極性があるかどうかの他に、分子の形がどうなっているかということも原因になっています。
(1) 極性分子
極性分子になりうるものの特徴は以下の通りです。
・種類の異なる2つの元素からなる分子(直線形)
塩化水素HClなど、種類の異なる2つの元素からなる分子は、原子と原子の間で共有電子対の綱引きが行われ、電気陰性度の大きい方の原子に共有電子対が引き寄せられます。よって、分子全体で見たときも、極性を持っています。
・折れ線形の分子
水H2Oなど、中心にある原子の電気陰性度が大きく、両手にくっつけている原子の電気陰性度が小さい場合には、中心の原子が両手の原子を引き連れて歩いていくような状態となり、折れ線形を取ります。この形だと、電荷のつり合いがとれないので、分子全体としても極性をもったままになります。
・三角すい形の分子
アンモニアNH3分子のように、折れ線形の分子にもう1つ原子が寄ってきたような構造をとる場合も、電荷のつり合いが取れず、分子全体としても極性を持ったままになります。

(2) 無極性分子
一方、無極性分子には次のようなものがあります。
・種類の同じ2つの元素からなる分子(直線形)
水素分子H2のように、同じ原子どうして共有結合をしてできた分子は、綱引きをしても同じ力で引っ張り合うので、つり合いがとれます。したがって、無極性分子になるといえます。
・両側から同じ力で引っ張られている分子(直線形)
二酸化炭素CO2分子のように、中心にある原子の電気陰性度の方が小さくて、両手についている原子の電気陰性度が大きく、かつ同じ大きさであれば、両手を同じ力で引っ張られているわけなので、極性は打ち消され、全体としてつり合いのとれた無極性分子になります。
・正四面体形の分子
メタンCH4分子のように、中心の原子に対し、正四面体形の頂点に同じ原子が並んでいる分子の場合は、中心の原子が外側の原子を均一に引っ張っており、分子全体では電荷は打ち消され、無極性分子になります。

言葉や平面図で考えると難しいので、実際に2人~4人集めることができるのであれば、実際に引っ張り合いっこをしてみると、必然的にこれらの形をとるようになることが分かると思うので、もし許されればやってみて下さい。
■分子もイオンをつくる!
分子は、さらにイオンをつくることもあります。
イオンをつくる分子の特徴は、分子内に非共有電子対(他の原子と共有していない電子のペア)を持っているということです。
たとえば、水分子H2OやアンモニアNH3分子には、それぞれ非共有電子対があります。また、水素イオンH+は、もともと水素原子が1個だけ持っていた電子さえも放出してイオンになったため、電子を一つももたないイオンです。
このとき、それぞれの分子は、自分の持っている非共有電子対を、水素イオンに提供して一緒に使うようになります。このときにできる共有結合を特に配位結合とよんでいます。とはいっても、実際に配位結合ができてしまうと、他の共有電子対との見分けはつかないほど、自然に仲間になじんでしまうので気をつけましょう。

■分子どうしは微妙に引かれあっている!
では、分子があつまってできている物質はどのようにしてできているのでしょうか?
実は、分子と分子の間には、ファンデルワールス力とよばれる弱い引力がはたらいています。このファンデルワールス力は、分子量が大きければ大きいほど強くなり、小さければ小さいほど弱くなることが知られています。
ちなみに、「ファンデルワールス力(van der Waals force)」と板書したとき、「力(force)」をカタカナの「カ」と間違えて認識する人が多いので、気を付けましょう。
この他にも、分子どうしの間には、電荷のかたよりがある極性分子どうしの間に静電気的な引力がはたらいていたり、電気陰性度の大きい原子同士では水素結合とよばれるやや強い力によって結合していることもあります。
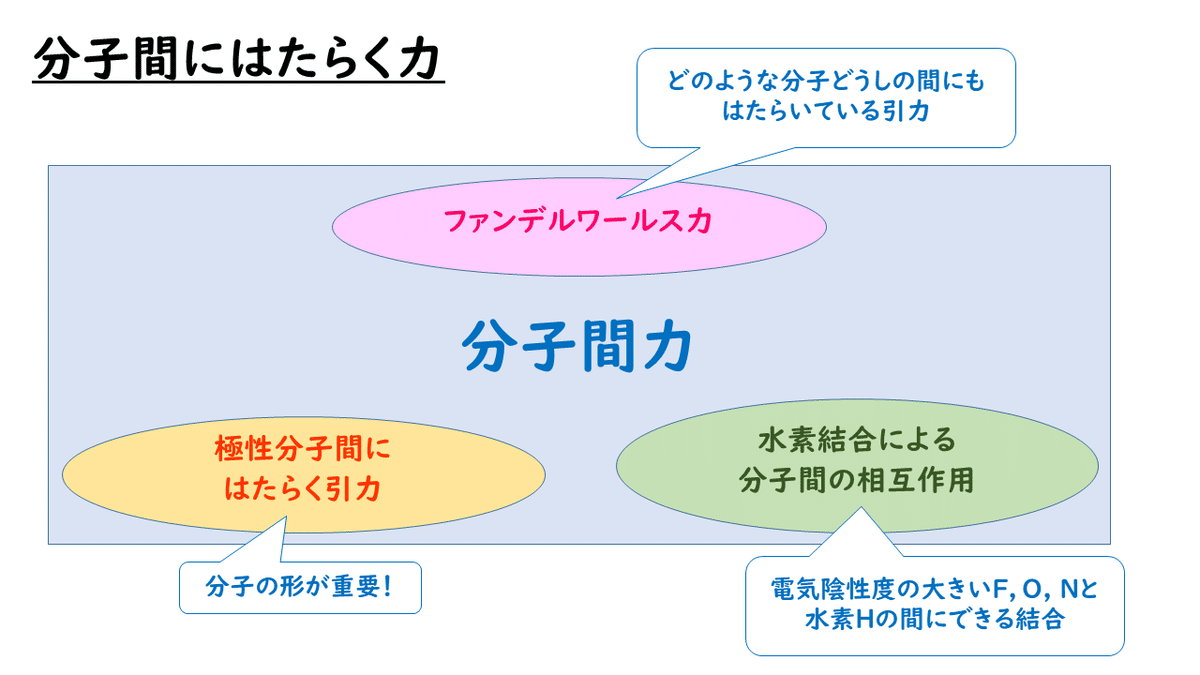
これの分子間にはたらく力をまとめて、「分子間力」とよんでいます。共有結合に比べると、かなり弱い力しか働かないですが、この分子間力によって分子たちが結合をし始めると、分子がたくさん集まってできた結晶(分子結晶)ができます。

このように、分子間力によって、分子が規則正しく並んだ状態にある固体のことを分子結晶といいます。
分子結晶には、ヨウ素I2や二酸化炭素CO2(ドライアイス)、水H2O(氷)などがあります。

分子結晶の特徴は、次の通りです。
(1) やわらかく、もろい
ドライアイスや氷は、ハンマーなどでたたくとすぐに割れます。分子間力はとても弱い力なので、力を加えると、かんたんに崩れてしまいます。
(2) 融点が低く、昇華しやすい
分子間力はとても弱い力なので、熱エネルギーを加えるとすぐに、液体を経ずに気体に変化してしまいます。アイスクリームを買ったときにつけてもらえるドライアイスが、家まで持って帰ってもビチョビチョにならないのは、ドライアイス(二酸化炭素の固体)がすぐに昇華して気体の二酸化炭素になってしまうからです。
(3) 電気を通さない
分子をつくる原子は、基本的に非金属元素ですので、電気は通しません。
今日はここまでです。
最後にワンポイントチェック
1.電気陰性度とはどのようなものか?
2.極性分子、無極性分子の特徴と具体的な物質の例をあげてみると?
3.分子結晶の特徴はどんなものか?
次回は、共有結合で結びついているくせに、分子をつくらない物質について見ていこうと思います。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
