
1-4. 共有結合の結晶の構造
こんにちは。おのれーです。またしても更新が遅れに遅れ、前回から2週間以上が過ぎてしまいました・・。
これまで「金属結晶」「イオン結晶」と見てきましたが、今回は「共有結合の結晶」について考えていきたいと思います。
なお、共有結合の結晶がどのようにできるかは"化学基礎"で学んでいますので、もう一度確認したい方は下の記事をご覧ください。
では、今回も始めていきます。
■ダイヤモンドの単位格子
共有結合の結晶は、結晶中のすべての原子が共有結合で限りなく連なっている構造をしています。その代表格ともいえるのが、ダイヤモンドです。
ダイヤモンドCは、炭素原子が4個の価電子を使って、4個の炭素原子と共有結合を形成しています。このとき、それぞれの炭素原子に結合する4個の炭素原子を結んでみると、正四面体形をしています。これが限りなく連なっているのがダイヤモンドの構造です。
このダイヤモンドの単位格子は、どのように考えればよいのでしょうか?
実はダイヤモンドの単位格子は、下の図のように、(i)で表される構造が4つと、(ii)で表される構造が4つが組み合わさってできている構造をしています。このような結晶構造は「ダイヤモンド型」と呼ばれており、同じ共有結合の結晶であるケイ素や二酸化ケイ素も同じような構造をしています。

この構造は、実は金属結晶の面心立方格子の中に、丸1個の原子が計4つ入り込んでいると考えることもできます(下図の黄色と赤色の原子が面心立方格子と同じ構造、緑色が丸1個の原子たち)。したがって、単位格子に含まれる原子の数は、次のように求められます。

ちなみに配位数は、最初に書いたように1つの炭素原子が4個の炭素原子と共有結合をしているという構造をしているので、「4」となります。
■単位格子と原子半径の関係
ダイヤモンド型の結晶格子についても、結晶の単位格子の一辺の長さが分かれば、そこから原子の半径を求めることができます。
では実際に、原子半径をr [cm]、単位格子の一辺の長さをl [cm]として、rとlの関係を調べてみましょう。
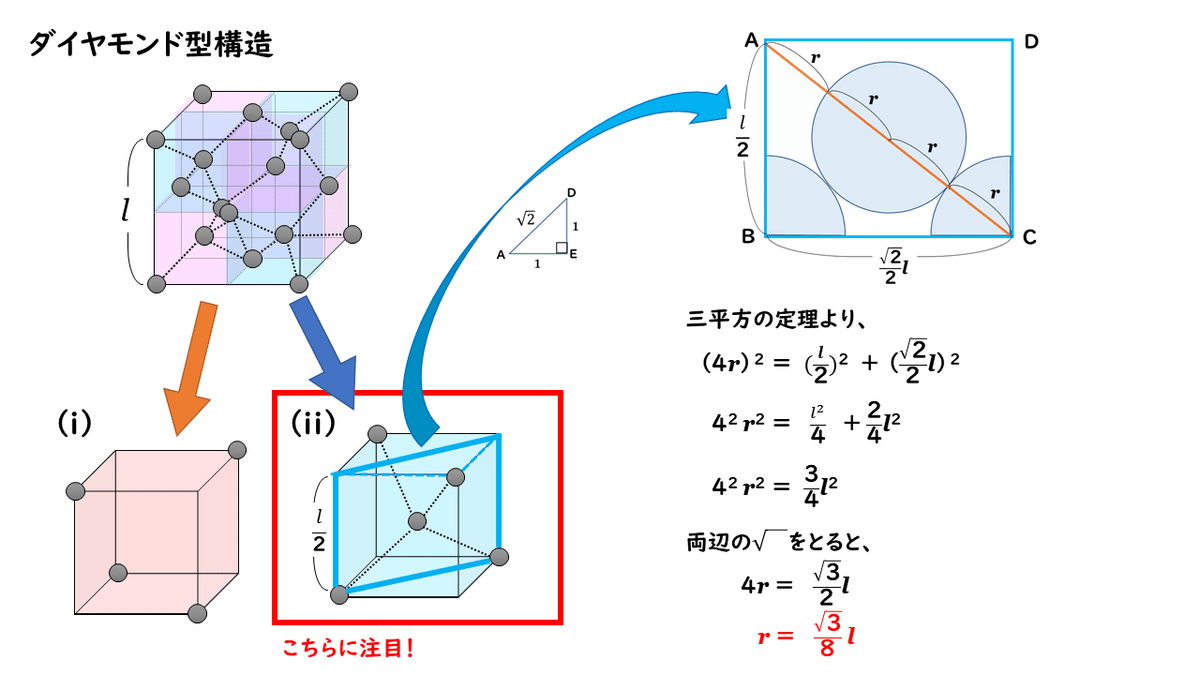
このように、ダイヤモンド型構造において、原子半径と単位格子の一辺の長さの関係を調べるときには、単位格子を8分割した小さな立方体の1個を取り出して考えます。これだけ分かっていれば、金属結晶のときと同じようにして求めることができますね。
■密度とアボガドロ定数
物質を構成する粒子をアボガドロ数個集めた単位を1molと呼び、化学の世界では、反応の量的関係を表すのに非常に重宝しています。
上の記事にも書きましたが、現在、この「1mol」の基準となっている「アボガドロ定数」は次のように定義されています。
6.02214076に10の23乗を乗じた数の要素粒子又は要素粒子の集合体(組成が明確にされたものに限る。)で構成された系の物質量
しかしこれは2019年5月20日から施行された新しい定義で、以前は次のような定義でした。
モルは、0.012 kgの炭素12に含まれる原子と等しい数の構成要素を含む系の物質量である。モルを使うときは、構成要素が指定されなければならないが、それは原子、分子、イオン、電子、その他の粒子またはこの種の粒子の特定の集合体であってよい。
この以前の定義において、アボガドロ数を正確に求めるために使われていた物質が、共有結合の結晶であるケイ素Siです。ケイ素はダイヤモンド型構造をとっており、きわめて純度の高い結晶を得ることができるため、正確なアボガドロ定数を測定するために用いられてきました。ちなみに、2011年に発表された、ケイ素の単体を用いた測定法で得られたアボガドロ定数の値は、
6.02214078×10^23 /mol
でした。現在の定義とほぼ同じ数値が得られていますね。
現在は新たな定義となり、アボガドロ定数の数字も確定しているので、もう測定することはないのかもしれませんが、先人の歴史を学ぶという意味でも、ここではどのようにしてアボガドロ定数を求めていたのかを考えてみたいと思います。


このように、単位格子の一辺の長さ、密度、原子量を正確に知ることができれば、アボガドロ定数を求めることができたのでした。
■不思議な物質、黒鉛
鉛筆の芯や乾電池の正極として用いられている黒鉛Cは、炭素原子が共有結合でたくさん結びついてできている構造をしており、ダイヤモンドCと同素体の関係にあります。しかし、ダイヤモンドの性質(無色透明で非常に硬く、電気を通さない)とは全く異なり、黒色をしており、やわらかく、電気を通すという性質を持っています。
この性質の違いはどこから生じているのでしょうか?
黒鉛は、各炭素原子が3個の炭素原子と共有結合を形成して正六角形の網目状の平面構造をつくり、この層がいくつも重なり合ってできています。さらに層と層は弱い分子間力だけで引きあっているため、うすくてはがれやすいという性質を持ち合わせます。

また、炭素原子の4個の価電子のうち、3個は平面構造をつくるために使われていますが、残りの1個の電子は、平面構造の中を自由に動くことができるので、金属のように電気をよく導くことができます。
したがって、黒鉛は共有結合の結晶でありながら、他の物質とは一線を画した性質をしています。これだけは別に覚えてあげるようにしてください。
では今日はここまでにしたいと思います。次回の更新は・・・あまり間が空かないように頑張ります!
最後にワンポイントチェック
1.共有結合の結晶を4種類あげなさい。
2.ダイヤモンド型構造の単位格子に含まれる原子数は何個か。
3.ダイヤモンド型構造の単位格子において、配位数はいくつか。
4.単位格子の一辺の長さと原子半径の関係を式で表すとどうなるか。
5.結晶の密度と単位格子の一辺の長さ、原子量から、アボガドロ定数を求める方法を説明できるか。
この記事が参加している募集
この記事が気に入ったらサポートをしてみませんか?
