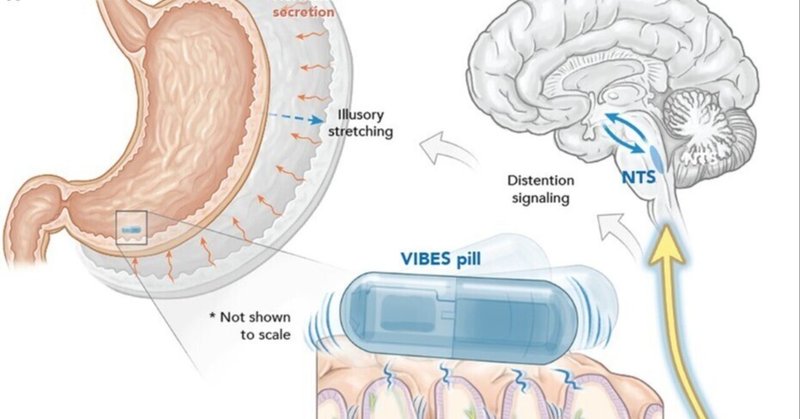
振動する摂取可能な生体電子刺激装置が胃の伸張受容体を調節し、錯覚的な満腹感をもたらす
広告
サイエンスサイエンス
ロゴ
VOL.9へ戻る 9, NO. 51
オープンアクセス
研究論文
エンジニアリング
シェアする
振動する摂取可能な生体電子刺激装置が胃の伸張受容体を調節し、錯覚的な満腹感をもたらす
https://www.science.org/doi/10.1126/sciadv.adj3003
SHRIYA S. SRINIVASAN HTTPS://ORCID.ORG/0000-0002-2508-1324 , AMRO ALSHAREEF HTTPS://ORCID.ORG/0000-0001-8813-2531, [...], AND GIOVANNI TRAVERSO HTTPS://ORCID.ORG/0000-0001-7851-4077 +9著者著者情報&所属
科学の進歩
2023年12月22日
9巻 51号
DOI: 10.1126/sciadv.adj3003
17,631
指標
総ダウンロード数
17,631
過去6ヶ月
17,631
過去12ヶ月
17,631
概要
はじめに
結果
考察
方法
謝辞
補足資料
参考文献と注釈
電子レター (0)
情報と著者
指標と引用
表示オプション
参考文献
メディア
テーブル
シェア
要旨
肥満症に対する効果的な治療法には、侵襲的な外科的・内視鏡的介入や患者の高いアドヒアランスが必要であり、肥満症患者が効果的に病気を管理することは困難である。胃メカノレセプターは胃の膨張を感知し、容積に依存した迷走神経シグナル伝達を行い、胃相を開始させ、満腹感に影響を及ぼす。本研究では、これらの胃伸張受容体を特異的に活性化し、機械的膨張に見合った迷走神経求心性反応を誘発する新しい管腔刺激様式を開発した。私たちは、機械受容体と脳卒中粘膜受容体を活性化するために内腔振動刺激を行い、セロトニンの放出を誘導し、摂食状態に見合ったホルモン代謝反応をもたらす摂食可能なデバイスであるVibrating Ingestible BioElectronic Stimulator(VIBES)錠剤を設計した。豚の 108 回の食事で VIBES を評価したところ、無処置の対照群に比べ、一貫して摂餌量が減少し(約 40%、P < 0.0001)、体重増加率が最小になった(P < 0.05)。メカノレセプター生物学の応用は、栄養障害に苦しむ患者を助ける我々の能力を一変させる可能性がある。
サイエンスアドバイザーのニュースレターを購読する
最新のニュース、解説、研究を毎日無料でお届けします。
はじめに
肥満の流行は、米国の成人の約42%に影響を及ぼしており(1, 2)、糖尿病、高血圧、がん、心臓病などの併存疾患の発生率を増加させることにより、医療資源をますます圧迫している(3, 4)。行動を修正することの難しさと薬物療法の限界を考えると、体重増加を効果的に減少させる代替法の必要性は依然として急務である。肥満手術は有効性が実証され、低侵襲の腹腔鏡手術(Roux-en-Yおよび腹腔鏡下バンディング)として発展してきたが、手術前後の生活習慣を改善するために大規模な治療を必要とし、治療を必要とする世界的な集団にとっては依然として費用がかかりすぎる(7400ドルと34000ドル)(5-7)。
迷走神経シグナル伝達は、食物摂取に反応して食欲不振性神経代謝分泌物が放出される負のフィードバックループを通じて、満腹感に重要な役割を果たしている(8)。食物の内容物による胃の膨張は、胃の筋組織を支配する迷走神経求心性の最も一般的なタイプである神経節内層終末(IGLE)によって伝達され、この神経節内層終末は収縮と膨張を感知する(9, 10)。これらの伸張性機械受容器は、短時間の迷走神経求心性シグナルを産生し、迷走神経求心性シグナルが終末し、報酬、エネルギー恒常性、空腹感、気分回路と相互作用する孤束路核(NTS)(11)の神経細胞活動を亢進させる(9、12)。その結果、NTSは代謝的・神経的な食欲不振シグナル伝達を引き起こし(13-15)、空腹感や満腹感を調節し、食物摂取量を変化させる(16)。このメカニズムは、組成[炭水化物、蛋白質、脂肪、生理食塩水(18)]に依存するのとは対照的に、主として容積に依存する(17)ため、胃内バルーン(IGB)を含む胃容積を操作する方法が、体重増加を最小限に抑えるための展開しやすいツールとして開発された(19)。
IGBは、胃の膨張を誘導して早期満腹感をもたらすように設計されている。IGBは、適応期には短期的な体重減少を可能にするが、10〜12週間後には空腹感や食行動の持続的な変化を促進することができず(20)、薬理学的療法や外科的療法と比較して優れた結果を示していない(19)。慢性的な膨張に対する神経の適応(摂食による周期的な膨張とは対照的)、および設置、除去、穿孔、閉塞の合併症は、IGBの長期的な有効性と安全性に課題を突きつけている(21, 22)。2016年以降、IGBを使用した患者における多数の死亡例を受けて、食品医薬品局(FDA)は警告を発し、一部の企業はIGB製品を回収した(23)。
より近位への介入として、局所的介入である迷走神経切開術と電気的迷走神経刺激(VNS)が、体重増加、食物摂取、甘いものへの欲求の減少、満腹感とエネルギー消費の増加と関連することが前臨床的に実証されている(12)。うつ病やてんかんに対して臨床的に実施された場合、VNSは体重増加の減少、甘いものへの欲求の減少、エネルギー消費の増加を示した。しかし、迷走神経の頸部レベルでの非特異的な軸索標的による非消化管(GI)副作用と代謝代償メカニズムが、肥満に対する臨床応用の普及を妨げている(24)。迷走神経切開術もかなりの効果を示したが(25)、その機序と副作用は不明であり、侵襲的な外科手術を伴うものである(26)。基本的に、現在の技術と神経シグナル伝達に関する理解では、VNSシステムは関連する軸索を特異的にターゲットにすることも、満腹感の基礎となる複雑な生理学的シグナル伝達を再現するためのパターン化された刺激を行うこともできない。
迷走神経代謝性の満腹感シグナル伝達において胃のメカノトランスデューサーが中心的な役割を担っていることを考えると(27)、メカノレセプターを選択的に活性化できるメカニズムおよび/または装置があれば、大きな臨床的価値がもたらされるであろう。骨格筋の伸張感受性紡錘線維における初期の実験では、振動が錯覚的な膨張を引き起こすことが示されている(28-30)。同様のメカニズムに従い、我々はこの概念実証研究において、胃の伸張受容体を選択的に活性化し、その反応を特徴付けるための振動刺激様式を考案した。我々は、胃平滑筋の最適化された管腔内振動が、胃の錯覚的な膨張を誘発し、迷走神経求心性信号と、摂食状態における機械的膨張から誘発されるものと同等の代謝反応を生じさせると仮定した(図1A)。これは、安全で使いやすく、摂取可能な装置であり、食前に一時的な、標的を絞った胃腔内機械刺激を行い、早期の満腹感を得ることができる。覚醒し、自由に動く豚において、VIBESは無処置の対照群と比較して、摂食量を減らし、体重増加率を最小化するという仮説を立てた。
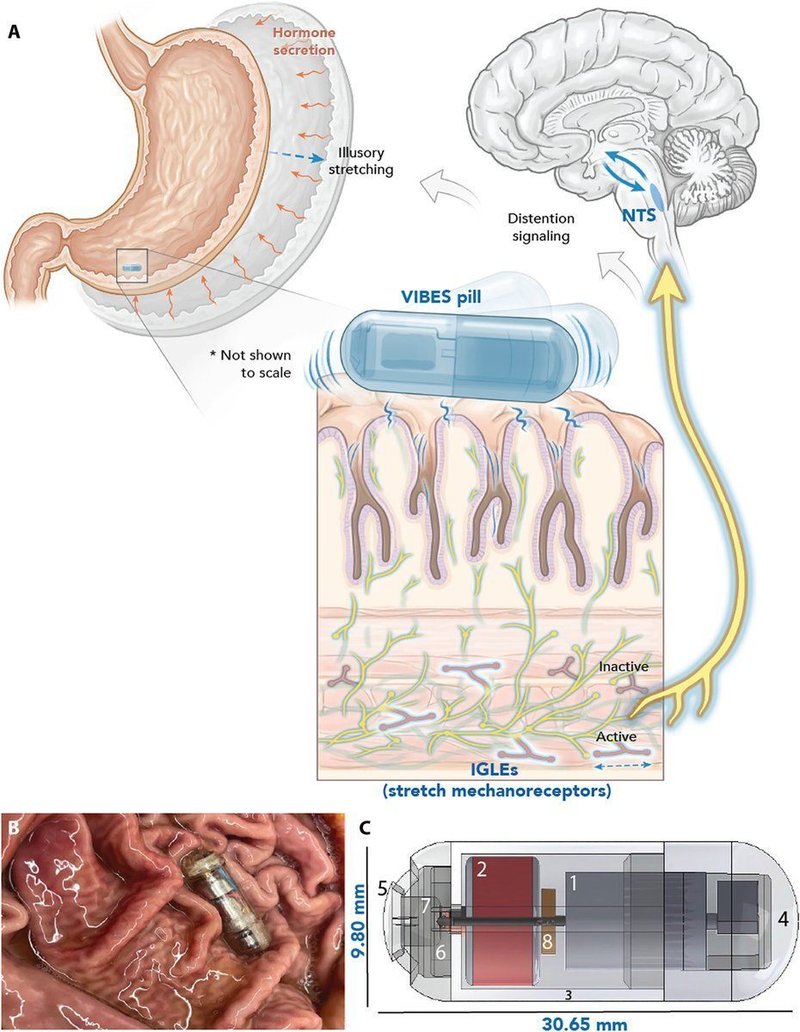
図 1. VIBESのコンセプトとメカニズム。
(A)振動式生体電子刺激装置(VIBES)は胃の内壁に接触し、胃液に触れると作動する。振動は腹腔神経叢の神経節内層終末(IGLE)を活性化し、NTSに膨張を知らせ、NTSは空腹回路と相互作用して、錯覚的な膨張を知らせる。(B)VIBESは豚の胃の胃絨毛の間に設置され、粘膜をなでながら刺激を与える。(C) VIBESピルは、(1)オフセットモーター、(2)酸化銀電池、(3)中心体、(4)モーターキャップ、(5)ピルキャップ、(6)ポゴピン、(7)ゼラチン膜、(8)抵抗器から構成される。原図はV.フルフォードによるもの。
結果
VIBES ピルの設計と特性評価
VIBESは、経口摂取が可能で、胃粘膜との接触が持続し、胃液に浸されると活性化し、胃IGLEを刺激するのに十分な振幅で一定時間振動し、消化管を安全に通過するように設計された。トリプルゼロカプセルの中にはゼラチン状の膜があり、胃液に浸漬すると4.3±1.2分で溶解し、バネ仕掛けのポゴピンが放出され、振動モーターを作動させる回路が完成する。錠剤の摂取と食道通過には一般に最大60秒かかることが知られており、錠剤が作動前に胃に到達するようになっている(31)。オフセットシャフトを持つモーターは、カスタムハウジング内に配置され、1.55V、80mA時間の酸化銀電池で駆動した場合、2~4mmの変位振幅を可能にする。
持続時間試験は、VIBES錠剤を胃液に浸し、柔らかい基質上で行った。VIBES錠剤の平均振動時間は38.3±1.83分であった(n = 5)。食事は一般に20~30分間に摂食され、胃内容物の一次混合は約1時間で行われるため、この時間範囲は許容範囲と判断された。システムが劣化したり、材料に脆弱性が生じたりしないことを確認するため、VIBES 錠剤を模擬胃液(pH 1.2)に 24 時間、模擬腸液に 10 日間、いずれも 37℃で浸漬する耐薬品性試験(「方法」に記載)を実施した。浸漬後、マクロスケールでもミクロスケールでも変化は観察されず、錠剤は培養期間後も正常に活性化できた(図S1)。したがって、VIBES 錠剤が胃に丸 1 日、腸に 1 週間以上滞留しても、消化管に損傷を与えることはない。周囲の組織環境に対する潜在的な加熱リスクを評価するため、熱試験が実施された。様々なモーター周波数で30分間作動させた結果、周囲の液体の変化は0.5℃未満であり、作動中の粘膜層に対する熱リスクはなかった(図S2)。
VIBESの性能研究には、胃の解剖学的構造がヒトと類似している豚モデル(生後4~6ヶ月の50~80kgのヨークシャー豚)を用いた。さらに、このブタは、生物医学的胃腸機器の評価に広く使用されている(32)。VIBES の錠剤の局在は、n = 10 匹の豚の内視鏡観察によって特徴づけられた。VIBES 錠剤は内視鏡的に胃腔に挿入され、最終的な位置決めが 30 分間に わたってビデオチャンネルで観察された。VIBES 錠剤は 0.04214 N の下向きの力を発揮し、密度は 2.019 g/cm3 であった。10回の試験すべてにおいて、錠剤は胃内容物(密度0.011~1.158g/cm3)を通過して沈下し、胃粘膜と安定に接触した(注S1)。胃の肛門および心窩部への局在は一般的であり、動物の位置に依存していた。いくつかの症例では、30分間の刺激の間に、錠剤が内膜に沿って移動するのが観察された。この30分間の間に、訓練された内視鏡医が空の胃の絨毛の密度をモニターし、胃腔容積の変化を推定した。すべての試験で、胃の容積に差は認められなかった。
すべての症例において、VIBESは投与後少なくとも30分間は消化管間移動運動複合体の位相性運動によって胃から排出されなかったことから、食前投与による膨張反応のために胃内滞留時間が延長される可能性が支持された。
胃の膨張をシグナルする伸張受容体の活性化
機械的膨張および振動刺激に応答する胃の神経シグナル伝達パターンを特徴づけるために(n = 4動物)、開腹後、胃心膜を支配する腹腔迷走神経の最大24枝の細線電気生理学的記録を行った。腹腔迷走神経は、胃から発生する信号を分離し、他の臓器からの標的外信号を軽減するために選択された。ベースライン記録では、小振幅の自発性スパイクと徐波関連スパイクが確認された。食物の摂取によって生じる膨張を模倣するため、内視鏡を用いて胃を最大容積の30、60、90%まで膨張させ、180秒間保持した(図S3)。神経活動がベースラインに戻るように、各気腹状態の間に5分間の休息を設けた。スパイクは6~10チャンネルのサブセットで観察され、気腹開始から10~12秒後に発現した(図2、AおよびB)。これらのチャンネルは、先行研究(10)と一致して、低閾値伸張感受性IGLEを支配する軸索に対応するチャンネルとした。スパイク振幅は、伸張開始時に高く、より高密度に集中し、その後、これらの求心性神経に関する先行研究(10)と同様に、ゆっくりとした順応速度(胃が順応するにつれて、膨張に基づく求心性神経が平準化する)を示した(図2B)。これはIGLEの既知のスパイキングパターン(図2A)と一致している(10)。胃内の気腹量を変化させることにより、膨張を調節した。
図2. 伸張感受性機械受容器の胃求心性電気生理学。
(A)気腹により胃腔(緑色)を胃体積の30、60、90%まで膨張させた。腹腔迷走神経枝から対応するENG(Electroneurographic)迷走神経反応を記録し、膨張に対するスパイクを示した。60、80、100Hzの振動刺激(青)では、同様の単調勾配のENG応答(黒)が得られた。ENG信号は可視化のために整流されている。(B)機械的膨張、(C)胃内のVibrating Ingestible BioElectronic Stimulator(VIBES)錠剤、および(D)両側迷走神経切開後のVIBES錠剤に反応する伸張感受性求心性線維からのENG信号。心拍数と呼吸のアーチファクトはベースライン時に存在する。(E)VIBESを介した周期的な振動により、伸張反応が繰り返し誘発された。(F)内視鏡ファイバーによる胃内腔の粘膜撫でと、(G)粘膜表面に対するVIBESピルの回転に対する求心性反応。電気生理学的トレースの下にある青いバーは、刺激がいつ発生したかを示す。
振動刺激によってこれらのIGLEが活性化され、同様の反応が生じるかどうかを調べるため、VIBESを用いて24~500Hzの振動数を胃内腔に加え、伸張感受性IGLEが活性化されたチャンネルの神経活動をモニターした(図S4)。ピルの接触面積は約298 mm2であるが、振動刺激は組織を伝搬し、30 cm先まで胃の筋膜を刺激する。
すべての試行において、機械的膨張時に観察されたものと同様のパターンで、64Hzから100Hzの周波数でスパイキングが観察された(図2C)。これらの周波数では、錠剤の変位の振幅は1mm以上であった。1mm以下の変位、35Hz以下または150Hz以上の周波数では、活性化は観察されなかった。信号振幅の変化は、機械的に活性化された求心性神経と同様に、ゆっくりとした適応を示した(図S5)。その後、両側迷走神経切開を行い、遠心性シグナルとフィードバックループの潜在的な交絡を排除するために、上記の結果を再現した。機械的気腹(図2B)、VIBES(図2C)、および両側迷走神経切開後のVIBES(図2D)からの生のスパイクパターンは、周波数スペクトルとコヒーレンスの点で高い類似性を示した。コントロール群とVIBES群で発生した信号の周波数スペクトルを比較すると(図S4)、支配的なピークは両群とも2904Hzで同一であり、振幅も同様であった。さらに、5つの最大のピークは両群で同じ周波数に生じた。さらに、VIBESとコントロールの求心性神経間のクロススペクトルコヒーレンスは0.0224であり、P値0.4426で統計的な差はなかった。平均信号の両側t検定も0.1のアルファ値で有意ではなかった。さらに、スパイクは繰り返し誘発することができ(図2E)、オンセットやプラトーの振幅は有意に減少しなかった(P < 0.05、n = 10)。これらの結果は、胃内腔振動が膨張に敏感な胃機械受容器の求心性神経活性化を誘導することを示唆している。
胃粘膜ストローク
膨張に加え、粘膜撫で刺激は胃機械受容体を誘発し、胃分泌活動を刺激する。胃粘膜の撫で回しは、このような受容体のスパイクを誘発することが知られている細いフィラメントを用いて、内視鏡を介して行った(図2F)。VIBES処理中、伸張によって活性化されていない軸索では、このような周期的バーストが観察された(図2G)。VIBESピルの表面形状が回転する際に胃粘膜を撫で、その結果、素早く適応する粘膜受容体からと思われる短い周期的バーストが生じたのかもしれません(11, 33)。粘膜を撫でると5-HTまたはセロトニンが放出されることが知られており(34-36)、この5-HTまたはセロトニンは、飽食シグナル伝達を行う迷走神経5-HT3受容体や、固有中枢反射および末梢反射を通じて蠕動運動、分泌、血管拡張、消化を調節する腸管5-HT4受容体に作用する。電気生理学的な結果を踏まえて、Franz cell apparatus(37)上の生体外組織を用いて、VIBESに反応するセロトニンの管腔分泌を測定した。その結果、0Hzの対照条件と比較して、80Hzの方が5-HT分泌レベルが最も増加した(図S6)。このデータと、100 Hzを超えるとVIBESピルが人間に聞こえにくくなるという不都合に基づいて、80 Hzが最適な動作周波数として選択された。さらに、表面接触を高めるためのスタッドやリッジなど、粘膜をより強くなでることができるように表面形状を変更した(図S7)。螺旋状のデザインは、直線状の表面や対照条件と比較して、管腔内のセロトニン放出を有意に増加させた(P < 0.05、スチューデントの両側t検定)。
VIBES の代謝効果
迷走神経求心性シグナルを介したVIBESの下流への影響を明らかにするため、摂食行動と満腹感に関連するホルモン分泌のプロファイリングを行った。VIBES 錠剤を投与した動物(n = 6、30 分から 60 分の間)と偽薬(n = 6)について、0 分、15 分、30 分、45 分、60 分、90 分、150 分に血液を採取した。その効果は、対照群とVIBES群間の刺激後のホルモンの平均値をα0.05で検定する両側異方分散t検定を用いて確認した(図3)。刺激後、錠剤は管内に留まり、自然に通過させた。対照動物が絶食状態でこれらのホルモンの期待されるレベルを示したのに対し、VIBESによる処置は「空腹ホルモン」であるグレリンの有意な減少をもたらした(P < 0.01)。グレリンの減少は通常、食後の反応であるが、VIBESで処理した絶食動物ではここで生じた(図3A)。さらに、インスリンレベルは、通常の食事摂取に見合った振幅と速度で有意に増加した(P < 0.01)(図3B)。血糖値を維持するグルカゴンは、対照群では増加したが、VIBES群ではベースラインのままであった(図3C)。インスリンの生合成に関連するC-ペプチド、インスリン分泌を促進するGLP-1、食欲抑制物質であるPyyのレベルは、刺激により有意に増加した(P < 0.01;図3、D〜F)。これらの傾向を総合すると、VIBESは人工的に膨満を知らせることで、胃相の代謝反応を誘導できることが示唆される。静脈カテーテルからのグルコースをVIBES投与前後30分間隔で測定した。群間で有意な変化は認められなかった(P < 0.01; Fig. 3G)。試験期間中に低血糖を示した動物はいなかった。
Fig. 3. VIBESによる胃迷走神経求心性神経の調節は、錯覚的な代謝性満腹感をもたらす。
(A)30分から60分の間、VIBES(Vibrating Ingestible BioElectronic Stimulator)刺激中の血液サンプリングの実験概略図。 (B~G)刺激なし(緑)とVIBES(青)の動物におけるホルモン反応をベースライン値で正規化したもの。個々の被験者のトレースを示し、グループ平均を太字で示す。矢印はコントロール群とVIBES群で観察された傾向を示し、動物およびヒトの食後における既知の傾向を表す。星印は、曲線下面積の差がP < 0.05で有意であることを示す(スチューデントの両側t検定)。
VIBES による摂食量の減少
空腹感と摂食行動に対する VIBES の影響を調べるため、4 頭の豚の摂食量を、無処置の場合 (対照群) と、経皮内視鏡的胃瘻造設 (PEG) チューブを通して VIBES を投与した場合 (VIBES 群) の少なくとも 24 回の食事についてモニターした。PEGチューブの潜在的な影響を考慮し、大きさと年齢が一致したPEGチューブを持つ4匹の動物もモニターした(PEG対照群)。繋留は10~15cmの非常に柔軟なテザーで行い、VIBESが胃の周囲を自由に掻爬できるようにした。内視鏡観察において、テザー接続された VIBES は、自由に浮遊するカプセルと比較して、接触、振動、機械的な力の伝達、および/または胃粘膜の撫で方に違いは見られなかった。午前7時30分と午後3時30分の食事時間の30分前に刺激を行った。さらに、午前11時から午後12時の間にリンゴ5個のおやつを与えた。動物には自由摂取させたが、提供後最初の30分間で消費された食物の割合を測定し、与えられた食事の摂取量とした。
VIBES群、PEG対照群、および対照群の食事摂取量の平均割合とSDは、それぞれ58.1±10.7(n=108食)、84.1±4.5(n=100食)、78.4±4.5(n=96食)であった。VIBES群の摂取量は、PEG-対照群およびコントロール群よりも有意に低かった(P<10-20、Studentの両側両側t検定;図4A)。PEG対照群と対照群との間には有意差はなく(P>0.05)、PEGチューブの存在自体がVIBES治療中に見られた有意差に影響を及ぼさなかったことを示している。各群の摂取量の分布をコルモゴロフ・スミルノフ検定を用いて比較し、VIBES介入の効果をさらに特徴付けた。VIBES群と対照群の間では、P値6.0103×10-7は、累積分布関数(CDF)間の最大垂直距離が0.4232で、分布が有意に異なることを示している。しかし、PEG-対照群と対照群の間では、P値は0.055、CDF間の最大距離は0.2119で、これらの分布に有意差はないことが示された(図S16)。動物 1 頭あたりに換算すると、VIBES 処理により摂取量は有意に減少し(すべてのケースで P < 0.001、Student の両側両側検定ホモ分散 t 検定)、その平均は通常の摂取量の 31%であった。VIBES を投与した各動物の 1 食あたりの消費エネル ギーも対照群より有意に低下した(すべてのケースで P < 0.001、Student の両側 両側棄却 t 検定;図 4C)。しかし、消費エネルギーには、PEG対照群と対照群との間に有意差は認められなかった(P < 0.1、スチューデントのt検定)。24回の食事期間中、摂取量の適応や傾向は観察されなかった。処置の潜時および潜在的な長期効果を評価するため、豚を3食処置し、その後の3食は無処置、最後の3食を処置するクロスオーバー試験デザインを用いた(図4D)。その結果、無処置群では摂取量が38%急増し(平均摂取率、処置群=51%、無処置群=89%)、VIBESは時間的迷走神経活性化によって機能し、神経適応や長期的な影響はほとんどないことが示唆された。また、ピアソンの相関係数を用いて、各被験者の試験期間中の摂取量の傾向を分析した。どの群においても、摂取パターンに有意な傾向を示した動物はいなかった(α=0.1)。このことはさらに、VIBES 療法に慣れや適応がないことを示している。VIBES投与期間中の体重増加率は、対照期間よりも有意に低かった(VIBES対PEG-対照: P<0.03、スチューデントの両側対のt検定;図4E)、対照群よりも有意に低かった(VIBES対対照:P<0.01、スチューデントの両側異分散t検定)。これらのデータを総合すると、VIBES錠剤は大型動物モデルにおいて、摂食量を有意に減少させ、体重増加の速度を遅らせることが示唆される。
図4. 摂食と体重増加に対する VIBES の効果。
(A)振動式生体電子刺激装置(VIBES)群、経皮内視鏡的胃瘻造設術(PEG)対照群、および対照群における豚の摂食率。(B)動物 A、B、C、D が VIBES を投与した 2 週間と無処置(対照)の 2 週間で消費した食事の割合。(C) VIBES、PEG-対照、または無処置(対照)で 2 週間飼育した動物 A、B、C、D の各食事で消費したエネルギー(点)。バーは中央値と四分位数を表す。(D)VIBES投与、無投与、VIBES投与の3食を連続させたクロスオーバー試験デザインにおける動物A(緑)、B(灰色)、C(青)の消費量。(E)VIBESを投与した場合の各動物の体重増加率は、PEG対照群および対照群では無投与の場合よりも有意に低かった(P < 0.05)。(F)動物が各カテゴリの行動に費やした時間。菱形は外れ値を示す。(G)対照群と(H)VIBES群の各行動に費やした時間の割合。
ラベル付けされた連続12時間の日中データ(午前7時から午後8時)で学習させた画像ベースのディープラーニングモデル(精度94%)を用いて、予備的な行動研究を実施した。これを用いて、VIBES投与条件またはPEG対照条件における4頭のブタ被験者の96時間のラベルなし昼間ビデオデータを解析した。表1に示した4つの行動のそれぞれで費やされた時間を、対照条件と処理条件における発生回数、時間、確率の観点から分析しました。4つの行動(活動、摂食、飲水、非活動)すべてにおいて、VIBES条件とPEG-対照条件では有意差があった[F, P < 0.001, 二元配置分散分析(ANOVA); 図4F]。交互作用効果は有意ではなく(P < 0.01)、それぞれの行動に対する反応が独立して有意であったことを示している。特筆すべきは、VIBES群では活動的な行動に費やす時間が有意に短かったことである。このような身体活動および採食の減少は、実験ブタにおける食後の満腹感を反映することが報告されている(39)。VIBES投与群では、PEG投与群に比べ、食後の代謝状態が良好で、食餌摂取量も平均して少ないことから、血糖値の低下に伴い、食後の非活動的行動が増加する可能性があると考えられた(39, 40)。そこで、1時間ごとに行動を分類した(図4、GとH)。時間単位でみると、VIBES条件とPEG対照条件では有意差があった(F, P < 0.001, 二元配置分散分析)。さらに、非活動的行動の確率はVIBES群で有意に高く、特に食後に高かった(午後2時、午後5時ではP < 0.001、午後7時ではP < 0.01)。
一般カテゴリー 行動タイプ 行動内容
不活発 睡眠 動かず、立たず、目を開けている。
休息 動かず、立たず、目を閉じている。
摂食 自由摂食 頭を餌入れに入れ、咀嚼する。
ペディアライト 生体内チームが電池交換/ 包帯固定をしている間、ケージのドア越しにペディアライトを飲む:頭がボトルに触れる
水飲み 水飲み口に頭をつける
アクティブ ぶら下がったおもちゃのボール 頭部または体がぶら下がったボール に触れる
ぶら下がる歯車 頭または体が歯車に触れる
自由に動くおもちゃ 頭や体と触れ合う;動く
ウッドチップを引っ掻く/根こそぎ取る ウッドチップをつついたり、鼻で動かしたりする
ケージの壁を引っ掻く、または登る ケージの壁に体を起こして触れる
研究者とのインタラクション 触れる、鼻をつける、 研究者から餌をもらう
表1. 行動分類
安全性と生体適合性
盲検化された内視鏡医が胃の粘膜を評価し、内視鏡検査中に炎症、変性、形態学的変化、その他ピルによる潜在的な悪影響がないか、対照動物(n = 6)およびVIBES動物(30分間の刺激を1回投与)(n = 6)で調査した。いずれの群でも異常は認められなかった。VIBESを2週間毎日(1日2回)使用した後でも、胃腔の内視鏡検査で擦り傷、刺激、炎症は観察されなかった(動画S1およびS2)。さらに、摘出後の組織の固定切片をヘマトキシリン・エオジン染色しても、形態異常、刺激、炎症は認められなかった(図S8)。
運動性および通過安全性への潜在的影響を評価するため、動物には偽薬(n = 3ブタ)またはVIBES錠剤(n = 3ブタ)を、小型の放射線不透過性バリウムペレットのセットとともに与えた。2日ごとにX線撮影を行い、すべてのバリウムペレットが排出されるまでの期間を測定した(図S9)。VIBESを用いた動物では、豚は平均4.3日(範囲:4~5日)ですべての錠剤を通過したが、対照動物では偽薬の通過に8.3日(範囲:7~9日)を要した(表S1)。さらに、本試験の全試験期間中、獣医スタッフは毎日、摂取量、健康状態、糞便排出量、嗜眠、鼓腸、および不快感や疾患のその他の行動徴候の変化を監視した。投与された動物に副作用や不快感は観察されなかった。実験群および対照群のどの動物においても、便の質や下痢の変化は観察されなかった。これらのデータから、VIBES は運動性に悪影響を与えないことが示唆された。すべての試験で、動物は閉塞、穿孔、苦痛の兆候なしに錠剤を通過させることができた。
胃液のpHを生体外Franz cell装置を用いてモニターし、VIBESが胃液に有意な変化をもたらすかどうかを評価した。実験群の20分間の刺激後、胃液のpHは、Studentの両側不均一分散t検定を用いて、未処理の対照群と有意差はなかった(各群n = 6サンプル)。対照群と実験群のpHの平均値とSDは、それぞれ1.265±0.03と1.260±0.029であった。電気生理学および5-HT反応によって示されたように、VIBESはおそらく5-HT3受容体を活性化し、膵臓分泌、食事終了、早期満腹感、食欲調節などの重要な消化管機能を誘発する。
しかし、5-HT3が過剰に活性化されると、吐き気や嘔吐が起こることが知られている(41)。したがって、すべての動物は治療中、4~6人のスタッフにより日中定期的に、また日中および夜間24時間連続ビデオ録画によりモニターされた。どの動物にも苦痛、嘔吐、下痢の徴候は観察されなかった。
考察
本研究では、胃伸展受容体を活性化し、胃の膨張を知らせて胃相を開始させる管腔振動刺激の様式を確立した。振動周波数の範囲を最適化し、VIBESピルに粘膜との相互作用を高める機能を持たせることで、膨張を指示する迷走神経求心性信号を発生させただけでなく、豚の摂食量を有意かつ一貫して減少させた。食事中のカロリー摂取を制限することは、体重増加を抑制するためのメカニズムとしてよく知られており、持続可能である。VIBES錠剤は、食事の20~30分前に比較的空腹な状態で摂取することで、食事の早い段階で望ましい満腹感を引き起こすことを想定している。この管腔刺激モダリティを錠剤の形にすることで、代替品と比較していくつかの貴重な利点が得られる。摂取可能な装置であるため、侵襲的な移植や手術は必要ない。刺激は、トリガーによる活性化によって胃腔内で直接行うことができ、目的の組織に特異的な刺激を与えることができる。
射出成形技術と電子機器の大量製造により、規模を拡大すれば、コストは数セントから数ドルの範囲になると予想される。自然通過と組み合わせることで、VIBESは消耗品となり、装置の再取得や再充電は不要となる。特定の患者集団にとっては、手術を必要としない一時的な治療が可能になる。しかし、送電技術や充電技術が改善されれば、移植可能なアクチュエータや胃に常駐するアクチュエータが開発され、慢性的な治療が必要な患者に対して、繰り返し経口投与する必要がなくなる可能性がある。
VIBESの堅牢な設計は、ヒトへの経口投与に共通する実用上の制約を克服している。伸張反応が誘発される周波数が30Hzの範囲にあることは、胃内容物が様々に変化し、誘発される振動が様々な程度で減衰する可能性がある中で、VIBESを機能させる上で極めて重要である。VIBESピルの位置は制御できず、食事中に移動する可能性がある。肛門と噴門の受容体は伸張感受性が高いため(10)、胃内での機能には支障はない。さらに、胃の張力受容体はゆっくりと順応するので、VIBESは一貫して伸張反応を起こすことができる。この大規模動物実験では、2週間にわたり、動物の日課、睡眠パターン、活動量にばらつきがあるにもかかわらず、VIBESを投与すると食物摂取量が一貫して減少することが実証された。また、この介入に対する反応は、満腹感反応において胃拡張が支配的な影響を及ぼすことを強調した以前の研究を補強するものであった。VIBESの使用により、観察可能な苦痛や否定的な副作用は認められず、大型動物モデルにおける20以上の試験で正常な経過を示したことから、関連する動物モデルにおける前臨床安全性が裏付けられた。
減量試験は、コストや資源、生理学の類似性、食事誘発性疾患モデルの簡便性といった実際的な制約を考慮すると、げっ歯類モデルで実施するのが最も一般的である(42)。VIBES 錠剤の幾何学的寸法に適合するヒトサイズの解剖学的構造 が必要であることから、私たちが選択した動物モデルは豚であった。しかし、実験室での研究に使用される若齢で成長期の豚では、体重減少を有意に測定することは困難である(43)。今後の研究では、より小型の動物モデル研究に適した小型化されたVIBES装置を考案し、ヒトに近い胃の形状を持つイヌのモデルで実施し、液体および固形食のシンチグラフィや胃の収縮などの指標を使用して、生理学的効果をさらに特徴付ける。今後の研究では、観察された非活動的行動の増加と食後傾眠のメカニズムとの潜在的な相関関係について、より長期間の研究を用いて掘り下げる必要がある。さらに、VIBESが小腸を通過することによる栄養吸収、マイクロバイオームの変化、サイトカインの影響、消化管の全体的な機能への影響についても徹底的に調査する必要がある。安全性と利便性を向上させるために、錠剤の活性化または不活性化を外部から制御するメカニズムも開発される可能性がある。
さらなる安全性の検証を経て臨床応用されれば、肥満、多食症、プラダー・ウィリー症候群のような、満腹感の発現が遅いために過剰な過食とそれに続く代謝、心臓、内分泌の合併症を引き起こす疾患に対する潜在的な治療選択肢のパラダイムシフトを促進することができるであろう。今後の研究では、VIBESピルの有効性と副作用を、FDAが承認している体重コントロールのための他の薬剤や、電気刺激のような新しいアプローチと比較する必要がある(44)。VIBESによって引き起こされる代謝反応は、II型糖尿病のようなインスリン分泌不全や調節障害を伴う疾患の治療にも活用できる可能性がある。さらに、VIBES の運動率向上作用についても研究する必要がある。IGLEのようなメカノレセプターを光遺伝学的に活性化することも、胃のレセプター生理を調節するもう一つの方法かもしれない。全体として、本研究は、迷走神経刺激の振動様式が、胃の機械受容体を介して作用し、錯覚的な満腹感を誘発し、食物摂取量を減少させ、体重増加率を制限するための基礎を築き、肥満治療への道を開くものである。
方法
VIBES の設計とモデリング
VIBES は SOLIDWORKS でモデリングした。錠剤は、トリプルゼロカプセルと同じ寸法に設計された。この錠剤は、3つのセクションが互いにプレスフィットして密閉されるように設計されており、電子機器を収容する2つのセクションは3つ目のセクションから完全に密閉されている。振動は、DCモーターのシャフトに取り付けられたオフセットウェイトによって実現される。3Dプリンターで作製するため、錠剤カプセルの肉厚はストラタシスのプリンターの性能に合わせて0.6mmを使用した。1.55V、80mA時間の酸化銀電池(DigiKey社製)は、その高い容量対サイズ比と、摂取可能な内視鏡カプセル(45)などの摂取可能な生物医学機器での使用に対する事前承認を考慮して使用された。ポゴピン(DigiKey社製)を使用したバネ仕掛けの機構は、錠剤が胃に達すると作動するように設計された。この錠剤は、胃液が錠剤のキャップから入り、電池のマイナスリードとモーターのマイナスリードを隔てるグルコース膜を溶かすように設計されている。
VIBESの製造
VIBESの外側のカプセルは、強度、透明性、耐薬品性に優れ、プロトタイピングに理想的な素材であるStratasysのVeroClearフォトポリマーを使用して3Dプリントされた。錠剤は、モーターキャップ、本体、錠剤キャップの3つのセクションに分かれている。組み立ては、まず振動モーターをモーターキャップに押し込む。銅パッドがプラスリードにはんだ付けされ、モーターの底に貼り付けられる。次に、バネ仕掛けのポゴピンを中央ボディに押し込み、電池をマイナス端子がポゴピンと接触するように挿入した。次に、電池のプラス端子がモーターのプラス銅パッドに接触するように、中央ボディ・アセンブリをモーター・キャップ・アセンブリに押し付けた。モーターのマイナスのリード線は、中央のボディからピルカプセルまで伸ばした。マイナス側のリード線は上部の導電性パッドにはんだ付けされ、完全に組み立てられるとポゴピンと接触して回路を閉じる。マイナスリードのパッドとポゴピンの間には、錠剤が胃液に浸されるか接触すると溶けるように設計されたゼラチン膜も配置され、胃に到達したときにのみ活性化するようになっている(図S10)。このゼラチンはpH1~6.8で溶けるので、pHの異なる胃液を持つ患者でも機能することができる(46)。
錠剤の特性評価(振動時間試験と耐薬品性試験)
錠剤の振動時間は、80ミリアンペア時間の酸化銀電池を用いて、満充電の状態で錠剤の振動が止まるまでの時間を測定することで特徴づけられた。酸性の胃液と接触するため、錠剤の化学的劣化が懸念される。正常な運動性を持つ健康な動物では、胃での滞留時間は4時間以内と予想される。安全係数6を用いて、模擬胃液(pH1.2; Ricca, CAS #7732 -18-5)に24時間浸漬し、模擬腸液(pH7; Ricca CAS #TS -7109-32)に10日間浸漬して錠剤の耐薬品性を評価した。この培養期間の後、錠剤を目視で評価し、機械的に欠陥、摩耗、弱化がないかを検査した。さらに、錠剤を作動させることができるかどうかを判断するために、電子部品を作動させた。
熱リスク試験
錠剤の熱的安全性を評価するため、FLIR A65SCテストキットを使用し、校正標準としてサーマルブラックボディ(Dahua Technology JQ-D70Z)を用いて水中および空気中の熱出力を測定した。生理食塩水20mlを入れたビーカー内で、錠剤を25、80、95、110、200、250、300Hzでそれぞれ30分間振動させ、各周波数で周囲の液体中に到達した平均温度、最低温度、最高温度を測定した。
生体内実験
すべての動物実験は、マサチューセッツ工科大学(MIT)の動物飼育委員会(Committee on Animal Care)によって承認されたプロトコルに従って行われた。研究は豚モデル[タフツ大学カミングス獣医学部(マサチューセッツ州グラフトン)の生後4~6ヵ月の50~80kgのヨークシャー豚]で行った。豚の胃の解剖学的構造がヒトに似ており、生物医学的な消化管デバイスの評価に広く使用されていることから、豚モデルが選択された(32)。特に断りのない限り、動物はデクスメデトミジン(0.03mg/kg)とミダゾラム(0.25mg/kg)を筋肉内注射して麻酔し、挿管して、酸素中2~3%のイソフルランで維持した。VIBES 錠剤を直接胃に入れる機序研究のために、上部消化管内視鏡検査を行い、胃にオーバーチューブを留置した。その後、VIBES 錠剤を直接胃に送り込んだ。
実験群と対照群の動物は、同じ実験操作(麻酔、内視鏡検査、採血、X線検査、摂食、ハンドリング、電気生理学的処置)を受けた。実験群では、刺激を行うVIBES錠剤が使用され、各試行で作動している錠剤が手動で確認された。対照群では、特に断りのない限り、何の機能も持たない偽薬が使用された。盲検化された内視鏡医が、対照群(n = 6)とVIBESピルを投与した群(n = 6)の両方で、胃の形態学的変化、損傷の徴候、副作用を評価した。
通過試験
運動性への潜在的影響を評価するため、動物に偽薬 (n = 3 頭) または VIBES 錠 (n = 3 頭) を、小型の放射線不透過性バリウムペレットとともに与えた。実験群では、VIBES錠剤をバナナの中に隠し、動物に手で与えた。動物が錠剤を咬んだり噛んだりして、飲み込む前に破損しないように注意した。錠剤がなくなるまで、すべての動物を1日おきにX線画像でモニターした。行動、摂食の変化、痛みや苦痛の兆候はすべて、ケージの近くに設置したビデオカメラ(MIPCシステム)を用いて監視・記録した。
電気生理学的検査
最終的な処置として、開腹および解剖後、左胃-大腸動脈と並走する迷走神経の腹腔枝を同定した。10~12個の30ゲージ細線電極を26ゲージ針で迷走神経腹腔枝に挿入した。内視鏡的空気膨張・吸引チャンネルを用いて、空気の量と流量をモニターしながら、胃をさまざまな程度に膨張させた。電気信号はIntan Technologies Recording and Stimulation Systemを用いて30kHzで記録した。20分間のベースライン信号が記録された。次に、内視鏡的空気膨張・吸引チャンネルを用いて、胃をさまざまな程度に膨張させた。胃の容積は、まず胃を完全に膨らませ、絨毛の分離を観察し、使用した空気の量を測定することによって決定した。これらの容積と分離レベルの30、60、90%を、神経細胞のスパイク生理の段階的研究に使用した。その後、さらに20分間のベースラインを記録した。その後、VIBES錠剤を胃に導入し、同様の方法で電気信号を記録した。膣切開は、記録電極を設置する近位の頸部レベルで行われた。
データはエクスポートされ、MATLABで処理された。データは、低周波のモーションアーチファクト、呼吸アーチファクト、ホワイトノイズを除去するため、バンドパスおよびノッチフィルター(60Hz)処理された。カットオフ周波数1000の5次バターワースハイパスフィルタを用いた。信号は振幅を評価するために整流された。各群で発生した信号を平均し、高速フーリエ変換を行って群間のスペクトル特性を比較した。
求心性電図信号の統計解析
計算されたスペクトルの類似性尺度の統計的有意性を決定するために、有意水準(α)を0.05に設定した2標本のt検定を行った。FFT信号の大きさはt検定の入力として使用された。さらに、クロス・スペクトラル・コヒーレンスは以下のように計算された。
有意性の評価には0.05のアルファが用いられた。
セロトニンのスクリーニング
豚の生体外組織における粘膜セロトニン放出を調べるため、6×4ウェルのフランツセル装置を用いた。VIBES処理を20分間行い、200μLの洗浄で管腔分泌物を採取し、未処理の対照組織と比較した。3つの時点で6つの独立したサンプルを採取した。セロトニン酵素結合免疫吸着測定法(ELISA;Enzo Bio Sciences社製)を用いて分泌物を定量した。
胃液pH試験
胃液の pH に及ぼす VIBES 錠剤の影響を調べるため、6 × 4 ウェルフランツセル装置を使用した。豚から採取した胃液を、豚の組織を挟んだ装置のドナ ーウェルとレシピエントウェルに入れた。実験サンプルにVIBES処理を20分間行った。内腔側の液のpHを、対照サンプルと実験サンプルでメトラー・トレドのpHメーターを用いて測定した。各群から独立した6検体を採取した。
代謝パネル
対照動物(n = 6)と実験動物(n = 6)の耳静脈カテーテルから採取した静脈血について、代謝ホルモンパネル(Eve Technologies)を実施した。対照群には偽薬を投与し、実験群にはVIBES薬を投与した。覚醒し自由に動く動物(n = 6)において、刺激の30分前から2時間、30分ごとに採血を行った。EDTAでスプレーコーティングした採血バイアルを、血液サンプルを入れた後に5回ずつ反転させた。血液は採取後10分以内にプロテアーゼ阻害剤カクテル(S8830、Sigma-Aldrich)で処理し、4℃、4000rpmで15分間遠心分離した。GLP-1を分析した血液は、採取後2分以内にDPPIV阻害剤(Sigma-Aldrich)で処理し、4℃、4000rpmで15分間遠心した。ELISA結果はベースライン値で正規化した。コントロールサンプルは、特定のロットのすべてのアッセイシグナルが許容範囲内に収まることを保証するために、すべてのアッセイ実行で実行した。両側ヘテロ分散 t 検定を用い、コントロール群と VIBES 群の刺激後のホルモンの平均値を α 0.05 で比較した。グルコースは、耳に留置した静脈カテーテルから採血し、携帯型グルコメーターで測定した。
2週間の摂食試験
豚モデルにおいて電子錠剤を繰り返し経口投与することは、咬んだり噛んだりするのを防ぐのが難しいため、困難である。さらに、手作業は動物にとって苦痛の原因となりうる。そこで我々は、経皮的胃瘻造設術(PEG)チューブを用いて、胃腔内にデバイスを緩く固定した。治療時間中も毎日操作できるよう、バッテリー源を外付けにした。テザリングしたVIBESピル(図S11および動画S3)を、内視鏡補助下で留置した28ゲージのPEGチューブ(AVANOS)を通して挿入した。午前7時30分と午後3時30分にLabDiet mini-pig grower pellets (5081)を、午前11時から午後12時にリンゴ5個のスナックを与えた。行動、食欲の変化、吐き気、嘔吐、無気力などの副作用を監視するため、刺激と摂食期間のビデオ撮影を分析した。動物の体重を少なくとも週に2回測定し、新鮮な糞便サンプルを刺激後週に2回採取した。
画像ベースの行動研究
対照条件と治療条件において被験者が示した行動の傾向と洞察を捉えるために、我々はディープラーニングアーキテクチャを開発した。解釈可能性を優先し、Lehnerの生得的行動の倫理学的モデルを用いて、行動と行動の連鎖を分類する問題を形式化した(図S12)(47)。振動は、餌を摂取する前に、放出装置であるVIBESが動物に与えている刺激です。その後、VIBESは摂食、飲水、活動レベルに影響を与える可能性があります。オペラント条件行動理論では、飽食の結果には正の強化価値も負の強化価値もなく、結果からのフィードバックメカニズムは時間依存性である。最初は摂食は正の強化刺激であるが、強化因子の価値は動物が満腹に達するまで時間とともに減少する。動物が食べ続けると、摂食は負の強化刺激となり、摂食を続けるにつれて負の価値が増加します。連続的な行動の流れの中で次の行動行為は、それに先行する行動の結果によって誘発されます。
被験者が示した行動を分類し、経時的な条件間の違いを追跡するために、ペンの上部の角に取り付けた暗視・音声付き1080p HD IP(ネットワーク)カメラを使って、動物施設内のブタの音声と映像データを収集した。動物はウッドチップを埋め込んだペン(5インチ×5インチ)に入れ、おもちゃ、給水栓、餌を壁に固定した。1920×1080解像度のRGBビデオデータを15FPSで、音声データを16,000Hzで連続的に収集した。2つのペンで4頭の豚から6日間連続しないデータを収集し、合計94時間のデータを収集した。
解析には、図S13に示すように、3段階のパイプラインを使用した。S13に示す。第1段階では、2Dポーズ統合を用いた生のビデオデータに対してマーカーレス・ポーズ推定を行った。22の異なる身体部位と環境内の10の物体の位置座標を時系列で推定するモデルを学習した。これには、種間・種内転移学習能力を示す深層畳み込みニューラルネットワークを組み込んだ。12時間にわたる日中のビデオ420フレームからなるデータセットでモデルを訓練した。3人の独立したビデオコーダーが420の画像フレームに注釈を付け、パフォーマンスを向上させるために様々な視点と色にまたがってラベル付けした。画像フレームのセットは、明確な視野角、様々な照明レベル、異なる解像度とビデオ品質の表現を保持しながら、ランダムにサンプリングされた。ラベルの一貫性を検証するため、元のラベルの周囲に半径10ピクセルの範囲を作成し、ビデオ・コーダー間の評価者間信頼性を測定するためにクロンバックのアルファを計算した結果、スコアは0.837となり、ラベルの高い内部一貫性が示された。我々は、関連するブタの身体部位と環境内のオブジェクトで構成される22の異なるキーポイントをラベル付けした(表S2)。
体の部位のトラッキングにはDeepLabCut(バージョン2.2.1.1)を使用した(18, 48, 49)。具体的には、21のビデオ/動物から取得した420フレームをラベル付けした[その後、95%をトレーニングに使用した;デフォルトのパラメータでResNet-50ベースのニューラルネットワークを使用し、400,000トレーニング反復;1シャッフルで検証したところ、テストエラーは6.34ピクセル、トレーニングは9.58ピクセルであった(画像サイズは1920×1080)]。そして、P-カットオフを0.6とし、今後の分析のためにX,Y座標を条件付けた。このネットワークを用いて、同様の実験設定の動画を分析した。
第2段階では、位置座標の時系列出力と、DeepLabCutモデルから導出された特徴量(水飲み口、頭、尾の間の角度など)を使用して、ブタが示す行動を推定した。各参加者の1日分(24時間)のビデオデータを、以下のエソグラムを使用してコーディングした。一次コーダーは、分析が終わるまで実験条件について盲検であった。二次コーダーは実験条件について盲検化されていなかった。コーダー間の信頼性は高い(κ=0.92)。これらのラベルから生成されたデータを用いて、100個の完全連結隠れユニットを持つ2層の長期短期記憶(LSTM)ネットワークを訓練し、ウィンドウ時間中のブタの行動を推定した。このモデルは学習率0.001で600エポック学習され、最大(早期停止)重み付きF1スコアは93.5%となった。
LSTMネットワークの出力は、睡眠や給餌器からの食事など、4つの一般的な行動カテゴリーを分類した(表S3)。クラスはカテゴリー内でアンバランスであり、"休息中 "のデータポイントは284,004と多く、"ペディアライトを与えられている "のデータポイントは2103と少ない。特徴検出器の性能を定量化するために、各時間の画像データに対して5重クロスバリデーションを使用する。
k回クロスバリデーションには、(i)データセットをランダムにサンプリングした、置換なしの独立したk回フォールドに分割すること、(ii)K-1回フォールドをモデル学習に使用し、残りを性能評価に使用すること、(iii)各反復でk回の性能推定値を得るために、事前のステップをk回繰り返すこと、(iv)k回の性能推定値の平均を求めること、が含まれる。次に、生成された全ての特徴量について、テスト画像に対するLSTMの性能を評価した。
モデルの性能を把握するために、動作の混同行列とモデルの精度を経時的に提供する。平均して、我々のモデルは4つの異なる一般的なカテゴリの行動を94%の精度で分類します(図S15とS16)。
DeepLabCutから出力されたデータは、活動ラベルと一連の画像と対になった時系列の位置座標データセットでした。ここからLSTMを用いて潜在と状態を推測した。第3ステージでは、潜在と段階を使用して、時間、頻度、持続時間、日ごとの行動の傾向などの特徴を計算する。
組織学
安楽死後、対照群と実験群の動物から胃切片を慎重に採取した。組織サンプルは4%パラホルムアルデヒドで24時間固定した。その後、リン酸緩衝生理食塩水で15分ずつ3回洗浄し、70%エタノールで保存した。その後、パラフィン処理し、包埋し、切片化した。組織をヘマトキシリンとエオジンで染色し、形態を評価し、介入に関連した副作用を調査した。
統計解析
定量的データは平均値(±SD)または適切な場合は範囲として報告されている。分布の正規性はShapiro-Wilk検定により確認した。比較分析は、特に断りのない限り、Studentの不均一分散両側t検定を用いて行った。P < 0.05を有意とみなした。
謝辞
R. Langerからの建設的なフィードバックに感謝する。原画およびイラストはV. E. Fulford, Alar Illustrationによるものである。標識データの作成に協力してくれたH. Sunに感謝する。
資金提供: この研究は、NIH(EB-000244)、Novo Nordisk、MIT機械工学科からの助成金により一部支援された。S.S.はSchmidt Science Fellowshipの支援を受けた。C.B.は、NSFからComputing Research Associationへの助成金#2030859によるCIFellows Projectの支援を受けた。
著者の貢献 構想: S.S.S.方法論: 方法論:A.A.、A.H.、S.S.S.、C.B.、G.T. 調査: 監督:S.S.S.、A.A.、A.H.、C.B.、J.K.、K.I.、J.J.、S.L.、W.A.M.M: A.H.、N.F.、G.T. 執筆(原案): 執筆(校閲・編集):S.S.、A.A.、A.H.、C.B: 全執筆者。
競合利益: S.S.、A.A.およびG.T.は、ここで紹介する開発内容を記載した特許出願(マサチューセッツ工科大学出願、第63/319,620号)の共同発明者である。G.T.は、ノボ ノルディスク社からコンサルティング料を受け取っていると報告している。G.T.の営利および非営利のすべての関係の詳細は、以下のリンクでご覧いただけます:https://dropbox.com/sh/szi7vnr4a2ajb56/AABs5N5i0q9AfT1IqIJAE-T5a?dl=0。すべての著者はMITに発明開示を提出しています。すべての著者は、他に競合する利害関係がないことを宣言している。
データおよび資料の入手 本論文の結論を評価するために必要なすべてのデータは、論文および/または補足資料に記載されている。
補足資料
このPDFファイルには
図S1~S16
ノートS1
表S1からS3
動画S1~S3の凡例
ダウンロード
19.65 MB
本原稿のその他の補足資料は以下の通りです:
動画S1~S3
ダウンロード
155.50 MB
参考文献と注釈
1
CDC, Obesity is a Common, Serious, and Costly Disease (CDC, 2022); www.cdc.gov/obesity/data/adult.html.
参考文献へ
Google SCHOLAR
2
NIDDK, Overweight & Obesity Statistics|NIDDK, www.niddk.nih.gov/health-information/health-statistics/overweight-obesity.
参考文献へ
Google SCHOLAR
3
F. L. Greenway、L. J. Aronne、A. Raben、A. Astrup、C. M. Apovian、J. O. Hill、L. M. Kaplan、K. Fujioka、E. Matejkova、S. Svacina、L. Luzi、L. Gnessi、S. Navas-Carretero、J. Alfredo Martinez、C. D. Still、A. Sannino、C. Saponaro, C. Demitri, L. E. Urban, H. Leider, E. Chiquette, E. S. Ron, Y. Zohar, H. M. Heshmati, A randomized, double-blind, placebo-controlled study of Gelesis100: A novel nonsystemic oral hydrogel for weight loss. Obes. Silver Spring Md 27, 205-216 (2019).
参考文献へ
クロスリファレンス
PUBMED
Google SCHOLAR
4
GBD 2015 肥満共同研究者、A. Afshin、M. H. Forouzanfar、M. B. Reitsma、P. Sur、K. Estep、A. Lee、L. Marczak、A. H. Mokdad、M. Moradi-Lakeh、M. Naghavi、J. S. Salama、T. Vos、K. H. Abate、C. Abbafati、M. B. Ahmed、Z. Al-Aly、A. Alkerwi、R. Al-Raddadi、A. T. Amare、A. Amberbir、A. K. Amegah、E. Amini、S. M. Amrock、R. M. Anjana、J. Ärnlöv、H. Asayesh、A. Banerjee、A. Barac、E. Baye、D. A. Bennett、A. S. Beyene、S. Biadgilign、S. Biryukov、E. Bjertness、D. J.ボネヤ、I.カンポス・ノナト、J.J.カレロ、P.セシリオ、K.セルシー、L.G.シオバヌ、L.コーナビー、S.A.ダムテュー、L.ダンドナ、R.ダンドナ、S.D.ダルマラトネ、B.B.ダンカン、B.エシュラティ、A.エステガマティ、V.L.フェイギン、J.C.フェルナンデス、T. フュルスト、T.T.ゲブレヒウォト、A.ゴールド、P.N.ゴナ、A.後藤、T.D.ハブテウォルド、K.T.ハドゥシュ、N.ハフェジ・ネジャド、S.I.ヘイ、M.堀野、F.イスラミ、R.カマル、A.カサエイアン、S.V.カティキレディ、A.P.ケングネ、C.N.ケサヴァチャンドラン、Y.S.カーダー、Y.-. H. Khang、J. Khubchandani、D. Kim、Y. J. Kim、Y. Kinfu、S. Kosen、T. Ku、B. K. Defo、G. A. Kumar、H. J. Larson、M. Leinsalu、X. Liang、S. S. Lim、P. Liu、A. D. Lopez、R. Lozano、A. Majeed、R. Malekzadeh、D. C. Malta、M. Mazidi、C. McAlinden、S. T. McGarvey、D. T. Mengistu、G. A. Mensah、G. B. M. Mensink、H. B. Mezgebe、E. M. Mirrakhimov、U. O. Mueller、J. J. Noubiap、C. M. Obermeyer、F. A. Ogbo、M. O. Owolabi、G. C. Patton、F. Pourmalek、M. Qorbani、A. Rafay、R. K. Rai、C. L. Ranabhat、N. Reinig、S. Safiri、J. J.シン、R.シリ、I.シウエ、H.S.ロバ、D.A.S.シルバ、J.I.シルバーバーグ、J.A.シン、S.ストレンジス、S.スワミナサン、R.タバレス-セイスデドス、F. タデセ、B.A.テドラ、B.S.テゲグネ、A.S.ターカウィ、J.S.タクール、M.トネッリ、R.トポール=マドリー、S.チロヴォラス、K.N.ウクワジャ、O.A. Uthman, M. Vaezghasemi, T. Vasankari, V. Vlassov, S. E. Vollset, E. Weiderpass, A. Werdecker, J. Wesana, R. Westerman, Y. Yano, N. Yonemoto, G. Yonga, Z. Zaidi, Z. M. Zenebe, B. Zipkin, C. J. L. Murray, Health effects of overweight and obesity in 195 countries over 25 years. N. Engl. J. Med. 377, 13-27 (2017).
参考文献へ
クロスリファレンス
PUBMED
ISI
Google SCHOLAR
(0)
eレターズ
eLettersは継続的な査読のためのフォーラムです。eLettersは編集、校正、索引付けはされませんが、選別はされます。eLettersは論文について実質的で学術的なコメントを提供する必要があります。図表を埋め込んで投稿することはできませんし、eレター内での図表の使用は一般的に推奨されません。図表が不可欠な場合は、eレターの本文中に図表へのリンクを含めてください。eレターを投稿する前に、利用規約をお読みください。
この記事に関するeレターはまだ発行されていません。
TrendMDのおすすめ記事
サイトカインとしてのアセチルコリン
サイシグナル 2005年
オピオイド受容体の満腹シグナル
ナンシー・R・ゴフ、サイシグナル、2012年
除神経は胃の腫瘍形成を抑制する
Chun-Mei Zhaoら、Sci Transl Med、2014年
バイオインスパイアされた、空腹ホルモン調節のための摂取可能な電気治療カプセル
Khalil B. Ramadiら、Science Robotics、2023年
満腹シグナルと記憶増強剤
ナンシー・R・ゴウ、サイエンス・シグナル、2009年
円錐角膜の単一細胞アトラスから転写シグネチャーの異常が明らかになり、機械的伸展が円錐角膜発症の引き金であることが示唆された。
Shengqian Douら、Cell Discovery、2022年
Anacardium occidentale幹樹皮エキスの消化管運動抑制作用の評価:止瀉活性のメカニズム研究
ブレッシング・O・オモラソほか, Journal of Pharmaceutical Analysis, 2021
振動抑制を考慮したフライス加工表面形状を予測する統合マシン・プロセス・コントローラモデル
Miao-Xian Guoら、Advances in Manufacturing誌、2022年
無症状または軽症のCOVID-19回復期患者における免疫記憶
Quan-Xin Longら、Cell Discovery、2021年
圧力下におけるCsV3Sb5の高ロバストなリエントラント超伝導
Xu Chenら、Chinese Physics Letters、2021年
搭載
最新号
サイエンス・アドバンシスの表紙画像
プロテインキナーゼCデルタは単核食細胞を制御し、がんの免疫療法への反応を妨げる
メフディ・チェイブ ジェレマイア・R・ホルト 他著
染色体8pの工学的解析により、肝がんにおける患者特異的合成致死療法が標的とする転移能の増大が明らかになった。
by thorben huth emely c. DREHER et al.
時空間社会的関連性は野生化マウスにおける免疫学的類似性を予測する
ALEXANDER E. DOWNIE OYEBOLA OYESOLA et al.
広告
サイエンスアドバイザーの登録
ScienceAdviserに登録すると、最新のニュース、解説、研究を毎日無料で受信できます。
最新ニュース
サイエンス・インサイダー 2023
日本、大学ランキングの下落を食い止めようと再挑戦
ニュース2023年12月29日
見慣れた天体は1つではなく2つの銀河かもしれない
NEWS29 12月 2023
サイエンス・エディターが選ぶ2023年の最も印象的な記事
サイエンス・インサイダー2023年12月28日
韓国では科学者のロビー活動が研究費の大幅削減を食い止める
サイエンス・インサイダー2023年12月27日
米国の新移民規則、STEM労働者のビザ承認に拍車
ニュース2023年12月22日
この振動ダイエットピルは、満腹感を得るために胃をだますかもしれない
広告
広告
全文を見る|PDFをダウンロード
スライドショーをスキップする
フォローする
ニュース
全てのニュース
サイエンスインサイダー
ニュース特集
サイエンス・ニュースを購読する
ニュース・フロム・サイエンスFAQ
ニュース・フロム・サイエンスについて
採用情報
採用情報
求人を探す
雇用者ハブ
コメント
オピニオン
分析
ブログ
ジャーナル
サイエンス
科学の進歩
科学免疫学
サイエンス・ロボティクス
サイエンス・シグナル
サイエンス・トランスレーショナル・メディシン
サイエンス提携誌
著者と査読者
著者向け情報
査読者情報
図書館員
機関購読の管理
図書館管理ポータル
見積依頼
図書館員FAQ
広告主
広告キット
カスタム出版情報
求人情報を掲載する
関連サイト
AAAS.org
AAASコミュニティ
EurekAlert
教室での科学
AAASについて
リーダーシップ
AAASでの仕事
賞と受賞
ヘルプ
よくある質問
アクセスと購読
単一号の注文
別刷りと許可
TOCアラートとRSSフィード
お問い合わせ
AAASロゴ
© 2023 米国科学振興協会. 無断複写・転載を禁じます。AAASはHINARI、AGORA、OARE、CHORUS、CLOCKSS、CrossRef、COUNTERのパートナーです。Science Advances eISSN 2375-2548。
利用規約 プライバシーポリシー アクセシビリティ
PDF
ヘルプ
参考文献1
この記事が気に入ったらサポートをしてみませんか?
