成人のメンタルヘルスに対する高プレバイオティクス食対プロバイオティクスサプリメント対シンバイオティクスの効果: 腸の気持ち」無作為化比較試験
4,237総閲覧数
1,029ダウンロード
記事のインパクトを見る
オリジナル研究論文
Front. Neurosci., 06 February 2023
Sec.腸脳軸
第16巻-2022年|https://doi.org/10.3389/fnins.2022.1097278
成人のメンタルヘルスに対する高プレバイオティクス食対プロバイオティクスサプリメント対シンバイオティクスの効果: 腸の気持ち」無作為化比較試験
https://www.frontiersin.org/articles/10.3389/fnins.2022.1097278/full


Tanya M. Freijy1,2、Lachlan Cribb1、Georgina Oliver1、Najwa-Joelle Metri3、Rachelle S. Opie4、Felice N. Jacka5,6,7、Jason A. Hawrelak8,9、Julia J. Rucklidge10、Chee H. Ng1、Jerome Sarris1,2,3*。
1オーストラリア、メルボルン、メルボルン大学精神医学部、メルボルンクリニック、教授ユニット
2メルボルン大学医学・歯学・健康科学部、フローリー神経科学・精神衛生研究所、メルボルン、VIC、オーストラリア
3NICM健康研究所、ウェスタン・シドニー大学、ウェストミード、ニューサウスウェールズ州、オーストラリア
4IPAN、運動栄養科学部、ディーキン大学、メルボルン、VIC、オーストラリア
5医学部、食品・気分センター、IMPACT戦略研究センター、ディーキン大学、メルボルン、VIC、オーストラリア
6思春期の健康のためのセンター、マードック子供研究所、メルボルン、VIC、オーストラリア
7ジェームズ・クック大学公衆衛生・医学・獣医科学学部(オーストラリア、OLD州タウンズビル
8タスマニア大学薬学部、ホバート、TAS、オーストラリア
9米国オレゴン州ポートランド、ウェスタン・ステーツ大学、人間栄養学・機能性医学部
10ニュージーランド、クライストチャーチ、カンタベリー大学、心理学・言語聴覚学部
背景 メンタルヘルスの改善に食事介入やプロバイオティクスやプレバイオティクスの補充など腸内細菌叢を標的とした介入を用いることを支持する予備的エビデンスがある。我々は、高プレバイオティクスの食事介入とプロバイオティクスサプリメントのメンタルヘルスに対する効果を検討した初のランダム化比較試験(RCT)について報告する。
方法 "Gut Feelings "は、中等度の心理的苦痛を有し、プレバイオティクス食品の摂取量が少ない成人119人を対象とした8週間の2×2要因RCTであった。治療群:(1)プロバイオティクスサプリメントと通常通りの食事(プロバイオティクス群)、(2)高プレバイオティクス食とプラセボサプリメント(プレバイオティクス食群)、(3)プロバイオティクスサプリメントと高プレバイオティクス食(シンバイオティクス群)、(4)プラセボサプリメントと通常通りの食事(プラセボ群)。主要アウトカムは、ベースラインから8週までの総合気分障害(TMD;Profile of Mood States Short Form)の評価であった。副次的アウトカムは、不安、抑うつ、ストレス、睡眠、ウェルビーイングの評価であった。
結果 線形混合効果モデルを用いた修正intention-to-treat解析の結果、プレバイオティクス食は8週時点でプラセボに比べてTMDを減少させた[Cohenのd = -0.60、95%信頼区間(CI) = -1.18, -0.03; p = 0.039]。プロバイオティクス(d = -0.19, 95% CI = -0.75, 0.38; p = 0.51)またはシンバイオティクス(d = -0.03, 95% CI = -0.59, 0.53; p = 0.92)による症状改善の証拠はなかった。不安、ストレス、睡眠はプレバイオティクス食によって改善され、プロバイオティクスはプラセボに比べてウェルビーイングを暫定的に改善した。シンバイオティクスの介入に対する有益性は認められなかった。いずれの治療も有害事象はほとんど認められず、忍容性は良好であった。
結論 高プレバイオティクス食介入は、中等度の心理的苦痛を有しプレバイオティクス摂取量の少ない成人において、気分、不安、ストレス、睡眠を改善する可能性がある。高プレバイオティクス食とプロバイオティクスサプリメントのシンバイオティクス併用は、さらなるエビデンスが必要であるが、精神的健康の転帰に有益な効果をもたらさないようである。サンプル数が比較的少ないため、結果は限定的である。
臨床試験登録:https://www.anzctr.org.au/Trial/Registration/TrialReview.aspx?id=372753、識別子ACTRN12617000795392。
はじめに
ヒトの腸内細菌叢は、消化管内に生息する微生物集団を指し、38兆個以上の細菌細胞(Sender et al.、2016)と比較的少量の古細菌、真核生物、ウイルス(Qin et al.、2010)から構成されている。多様性の推定によると、ヒト集団全体で1,000種以上の腸内細菌が存在し、1人当たり少なくとも160種が優勢である(Qin et al.) 成人の腸内細菌叢組成は様々な要因によって形成され(Jernberg et al., 2007; Khachatryan et al., 2008; Mariat et al., 2009; Scott et al., 2013)、食事は変動の50%以上を調節する可能性がある(Zhang et al., 2010; Oriach et al., 2016)。欧米では、時間の経過とともに腸内細菌の多様性が失われているが、これは食物繊維の消費量が減少し、その結果、腸内細菌叢の発酵性基質が枯渇したことが一因と考えられる(Deehan and Walter, 2016)。発酵性基質の不足は、特定の細菌種の喪失、多様性の喪失、短鎖脂肪酸(SCFA)などの有益な発酵最終産物の産生の減少につながる可能性がある(Sonnenburg and Sonnenburg, 2014)。成人期の腸内細菌叢は比較的安定しているにもかかわらず(Wu et al.、2011)、短期間の食事変化によりその組成が速やかに変化することが示されている(David et al.、2014)。したがって、食事介入は腸内細菌叢の組成を調節する適切な戦略であると考えられる。
前臨床およびヒトでの研究から、中枢神経系と腸内細菌叢の間の双方向コミュニケーションチャネルである「微生物叢-腸-脳軸」に関する広範な証拠が得られている(総説Cryan et al.) ヒトでは、うつ病は腸内細菌叢組成の変化と関連しているようであるが(Naseribafrouei et al., 2014; Jiang et al., 2015; Aizawa et al., 2016; Kelly et al., 2016; Zheng et al., 2016; Valles-Colomer et al., 2019)、うつ病患者と健常者の特定の違いに関する一貫性はほとんどない。これは、栄養摂取量を測定した研究が1件(Kellyら、2016年)のみであることから、食事のばらつきが一因である可能性がある。糞便微生物叢移植(FMT)研究は、うつ病における腸内細菌叢の潜在的な原因的役割を示している。うつ病患者から微生物叢欠乏ラットへのFMT後、レシピエント動物では抑うつおよび/または不安様行動が観察されたが、健常対照動物からFMTを受けた動物では観察されなかった(Kellyら、2016;Zhengら、2016)。他の研究では、リポ多糖(グラム陰性菌の外膜の一部)への曝露による腸内細菌誘発性の炎症反応が、ヒトにおけるうつ病の発症に関与している可能性が示唆されている(Caniら、2007;Maesら、2012、2013)。神経系、内分泌系、免疫系の相互作用に焦点を当てて、腸脳軸の根底にある様々なメカニズムが提唱されている(Cryan and Dinan, 2012)。
腸内細菌叢の組成は、プロバイオティクスによって調節することができる。プロバイオティクスとは、適切な量を摂取することで健康に役立つ生きた細菌のことである(FAO/WHO, 2002; Hill et al.) プロバイオティクスは、病原体を競合的に排除して増殖を抑制し、サイトカイン合成を誘発し、SCFAを産生することにより、宿主の健康を増進する(Kaur et al.) ラクトバチルス(Lactobacillus)属やビフィドバクテリウム(Bifidobacterium)属(Bravoら、2011;Messaoudiら、2011;Wangら、2016)など、メンタルヘルスに有益な効果をもたらす特定のプロバイオティクスは、「サイコバイオティクス」と呼ばれている(Dinanら、2013)。ある研究では、ラクトバチルス・ヘルベティカス(R0052株)とビフィドバクテリウム・ロンガム(R0175株)を4週間補充することで、抑うつや身体化の評価、問題解決能力、自己非難のスコアが改善し、尿中遊離コルチゾールが減少した(Messaoudi et al.) これと一致して、主に臨床集団において、プロバイオティクスによる心理的症状の改善が、いくつかのメタアナリシスで報告されている(McKeanら、2017;Ngら、2018;Gohら、2019;Liuら、2019;Nikolovaら、2019;Chaoら、2020;Zagórskaら、2020)。他のメタ分析的エビデンスでは、臨床的または非臨床的サブグループにおいてプロバイオティクスの効果がないことが示されている(Reisら、2018年)。
腸内細菌叢の組成を調節するもう一つの方法は、プレバイオティクスの摂取である。プレバイオティクスは、宿主微生物によって選択的に利用され、健康上の利益をもたらす非生存性の基質である(Gibson et al.) プレバイオティクスは、大腸内の微生物によって部分的または完全に発酵され、特定の保護細菌、特にビフィズス菌や乳酸菌の増殖を刺激する(Cummingsら、2001年)。プレバイオティクス摂取の利点としては、血清エンドトキシン濃度の低下、腸の完全性、免疫力、血糖値、血漿脂質値、ミネラルの吸収促進(Iannitti and Palmieri, 2010; Al-Sheraji et al., 2013)、SCFAの産生(Miller and Wolin, 1979)などが挙げられる。最も確立されたプレバイオティクスは、フラクトオリゴ糖(FOS)やイヌリンを含むフルクタン、およびガラクトオリゴ糖(GOS)である(Gibsonら、2017)。これらの化合物は水溶性食物繊維の一種であり、果物、野菜、穀物、豆類、ナッツ類に様々な量で含まれている。このような植物性食品はもともと食物繊維が豊富であるため、プレバイオティクスの効果は、長期の高食物繊維食と関連した腸内細菌叢組成の重要な違いに影響を及ぼす可能性がある(Simpson and Campbell, 2015)。食物繊維の摂取量と全体的な食事の質の増加を伴う食事介入は、臨床的うつ病患者(Jackaら、2017)および上昇した抑うつ症状(Francisら、2019;Parlettaら、2019)の抑うつ症状を軽減することが報告されている。気分を改善するためにプレバイオティクスサプリメントを使用した予備的研究では、異質性と限られた研究基盤のためと思われるが、全体として結論は出ていないものの、いくつかの有望な知見が得られている(Schmidtら、2015;Kaoら、2016;Johnstoneら、2021)(Desmedtら、2019;Liuら、2019;Hofmeisterら、2021)。
Gut Feelings」試験は、プレバイオティクスとプロバイオティクスの補充に関する既存の文献を拡張し、高プレバイオティクス植物性食品を豊富に含む食事を摂取することで腸内細菌叢組成が改善し(Tuohy et al. 具体的には、高プレバイオティクス食を開発し、マルチストレイン・プロバイオティクス、および両者を組み合わせたシンバイオティクスと比較投与した。さらに、シンバイオティクス[プロバイオティクスとプレバイオティクスの相補的な組み合わせ(Saulnier et al. 我々の知る限り、本研究はヒトの精神的健康に対する高プレバイオティクス食の効果を検討した最初の研究であり、脳機能と行動を対象とした全体的な食事介入の欠如に関する文献的ギャップに対処するものである(Berdingら、2021b)。我々の第一の目的は、プレバイオティクスおよび/またはプロバイオティクスのサプリメントの食事摂取が、心理的苦痛の症状がありプレバイオティクス食品の摂取量が少ない成人の気分を、プラセボと比較して改善するかどうかを確立することであった。副次的な目的は、抑うつ、不安、ストレス、ウェルビーイング、健康関連QOL(疲労およびウェルビーイング因子)、腸の健康、睡眠に対する治療効果を測定すること、および治療反応が介入アドヒアランスによって調節されるかどうかを測定することであった。われわれは、気分の改善においてシンバイオティクス治療が他のすべての治療よりも優れており、一方プレバイオティクスとプロバイオティクス治療の両方がプラセボよりも優れており、このパターンは各測定において一貫しているという仮説を立てた。材料と方法
2.1. 研究デザイン
本試験は、中等度の心理的苦痛を有し、プレバイオティクスの摂取量が少ない119人の非臨床成人参加者を対象とした、プロバイオティクスサプリメントおよび/または高プレバイオティクス食事介入の8週間、2×2要因、無作為化、プラセボ対照、優越性試験であった。試験はオーストラリアのメルボルンの都心部(The Melbourne Clinic, Richmond)で実施された。試験は2017年5月に前向きに登録された(ACTRN12617000795392)。募集と介入実施は、2017年9月から2019年7月までの23ヵ月間にわたって行われた。評価は、試験開始前(事前スクリーニング、ベースライン)、参加中(2週目、4週目、6週目)、試験終了時(8週目)、追跡調査時(20週目)に完了した。本試験はThe Melbourne Clinic Research Ethics Committee(TMCREC 289)から倫理的承認を得た。試験プロトコールはSPIRITガイドライン(Chanら、2013年)に従って作成された。研究成果は、CONSORT 2010ガイドライン(Moher et al.、2010)に従って報告された。
2.2. 参加者
2.2.1. 除外基準
適格な参加者は、中等度の心理的苦痛[K10(Kessler et al.、2002)スコア16~26]を有し、プレバイオティック繊維の摂取量<3g/日(食事改善のための十分な範囲を確保する)、18~65歳、英語の筆記および会話に堪能で、研究手順に同意できる者であった。除外基準には、過去2週間の発酵食品またはプロバイオティクスサプリメントの使用、35を超える肥満度(BMI)、妊娠、過敏性腸症候群、慢性便秘、発酵性短鎖炭水化物(FODMAP)過敏症などの胃腸疾患の存在が含まれた。その他の除外基準には、薬物使用障害または臨床精神障害があること、過去4週間に向精神薬を使用していること、主に中枢神経系に作用する薬を使用していること、抗生物質、プロトンポンプ阻害薬、非ステロイド性抗炎症薬(1ヵ月に3回以上)を使用していること、免疫抑制薬を使用していることが含まれた。抗生物質の使用を除外する以外のすべての基準を満たした人は、4週間の抗生物質洗浄期間の後、試験に参加することができた。
2.2.2. 募集
地域在住の成人は、オンラインの研究広告および地元地域に掲示されたポスターに反応して、自己紹介により募集された。参加希望者は、REDCap(Harris et al.、2009)を用いて作成された研究情報とオンライン事前スクリーニング質問票へのリンクを含む研究ウェブサイトに誘導された。質問票の結果、適格であると判断された者には、さらに適格性評価を進めるかどうか、電話で連絡をとった。
2.3. 介入
治療群:(1)プロバイオティクスサプリメントと通常通りの食事(プロバイオティクス群)、(2)高プレバイオティクス食とプラセボサプリメント(プレバイオティクス食群)、(3)プロバイオティクスサプリメントと高プレバイオティクス食(シンバイオティクス群)、(4)プラセボサプリメントと通常通りの食事(プラセボ群)。
2.3.1. サプリメント介入
参加者は1日2回(朝夕1カプセルずつ、食事と一緒に)、8週間カプセルを摂取するよう指示された。BioCeuticals®社から提供されたプロバイオティクス製剤は、1カプセルあたり120億コロニー形成単位(CFU)を供給し、以下を含んでいた: ビフィズス菌(Bb-06): ビフィズス菌(Bb-06):20億CFU;ビフィズス菌(Bifidobacterium animalis subsp: 10億CFU;ビフィドバクテリウム・ロンガム(R0175): 10億CFU;ラクトバチルス・アシドフィルス(La-14): 20億CFU;ラクトバチルス・ヘルベティカス(R0052): 20億CFU;ラクトバチルス・カゼイ(Lc-11): 20億CFU;ラクトバチルス・プランタラム(Lp-115): 10億CFU;ラクトバチルス・ラムノサス(HN001): 10億CFU。参加者は、安定性を確保するため、製品を25℃以下で保管するよう指示された。同じくBioCeuticals®社から提供されたプラセボカプセルには不活性物質(微結晶セルロース)が含まれており、外観、味、食感はプロバイオティクス製品と同じであった。
2.3.2. 食事介入
本研究のために開発された高プレバイオティクス食は、Monash University Department of Gastroenterology High Fibre, High-Prebiotic Diet(モナシュ大学消化器内科高繊維・高プレバイオティクス食)1 を参考にした。高プレバイオティクス食品の例としては、アスパラガス、ニンニク、タマネギ、オーツ麦、全粒小麦、ひよこ豆、スイカなどがある。食事性プレバイオティクスの摂取量は、サプリメントによるプレバイオティクスが生理学的および行動学的効果をもたらすレベルである1日あたり最低5gを満たすことを意図した(Taylor and Holscher, 2020)。膨満感や鼓腸など、一般的に報告されているプレバイオティクスの副作用のリスクを最小限に抑えるため、プレバイオティクスを多く含む食品は、5日間かけて徐々に食事に導入された(Cummings et al.) 残りの食事は参加者の裁量に任された。通常通りの食事コントロールでは、参加者は8週間の試験期間中、習慣的な食事を続けた。
2.4. 手順
参加者は、ベースラインの診察の直前に2週間の発酵食品とプロバイオティクスの洗浄を行うよう指示され、プロバイオティクスのサプリメントと以下の発酵食品は除外された:ヨーグルト、ケフィア、漬け物、味噌、ザワークラウト、キムチ(韓国の白菜漬け)、コンブチャ茶。低温殺菌されたザワークラウトや味噌汁のような加熱処理された発酵食品は、「ポストバイオティクス」治療効果が生存不可能な(死滅した)プロバイオティクス細菌によって誘発される可能性があるため除外された(Chudzikら、2021年)。メルボルンクリニックでのベースラインセッションで、参加者は書面によるインフォームドコンセントを行い、人口統計、健康状態、服薬、サプリメントの使用に関するアンケートに回答した。臨床精神疾患の評価と除外のためにMini International Neuropsychiatric Inventory 6.0 (Sheehan et al., 1998)とMcLean Borderline Personality Disorder (Zanarini et al., 2003)、腸障害のためにRome-IV Diagnostic Questionnaire for Functional Gastrointestinal Disorders in Adults (Rome-IV) (Palsson et al., 2016)が実施された。その後、すべてのベースライン試験評価が完了した。
適格な参加者は無作為に割り付けられ、8週間分のカプセルと保管および使用に関する指示が与えられた。参加者は、8週間の試験期間中、発酵食品と既知のプロバイオティクスを除き、ほぼ同じ生活習慣を維持するよう求められた。すなわち、現在の身体活動、瞑想などのセルフケアの実践、微量栄養素の補給は、最小限の変更にとどめた。食事介入群に割り付けられた参加者は、この研究のために特別に認定実践栄養士によって配信された高プレバイオティクス食に関する7分間の紹介ビデオを視聴した。非食事療法群の参加者は、同様の長さのビデオで、研究の手順、サプリメントの摂取量と保存方法について詳しく説明された。両グループとも、ビデオ内容のスライドをハードコピーで受け取った。ダイエット群の参加者には、高プレバイオティクス食品のリストと1食分の量が示され、"スターターキット "として、高繊維質の箱入りシリアル、フルーツとナッツのミューズリーバー、乾燥豆類など、保存可能な高プレバイオティクス食品の詰め合わせが配布された。
ベースライン後、各経過観察時点(2週目、4週目、6週目、8週目、20週目)で主要アウトカムの評価が行われ、副次的アウトカムは8週目のみ再評価された。安全性モニタリングは、1週目に電話、2週目、4週目、6週目、8週目に評価が行われた。参加者はベースライン、2週目、8週目に対面式で参加し、残りの評価はオンラインで行われた。
2.5. 結果
2.5.1. 主要アウトカム
主要アウトカムは、Profile of Mood States Adult Short Form, 2nd edition (POMS 2-SF) (Curran et al., 1995)の気分障害合計(TMD)スコアであった。POMS 2-SFは、過去1週間に経験した心理的苦痛の自己報告式の測定法である。これは、5段階リッカート尺度(0~4)の35項目からなり、6つの気分下位尺度を評価する。TMDは、5つの否定的気分下位尺度(怒り-敵意、混乱-当惑、抑うつ-抑うつ、疲労-惰性、緊張-不安)の得点の合計として計算され、残りの肯定的気分下位尺度(活力-活動性)はこの合計から差し引かれる。TMDの値が高いほど否定的な気分の状態を示すので、TMDの減少は改善を示す。
2.5.2. 副次的アウトカム
副次的アウトカムには、Beck Anxiety Inventory (BAI) (Beck et al., 1988)による不安の自己報告測定、Beck Depression Inventory-II (BDI) (Beck et al., 1996)による抑うつ、Perceived Stress Scale (PSS) (Cohen et al., 1983)によるストレス、Wellbeing (PSS) (Cohen et al., 1996)によるウェルビーイングが含まれる、 1983)、WHO-5 Wellbeing Index(WHO-5)(World Health Organizationion Regional Office for Europe、1998)のウェルビーイング、Leeds Sleep Evaluation Questionnaire(LSEQ)(Parrott and Hindmarch、1978)の睡眠、Short Form Survey-36(SF-36)(Ware and Sherbourne、1992)のウェルビーイングおよび疲労下位尺度である。BAI、BDI、PSSは得点が低いほど転帰が良好であることを示し、SF-36、WHO-5、LSEQは得点が低いほど転帰が不良であることを示す。追加アウトカムは、BMI(体重(kg)/[身長(m)2])、およびRome-IV(Palsson et al. Rome-IVの報告時間枠は、第8週の投与のために「過去1ヵ月」に変更された。
食事摂取量はMonash University Comprehensive Nutrition Assessment Questionnaire2(CNAQ)により測定し、報告時期は「過去1ヵ月」に変更した。CNAQは、有効性が確認された(Barrett and Gibson, 2010)297項目の食物摂取頻度調査票(FFQ)であり、プレバイオティック食物繊維を含む栄養摂取量を評価する。さらに、Dietitians Australia Healthy Eating Assessment(脚注2参照)3から改良された専用のオンライン食事スクリーナーが、適格性の評価と食事遵守のモニタリングのために開発された。このスクリーナーは、野菜、果物、パンとシリアル、乳製品、肉類とその代替品、任意選択、アルコール、プレバイオティクスが豊富な食品、発酵食品の摂取量を測定した。食事の質に関する総合スコア(0~100)と1日当たりのプレバイオティクス摂取量(グラム)が算出された。
2.5.3. アドヒアランス
サプリメントのアドヒアランスは8週目に返送されたカプセル数で評価し、食事のアドヒアランスは0週目、2週目、4週目、6週目、8週目、20週目に目的別に作成した食事スクリーナーを用いて評価した。
2.6. 無作為化と盲検化
Permuted block randomisation(1ブロックにつき4人)を用いて、隠蔽されたランダム割り付け順序に従い、1:1:1:1の割り付け比率で参加者を4つの介入のいずれかに割り付けた。無作為化ソフトウェア4とMicrosoft Excelを用いて、利害関係のない第三者がシーケンスを作成した。サプリメントのボトル(BioCeuticals®社から提供された)は、ラベルに連番が振られている以外は、互いに同一であった。参加者、研究者、結果評価者はサプリメントの介入について盲検化された。食事介入の性質上、参加者と治験責任医師の盲検化は不可能であったが、データの洗浄と解析の準備は群割付を盲検化して行われた。
2.7. サンプルサイズ
α=0.05、β=0.80、臨界F(3,124)2.68の両側分析に基づき、試験後のプラセボ群と治療群間の差(Cohenのfが0.15、2群間比較ではCohenのdが0.30に相当)を検出するために、128人の参加者の募集を計画した。8週目(主要アウトカム)におけるプラセボに対する各治療群の対比は、利用可能なデータの半分しか使用しなかったため、統計的検出力が低かったことに注意されたい。したがって、この検出力分析は、この予備的RCTでは反保守的であった。最後に、サンプルサイズの計算では脱落を考慮していないが、これはintention-to-treat分析を採用することで部分的に対処した。
2.8. 統計解析
主要アウトカム(TMD)に対する治療効果を評価するために、線形混合効果モデルを用いたintention-to-treat解析が用いられた。このようなモデルは、被験者内の相関を考慮し、試験未完了者を含むすべての利用可能なデータを使用する。赤池情報量規準(AIC)を用いて、時間を連続変数、カテゴリー変数、対数変換連続変数として含むモデル間のモデル適合性を比較することにより、時間(試験来院)の非線形効果を評価した。連続時間が最も適合度が高く、全体を通して連続時間が使用された。すべての混合効果モデルには、参加者レベルのランダム切片が含まれていた。
主要アウトカムモデルには、ベースラインスコア、時間、治療、治療×時間を固定効果項として含めた。治療は、プラセボを参照カテゴリーとする4レベルのカテゴリー変数(プラセボ、プレバイオティクス食、プロバイオティクス、シンバイオティクス)とした。副次的アウトカムについては、ベースラインと8週目でのみ観察が可能であった。これらのモデルは、試験後のスコアをアウトカムとし、治療とベースラインのスコアを予測因子とした(すなわち、ランダム効果なし)、事前事後研究デザインで好ましい方法である(O'Connell et al.) 二次アウトカム尺度の合計PSS、WHO-5、LSEQについては、ほぼ正規分布している線形回帰モデルを用いた。比例オッズ(PO)モデルは、順序尺度化された副次的アウトカム、または明らかに正規性でないアウトカム(例えば、フロア効果による)に使用された:合計BAI、合計BDI、SF-36疲労およびウェルビーイングの下位尺度、およびRome-IV(Bürkner and Vuorre, 2019)。POモデルは、Rパッケージordinal(Christensen, 2015)を用いて適合させた。順序結果変数の閾値は、AICを最小化するモデルに従って、等距離、対称、または柔軟として推定した。
さらに、プレバイオティクス食とプロバイオティクスサプリメントの相互作用を評価するために、要因モデルを当てはめた(Simon and Freedman, 1997)。主要アウトカムについて、モデルには固定効果としてベースラインスコア、プレバイオティクス食、プロバイオティクス、プレバイオティクス食×プロバイオティクス、時間、プレバイオティクス食×時間、プロバイオティクス×時間、プレバイオティクス食×プロバイオティクス×時間の項が含まれた。プレバイオティック・ダイエットとプロバイオティクスの項は、それぞれ、与えられた治療を0.5、与えられなかった治療を-0.5としてコード化した。時間は、最終的な研究訪問が値0となるようにコード化した。2つの治療が相加的であった場合(すなわち、相互作用がなかった場合)、プレバイオティクス食×プロバイオティクスの相互作用項の係数は0となる。この交互作用の係数が正の場合は、2つの治療が拮抗していることを示し、交互作用の係数が負の場合は、治療が相乗的であることを示す。
各副次アウトカムについて、8週目のアウトカムデータの欠損を多重にインプットする感度分析を行った(補足テキスト1参照)。Cohen's d効果量は、ベースライン時のプール標準偏差を用いて算出した。多重比較の調整は行わなかったため、副次的アウトカムは探索的と考えるべきである。混合効果モデルはRパッケージnlmeを用いて適合させた。すべての解析にRバージョン4.0.5を使用した(R Core Team, 2019)。結果
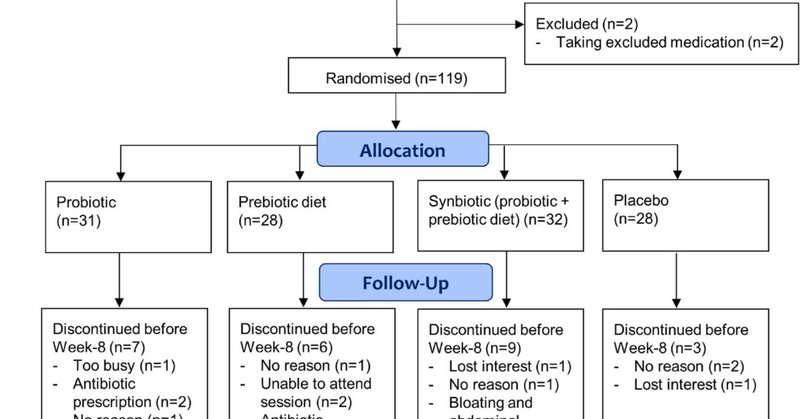
合計119名の参加者が4つの試験群に無作為に割り付けられた(プレバイオティクス食28名、プロバイオティクス30名、シンバイオティクス32名、プラセボ28名)。1名の参加者は、MHSオンライン評価センターの技術的エラーによりベースラインのPOMS 2-SFデータが回復できなかったため、主要アウトカムの解析には含まれなかった。したがって、118人の参加者が解析に含まれた。サンプルの社会人口統計学的および臨床的特徴を表1にまとめた。主要な人口統計学的および臨床的変数において、各群は類似していた。リクルートとフォローアップを記述したCONSORTチャートを図1に示す。試験の継続率は中程度で、93例(79%)が試験を完了した。非完了者はプレバイオティクス食群で6人、プロバイオティクス群で7人、シンバイオティクス群で9人、プラセボ群で3人であり、これは群間で同様であった[χ2(3)=2.85、p=0.42]。中止の主な理由は、興味喪失/理由なし(n=7)、除外薬物使用(例:抗生物質;n=6)、セッションに参加できない(n=5)、有害事象(n=3)であった。
表1
表1. サンプルの社会人口統計学的特徴および臨床的特徴。
図1
図1. CONSORTフロー図。
3.1. アドヒアランス
カプセルのアドヒアランスは全群で高かった:プロバイオティクス94.1%、プレバイオティクス食94.4%、シンバイオティクス94.0%、プラセボ95.8%。食事順守に関しては、目的別に作成した食事スクリーナーから推定されたプレバイオティック繊維の総摂取量が、補足表2に各時点における食事群と非食事群について表示されている。2週目から8週目までのプレバイオティクス総摂取量は、食事療法群が非食事療法群よりも大幅に多かった(すべてp<0.001)。すべての追跡調査において、ベースラインに比べてプレバイオティック繊維の摂取量が増加した試験完了者は、食事療法群で36人(85.7%)であったのに対し、非食事療法群では3人(5.9%)であった。
3.2. 盲検化の評価
サプリメントの盲検化がうまくいっているかどうかは、8週目のアンケート項目「あなたの意見では、あなたの試験用カプセルにはどのような製剤が含まれていましたか」で評価された。この回答(補足表3)は、盲検化が成功したことを示している。
3.3. 主要アウトカム 気分障害
各治療法をプラセボ群と比較したモデルの結果を表2に示す。TMD尺度に対する治療効果を図2に示す。8週目において、プレバイオティクス食がプラセボに対して気分障害を減少させたという中等度のエビデンスがあった[平均差(MD)=-6.97;95%CI=-13.6、-0.345;p=0.039;図1]。プロバイオティクスまたはシンバイオティクス治療が、プラセボと比較して気分障害を減少させたという証拠はほとんどなかった(それぞれ、MD = -2.17点;95%CI = -8.72、4.38;p = 0.51およびMD = -0.331、95%CI = -6.81、6.15;p = 0.92)。これらの効果量は、それぞれ-0.19および-0.03のCohenのdに相当した。注目すべきことに、2週目から8週目までの治療反応(症状の変化率)の傾きは、どの治療群もプラセボ群と差がなかった(治療×時間の交互作用:プレバイオティクス食群、プロバイオティクス群、シンバイオティクス群でそれぞれp=0.84、p=0.94、p=0.32)。すなわち、各群は2週目から8週目にかけて同程度の割合で改善する傾向があった(図2参照)。カプセルおよび食事のアドヒアランス率はいずれも非常に高かったため、治療反応が介入アドヒアランスによって緩和されるかどうかは検討しなかった。
表2
表2. 主要アウトカムおよび副次的アウトカムに対する治療の効果。
図2
図2. 治療別のベースライン時および推定追跡時のPOMS 2-SF総合気分障害(TMD)スコア。各訪問時のPOMS-2 TMDの非因子モデルに基づく推定値(群別)。モデルベースの予測値は、ベースラインのTMDスコアを平均として計算されている。POMS 2, Profile of Mood States 2-SF; SE, 標準誤差; BL, 0週目; W2, 2週目; W4, 4週目; W6, 6週目; W8, 8週目。
要因モデルでは、プレバイオティクス食とプロバイオティクス治療の間に拮抗的な相互作用の弱い証拠があった(相互作用推定値=8.80、95%CI=-0.48、18.1、p=0.063)。これは、シンバイオティクス群における気分障害の変化は、治療が相加的であった場合(すなわち、治療の相互作用がなかった場合)に予想されるよりも8.80ポイント大きいと推定され、反応が悪いことを示していた。
3.4. 副次的結果
副次的アウトカムの結果を表2に示す。プレバイオティクス食がBAIにおける不安症状を軽減した中等度のエビデンスがあった[より重篤な不安のオッズ比(OR)=0.290、95%CI=0.102、0.801;p=0. 018]、PSSの知覚ストレス(MD = -3.20, 95% CI = -5.82, -0.575; p = 0.017)、およびLSEQの自己評価睡眠(MD = 0.770, 95% CI = 0.119, 1.42; p = 0.021)の改善が、プラセボ群と比較して認められた。WHO-5、BDI、SF-36疲労・ウェルビーイング尺度では有益性のエビデンスはなかった(表2)。プロバイオティクス治療では、プラセボと比較して、SF-36ウェルビーイング尺度の改善の中等度の証拠(より良いウェルビーイングのOR=2.90、95%CI=1.10、7.77;p=0.032)と不安症状の改善の弱い証拠(より重い不安のOR=0.394、95%CI=0.142、1.07;p=0.069)があった。シンバイオティクス治療が副次的転帰を改善したという証拠はなかった。欠損アウトカムデータを多重にインプットした感度分析では、結果に実質的な変化は認められなかった(補足表4)。どの治療法も8週目のBMIに影響を与えたという証拠はなかった(すべてp>0.3)。
要因モデルでは、総BAI(p相互作用=0.053)、総PSS(p相互作用=0.12)、LSEQ全体平均(p相互作用=0.078)、およびSF-36ウェルビーイング下位尺度(p相互作用=0.12)において、プレバイオティクス食とプロバイオティクスサプリメントの間に拮抗的な相互作用の弱い証拠があった。WHO-5(p交互作用=0.30)、BDI総計(p交互作用=0.28)、SF-36疲労下位尺度(p交互作用=0.21)では、拮抗的な交互作用の証拠が弱かった。
3.5. 腸の健康症状に対する介入の効果
主要なRome-IV腸健康症状の経時的変化を各群について補足図3にプロットしたが、観察可能なパターンは認められなかった。症状は全般的に軽いようであった。シンバイオティクス治療が、プラセボと比較して、より重度の腹痛を有する確率を増加させたという弱い証拠があった(OR = 3.10, 95% CI = 1.00, 9.99; p = 0.053)(補足表6)。プラセボ群と比較して、治療が他の腸の健康パラメータに影響を与えたという明確な証拠はなかった。
3.6. 栄養アウトカムに対する食事介入の効果
プレバイオティックオリゴ糖およびレジスタントスターチの総摂取量、ならびに食事の質スコアを、食事介入を受けた群と受けなかった群で比較したのが補足表5である。8週目では、食事療法を受けた2群は非摂食群より平均推定総オリゴ糖摂取量が3.25g/日多かった(95%CI = 2.22, 4.28, p < 0.001)。同様に、食事療法群では、レジスタントスターチの平均推定総摂取量が多く(MD = 2.15g/日、95%CI = 1.15、3.16、p < 0.001)、食事の質スコアも高かった(MD = 5.32、95%CI = 1.57、9.06、p = 0.006)。
3.7. 20週目の追跡
8週目の試験終了から20週目の追跡調査(n = 70)までのPOMS 2-SFにおける気分障害の変化を、各群について補足図1に示した。第20週では、気分障害はプラセボと比較して各治療群で低かったものの、差の証拠はほとんどなかった(プレバイオティクス群、プロバイオティクス群、シンバイオティクス群それぞれについて、MD=-5.85、95%CI=-13.9、2.7、p=0.15、MD=-5.07、95%CI=-13.0、2.88、p=0.21、MD=-5.97、95%CI=14.2、2.31、p=0.16)。補足図2は、食事療法群と非食事療法群における1日の平均プレバイオティック繊維摂取量を示している。追跡調査において、食事療法群のプレバイオティック繊維摂取量は大幅に減少し、ベースラインレベルをわずかに上回る程度であった。1日の総プレバイオティック繊維摂取量が、追跡調査時に食事療法群の方が非食事療法群より多かったという証拠はほとんどなかった(MD = 0.608g/日、95%CI = -0.121, 1.34、p = 0.10)。
3.8. 有害事象
有害事象はまれであり、治療群間で同様の分布であった(表3参照)。最も多く報告された有害事象は、腹部膨満感、ガス、腹部不快感、風邪・インフルエンザ症状、副鼻腔の問題、便通の変化、頭痛であった。
表3
表3. 有害事象の発生率考察
Gut Feelings試験では、高プレバイオティクス食、プロバイオティクスサプリメント、およびそれらのシンバイオティクスの組み合わせが成人のメンタルヘルス症状に及ぼす影響を評価した。その結果、高プレバイオティクス食はプラセボに比べて主要アウトカムである顎関節症の症状を改善した。他の試験群では有意な効果は認められなかった。不安、知覚ストレス、睡眠の改善も高プレバイオティクス食に対して認められた。プロバイオティクスサプリメントでは、ウェルビーイングの改善が認められたが、この結果は予備的なものと考えるべきである。予想外なことに、プロバイオティクスと高プレバイオティクス食のシンバイオティクスの組み合わせには効果が認められなかった。
高プレバイオティクス食を8週間摂取することで、全体的な気分障害と不安の改善が認められた。プレバイオティクスが豊富な食事介入とメンタルヘルスに特化した先行文献は比較のために存在しないが、Liuら(2019年)による最近のメタアナリシスでは、単離されたプレバイオティクス繊維サプリメントとプロバイオティクスサプリメントの心理的症状に対する効果が調査された。高プレバイオティクス食に関する今回の結果とは逆に、プレバイオティクスサプリメントに対するうつ症状(Cohenのd=-0.08、p=0.51)や不安症状(d=0.12、p=0.11)に対する有意な有益性は認められなかった。メタアナリシスに含まれる研究が少ないことはさておき、この不一致にはいくつかの可能性がある。第一に、プレバイオティクス繊維の単離製剤は、プレバイオティクスが豊富な植物性食品を多く含む食事よりも効果が低い可能性がある。われわれの治療食は、いくつかの食品群にわたって高プレバイオティクス食品を最小限に加工したものを摂取しており、ほとんどのプレバイオティクスサプリメント製剤よりも幅広いプレバイオティクス繊維および候補プレバイオティクス(例えば、短鎖FOS、GOS、イヌリン、β-グルカン、レジスタントスターチ、ポリフェノール)の摂取を促進しており、異なる発酵効果を誘導している可能性がある(Williams et al.) 第二に、おそらく高プレバイオティクス食から観察された精神衛生上の利点は、単にプレバイオティクスの作用とは対照的に、野菜、果物、総繊維の摂取量の増加(およびその結果としての食事のマクロおよび微量栄養素組成の変化)に部分的に起因している可能性がある(Giri and Sharma, 2022)。実際、我々の研究では、高プレバイオティクス食を摂取した人は、試験終了時にオリゴ糖とレジスタントスターチの摂取量が非摂取群より有意に多かっただけでなく、食事の質のスコアも非摂取群より高く、食事パターンが全体的に改善したことを示している。さらに、天然のホールフードでは、プレバイオティック繊維は、他の形態の食物繊維、ミネラル、ビタミン、植物化学物質、および他の生物活性化合物と協調して存在する。例えばオーツ麦には、レジスタントスターチ、β-グルカン、アラビノキシラン、ステロール、フェノール化合物とともに、フルクタンとGOS(Biesiekierskiら、2011)が含まれている(Rose、2014)。全粒穀物に最も多く含まれるフェノールであるフェルラ酸は、抗炎症活性を示し、酸化還元経路に影響を与え、神経学的効果を発揮する可能性がある(Neacsu et al.) これらのことを考慮すると、プレバイオティクスの高い食事は、腸内細菌叢に依存した結果だけでなく、食事全般の改善による保護効果も促進すると考えられる。
Firthら(2019、2021)による最近のメタアナリシスでは、主に非臨床サンプルにおけるメンタルヘルスへの食事介入の研究が検討された。非活動的対照と比較して、通常繊維質の豊富な植物性食品の摂取を増やすことを含む食事改善は、抑うつ症状を緩やかに減少させたが(ヘッジのg = 0.114、p = 0.035)、不安症状は減少しなかった(g = 0.077、p = 0.302)。対照的に、高プレバイオティクスの食事介入に対する反応では、抑うつ症状よりも不安症状の方が有益であり、顎関節症も減少するという比較的強いエビデンスが認められた。偶然の発見である可能性もあるが、この乖離は、高プレバイオティクス食の生物学的または心理学的効果と、より広範に食事の質を標的とした介入との明確な違いを反映している可能性もある。高プレバイオティクス食がプレバイオティクスサプリメントよりも精神的健康症状の改善をもたらしうる理由の第3の説明は、サプリメントは食事介入とは異なり、盲検化やプラセボ対照が容易であるということである。今回の研究で観察された高プレバイオティクス食の効果の大きさは、プラセボ効果やホーソン効果のような症状報告に関するバイアスの結果かもしれない。一方、もしそのような効果がエンドポイントを改善する原動力となるのであれば、これはシンバイオティクス介入にも当てはまるはずである。注目すべきは、我々の研究で用いられた高プレバイオティクス食は、試験終了時の胃腸症状やBMIを変化させなかったことである。したがって、その心理的な利点の可能性は、それぞれ腸機能の改善や体重減少の認知に起因するものではない。後者の知見は、体重変化とは無関係に抑うつ症状の改善を達成した、臨床うつ病患者を対象とした別の食事介入研究と一致している(Jacka et al.)
高プレバイオティクス食は気分症状の軽減と関連していたにもかかわらず、2週目から8週目までプレバイオティクス群とプラセボ群との間で治療反応の傾きに差はみられず、食事による明らかな気分改善効果の多くは治療開始後2週間の間に生じたことが示された。その後、気分の改善効果は持続したが、プラセボと比較して増加することはなかった。同様のパターンが、食事療法群におけるプレバイオティック繊維の摂取量についても認められ、これは2週目から8週目まで安定したレベル(非食事療法群よりかなり高い)で維持された(補足表2参照)。腸内細菌叢の組成および遺伝子発現は、5日間という短期間の食事介入によって調節される可能性があることから(2014年)、試験の最初の2週間で達成されたこのような迅速な治療効果は、生物学的に妥当であると考えられる。20週目の追跡データが示すように(補足図1、2)、気分効果は可逆的である可能性があり、これはプレバイオティクス摂取量がベースライン近くまで低下するのに伴い、高プレバイオティクス食の中止後に腸内生態系が以前の組成に戻るためと予想される。
試験中、参加者のプレバイオティクス摂取量が大幅に増加したことで、乳酸菌、ビフィズス菌、酪酸産生種などの有益な腸内細菌の増殖が促進され(So et al. メカニズム的には、このような効果は、プレバイオティクス発酵から産生される腸内微生物の代謝産物であるSCFA(主に酢酸、酪酸、およびプロピオン酸)に部分的に起因すると考えられる。このプロセスには、プレバイオティクスからSCFAへの直接発酵と、ある微生物の発酵最終産物が他の微生物によって利用されてSCFAを産生するクロスフィーディングによる間接発酵の両方が関与している可能性がある(Holscher, 2017)。SCFAは腸管バリアの完全性と腸管免疫をサポートし、末梢の炎症、ひいては神経炎症から保護する(Berdingら、2021a)。酪酸塩はまた、中枢神経系と直接相互作用し、ミクログリアの炎症反応を制御する(Huuskonenら、2004;Swannら、2019)。このようなSCFAの抗炎症作用に伴い、オリゴ糖(FOSやGOSなど)の補給がC反応性タンパク質(CRP)濃度を低下させることがメタ分析で示されている(McLoughlinら、2017)。また、SCFAは血液脳関門を強化し、神経伝達物質や神経栄養因子のレベルを調節することができる(Berdingら、2021a)。さらに、SCFAはヒトの心理社会的ストレスに対するコルチゾール反応を低下させ(Dalile et al. これと一致して、2つのプレバイオティクス介入がコルチゾールレベルの低下をもたらした(Schmidtら、2015;Farhangiら、2018)。本研究では、潜在的なメカニズムを追跡するために糞便代謝産物や炎症マーカーを測定していないが、将来の論文で参加者の糞便微生物叢組成の変化とメンタルヘルスアウトカムについて分析する予定である。
主要アウトカムである顎関節症に対する有益な効果に加えて、高プレバイオティクス食は試験終了時に知覚ストレス(PSSで評価)と睡眠(LSEQ)の改善ももたらすようであった。知覚ストレスの改善は、3週間のGOSサプリメント摂取後に起床時のコルチゾール(ストレスホルモン)が低下したことを報告した研究(Schmidtら、2015年)や、プレバイオティクスと発酵食品の両方を多く含む食事を4週間摂取した後に、群内、用量依存的に知覚ストレスが低下したことを報告した研究(Berdingら、2022年)と一致している。我々の結果は、FOS(Schmidtら、2015年)、キシロオリゴ糖(Childsら、2014年)、リュウゼツランフルクタン(Ramnaniら、2015年)、またはイヌリンが豊富な野菜(Hielら、2019年)の摂取後にストレスに対する効果をもたらさなかったプレバイオティクス介入とは異なる。期間、ストレスの測定方法、サンプルサイズ、プレバイオティクスの種類における研究間のばらつきが、効果の違いを部分的に説明しているかもしれない。プレバイオティクス食に反応して睡眠が改善するという我々の発見は、有望な動物(Thompsonら、2017年)や乳児(Colomboら、2021年)の研究と一致しているが、我々の研究は睡眠の改善を報告した最初のヒト成人プレバイオティクス試験であるようだ。睡眠に変化がないと報告したヒトの研究では、FOSとイヌリンの混合物(Smith, 2005; Buigues et al., 2016)、またはGOS(Johnstone et al. 興味深いことに、SCFAや神経活性ステロイドなど、プレバイオティクス発酵に反応して産生される腸内微生物の代謝産物が、ストレス生理(Thompsonら、2017、2020;van de Wouwら、2018)と睡眠(Thompsonら、2017)の両方を調節する上で重要な役割を果たす可能性があることが、最近の前臨床文献で示されている。したがって、ストレスと睡眠への影響を明らかにするためには、高プレバイオティクス食を用いたヒトでの更なる研究が推奨され、特に、潜在的なメカニズムの調査を可能にする糞便メタボローム解析が推奨される。
プロバイオティクス投与によりウェルビーイングの改善(SF-36ウェルビーイング下位尺度による評価)と不安(BAI)改善の弱いエビデンスが得られたが、探索的な性質のため、これらの知見は慎重に解釈されるべきであることを強調する。主要アウトカムである顎関節症に対するプロバイオティクスの有益性のエビデンスはほとんどなかった。最近のメタアナリシスは、同様の集団における我々のプロバイオティクスの結果と一致しているようである。Liuら(2019)は、プロバイオティクスが不安と抑うつ症状の軽減をもたらすことを見出したが、効果量は小さかった(抑うつのCohen's d = -0.24、不安のCohen's d = -0.10)。さらに、著者らは、プロバイオティクスによって誘発されたより大きなメンタルヘルス効果は、臨床サンプルとコミュニティサンプルで明らかになったが、後者は単独では有意ではなかった。他のメタアナリシスでは、1つの例外(McKean et al., 2017)を除き、非臨床集団ではメンタルヘルスに対するプロバイオティクス効果がないことが報告されている(Ng et al., 2018; Reis et al., 2018; Goh et al., 2019; Chao et al., 2020)。このような情報を考慮すると、プロバイオティクスがウェルビーイングや不安を改善する可能性があるという我々の知見は、より大規模なサンプルにおいてさらなる再現が必要であり、不安については、我々の結果は非臨床集団から抽出された既存のデータと一致している。また、プロバイオティクスの効果は菌株特異的であるようであり(McFarland et al.
本研究の予期せぬ発見は、高プレバイオティクス食の観察された気分の利点は、プロバイオティクスサプリメントと組み合わせた場合には明らかではなかったことである。このことは、プレバイオティクス食事がプレバイオティクス介入群で観察された転帰を改善させたという証拠として、我々の所見を解釈することには慎重でなければならないことを意味する。シンバイオティクス群では、プレバイオティクス食とプロバイオティクスサプリメントとの間に顎関節症に対する拮抗的な相互作用の弱いエビデンスがみられた(p = 0.063)。具体的には、プロバイオティクスとプレバイオティクスの治療が相加的であった場合、すなわち相互作用がなかった場合に予想されるスコアと比較して、シンバイオティクス治療はPOMS 2-SFスコアを8.8ポイント悪化させた。この拮抗的相互作用は、プレバイオティクス食とプロバイオティクスのシンバイオティクス併用が有害であることを意味するものではないことに注意することが重要である。むしろ、シンバイオティクス群は試験終了時にTMDについてプラセボ群と同様の結果に達しており、要因計画で予想される相加効果や相乗効果をはるかに下回っている。副次的アウトカムである不安(BAIによる評価)、ストレス(PSS)、睡眠(LSEQ)、ウェルビーイング(SF-36ウェルビーイング下位尺度)についても、プレバイオティクス食とプロバイオティクスとの拮抗的相互作用の弱いエビデンスが同様に認められた。しかしながら、拮抗的な相互作用に関する結論は、この研究がそのような相互作用を検出するのに適切な検出力を有しておらず(Simon and Freedman, 1997)、主要アウトカムに関する相互作用効果の95%信頼区間が非常に広かった(-0.41~18.1)という事実によって抑制されるべきである。
シンバイオティクスはプロバイオティクスやプレバイオティクス単独よりも腸内細菌叢(Saulnierら、2008)やSCFA産生(Childsら、2014)を刺激することが報告されているため、シンバイオティクス併用がプレバイオティクス食のみの介入と同様に有益な効果をもたらさなかったと思われる理由は不明である。さらに、シンバイオティクスは心理学的転帰を改善し(Haghighatら、2021年;Moludiら、2022年)、炎症マーカーCRPと腫瘍壊死因子αを減少させ(McLoughlinら、2017年)、酸化ストレスを減少させ(Salehi-Abargoueiら、2017年)、血清脳由来神経栄養因子レベルを増加させることが示されている(Haghighatら、2021年)。プレバイオティクスとシンバイオティクスの治療効果が異なることの説明として、無作為の偶然を否定することはできないが、他の説明も考えられる。第一に、摂取したプロバイオティクス細菌が内因性微生物叢とプレバイオティクス食餌基質をめぐって競合し(O'Toole and Cooney, 2008)、酪酸産生菌などの内因性細菌が利用できる基質が減少した結果、酪酸産生が低下した可能性がある。第2に、シンバイオティクスによって腸内細菌叢の刺激が増強された結果、腸の症状が増加する可能性がある。このようなシナリオでは、腹部膨満感などの腸に関連した不快感によって、治療効果がやや減少する可能性がある。この可能性は、Rome-IVの腸の健康データの解析で調査された。腹部膨満感、便秘、便の質が悪化したという証拠はなかったが、シンバイオティクスがプラセボに比べて腹痛の重症度を増加させたという決定的ではないが示唆的な証拠があった(OR = 3.10; p = 0.053)。高プレバイオティクス食とプロバイオティック処方の相互作用の可能性は、将来、より大規模な試験で評価されるべきであり、そのような研究では、症状が精神的健康の変化を媒介するかどうかを明らかにするために、腸症状の尺度を採用することが推奨される。
4.1. 長所と限界
本研究の長所には、介入の無作為化、プロバイオティクス介入の二重盲検化、目的に合わせたFFQによるアドヒアランスの定期的評価、ベースラインの精神的健康度が均質であること、参加者の継続率が中程度に高いことなどがある。弱点もある。第1に、参加者および研究者は食事介入の割り付けについて盲検化されていなかったため、参加者が症状をどのように認識し、または報告したかに影響を与えた可能性があり、自己報告測定にバイアスをもたらした可能性がある。第2に、プレバイオティクスの食事介入とプラセボサプリメントの対照は、真の「プラセボ対照」比較ではない可能性がある。参加者はプロバイオティックサプリメントよりも食事介入に対してより大きな期待を持っていた可能性があり、このことは試験では十分に「コントロール」されていなかった可能性がある。第3に、治療比較では比較的小さなサンプルサイズしか得られなかった。最後に、サンプルは非臨床患者で構成され、そのほとんどが高学歴で比較的社会経済的地位の高い人であったため、今回の知見の外部妥当性には限界がある。さらに、我々のサンプルは大部分が女性であり、女性は男性よりも食事介入からより大きな精神衛生上の利益を享受するようである(Firthら、2019)。これらの理由から、我々の結果が男性、臨床グループ、または異なる社会経済的地位の集団に拡大するかどうかは不明である。
4.2. 意義
本研究の結果は、増加しつつある栄養精神医学研究(Sarris, 2019)に追加され、非臨床集団において有用である可能性のある戦略に関する予備的な洞察を提供するものである。我々の知見は、プレバイオティクスに富む全植物性食品の摂取量を増やすことを含む比較的単純な食事の変化がうつ病に有益であると報告された、うつ病疾患におけるこれまでの介入とある程度一致している(Jackaら、2017;Francisら、2019;Parlettaら、2019)。このような変化は、簡単で、経済的で(Opieら、2015年)、費用対効果が高く(Chattertonら、2018年;Segalら、2020年)、安全に実施できるようである。さらに、プレバイオティクスの抗炎症作用(McLoughlin et al., 2017)、およびプレバイオティクスが豊富な食品を多く摂取することが食事全体の質を改善するという我々の知見を考慮すると、プレバイオティクスが豊富な食品を毎日数食継続的に摂取することは、メンタルヘルス問題と併存することが多い身体疾患の発症を抑制することにも役立つ可能性がある。介入の実施可能性については、登録栄養士が食育セッションを行ったが、非同期のビデオ媒体で行われたため、より大規模な集団への拡張性が高まった。結論
要約すると、これは高プレバイオティクス食介入、プロバイオティクスサプリメント、およびそれらの併用による精神的健康の転帰を検討した初のRCTであった。我々は、プレバイオティクスが豊富な全植物性食品を多く含む食事が、非臨床成人において、自己申告による気分障害、不安、ストレスを軽減し、睡眠を改善する可能性があることを見出した。したがって、高プレバイオティクス食は、非臨床集団における精神的健康の促進に有用な戦略であるかもしれない。本研究で使用された特定のプロバイオティクス菌株の組み合わせの使用を支持するエビデンスは限られており、このプロバイオティクスと高プレバイオティクス食とのシンバイオティクス組み合わせについては、今回のサンプルにおける精神的健康の改善に関するエビデンスは認められなかった。臨床集団と非臨床集団の両方におけるより大規模な確認的RCTが必要である。
データの利用可能性
本研究で提示されたデータセットはオンラインリポジトリにある。リポジトリ名とアクセッション番号は、https://osf.io/ye8b7/。
倫理声明
ヒト参加者を含む研究は、Melbourne Clinic Research Ethics Committee (TMCREC 289)により審査・承認された。患者/参加者は、本研究に参加することについて書面によるインフォームド・コンセントを提供した。
著者貢献
JS、TF、FJ、JH、RO、JRが本研究の構想およびデザインに貢献した。TF、GO、JSはプロジェクトの運営にあたった。TFとROは介入を開発した。TFとGOが介入を実施した。JSとCNがスーパーバイザーを務めた。TF、LC、N-JMはデータキュレーションを管理し、原稿を執筆した。統計解析はLCとTFが行った。著者全員が原稿の改訂に貢献し、提出された原稿を承認した。
資金提供
BioCeuticals: プロバイオティクスとプラセボのサプリメント (www.bioceuticals.com.au); The Healthy Grain: 大麦ベースの朝食用シリアル (www.thehealthygrain.com); Uncle Tobys: ロールドオーツ、ミューズリー、フルーツ/グレインスナックバー (www.uncletobys.com.au); Sanitarium: 小麦ビスケット朝食用シリアル (www.sanitarium.com.au); Ward McKenzie's: 乾燥豆類 (www.mckenziesfoods.com.au); Real Foods: コーンクリスプブレッド (www.cornthins.com) から現物出資を受けた。スポンサーは、研究デザイン、データ収集および分析、発表の決定、原稿の作成には関与していない。
謝辞
本研究への参加者の貴重な貢献に感謝する。また、Jenifer Murphy博士とRosemary Arnold女史には研究デザインに協力いただき、Amy Loughman博士には専門的な方法論的支援を、Jane Muir博士には高プレバイオティクス食介入に関する専門知識を提供していただいた。研究データの大部分は、メルボルン大学でホストされているREDCap電子データ収集ツールを用いて収集・管理された。
利益相反
JSは、発表謝礼、出張支援、臨床試験助成金、書籍印税、または独立コンサルタント料のいずれかを受け取っている: Integria Healthcare and MediHerb、Pfizer、Scius Health、Key Pharmaceuticals、Taki Mai、Fiji Kava、Noetic Foundry、FITBioCeuticals、Blackmores、Soho-Flordis、Healthworld、HealthEd、HealthMasters、Kantar Consulting、Angelini Pharmaceuticals、Grunbiotics、Polistudium、Australian Natural Therapeutics Group、Research Reviews、 Elsevier、Chaminade University、International Society for Affective Disorders、Complementary Medicines Australia、SPRIM、Terry White Chemists、ANS、Society for Medicinal Plant and Natural Product Research、Sanofi-Aventis、Omega-3 Centre、National Health and Medical Research Council、CR Roper Fellowship。
CNはルンドベック、グルンバイオティクス、セルヴィエ、ヤンセン・シラグ、イーライリリーのコンサルタントを務め、ワイスとルンドベックから研究助成金を受け、セルヴィエ、ルンドベック、ブリストル・マイヤーズ スクイブ、オルガノン、イーライリリー、グラクソ・スミスクライン、ヤンセン・シラグ、アストラ・ゼネカ、ファイザーから講演謝礼を受けている。
JRは過去5年間にHealth Research Council (NZ)、Waterloo Foundation、Vic Davis Memorial Trust、UC Foundation、Canterbury Medical Research Foundation、GAMA Foundation、Foundation for Excellence in Mental Health Careから研究助成を受け、Harper Collinsからは書籍の印税を受け取っている。
FJはNHMRC Investigator Grant(#1194982)の支援を受けている。彼女は以下を受けた: (1)国立保健医療研究評議会(NHMRC)脳と行動研究所、オーストラリアン・ロータリー・ヘルス、ジーロング医学研究財団、イアン・ポッター財団、メルボルン大学から競争的資金/研究支援、(2)オーストラリア食肉家畜生産者事業団、ウールワース・リミテッド、A2ミルク・カンパニー、ビーフィット・フーズ、ベガ・デイリーから研究に対する産業界の支援; (3) Fernwood Foundation、Wilson Foundation、JTM Foundation、Serp Hills Foundation、Roberts Family Foundation、Waterloo Foundationからの慈善活動支援、(4) Sanofi-Synthelabo、Janssen Cilag、Servier、Pfizer、Network Nutrition、Angelini Farmaceutica、Eli Lilly、Metagenics、The Beauty Chefからの出張支援と講演謝礼。FJは商業出版用に2冊の本を執筆。JHはProbioticAdvisor.comの最高研究責任者である。
残りの著者は、潜在的な利益相反と解釈されうる商業的または金銭的関係がない中で研究が行われたことを宣言する。
発行者注
本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fnins.2022.1097278/full#supplementary-material に掲載されている。
脚注
^ www.monash.edu/medicine/ccs/gastroenterology/prebiotic
^ www.cnaq.com.au
^ www.healthyeatingquiz.com.au
^ www.sealedenvelope.com
参考文献
相澤英明、辻秀樹、浅原拓也、高橋俊彦、寺石拓也、吉田聡、他(2016).大うつ病性障害患者の腸内細菌叢におけるBifidobacteriumとLactobacillusの関連性の可能性。J. Affect. Disord. 202, 254-257. doi: 10.1016/j.jad.2016.05.038
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Al-Sheraji, S. H., Ismail, A., Manap, M. Y., Mustafa, S., Yusof, R. M., and Hassan, F. A. (2013). 機能性食品としてのプレバイオティクス: A review. J. Funct. Foods 5, 1542-1553.
Google Scholar
Barrett, J. S., and Gibson, P. R. (2010). FODMAP摂取量およびグリセミック指数を含む包括的な半定量的食物摂取頻度調査票の開発と検証。J. Am. Diet. Doi:10.1016/j.jada.2010.07.011。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Beck, A. T., Epstein, N., Brown, G., and Steer, R. A. (1988). 臨床不安を測定するための目録: 心理測定学的特性。J. Consult. Clin. Psychol. 56, 893-897.
Google Scholar
Beck, A. T., Steer, R. A., and Brown, G. K. (1996). ベックうつ病目録(BDI-II)。ロンドン: ピアソン。
Google Scholar
Berding, K., Bastiaanssen, T. F. S., Moloney, G. M., Boscaini, S., Strain, C. R., Anesi, A., et al. ストレスに対処するために微生物を養う: サイコバイオティクス食は、健康な成人集団における微生物の安定性と知覚ストレスに影響を与える。モル。Psychiatry doi: 10.1038/s41380-022-01817-y
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Berding, K., Vlckova, K., Marx, W., Schellekens, H., Stanton, C., Clarke, G., et al. 食事と微生物叢-腸-脳軸: 良好な精神的健康の種をまく。栄養学の進歩 12, 1239-1285.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Berding, K., Carbia, C., and Cryan, J. F. (2021a). 食物繊維、認知、そして微生物: 食物繊維、認知、そして微生物叢-腸-脳軸。Exp. Biol. Med. 246, 796-811.
パブコメ抄録|全文|Google Scholar
Biesiekierski, J., Rosella, O., Rose, R., Liels, K., Barrett, J., Shepherd, S., et al. 加工穀類およびシリアル中のフルクタン、ガラクトオリゴサッカリドおよびその他の短鎖炭水化物の定量化。J. Hum. Nutr. Diet. 24, 154-176. doi: 10.1111/j.1365-277X.2010.01139.x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bravo, J. A., Forsythe, P., Chew, M. V., Escaravage, E., Savignac, H. M., Dinan, T. G., et al. 乳酸菌の摂取は、迷走神経を介してマウスの情動行動と中枢性GABA受容体の発現を制御する。Proc. Natl. Acad. (1)乳酸菌は迷走神経を介して情動行動と中枢性GABA受容体の発現を制御する。
パブコメ抄録|クロスリード全文|Google Scholar
Buigues, C., Fernández-Garrido, J., Pruimboom, L., Hoogland, A. J., Navarro-Martínez, R., Martínez-Martínez, M., et al. 虚弱症候群に対するプレバイオティクス製剤の効果: 無作為化二重盲検臨床試験。Int. J. Mol. Doi: 10.3390/ijms17060932.
PubMed Abstract|RefRef Full Text|Google Scholar
Bürkner, P.-C., and Vuorre, M. (2019). 心理学における順序回帰モデル.A tutorial. Adv. Methods Pract. Psychol. Sci. 2, 77-101.
Google Scholar
Cani, P. D., Neyrinck, A. M., Fava, F., Knauf, C., Burcelin, R. G., Tuohy, K. M., et al. 腸内細菌叢におけるビフィズス菌の選択的増加は、内毒素血症と関連した機序により、マウスの高脂肪食誘発糖尿病を改善する。Diabetologia 50, 2374-2383.
PubMedアブストラクト|全文|Google Scholar
Chan, A. W., Tetzlaff, J. M., Altman, D. G., Laupacis, A., Gøtzsche, P. C., Krleža-Jerić, K., et al. SPIRIT 2013声明: 臨床試験の標準プロトコール項目の定義。Ann. Intern. Med. doi: 10.7326/0003-4819-158-3-201302050-00583
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chao,L.、Liu,C.、Sutthawongwadee,S.、Li,Y.、Lv,W.、Chen,W.、他(2020)。プロバイオティクスの、ストレス条件下またはうつ病または不安症と診断された健康な参加者のうつ病または不安症の変数に対する効果: ランダム化比較試験のメタアナリシス。Front. Neurol. 11:421. doi: 10.3389/fneur.2020.00421
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chatterton, M. L., Mihalopoulos, C., O'Neil, A., Itsiopoulos, C., Opie, R., Castle, D., et al. 大うつ病成人に対する食事介入の経済評価(「SMILES」試験)。doi: 10.1186/s12889-018-5504-8.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Childs, C. E., Röytiö, H., Alhoniemi, E., Fekete, A. A., Forssten, S. D., Hudjec, N., et al. キシロオリゴ糖単独またはビフィドバクテリウム・アニマリス・サブスピーシー・ラクティスとのシンバイオティクス併用は、健康成人においてビフィズス形成を誘導し、免疫機能のマーカーを調節する: 二重盲検、プラセボ対照、無作為化、要因クロスオーバー試験。Br. J. Nutr. 111, 1945-1956.
Google Scholar
Christensen, R. H. B. (2015). Ordinal-regression models for ordinal data. R Package Version 28.
Google Scholar
Chudzik, A., Orzyłowska, A., Rola, R., and Stanisz, G. J. (2021). うつ症状の緩和に関するプロバイオティクス、プレバイオティクス、ポストバイオティクス: 脳-腸-マイクロバイオーム軸の調節。バイオモレキュールズ11:1000.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cohen, S., Kamarck, T., and Mermelstein, R. (1983). 知覚ストレスのグローバル尺度。J. Health Soc. Behav. 24, 385-396.
Google Scholar
Colombo, J., Carlson, S. E., Algarín, C., Reyes, S., Chichlowski, M., Harris, C. L., et al. プレバイオティクスを添加した牛乳ベースの乳児用調製粉乳を摂取した乳児の睡眠覚醒パターンに対する発達効果: ランダム化比較試験。Pediatr. 論文概要|大塚製薬株式会社(2021):プレバイオティクスを添加した牛乳ベースの乳児用調製粉乳を摂取した乳児の睡眠・覚醒パターンの発達効果:無作為化比較試験。
パブコメ抄録|全文|Google Scholar
Cryan, J. F., and Dinan, T. G. (2012). 心を変える微生物: 腸内細菌叢が脳と行動に及ぼす影響。Nat. Rev. Neurosci. 13, 701-712.
パブコメ抄録|Ref 全文|Google Scholar
Cryan, J. F., O'Riordan, K. J., Cowan, C. S. M., Sandhu, K. V., Bastiaanssen, T. F. S., Boehme, M., et al. 微生物叢-腸-脳軸。Physiol. Rev. 99, 1877-2013. doi: 10.1152/physrev.00018.2018.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cummings, J. H., Macfarlane, G. T., and Englyst, H. N. (2001). プレバイオティクスの消化と発酵。Am. J. Clin. Nutr. 73, 415S-420S.
Google Scholar
Curran, S., Andrykowski, M., and Studts, J. (1995). Profile of Mood States (POMS-SF)の短形式: 心理測定情報。Psychol. doi: 10.1037/1040-3590.7.1.80.
クロスレフ・フルテキスト|Google Scholar
Dalile, B., Vervliet, B., Bergonzelli, G., Verbeke, K., and Van Oudenhove, L. (2020). 大腸送達短鎖脂肪酸は、健常男性の心理社会的ストレスに対するコルチゾール反応を減弱させる: 無作為化プラセボ対照試験。神経精神薬理学 45, 2257-2266.
パブコメ要旨|全文|Google Scholar
David, L. A., Maurice, C. F., Carmody, R. N., Gootenberg, D. B., Button, J. E., Wolfe, B. E., et al. 食事はヒトの腸内細菌叢を迅速かつ再現性よく変化させる。Nature 505:7484.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Deehan, E. C., and Walter, J. (2016). The fiber gap and the disappearing gut microbiome: ヒトの栄養への示唆。Trends Endocrinol. Metab. 27, 239-242. doi: 10.1016/j.tem.2016.03.001
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Desmedt, O., Broers, V. J. V., Zamariola, G., Pachikian, B., Delzenne, N., and Luminet, O. (2019). ヒト介入研究におけるプレバイオティクスの情動と認知に対する効果。Nutr. Rev. 77, 81-95. doi: 10.1093/nutrit/nuy052.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dinan, T. G., Stanton, C., and Cryan, J. F. (2013). サイコバイオティクス: 向精神薬の新しいクラス。Biol. 精神医学 74, 720-726.
パブコメ抄録|全文|Google Scholar
WHO (2002). 食品中のプロバイオティクス評価のためのガイドライン: 食品中のプロバイオティクス評価のためのガイドライン作成に関するFAO/WHO合同作業部会報告書。ロンドン: FAO/WHO.
Google Scholar
Farhangi, M. A., Javid, A. Z., Sarmadi, B., Karimi, P., and Dehghan, P. (2018). 2型糖尿病女性における機能性食品としてのレジスタントデキストリンの有効性に関するランダム化比較試験: 視床下部-下垂体-副腎軸と免疫系を標的とする。Clin. Nutr. 37, 1216-1223. doi: 10.1016/j.clnu.2017.06.005
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Firth, J., Marx, W., Dash, S., Carney, R., Teasdale, S. B., Solmi, M., et al. うつ病と不安の症状に対する食事改善の効果: ランダム化比較試験のメタアナリシス。Psychosom. Med. 81, 265-280.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Firth,J.、Marx,W.、Dash,S.、Carney,R.、Teasdale,S. B.、Solmi,M.、他(2021)。うつ病と不安の症状に対する食事改善の効果: ランダム化比較試験のメタアナリシス: 第二誤謬。Psychosom. Med. 83, 265-280.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Francis, H. M., Stevenson, R. J., Chambers, J. R., Gupta, D., Newey, B., and Lim, C. K. (2019). 簡単な食事介入は若年成人のうつ症状を軽減することができる-無作為化比較試験。PLoS One 14:e0222768. doi: 10.1371/journal.pone.0222768.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gibson, G. R., Hutkins, R., Sanders, M. E., Prescott, S. L., Reimer, R. A., Salminen, S. J., et al. 専門家合意文書: The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 14, 506-514. doi: 10.1038/nrgastro.2017.75
PubMed Abstract|クロスリファレンス全文|Google Scholar
Giri, R., and Sharma, R. K. (2022). 食事におけるサイコバイオティクス: 神経活性および精神活性微生物代謝産物の意義と応用。Nutr. Rev. 80, 2002-2016. doi: 10.1093/nutrit/nuac019
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
郭 洙洙(Kuo, P.-H., Goh, K. K., Liu, Y.-W., Kuo, P.-H., Chung, Y.-C. E., Lu, M.-L., and Chen, C.-H. (2019). うつ症状に対するプロバイオティクスの効果: ヒト研究のメタアナリシス。Psychiatry Res. 282:112568. doi: 10.1016/j.psychres.2019.112568.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Haghighat, N., Rajabi, S., and Mohammadshahi, M. (2021). 血液透析患者における血清脳由来神経栄養因子レベル、うつ病および不安症状に対するシンバイオティクスおよびプロバイオティクスの補充効果: 無作為化二重盲検臨床試験。Nutr. Neurosci. 24, 490-499. doi: 10.1080/1028415x.2019.1646975
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Harris, P. A., Taylor, R., Thielke, R., Payne, J., Gonzalez, N., and Conde, J. G. (2009). Research electronic data capture (REDCap) - A metadata-driven methodology and workflow process for providing translational research informatics support. J. Biomed. Inform. 42, 377-381. doi: 10.1016/j.jbi.2008.08.010.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hiel, S., Bindels, L. B., Pachikian, B. D., Kalala, G., Broers, V., Zamariola, G., et al. 健康なヒトにおける腸の健康と栄養行動に対するイヌリンが豊富な野菜をベースとした食事の効果。Am. J. Clin. Nutr. 109, 1683-1695. doi: 10.1093/ajcn/nqz001
パブコメ抄録|全文|Google Scholar
Hill, C., Guarner, F., Reid, G., Gibson, G. R., Merenstein, D. J., Pot, B., et al. 専門家のコンセンサス文書: The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 11:491502.
Google Scholar
Hofmeister, M., Clement, F., Patten, S., Li, J., Dowsett, L. E., Farkas, B., et al. 抑うつ症状に対する腸内細菌叢を標的とした介入の効果: A systematic review and meta-analysis. CMAJ Open 9, E1195-E1204. doi: 10.9778/cmajo.20200283.
パブコメ抄録|全文|Google Scholar
Holscher, H. D. (2017). 食物繊維およびプレバイオティクスと消化管微生物叢。Gut Microbes 8, 172-184.
Google Scholar
Huuskonen, J., Suuronen, T., Nuutinen, T., Kyrylenko, S., and Salminen, A. (2004). 酪酸ナトリウムと短鎖脂肪酸によるミクログリア炎症反応の制御。Br. J. Pharmacol. 141, 874-880.
Google Scholar
Iannitti, T., and Palmieri, B. (2010). 臨床におけるプロバイオティクス製剤の治療的使用。Clin. 29:562048.
Google Scholar
Jacka, F. N., O'Neil, A., Opie, R., Itsiopoulos, C., Cotton, S., Mohebbi, M., et al. 成人の大うつ病患者に対する食事改善の無作為化比較試験('SMILES'試験)。BMC Med. 15:23. doi: 10.1186/s12916-017-0791-y
PubMed要旨|全文|Google Scholar
Jernberg, C., Löfmark, S., Edlund, C., and Jansson, J. K. (2007). 抗生物質投与がヒト腸内細菌叢に及ぼす長期的生態学的影響。ISME J. 1, 56-66.
Google Scholar
Jiang, H., Ling, Z., Zhang, Y., Mao, H., Ma, Z., Yin, Y., et al. Altered fecal microbiota composition in patients with major depressive disorder. Brain. Behav. Immun. 48, 186-194.
Google Scholar
Johnstone, N., Milesi, C., Burn, O., van den Bogert, B., Nauta, A., Hart, K., et al. 健康な女性(18~25歳)におけるガラクトオリゴ糖プレバイオティクスの抗不安作用と、それに対応する腸内細菌組成の変化。(2021)ガラクトオリゴ糖プレバイオティクスの健常女性(18-25歳)における抗不安作用とそれに伴う腸内細菌組成の変化.
パブコメ抄録|Ref 全文|Google Scholar
Kao, A. C. C., Harty, S., and Burnet, P. W. J. (2016). プレバイオティクスが神経生物学と行動に及ぼす影響。Int. Rev. Neurobiol. 131, 21-48.
Google Scholar
Kaur, I. P., Chopra, K., and Saini, A. (2002). プロバイオティクス: 医薬品への応用の可能性。Eur. J. Pharm. Sci. 15, 1-9. doi: 10.1016/S0928-0987(01)00209-3
クロスレフ・フルテキスト|Google Scholar
Kelly, J. R., Borre, Y., O'Brien, C., Patterson, E., El Aidy, S., Deane, J., et al. Transferring the blues: うつ病に関連する腸内細菌叢は、ラットにおいて神経行動学的変化を誘導する。J. Psychiatr. 論文タイトル:「憂鬱を移す:うつ病に関連する腸内細菌叢がラットの神経行動学的変化を引き起こす」。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kessler, R. C., Andrews, G., Colpe, L. J., Hiripi, E., Mroczek, D. K., Normand, S. L., et al. 非特異的な心理的苦痛における集団の有病率と傾向をモニターするための短いスクリーニング尺度。Psychol. Psychol. 32, 959-976.
パブコメ抄録|全文|Google Scholar
ハチャトリアン(Khachatryan, Z. A.)、クツォヤン(Ktsoyan, Z. A.)、マヌキヤン(Manukyan, G. P.)、ケリー(Kelly, D.)、ガザリヤン(Ghazaryan, K. A.)、アミノフ(Aminov, R. I. (2008). 腸内細菌叢の組成制御における宿主遺伝学の優勢な役割。この論文では、腸内細菌叢の組成を制御する宿主遺伝学の優位な役割を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lewis, S. J., and Heaton, K. W. (1997). 腸管通過時間の有用な目安としての便形スケール。Scand. J. Gastroenterol. 32, 920-924. doi: 10.3109/00365529709011203
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu, R. T., Walsh, R. F., and Sheehan, A. E. (2019). うつ病と不安に対するプレバイオティクスとプロバイオティクス: 対照臨床試験のシステマティックレビューとメタアナリシス。Neurosci. Biobehav. doi: 10.1016/j.neubiorev.2019.03.023.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Maes, M., Kubera, M., Leunis, J. C., Berk, M., Geffard, M., and Bosmans, E. (2013). うつ病では、細菌の移動が炎症反応、酸化・ニトロソ化ストレス(O&NS)、O&NSで損傷したネオエピトープに対する自己免疫反応を促進する可能性がある。Acta Psychiatr. Scand. 127, 344-354.
Google Scholar
Maes, M., Kubera, M., Leunis, J.-C., and Berk, M. (2012). 慢性うつ病における腸内常在菌に対するIgAおよびIgM応答の増加: 慢性うつ病における腸内常在菌に対するIgAおよびIgM反応の増加:細菌の移動増加またはリーキーガットのさらなる証拠。J. Affect. Disord. 141, 55-62.
Google Scholar
Mariat, D., Firmesse, O., Levenez, F., Guimarães, V., Sokol, H., Dore, J., et al. ヒト微生物叢のファーミキューテス/バクテロイデーテス比は年齢とともに変化する。BMC Microbiol. 9:123. doi: 10.1186/1471-2180-9-123
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
McFarland, L. V., Evans, C. T., and Goldstein, E. J. C. (2018). プロバイオティクスの有効性に関する菌株特異性と疾患特異性: A systematic review and meta-analysis. Front. doi: 10.3389/fmed.2018.00124.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
McKean, J., Naug, H., Nikbakht, E., Amiet, B., and Colson, N. (2017). 健康な参加者におけるプロバイオティクスと不顕性精神症状: A systematic review and meta-analysis. J. Altern. Complement. Med. 23, 249-258.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
McLoughlin, R. F., Berthon, B. S., Jensen, M. E., Baines, K. J., and Wood, L. G. (2017). 短鎖脂肪酸、プレバイオティクス、シンバイオティクス、および全身性炎症: A systematic review and meta-analysis. Am. J. Clin. Nutr. 106, 930-945.
Google Scholar
Messaoudi, M., Lalonde, R., Violle, N., Javelot, H., Desor, D., Nejdi, A., et al. ラットおよびヒト被験者におけるプロバイオティクス製剤(ラクトバチルス・ヘルベティカスR0052およびビフィドバクテリウム・ロンガムR0175)の向精神薬様特性の評価。(1)プロバイオティック製剤(乳酸菌R0052およびビフィズス菌R0175)のラットおよびヒトにおけるプロバイオティック様作用の検討。
パブコメ抄録|全文|Google Scholar
Miller, T. L., and Wolin, M. (1979). 糖分解性腸内細菌による発酵。Am. J. Clin. Nutr. 32, 164-172.
Google Scholar
Moher, D., Hopewell, S., Schulz, K. F., Montori, V., Gøtzsche, P. C., Devereaux, P. J., et al. CONSORT 2010の解説と詳細化: 並行群間無作為化試験を報告するための更新されたガイドライン。BMJ 340:c869. doi: 10.1136/bmj.c869.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Moludi,J.、Khedmatgozar,H.、Nachvak,S. M.、Abdollahzad,H.、Moradinazar,M.、Sadeghpour tabaei,A.(2022)。冠動脈疾患患者におけるプロバイオティクスとプレバイオティクスの併用投与が慢性炎症、うつ症状に及ぼす影響: 無作為化臨床試験。Nutr. Neurosci. 25, 1659-1668.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Naseribafrouei, A., Hestad, K., Avershina, E., Sekelja, M., Linløkken, A., Wilson, R., et al. ヒトの糞便微生物叢とうつ病との相関。Neurogastroenterol. Motil. 26, 1155-1162.
Google Scholar
Neacsu, M., McMonagle, J., Fletcher, R. J., Hulshof, T., Duncan, S. H., Scobbie, L., et al. 健康なヒトボランティアにおける小麦ふすまを豊富に含むシリアル製品からの植物フェノールの利用可能性と用量反応。Mol. Nutr. doi: 10.1002/mnfr.201600202.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ng, Q. X., Peters, C., Ho, C. Y. X., Lim, D. Y., and Yeo, W.-S. (2018). うつ症状を緩和するためのプロバイオティクスの使用に関するメタ分析。J. Affect. Disord. 228, 13-19.
Google Scholar
Nikolova, V., Zaidi, S. Y., Young, A. H., Cleare, A. J., and Stone, J. M. (2019). 腸の感覚: 臨床うつ病治療のためのプロバイオティクスの無作為化対照試験: 系統的レビューとメタアナリシス。Ther. Adv. Psychopharmacol. 9:2045125319859963.
パブコメ抄録|クロスリファレンス全文|Google Scholar
O'Connell, N. S., Dai, L., Jiang, Y., Speiser, J. L., Ward, R., Wei, W., et al. 臨床研究における事前事後データの分析方法: 一般的な5つの方法の比較。J. Biom. Biostat. 8, 1-8.
Google Scholar
Opie, R., Segal, L., Jacka, F. N., Nicholls, L., Dash, S., Pizzinga, J., et al. 大うつ病性障害を有するコホートにおける健康的な食事の値ごろ感の評価。J. Public Health Epidemiol. 7, 159-169.
Google Scholar
Oriach, C. S., Robertson, R. C., Stanton, C., Cryan, J. F., and Dinan, T. G. (2016). Food for thought: 微生物叢-腸-脳軸における栄養の役割。Clin. Nutr. Exp. 6, 25-38.
Google Scholar
O'Toole, P. W., and Cooney, J. C. (2008). プロバイオティクス細菌は腸内細菌叢の組成と機能に影響を与える。Interdiscip. Perspect. Infect. Dis. 2008:175285.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Palsson, O. S., Whitehead, W. E., van Tilburg, M. A. L., Chang, L., Chey, W., Crowell, M. D., et al. 成人のためのRome IV診断質問票の開発と検証。Gastroenterology 150, 1481-1491. doi: 10.1053/j.gastro.2016.02.014.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Parletta, N., Zarnowiecki, D., Cho, J., Wilson, A., Bogomolova, S., Villani, A., et al. 魚油を補充した地中海風食事介入は、うつ病患者の食事の質と精神的健康を改善する: 無作為化比較試験(HELFIMED)。Nutr. Neurosci. 22, 474-487. doi: 10.1080/1028415X.2017.1411320
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Parrott, A., and Hindmarch, I. (1978). 睡眠評価質問票の因子分析。Psychol. Med. 8, 325-329.
Google Scholar
Qin, J., Li, R., Raes, J., Arumugam, M., Burgdorf, K. S., Manichanh, C., et al. メタゲノム配列決定によって確立されたヒト腸内細菌遺伝子カタログ。Nature 464:7285.
Google Scholar
R Core Team (2019). R: A language and environment for statistical computing. Vienna: R Foundation for Statistical Computing.
Google Scholar
Ramnani, P., Costabile, A., Bustillo, A., and Gibson, G. R. (2015). A randomised, double-blind, crossover study investigating the prebiotic effect of agave fructans in healthy human subjects. J. Nutr. Sci. 4:e10. doi: 10.1017/jns.2014.68.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Reis, D. J., Ilardi, S. S., and Punt, S. E. (2018). プロバイオティクスの抗不安作用: 臨床および前臨床文献の系統的レビューとメタ分析。PLoS One 13:6. doi: 10.1371/journal.pone.0199041.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rose, D. J. (2014). 全粒穀物の腸内細菌叢への影響: オーツ麦の次のフロンティア?論文番号:Br. J. Nutr. 112, S44-S49.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Salehi-Abargouei, A., Ghiasvand, R., and Hariri, M. (2017). プレバイオティクス、プロシンバイオティクス、シンバイオティクス: それらは血漿酸化ストレスパラメーターを低下させることができるか?A systematic review. Probiotics Antimicrob. プロテインズ 9, 1-11. doi: 10.1007/s12602-016-9248-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sarris, J. (2019). 栄養精神医学: 概念から臨床まで。Drugs 79, 929-934.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Saulnier、D. M.、Gibson、G. R.、Kolida、S. (2008). ヒトの糞便微生物叢組成に対する選択されたシンバイオティクスのin vitro効果。FEMS Microbiol. Ecol. 66, 516-527. doi: 10.1111/j.1574-6941.2008.00561.x
パブコメ抄録|クロスリファレンス全文|Google Scholar
Schmidt, K., Cowen, P. J., Harmer, C. J., Tzortzis, G., Errington, S., and Burnet, P. W. (2015). プレバイオティクスの摂取は、健康なボランティアにおいて、覚醒時のコルチゾール反応を低下させ、感情の偏りを変化させる。心理薬理学(Berl)232、1793-1801。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Scott, K. P., Gratz, S. W., Sheridan, P. O., Flint, H. J., and Duncan, S. H. (2013). 腸内細菌叢に対する食事の影響。Pharmacol. Res. 69, 52-60.
Google Scholar
Segal, L., Twizeyemariya, A., Zarnowiecki, D., Niyonsenga, T., Bogomolova, S., Wilson, A., et al. 大うつ病治療のためのグループベースの食事介入の費用対効果および費用効用分析-HELFIMED試験。Nutr. Neurosci. 23, 770-778. doi: 10.1080/1028415X.2018.1556896.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sender, R., Fuchs, S., and Milo, R. (2016). ヒトと細菌の体内細胞数の推定値の改訂。doi: 10.1371/journal.pbio.1002533.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sheehan, D. V., Lecrubier, Y., Sheehan, K. H., Amorim, P., Janavs, J., Weiller, E., et al. ミニ国際精神神経面接(M.I.N.I.): DSM-IVおよびICD-10のための構造化精神医学的診断面接の開発と検証。J. Clin. Psychiatry 59, Suppl. 20 22-33.
Google Scholar
Simon, R., and Freedman, L. S. (1997). 2×2要因臨床試験のベイズデザインと分析。Biometrics 53, 456-464.
Google Scholar
Simpson, H. L., and Campbell, B. J. (2015). 食物繊維と微生物叢の相互作用。Aliment. Pharmacol. Ther. 42:1655. doi: 10.1111/apt.13248
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Smith, A. P. (2005). 幸福の概念: 栄養研究との関連性。Br. J. Nutr. 93, S1-S5.
Google Scholar
So, D., Whelan, K., Rossi, M., Morrison, M., Holtmann, G., Kelly, J. T., et al. 健康成人における腸内細菌叢組成に対する食物繊維介入: A systematic review and meta-analysis. Am. J. Clin. doi: 10.1093/ajcn/nqy041.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sonnenburg, E. D., and Sonnenburg, J L. (2014). 私たちの微生物の自己を飢えさせる: 微生物がアクセス可能な炭水化物を欠乏させた食事の有害な結果。Cell Metab. 20, 779-786. doi: 10.1016/j.cmet.2014.07.003.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Swann, O. G., Kilpatrick, M., Breslin, M., and Oddy, W. H. (2019). 食物繊維とうつ病および炎症との関連。Nutr. 78、394-411。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Swanson, K. S., Gibson, G. R., Hutkins, R., Reimer, R. A., Reid, G., Verbeke, K., et al. シンバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)のコンセンサス・ステートメント。Nat. Rev. Gastroenterol. Hepatol. 17, 687-701. doi: 10.1038/s41575-020-0344-2
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Taylor, A. M., and Holscher, H. D. (2020). うつ病、不安、ストレスと食事および微生物との関連についてのレビュー。Nutr. Neurosci. 23, 237-250.
Google Scholar
Thompson, R. S., Roller, R., Mika, A., Greenwood, B. N., Knight, R., Chichlowski, M., et al. 食餌性プレバイオティクスと生理活性乳画分は、NREM睡眠を改善し、REM睡眠のリバウンドを増強し、ストレスによる日内体温と腸内細菌α多様性の低下を減衰させる。Front. Behav. Neurosci. 10:240. doi: 10.3389/fnbeh.2016.00240
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Thompson, R. S., Vargas, F., Dorrestein, P. C., Chichlowski, M., Berg, B. M., and Fleshner, M. (2020). 食餌性プレバイオティクスは、睡眠を改善する新規の微生物依存性糞便代謝産物を変化させる。論文番号: 10:3848.
パブコメ抄録|Ref 全文|Google Scholar
Tuohy, K. M., Conterno, L., Gasperotti, M., and Viola, R. (2012). 全植物性食品、ポリフェノール、および/または食物繊維を用いたヒト腸内マイクロバイオームのアップレギュレーション。J. Agric. Food Chem. 60, 8776-8782.
Google Scholar
Valles-Colomer, M., Falony, G., Darzi, Y., Tigchelaar, E. F., Wang, J., Tito, R. Y., et al. QOLとうつ病におけるヒト腸内細菌叢の神経活性の可能性。Nat. Microbiol. 4, 623-632. doi: 10.1038/s41564-018-0337-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
van de Wouw, M., Boehme, M., Lyte, J. M., Wiley, N., Strain, C., O'Sullivan, O., et al. 短鎖脂肪酸:ストレスによる脳腸軸の変化を緩和する微生物代謝産物。J. Physiol. 596, 4923-4944.
パブコメ要旨|全文|Google Scholar
Wang, H., Lee, I.-S., Braun, C., and Enck, P. (2016). 動物およびヒトの中枢神経系機能に対するプロバイオティクスの効果-系統的レビュー。J. Neurogastroenterol. Motil. 22, 589-605. doi: 10.5056/jnm16018.
パブコメ抄録|全文|Google Scholar
Ware, J. E., and Sherbourne, C. D. (1992). MOS36項目健康調査(SF-36): 概念的枠組みと項目の選択。Med. Care 30, 473-483.
Google Scholar
Williams, B. A., Grant, L. J., Gidley, M. J., and Mikkelsen, D. (2017). 食物繊維の腸内発酵:植物細胞壁の物理化学と健康への影響。Int. J. Mol. Doi: 10.3390/ijms18102203.
パブコメ抄録|全文|Google Scholar
World Health Organizationion Regional Office for Europe (1998). プライマリーヘルスケアにおけるウェルビーイングの測定: DepCareプロジェクト: WHO会議報告書。ストックホルム: World Health Organization Regional Office for Europe.
Google Scholar
Wu, G. D., Chen, J., Hoffmann, C., Bittinger, K., Chen, Y.-Y., Keilbaugh, S. A., et al. 長期的な食事パターンと腸内細菌の腸型との関連性。Science 334:6052.
Google Scholar
Zagórska, A., Marcinkowska, M., Jamrozik, M., Wiśniowska, B., and Paśko, P. (2020). プロバイオティクスからサイコバイオティクスへ-精神疾患における腸脳軸。Benef. 微生物 11, 717-732.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zanarini, M. C., Vujanovic, A. A., Parachini, E. A., Boulanger, J. L., Frankenburg, F. R., and Hennen, J. (2003). BPDのスクリーニング尺度:McLean screening instrument for borderline personality disorder (MSI-BPD). J. Pers. Disord. 17, 568-573. doi: 10.1521/pedi.17.6.568.25355.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang,C.,Zhang,M.,Wang,S.,Han,R.,Cao,Y.,Hua,W.,他(2010)。マウスのメタボリックシンドローム発症に関連する腸内細菌叢、宿主遺伝、食餌の相互作用。ISME J. 4, 516-530.
Google Scholar
Zheng, P., Zeng, B., Zhou, C., Liu, M., Fang, Z., Xu, X., et al. 腸内細菌叢のリモデリングは、宿主の代謝を介する経路を介してうつ様行動を誘導する。Mol. 精神医学 21, 786-796.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:プレバイオティクス、プロバイオティクス、シンバイオティクス、食事、腸内細菌叢、気分、臨床試験、メンタルヘルス
引用 Freijy TM, Cribb L, Oliver G, Metri N-J, Opie RS, Jacka FN, Hawrelak JA, Rucklidge JJ, Ng CH and Sarris J (2023) 成人のメンタルヘルスに対する高プレバイオティクス食対プロバイオティクスサプリメント対シンバイオティクスの効果: 腸の気持ち "ランダム化比較試験。Front. Neurosci. 16:1097278.
受理された: 13 November 2022; Accepted: 15 December 2022;
発行:2023年02月06日
編集者
アショク・クマール(フロリダ大学、米国
査読者
キラン・ヴィール・サンドゥ(アイルランド、コーク大学
コスミン・モルドヴァン、ティトゥ・マイオレスク大学(ルーマニア
Copyright © 2023 Freijy, Cribb, Oliver, Metri, Opie, Jacka, Hawrelak, Rucklidge, Ng and Sarris. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 ジェローム・サリス、j.sarris@westernsydney.edu.au
免責事項:本論文で表明されたすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
精神疾患の補助療法としてのプロバイオティクスの系統的レビュー
エヴァン・フォース、ベンジャミン・ビューナー、アナ・ストーラー、カサンドラ・スガルボッサ、ルーメン・ミレフ、アルティ・チンナ・メイヤッパン
虚血性脳卒中マウスに対する防中益気湯の保護効果と腸内細菌叢のメカニズム
Qianqian Li, Mengxin Cao, Zijun Wei, Jianing Mei, Yuechan Zhang, Man Li, Manlin Li, Yunyun Zhang and Zhifei Wang
血清短鎖脂肪酸は海馬のBDNFを調節し、マウスの高ペクチン繊維食による神経炎症の減少と相関する。
Jamie S. Church, Jane A. M. Bannish, Leighelle A. Adrian, Kimberly Rojas Martinez, Asari Henshaw, Jared J. Schwartzer
片頭痛における鍼治療の効果: 活性化尤度推定によるメタ解析
Jing Zhao, Liu-xue Guo, Hong-ru Li, Xin-yun Gou, Xiao-bo Liu, Yue Zhang, Dong-ling Zhong, Yu-xi Li, Zhong Zheng, Juan Li, Yue Feng and Rong-jiang Jin
フレキシタリアン食と健康: エビデンスに基づく文献のレビュー
エマ・J・ダービシャー
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー|利用規約
この記事が気に入ったらサポートをしてみませんか?
