脳内常在細菌と神経変性疾患:「脳マイクロバイオーム」理論
本文へスキップ
トップバーナビゲーション
加齢神経科学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
5,910
総閲覧数
634
ダウンロード
1
引用
記事のインパクトを見る
記事のaltmetricスコアは40
レビュー記事
Front. エイジング・ニューロサイエンス, 19 October 2023
脳老化の細胞・分子メカニズム
第15巻 - 2023年|https://doi.org/10.3389/fnagi.2023.1240945
この論文は次の研究テーマの一部です。
神経感覚と神経認知の老化: 分子・細胞メカニズムと治療的展望。
全3記事を見る
脳内常在細菌と神経変性疾患:「脳マイクロバイオーム」理論
https://www.frontiersin.org/articles/10.3389/fcimb.2024.1382145/full?utm_source=dlvr.it&utm_medium=twitter

タレク・ジアド・アラビ1 アリヤ・アブドゥルモセン・アラブドゥルカデル1 ベラル・ネダル・サッバ1 アブデラフマン・ウーバン1,2*1
1サウジアラビア、リヤド、アルファイサル大学医学部
2サウジアラビア、リヤド、アルファイサル大学医学部病理学教室
アルツハイマー病の毒性蛋白質異常説の妥当性をめぐる論争により、科学界は神経変性疾患(ND)の病因における代替理論を模索するようになった。最近の研究では、中枢神経系にマイクロバイオームが存在するという証拠が得られている。脳内に生息する微生物が慢性的な神経炎症を引き起こし、それがさまざまな神経変性疾患の発症につながるという仮説もある。肺炎クラミジア、ヘリコバクター・ピロリ、クチバクテリウム・アクネスなどの細菌がND患者の脳に生息していることが判明している。さらに、これらの患者の中枢神経系では、カンジダやマラセチアなどの真菌が同定されている。しかし、脳マイクロバイオーム仮説にはいくつかの限界がある。文献によって結果が異なること、サンプルの汚染に関する懸念、外因性デオキシリボ核酸の存在などが、この仮説に対する疑念につながっている。これらの結果は、NDの病態に関する貴重な知見を提供するものである。ここでは、脳マイクロバイオーム説に対する証拠のレビューと、この仮説が直面している困難について述べる。さらに、NDにおける脳への細菌の侵入と生体に関連した神経変性の可能性のある機序、およびこの仮説の潜在的な治療的前提を定義する。
はじめに
最近、アルツハイマー病(AD)の毒性蛋白質異常説の妥当性、そしておそらくは改竄に対する懸念が高まっている(Espayら、2023)。そのため、科学界では多くの人々が代替仮説を探し始めている。最近の研究では、脳内マイクロバイオーム中の特定の微生物が慢性的な神経炎症を引き起こし、ADを発症させるという仮説が提唱されている。
脳マイクロバイオームとは、ヒトの脳内に存在する細菌、ウイルス、真菌、その他の微生物を含む複雑な微生物群集を指す(Link, 2021)。従来、脳は微生物が存在しない無菌環境であると考えられてきた。しかし、最近の科学的調査によって、このパラダイムが覆され、脳内に多様でダイナミックな微生物叢が存在する可能性が明らかになった(Link, 2021)。
脳内マイクロバイオームの関与を理解することは、ヒトの健康にとって重大な意味を持つ。脳と腸内マイクロバイオーム間の双方向コミュニケーション経路である脳腸軸は、脳機能と行動に対する細菌の潜在的な相互作用と影響を浮き彫りにしている(Martin et al.) 腸内細菌叢が産生する微生物代謝産物、神経伝達物質、免疫分子は、様々なシグナル伝達経路を通じて脳機能と行動に影響を及ぼす可能性がある(Martin et al.) 逆に、脳は神経、内分泌、免疫機構を通じて腸内細菌叢に対する制御を及ぼすこともできる(Galland, 2014)。脳内微生物叢の変化は、神経疾患に影響を及ぼす可能性がある。
高スループットのデオキシリボ核酸(DNA)配列決定やメタゲノム解析などの分子技術により、様々な身体部位に存在する微生物群集に関する貴重な知見が得られている(Link, 2021)。これらの手法により、脳組織のサンプルから細菌DNAが検出され、脳内に細菌が存在することが証明された。HIV患者では、脳のあらゆる部位でαプロテオバクテリアが確認された。これはさらに、16Sリボソームリボ核酸(RNA)遺伝子の増幅と細菌ペプチドグリカンのin-situ標識の両方を用いて検証された(Branton et al.) 脳は無菌ではないという声明は、これらの実験で行われたいくつかの検証技術によって強化された。しかし、これらの知見は後に、以前に行われた実験を振り返る論文によって反論された(Salterら、2014年;Mangulら、2018年;Link、2021年)。動物実験では、細菌による脳のコロニー形成が実証されている(Roberts et al.) 例えば、常在細菌叢を持たない無菌マウスを用いた研究では、特定の細菌を導入することで脳がコロニー化することが示されている(Banerjee et al.) これらの研究により、特定の微生物による脳のコロニー化が実証され、これらの微生物が脳内に定着し、持続することが示された。
脳内マイクロバイオームの意味は、基本的な微生物コロニー形成にとどまらない。脳内微生物叢の組成の不均衡や変化であるディスバイオーシスは、AD、多発性硬化症(MS)、パーキンソン病(PD)、うつ病、不安障害など、いくつかの神経疾患や精神神経疾患と関連している(Westfallら、2020;Góralczyk-Bińkowskaら、2022;Nandwanaら、2022)。脳とその常在微生物との間の複雑な相互作用を理解することで、これらの病態の病因、進行、治療介入の可能性に関する新たな知見が得られるかもしれない。
脳マイクロバイオームの概念はまだ初期段階にあり、多くの側面が解明されていないことに注意することが重要である。この分野は、サンプルの汚染、技術的限界、方法論の違いなどの課題に直面しており、研究結果の信頼性と妥当性を確保するためには、これらの課題に対処する必要がある。腸-脳-マイクロバイオーム軸の炎症と神経変性疾患との関連については、多くのデータが記述しているが、本総説では、中枢神経系における細菌や真菌の直接的な生息に焦点を当てる。疾患脳における脳マイクロバイオームの存在を支持する文献と否定する文献を要約する。次に、このような患者における微生物の侵入と疾患進行の可能性のある機序を強調する。最後に、脳マイクロバイオーム理論の限界と今後の研究の方向性について述べる。とはいえ、脳マイクロバイオームの存在を支持する新たな証拠は、脳とその微生物との複雑な関係に対する我々の理解にパラダイムシフトをもたらすものである。
神経変性疾患と脳マイクロバイオーム
神経変性疾患の発症と特定の細菌や真菌との関連については、いくつかの研究がなされている。本節では、神経変性疾患における脳内マイクロバイオームとその役割に関する説を支持する研究、およびそれに反する証拠を支持する研究を紹介する(表1)。
表1
www.frontiersin.org
表1. 神経変性疾患における脳マイクロバイオーム説を支持する証拠と否定する証拠の要約。
2.1. アルツハイマー病と脳マイクロバイオーム
いくつかの研究で、AD患者では対照患者と比較して細菌のレベルが指数関数的に高いことが判明している(Emery et al.) それらの細菌の中でも、クラミジア・ニューモニエはAD患者の脳で頻繁に見つかっている(Balin et al., 1998; Gérard et al., 2006)。例えば、Gérardらは、AD患者のアストロサイト、ミクログリア、ニューロンにおいて、アミロイド斑や神経原線維のもつれに隣接して、高レベルの肺炎クラミジアDNAを検出した(Gérardら、2006年)。一方、ADとC. pneumoniaeとの関連を証明できなかった研究者もいる(Ring and Lyons, 2000; Taylor et al.)
Borrelia burgdorferiは、著者らがADの原因微生物として同定したもう1つの細菌である。Macdonaldらは、ADの分娩後生検で何度かこの細菌を同定している(Macdonald, 1986; Macdonald and Miranda, 1987; Macdonald, 1988)。B.burgdorferiはまた、ADおよびPD患者においてアミロイドおよびタウ凝集体と共局在する(Senejaniら、2022年)。Miklossyによる分析では、B. burgdorferiはADにおいて対照群よりも13倍多いことが判明している(Miklossy, 2011)。C.pneumoniaeの場合と同様に、微生物とADの病原体との間に関連性を認めなかった研究もある(Gutackerら、1998;McLaughlinら、1999)。例えば、Gutackerらの研究では、AD患者にスピロヘータが存在する証拠は認められなかった(Gutackerら、1998)。B.burgdorferiは、アストロサイトやニューロンがインターロイキン(IL)-6、-8、-10、インターフェロン-γ、腫瘍壊死因子(TNF)-131などの炎症性サイトカインを放出し、酸化ストレスを調節すると考えられている(Wawrzeniakら、2020;Senejaniら、2022)。
最近のエビデンスでは、慢性胃炎、消化性潰瘍疾患、胃がんの原因菌として知られるグラム陰性菌ヘリコバクター・ピロリが、ADの発症に関与していることも明らかになっている(Mawanda and Wallace, 2013)。Kountourasらは、AD患者の脳脊髄液中の抗H. pylori特異的IgGレベルが対照群よりも有意に高いことを見出した(Kountouras et al.) さらに、抗体レベルは疾患の重症度と正の相関があった。我々の知る限り、AD患者の分娩後脳組織におけるピロリ菌の存在を解析した研究はない。対照的に、Shiotaらは、917人の日本人患者を対象とした研究で、ピロリ菌の有無とADとの間に関連は認められなかった(Shiota et al.) ピロリ菌とADに関連するメカニズムは依然として不明である。最近、謝らは、マウスの腸内に存在するピロリ菌由来の外膜小胞(OMV)が、細胞横断的な経路で生物学的障壁を通過し、最終的には血液脳関門を通過して脳に到達することを明らかにした(謝ら、2023年)。中枢神経系では、OMVはアストロサイトに入り、グリア細胞を活性化し、神経細胞の機能障害を引き起こす。さらに著者らは、補体成分3(C3)とその受容体シグナル伝達が、OMVによるアストロサイト、グリア細胞、神経細胞間の相互作用の仲介に重要な役割を果たしていることを示した(Xie et al.) 補体経路を薬理学的に阻害すると、OMVによって誘発されたグリア細胞と神経細胞の機能障害が回避され、ADの病態と認知機能の低下が抑制された。C3阻害で見られたポジティブな効果が臨床に応用できるかどうかは、まだ研究されていない。
真菌に関して、Alonsoらは、Alternaria属、Botrytis属、Candida属、Malassezia属の真菌が、対照群と比較してAD患者の前頭皮質でより一般的であることを示した(Alonsoら、2018)。さらに、Pisaらは、コホートの全AD患者の脳サンプルにおいて、Candida、Cladosporium、Malassezia、Neosartorya hiratsukae、Phoma、Sacharomyces cerevisae、Sclerotinia borealisなどの真菌を同定した(Pisaら、2015)。注目すべきは、この研究において、すべての研究領域で単一の種が同定されなかったことである。
Emeryらは、産後のAD患者では、非疾患患者と比較して、皮膚、鼻咽頭、口腔領域に関連する細菌(特にCutibacterium acnes)が有意に増加していることを発見した(Emeryら、2017)。脳内常在菌とADの間には強い関連があるように思われるが、研究間の異質性は依然として高い(表1)。ADにおける細菌や真菌の役割を確認し、脳内マイクロバイオームの主要な担い手を特定するためには、さらなる研究が必要である。
2.2. パーキンソン病と脳マイクロバイオーム
脳内マイクロバイオームとPDとの関連をめぐるデータは、ADよりもはるかに限られている(表1)。Pisaらは、PD患者の中枢神経系に細菌が存在することを初めて証明した(Pisaら、2020年)。著者らは、Streptococcus属の細菌が患者の大脳皮質に頻繁に存在し、Pseudomonas属は一般的に髄質に生息していることを発見した。興味深いことに、C. acnesは異なる中枢神経系領域にわたる複数の患者で頻繁に同定され、神経変性疾患全体におけるC. acnesの役割が明らかになった可能性がある(Pisa et al.) さらに、ボトリチス属、カンジダ属、フザリウム属、マラセチア属の真菌がPD検体で認められた(Pisa et al.) しかし、Bedarfらは、PDの発症における微生物説の妥当性や、健常人の脳内マイクロバイオームの存在について懸念を示し、先行研究で大きな偽陽性結果が得られた理由としてオフターゲット増幅を挙げている(Bedarfら、2021)。したがって、PDにおける微生物の真の役割は依然として不明である。
2.3. 筋萎縮性側索硬化症と脳マイクロバイオーム
筋萎縮性側索硬化症(ALS)は世界で最も一般的な運動ニューロン疾患であり、診断後5年以内に急速に死亡する(Beauverdら、2012;Alonsoら、2019b)。ALS患者における微生物を評価する研究は限られているが、そのような患者における脳マイクロバイオームの存在を示す研究は出現しつつある。例えば、AlonsoらはALS患者の脳脊髄液中に対照群よりも有意に多量の真菌抗原を検出し、そのオッズ比は4.8であった(Alonsoら、2015)。ALS患者の脳では、免疫組織化学を用いていくつかの真菌抗原が可視化された。ポリメラーゼ連鎖反応(PCR)を用いて、著者らは解析したALS患者全員からC. albicans DNAを抽出した。Trichoderma virideとCryptococcus magnusのDNAも抽出された(Alonso et al.) Alonsoらによる別の研究では、これらの知見が支持され、さらにMalassezia属、Fusarium属、Botrytis属の真菌DNAが同定された(Alonsoら、2017年)。
次にAlonsoらは、ALS患者の脳サンプルにおける細菌感染の同定を試みた(Alonsoら、2019b)。nested PCRを用いて、ALS中枢神経組織からいくつかの細菌が検出され、主にC. acnes、次いでCorynebacterium、Fusobacterium nucleatum、Lawsonella clevelandesis、Streptococcus thermophilusが検出された。また、次世代シーケンサーを用いた解析では、ALS患者全員から放線菌目、バークホルデリウム目、根粒菌目が検出され、キサントモナデス目は2人からしか検出されなかった。ALSにおける細菌および真菌の浸潤は神経炎症を促進するという仮説が立てられており、これは疾患脳における神経炎症プロセスの役割を強調する他の研究と一致している(Henkel et al.) しかし、これらの知見を確認するためには、異なるグループによる研究が必要である。
2.4. 多発性硬化症と脳マイクロバイオーム
多発性硬化症(MS)は、思春期や若年成人の集団によくみられる自己免疫疾患である(Dobson and Giovannoni, 2019)。Krieselらは、てんかん患者(対照)と比較して、生きているMS患者の脳内の細菌の存在を明らかにすることを目的とした(Krieselら、2019)。微生物配列の読み取りは、対照と比較してMS患者で有意に高かった。さらに、11の系統から29の細菌属候補が同定された。興味深いことに、1人の患者は、患者の臨床経過中の2つの異なるタイムポイントで、本研究で2回生検された。最初のサンプルは細菌の数が限られており、対照検体とほぼ同じであった。一方、2回目の生検では複数の細菌候補が認められた。注目すべきは、この研究では生きている患者からの検体を利用したことで、他の研究でよく見られる死後汚染の役割を限定していることである。Brantonらはまた、進行性MS患者の白質に、再発寛解型と比較して、炎症マーカーの増加と関連するプロテオバクテリアが多く存在することを同定した(Brantonら、2016)。さらに、MSの動物モデルにおいて、非アルビカンス型カンジダ種(C. glabrata、C. krusei、C. parapsilosis)が中枢神経系に到達できることが研究で示されている(Fraga-Silvaら、2022年)。具体的には、C. glabrataとC. kruseiはMSの重症度を悪化させたが、C. parapsilosisは悪化させなかった。これらの知見を総合すると、脳内マイクロバイオームの存在とMSの増悪との間に強い関連があることが示唆される。
2.5. ハンチントン病と脳マイクロバイオーム
ハンチントン病は、ハンチントン遺伝子のCAGトリヌクレオチドリピート拡大によって引き起こされる遺伝性神経変性疾患である(Stokerら、2022年)。Alonsoらは、次世代シーケンサーを用いて、Candida属、Davidiella属、Malassezia属、Rhodotorula属、Ramularia属の真菌を発見した(Alonsoら、2019a)。また、これらの患者の線条体および前頭皮質において、シュードモナス、クチバクテリウム、大腸菌、アシネトバクター、バークホルデリアを含むいくつかの細菌が同定された(Alonso et al.) 現在までのところ、ハンチントン病の脳マイクロバイオームの研究を試みた研究は他にない。
細菌はどのようにして脳に到達するのか?
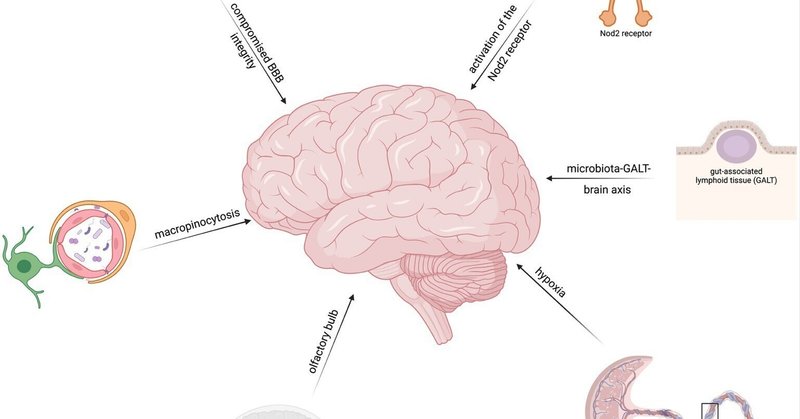
微生物は、神経感染症で観察される最も一般的な経路の1つである血行性拡散によって脳に侵入する。この過程で細菌は血流に浸潤し、そこから血液脳関門(BBB)を通過して脳に到達する(Khanら、2002;Dandoら、2014;Espinalら、2022)。そして、細胞外DNAやリポ多糖(LPS)を介してBBBの障害を悪用し、脳に直接侵入する。傷害、炎症、あるいはその他の基礎疾患によってBBBの完全性が損なわれると、細菌や真菌はバリアに侵入して脳に侵入することができる(Tetz, 2022)。さらに、細菌が感染時に放出する細胞外DNAやLPSは、BBBを直接破壊し、脳への細菌の侵入を促進する可能性がある(Tetz, 2022)。この説は、微生物の侵入を防ぐ上でBBBが強固であることの重要性を強調し、脳への感染を促進する上でBBBが損なわれることの重要な役割を浮き彫りにしている。
細菌侵入のもう一つの様式は、脳微小血管内皮細胞(BMEC)の侵入である。この細胞は脳内の血管を覆っており、BBBの重要な構成要素となっている。ある種の細菌は、BMECにおいてマクロピノサイトーシスと呼ばれるプロセスを誘導することが研究で証明されている。マクロピノサイトーシスには細胞外液や溶質の非特異的取り込みが含まれ、細菌によって活性化されると、内皮細胞内への取り込みが可能になる(Lohら、2017;Espinalら、2022)。このメカニズムは、細菌がBBBを突破して脳実質に侵入する直接的な経路を提供する可能性がある。
驚くべきことに、特定のケースでは、細菌は母体の低酸素症後にも胎児の脳に侵入することができる。母体低酸素症とは、母体への酸素供給量の減少を特徴とする状態を指し、発育中の胎児に影響を及ぼす可能性がある。ある種の細菌が母体低酸素症の間に胎盤を通過して胎児の脳に浸潤し、神経学的に不利な転帰をもたらすことが研究で示されている(Zarate et al.) この経路は、発達中の脳の脆弱性を浮き彫りにし、妊娠中の細菌感染の潜在的な結果を強調している。
もう1つ提案されている説は、嗅球を介した中枢神経系への侵入である(Pisa et al.) 嗅球は中枢神経系の最も外側にあり、外部環境と脳を直接つなぐ。ɑシヌクレイン関連病態と神経伝達物質の変化による嗅球の変性の結果、PDの最も早い徴候の一つが無嗅覚症である(Doty, 2012)。この説は、ADとPDの両方の脳に皮膚細菌叢の主要成分であるアクネ菌が存在することの説明となる(Emery et al.) しかし、この説を確認するにはさらなる研究が必要であり、この説を直接支持する証拠はまだ得られていない。
さらに、細菌細胞壁の構成成分である細菌ペプチドグリカンが、Nod2受容体を介して腸-脳間のコミュニケーションを媒介することも判明している。Nod2受容体は腸と脳の両方に存在し、免疫調節に関与している。細菌のペプチドグリカンによってNod2受容体が活性化されると、脳の機能やコミュニケーションに影響を与えるシグナル伝達経路が開始される(Gabanyi et al.) このことは、腸内細菌叢と脳との複雑な関係を浮き彫りにし、細菌が脳の健康と機能に間接的に影響を及ぼす可能性のある経路を示唆している。
最後に、プレバイオティクスによる微生物叢-腸関連リンパ組織(GALT)-脳軸の調節が、間接的に脳に影響を与えることが示されている。プレバイオティクスは、有益な腸内細菌の増殖と活性を促進する食物繊維である。プレバイオティクスは、腸内細菌叢の構成にポジティブな影響を与えることで、GALTに下流の影響を及ぼし、続いて脳機能と行動に影響を及ぼす可能性がある(Elena et al.) この理論は、細菌侵入と関連する神経学的合併症のリスクを間接的に軽減する戦略として、腸内細菌叢を調節する可能性を強調している。
まとめると、微生物侵入の理論として考えられるのは、血行性拡散、BMECの侵入、BBBの障害、母体の低酸素症、腸脳連絡経路などである(図1)。これらのメカニズムを理解することは、神経変性疾患の発症に微生物がどのように関与しているかを理解する上で極めて重要である。この知識は、細菌が脳の防御を突破し、神経変性疾患に関連する神経学的障害を引き起こすために用いる戦術について、貴重な洞察を与えてくれる。
図1
www.frontiersin.org
図1. 微生物侵入のメカニズムに関する諸説には、血行性拡散、脳微小血管内皮細胞(BMEC)の侵入、血液脳関門機能の異常、胎盤低酸素症、腸-脳経路などがある。
微生物関連神経変性のメカニズム
脳内マイクロバイオームの文脈における神経変性の基礎となる重要なメカニズムは、神経炎症である。TNF-αやIL-1β、-6などの炎症性サイトカインは、神経変性疾患の患者において有意に上昇している(Fillitら、1991;Liuら、2022)。具体的には、B. burgdorferi、C. pneumoniae、H. pyloriからなる感染負荷を有するPD患者において、IL-6レベルが上昇していることが研究で明らかになっている(Buら、2015)。細菌成分、主にLPSは、中枢神経系における炎症細胞の炎症性表現型の変化を誘導することができる。LPSは、核因子κ-軽鎖エンハンサー活性化B細胞(NFκB)遺伝子の発現を促進し、その結果、幅広いスペクトルのサイトカインが放出される(Hernandez Baltazarら、2020年)。LPSはまた、ミクログリア細胞においてミトコンドリア分裂を介した解糖系への代謝転換を誘導する(Nairら、2019)。チロシンキナーゼ阻害剤であるダサチニブでLPS関連経路を標的とすることは、マウスにおいて有望な結果を示している。Ryuらは、ダサチニブがミクログリアとアストロサイトにおけるLPS誘発性の変化を有意に制御し、炎症性サイトカインの放出を鈍らせ、処置したマウスの中枢神経における好中球のローリングを阻害することを見出した(Ryuら、2019)。貪食もまた、神経炎症プロセスにおいて主要な役割を果たしている。具体的には、B. burgdorferiなどのスピロヘータはミクログリア細胞上のtoll様受容体によって認識され、炎症反応を引き起こす(Dehaghi et al.) さらに、スピロヘータはプラスミノーゲンと第XII因子を活性化することにより、凝固経路を変化させることができる(Dehaghi et al.)
脳内微生物によって引き起こされる炎症促進メカニズムに加えて、これらの微生物は神経変性を促進する直接的な神経毒性作用も有する。例えば、カンジダ菌やアスペルギルス菌のマイコトキシンは、神経細胞以外の組織に付着し、マイコトキシンを継続的に放出する(Purzycki and Shain, 2010)。これらのマイコトキシンは、BBBを維持し、ミエリン産生のための栄養素を供給するアストロサイトやオリゴデンドロサイトの機能を鈍らせ、MS患者の素因となる(Purzycki and Shain, 2010)。さらに、フザリウム菌が産生する毒素であるフモニシンB1は、マウスの中枢神経系細胞で壊死細胞死を引き起こし、ミトコンドリア活性を阻害する(Osuchowski and Sharma, 2005)。しかし、これらの影響は一次皮質ニューロンには影響しないようである。同様に、Penicillium crustosumが放出するpenitrem Aは、被爆ラットの大脳の虚血性細胞変化の結果として振戦を誘発する(Cavanaghら、1998年)。結論として、微生物は、主に神経炎症と直接的な神経毒性作用を通じて、いくつかのメカニズムで神経変性を促進する可能性がある(図2)。
図2
www.frontiersin.org
図2. 主に神経炎症と神経毒性物質の放出による直接的な毒性を介して中枢神経に侵入する微生物。
治療標的としての脳内マイクロバイオーム
脳内マイクロバイオームの存在を示す研究が増えていることから、これらの生物を抗生物質の標的とできるかという疑問が生じる。BBBは不透過性であるため、中枢神経系に到達できる抗菌薬は、メトロニダゾール、フルオロキノロン系抗菌薬の一部、フルコナゾールなど限られたものだけである(Nau et al.) しかし、神経変性疾患の治療や予防における抗菌薬の有効性を、脳内マイクロバイオームとの関連で直接取り上げた報告はない。とはいえ、いくつかの臨床試験では、神経変性疾患の転帰に対する抗菌薬の影響について研究されている。
ADやハンチントン病ではテトラサイクリン系抗菌薬の使用が研究されている。例えば、ミノサイクリンはハンチントン病やALSのマウスモデルにおいて病気の進行を抑制する(Chenら、2000;Zhangら、2003)。これらの知見を裏付けるように、神経変性疾患のげっ歯類モデルにおけるミノサイクリンの影響に関するメタアナリシスでは、ミノサイクリンはそのようなモデルにおいて神経保護作用を有することが明らかにされている(Li et al.、2013)。この抗生物質はハンチントン病患者において安全で忍容性のあるプロフィールを示したが(Thomasら、2004年)、2010年に実施された臨床試験では、この治療が無益であることが示された(Huntington Study Group DOMINO Investigators、2010年)。第三世代セファロスポリンであるCeftriaxoneもALS患者で研究されている。第1相および第2相臨床試験では有望な安全性プロファイルが示されたが(Berry et al., 2013)、ランダム化比較第3相試験では疾患への影響を示すことはできなかった(Cudkowicz et al., 2014)。最近、Mandrioliらによるランダム化比較試験で、ラパマイシンはALS患者の病勢進行、生存、QOLに影響を与えないことが示された(Mandrioliら、2023)。抗菌薬は前臨床モデルでは有効であることが証明されているが、これらの結果は臨床現場には反映されないようである。とはいえ、脳のマイクロバイオームを変化させることができる未研究の抗菌薬が存在するかどうか、またそのような効果によって疾患の進行を抑制できるかどうかを見極めるためには、さらなる試験が必要である。
今後の研究の方向性
最近の研究では、ヒトのマイクロバイオームと健康との複雑な関係が掘り下げられている。腸内細菌叢が大きな注目を集めている一方で、その影響が消化以外にも及ぶことを示唆する新たな証拠も出てきている。脳マイクロバイオームの研究により、これまで見過ごされてきた微生物叢と脳の軸の一面が明らかになり、神経変性疾患に対するその潜在的な意味合いについての問い合わせにつながっている。ADやPDのような疾患における脳内マイクロバイオームの役割を解明することは、革新的な治療ターゲットや診断法を提供し、臨床の未来を形作る可能性がある。本セクションでは、脳内マイクロバイオームの研究と神経変性疾患への寄与の可能性について、今後の研究の方向性を探る。
有望な研究手段のひとつは、脳内に存在する微生物叢の組成と動態の特徴をさらに明らかにすることである。脳内微生物のスペクトルは、個体間だけでなく、単一個体から調べた脳の部位間でも異なっている(Hu et al.) 海馬と小脳から採取したサンプル間では、β多様性に有意な差が認められ、微生物DNAの出現に脳の部位が影響していることが明らかになっている(Westfall et al.) メタゲノミクス、トランスクリプトミクス、プロテオミクスなどの先端技術は、脳内の複雑な微生物生態系の解明に役立つ(Baldrian and López-Mondéjar, 2014)。さまざまな神経変性疾患に関連する特異的な微生物シグネチャーを解読することで、根本的な疾患メカニズムに関する貴重な知見が得られる可能性がある。特定の神経変性疾患に関連する特異的な微生物プロファイルや生物学的異常パターンを同定することにより、研究者は早期発見や診断を強化し、個々の患者に合わせた標的介入策を開発することができる。
微生物組成を理解することに加えて、研究者は神経変性疾患における脳内マイクロバイオームの機能的帰結についても調査する必要がある。これには、特定の微生物種やその代謝産物が、神経変性疾患の病態、進行、症状にどのような影響を及ぼすかを探ることが含まれる。微生物は、短鎖脂肪酸(SCFA)、神経伝達物質、二次代謝産物など、脳の健康に直接的または間接的な影響を与えうる様々な代謝産物を産生する(Silva et al.) 酢酸、プロピオン酸、酪酸などのSCFAは、大腸や末梢組織で局所的な効果を発揮するだけでなく、微生物叢、腸、脳の間のコミュニケーションにおいても重要な役割を果たしていると考えられている。内皮細胞にモノカルボン酸トランスポーターが存在することから、SCFAは血液脳関門を通過する可能性がある。しかし、SCFAの脳内生理的濃度やその他の微生物代謝産物に関する既存の研究は限られている(Silva et al.)
これらの代謝産物が、神経炎症、タンパク質の凝集、酸化ストレス、神経変性に関連するその他の要因などの重要なプロセスにどのように影響するのか、理解を深めることが不可欠である。これらの領域における知識の拡大は、神経変性疾患の複雑性の解明と効果的な治療介入の開発に大きく貢献する。
脳マイクロバイオーム理論の限界
脳内マイクロバイオームの存在、ひいては神経変性疾患における微生物の役割については、依然として大きな論争があることに留意することが重要である。ADとPDの患者集団によって結果が異なることから、脳マイクロバイオーム説をめぐる疑念が高まっている。先に述べたように、Bedarfらは、PD患者と対照患者の両方の脳に微生物が存在する証拠を見いださなかった(Bedarfら、2021年)。同様の所見はADでも見られ、いくつかの研究で中枢神経系に生息する細菌の存在とADとの間に相関関係はないことが判明している(Ring and Lyons, 2000; Taylor et al., 2002; Wozniak et al., 2003)。したがって、脳内マイクロバイオーム説は、毒性タンパク症仮説に代わるもっともらしい選択肢を提供するかもしれないが、より詳細なデータが出るまで、先行研究の結果を解釈する際には注意が必要である。
主な課題の一つは、外因性DNAによる汚染の可能性であり、これが偽陽性の微生物シグナルにつながる可能性がある。コンタミネーションは、サンプル調製やシーケンスに使用される試薬など、様々な原因から発生する可能性がある(Link, 2021)。別の研究では、汚染のさらなる要因として、相当量のヒトゲノムDNAが蔓延していることを強調しており、不正確な結果につながる可能性がある(Emery et al.)
さらに、脳サンプル中の細菌バイオマスは著しく低いため、一般的なバックグラウンドノイズの中で本物の微生物シグナルを検出し、特徴付けるという点では難題となる。微生物バイオマスが限られているため、本物の微生物の存在と、サンプル処理やシーケンス中に導入される可能性のあるアーチファクトとの区別が複雑になる(Bedarf et al.) もう一つの限界は、宿主DNAの偽陽性増幅の可能性であり、宿主配列を微生物と誤分類することにつながる。これはオフターゲット増幅やサンプル中の宿主DNAの存在によって起こりうる。結果の誤解を避けるためには、宿主配列と微生物配列を注意深く分析し、区別することが重要である。
結論
新たな証拠により、脳内マイクロバイオームが、主に神経炎症と神経毒性を介して、ADやPDなどの神経変性疾患の発症に関与している可能性が浮き彫りになってきた。C.pneumoniae、B.burgorferi、H.pylori、C.acnesなどの細菌は、神経変性疾患の発症に関与しているようである。カンジダ属やマラセチア属の真菌も神経変性疾患患者の脳から検出されている。しかし、AD、PD、さらには正常患者の脳においても、いくつかの研究で否定的な結果が報告されていることに注意することが重要である。
微生物が中枢神経系に侵入する方法を説明するために、複数の理論が提唱されている。有力な説としては、炎症によるBBBの破壊、BMECへの細菌の侵入、GALTを介した細菌の移動などがある。しかし、これらの仮説を支持する証拠は限られており、検証にはさらなる研究が必要である。脳マイクロバイオーム説にはいくつかの限界もある。外因性のDNA汚染や宿主DNAのオフターゲット増幅が、文献に見られる矛盾したデータを説明しているのではないかという仮説もある。残念ながら、神経変性疾患における抗菌薬治療の有効性を評価したヒトを対象とした研究では、疾患の進行に対する影響を示すことはできなかった。全体として、脳内マイクロバイオーム理論は、神経変性疾患の発症機序における有力な理論として浮上している。しかし、さらなる研究が報告されるまでは、これらの結果を慎重に解釈することが肝要である。
著者貢献
TA、AA、BSが原稿を執筆。AOは原稿を批判的に修正し、原稿のテーマを構想した。すべての著者が論文に貢献し、提出された原稿を承認した。
謝辞
BioRender.comは本原稿の図の作成に使用した。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
Alonso, R., Pisa, D., and Carrasco, L. (2019a). ハンチントン病患者における脳内微生物叢。Front. Microbiol. 10:2622. doi: 10.3389/fmicb.2019.02622.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Alonso, R., Pisa, D., and Carrasco, L. (2019b). 筋萎縮性側索硬化症の神経組織における細菌の探索。Front. Neurosci. 13:171. doi: 10.3389/fnins.2019.00171.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Alonso, R., Pisa, D., Fernández-Fernández, A. M., and Carrasco, L. (2018). 高齢者とアルツハイマー病患者の脳組織における真菌と細菌の感染。Front. Aging Neurosci. 10:159. doi: 10.3389/fnagi.2018.00159
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Alonso, R., Pisa, D., Fernández-Fernández, A. M., Rábano, A., and Carrasco, L. (2017). 筋萎縮性側索硬化症患者の神経組織における真菌感染。Neurobiol. Dis. 108, 249-260. doi: 10.1016/j.nbd.2017.09.001.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Alonso, R., Pisa, D., Marina, A. I., Morato, E., Rábano, A., Rodal, I., et al. 筋萎縮性側索硬化症患者の脳脊髄液および脳組織における真菌感染の証拠。Int. J. Biol. Sci.11,546-558.doi:10.7150/ijbs.11084。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Baldrian, P., and López-Mondéjar, R. (2014). 微生物ゲノミクス、トランスクリプトミクス、プロテオミクス:補完的手法を用いた分解研究の新発見。Appl. Microbiol. Biotechnol. 98, 1531-1537. doi: 10.1007/s00253-013-5457-x
パブコメ抄録|クロスリファレンス全文|Google Scholar
Balin, B. J., Gérard, H. C., Arking, E. J., Appelt, D. M., Branigan, P. J., Abrams, J. T., et al. アルツハイマー病脳における肺炎クラミジアの同定と局在。Med. Microbiol. Immunol. 187, 23-42. doi: 10.1007/s004300050071
クロスレフ・フルテキスト|Google Scholar
Banerjee, A., Kim, B. J., Carmona, E. M., Cutting, A. S., Gurney, M. A., Carlos, C., et al. 細菌ピリはインテグリン機構を利用し、免疫活性化と効率的な血液脳関門侵入を促進する。Nat. Commun. 2:462. doi: 10.1038/ncomms1474
抄録|全文|Google Scholar
Beauverd, M., Mitchell, J. D., Wokke, J. H., and Borasio, G. D. (2012). 筋萎縮性側索硬化症/運動ニューロン疾患の治療に対する遺伝子組換えヒトインスリン様成長因子I(rhIGF-I)。Cochrane Database Syst. Rev.11:Cd002064.doi:10.1002/14651858.CD002064.pub3。
PubMed Abstract | CrossRef Full Text | Google Scholar
Bedarf, J. R., Beraza, N., Khazneh, H., Özkurt, E., Baker, D., Borger, V., et al. 大したことはない?オフターゲット増幅は、健常者とパーキンソン病患者における脳内細菌叢の偽陽性検出につながる可能性がある。微生物ゲノム9:75.
パブコメ抄録|全文|Google Scholar
Berry, J. D., Shefner, J. M., Conwit, R., Schoenfeld, D., Keroack, M., Felsenstein, D., et al. 筋萎縮性側索硬化症におけるセフトリアキソンの多相無作為化試験のデザインと初期結果。PLoS One 8:e61177. doi: 10.1371/journal.pone.0061177.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV/AIDSにおける脳内微生物集団。HIV/AIDSにおける脳内微生物集団:宿主の免疫状態とは無関係にα-プロテオバクテリアが優勢。PLoS One 8:e54673. doi: 10.1371/journal.pone.0054673.
パブコメ抄録|全文|Google Scholar
Branton, W. G., Lu, J. Q., Surette, M. G., Holt, R. A., Lind, J., Laman, J. D., et al. 多発性硬化症における炎症性脱髄病変内での脳内細菌叢の崩壊。Sci. Rep. 6:37344. doi: 10.1038/srep37344
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bu,X.L.、Wang,X.、Xiang,Y.、Shen,L.L.、Wang,Q.H.、Liu,Y.H.、他(2015)。感染負荷とパーキンソン病との関連:症例対照研究。Parkinsonism Relat. Disord. 21, 877-881. doi: 10.1016/j.parkreldis.2015.05.015
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cavanagh, J. B., Holton, J. L., Nolan, C. C., Ray, D. E., Naik, J. T., and Mantle, P. G. (1998). 振戦原性マイコトキシンpenitrem aのラット小脳への影響。Vet. Pathol. 35, 53-63. doi: 10.1177/030098589803500105
パブコメ要旨|全文|Google Scholar
Chen, M., Ona, V. O., Li, M., Ferrante, R. J., Fink, K. B., Zhu, S., et al. ミノサイクリンはカスパーゼ-1とカスパーゼ-3の発現を阻害し、ハンチントン病トランスジェニックモデルマウスにおける死亡率を遅延させる。Nat. Med. 6, 797-801.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cudkowicz, M. E., Titus, S., Kearney, M., Yu, H., Sherman, A., Schoenfeld, D., et al. 筋萎縮性側索硬化症に対するセフトリアキソンの安全性と有効性:多段階無作為化二重盲検プラセボ対照試験。Lancet Neurol. 13, 1083-1091. doi: 10.1016/s1474-4422(14)70222-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dando, S. J., Mackay-Sim, A., Norton, R., Currie, B. J., John, J. A. S., Ekberg, J. A. K., et al. 中枢神経系に侵入する病原体:感染経路と侵入の細胞・分子機構。Clin. Microbiol. 27, 691-726. doi: 10.1128/cmr.00118-13.
パブコメ抄録|全文|Google Scholar
Dehhaghi, M., Kazemi Shariat Panahi, H., and Guillemin, G. J. (2018). 神経変性疾患における微生物の足跡。Front. Cell. Neurosci. 12:466. doi: 10.3389/fncel.2018.00466
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dobson, R., and Giovannoni, G. (2019). 多発性硬化症-総説。Eur. J. Neurol. 26, 27-40. doi: 10.1111/ene.13819.
クロスレフ・フルテキスト|Google Scholar
Doty, R. L. (2012). パーキンソン病における嗅覚機能障害。Nat. Rev. Neurol. 8, 329-339. doi: 10.1038/nrneurol.2012.80
クロスレフ・フルテキスト|Google Scholar
Elena, F.-R., Joel, R.-E., José Sergio, L.-B., and Cristina Doriany, B.-P. (2019). Prebiotics and the modulation on the microbiota-GALT-Brain Axis, Prebiotics and probiotics, (Eds.) F.-R. エレナおよびR.Joel. Rijeka: IntechOpen, 11
Google Scholar
Emery, D. C., Shoemark, D. K., Batstone, T. E., Waterfall, C. M., Coghill, J. A., Cerajewska, T. L., et al. 16S rRNA次世代シーケンサー解析により、アルツハイマー病死後脳の細菌が明らかになった。Front. Aging Neurosci. 9:195. doi: 10.3389/fnagi.2017.00195
PubMed Abstract|クロスリファレンス全文|Google Scholar
Espay, A. J., Herrup, K., and Daly, T. (2023). 第10章-神経変性における毒性タンパク症仮説の改竄閾値の発見、ハンドブックClin. Neurology, (Ed.) A. J. Espay . Elsevier, 143-154.
Google Scholar
Espinal, E. R., Matthews, T., Holder, B. M., Bee, O. B., Humber, G. M., Brook, C. E., et al. B群レンサ球菌が誘導するマクロピノサイトーシスは、脳内皮細胞への細菌の浸潤に寄与する。病原体11:474.
PubMedアブストラクト|クロスリファレンス|Google Scholar
Fillit, H., Ding, W., Buee, L., Kalman, J., Altstiel, L., Lawlor, B., et al. アルツハイマー病における循環腫瘍壊死因子レベルの上昇。Neurosci. Lett. 129, 318-320. doi: 10.1016/0304-3940(91)90490-K
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
フラガ-シルバ、T.F.D.C.、ムンホス-アルベス、N.、三村、L.A.N.、オリベイラ、L.R.C.D.、フィゲイレド-ゴドイ、L.M.A.、ガルシア、M.T.、他(2022)。非アルビカンス型カンジダ種による全身感染は、多発性硬化症モデルマウスの発症に影響を及ぼす。J. Fungi 8:386.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gabanyi, I., Lepousez, G., Wheeler, R., Vieites-Prado, A., Nissant, A., Chevalier, G., et al. 神経細胞Nod2を介した細菌感知が食欲と体温を制御する。科学 376:eabj3986.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Galland, L. (2014). 腸内マイクロバイオームと脳。J. Med. 食品 17, 1261-1272.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gérard, H. C., Dreses-Werringloer, U., Wildt, K. S., Deka, S., Oszust, C., Balin, B. J., et al. アルツハイマー病脳におけるクラミドフィラ(クラミジア)・ニューモニエ。FEMS Immunol. Med. Microbiol. 48, 355-366. doi: 10.1111/j.1574-695X.2006.00154.x
クロスレフ・フルテキスト|Google Scholar
Góralczyk-Bińkowska, A., Szmajda-Krygier, D., and Kozłowska, E. (2022). 精神疾患における微生物叢-腸-脳軸。Int. J. Mol. Sci. 23:245. doi: 10.3390/ijms231911245
パブコメ抄録|全文|Google Scholar
Gutacker, M., Valsangiacomo, C., Balmelli, T., Bernasconi, M. V., Bouras, C., and Piffaretti, J. C. (1998). アルツハイマー病におけるBorrelia burgdorferi sensu latoの関与に対する議論。Res. Microbiol. 149, 31-37. doi: 10.1016/S0923-2508(97)83621-2
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Henkel, J. S., Engelhardt, J. I., Siklós, L., Simpson, E. P., Kim, S. H., Pan, T., et al. 筋萎縮性側索硬化症脊髄組織における樹状細胞、MCP-1、活性化ミクログリア/マクロファージの存在。Ann. Neurol. 55, 221-235.
PubMed Abstract|RefRef Full Text|Google Scholar
Hernandez Baltazar, D., Nadella, R., Barrientos Bonilla, A., Flores Martínez, Y., Olguín, A., Heman Bozadas, P., et al. リポ多糖に基づく神経炎症はミクログリアの分極化を誘導するか?Folia Neuropathol. 58, 113-122. doi: 10.5114/fn.2020.96755
PubMedアブストラクト|全文|Google Scholar
Hu, X., Mckenzie, C.-A., Smith, C., Haas, J. G., and Lathe, R. (2023). 健康および疾患における脳マイクロバイオームの驚くべき複雑性。
CrossRef 全文|Google Scholar
Huntington Study Group DOMINO Investigators (2010). ハンチントン病におけるミノサイクリンの有用性試験。Mov. Disord. 25, 2219-2224.
クロスレフ・フルテキスト|Google Scholar
Khan, N. A., Wang, Y., Kim, K. J., Chung, J. W., Wass, C. A., and Kim, K. S. (2002). 細胞傷害性壊死因子-1は大腸菌K1の中枢神経系への侵入に寄与する。J. Biol. Chem. 277, 15607-15612.
パブコメ抄録|全文|Google Scholar
Kountouras, J., Boziki, M., Gavalas, E., Zavos, C., Deretzi, G., Grigoriadis, N., et al. アルツハイマー病における脳脊髄液ヘリコバクター・ピロリ抗体の増加。Int. J. Neurosci. 119, 765-777. doi: 10.1080/00207450902782083.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kriesel, J. D., Bhetariya, P., Wang, Z.-M., Renner, D., Palmer, C., and Fischer, K. F. (2019). 生きている患者から得られた原発性脱髄脳標本における微生物配列と細菌細胞壁抗原のスペクトル。Sci. Rep. 9:1387. doi: 10.1038/s41598-018-38198-8.
パブコメ要旨|Ref 全文|Google Scholar
Li, C., Yuan, K., and Schluesener, H. (2013). 齧歯類の神経変性疾患に対するミノサイクリンの影響:メタアナリシス。Rev. Neurosci. 24, 553-562. doi: 10.1515/revneuro-2013-0040
パブコメ抄録|全文|Google Scholar
リンク, C. D. (2021). 脳マイクロバイオームは存在するか?Neurosci. Insights 16:26331055211018709.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu, T.-W., Chen, C.-M., and Chang, K.-H. (2022). パーキンソン病における神経炎症のバイオマーカー。Int. J. Mol. (2022)。パーキンソン病における神経炎症のバイオマーカー。
パブコメ要旨|全文|Google Scholar
Loh, L. N., McCarthy, E. M. C., Narang, P., Khan, N. A., and Ward, T. H. (2017). Escherichia coli K1は、脳微小血管内皮細胞への侵入に宿主マクロピノサイト経路を利用する。Traffic 18, 733-746. doi: 10.1111/tra.12508.
パブコメ抄録|全文|Google Scholar
MacDonald, A. B. (1986). 認知症患者の脳におけるボレリア。JAMA 256, 2195-2196. doi: 10.1001/jama.1986.03380160053011.
パブコメ抄録|全文|Google Scholar
MacDonald, A. B. (1988). 新皮質ボレリア症とアルツハイマー病の同時発症。Ann. N. Y. Acad. DOI: 10.1111/j.1749-6632.1988.tb31909.x.
クロスレフ・フルテキスト|Google Scholar
MacDonald, A. B., and Miranda, J. M. (1987). 新皮質ボレリア症とアルツハイマー病の同時発症。Hum. Pathol. 18, 759-761. doi: 10.1016/S0046-8177(87)80252-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mandrioli,J.、D'Amico,R.、Zucchi,E.、De Biasi,S.、Banchelli,F.、Martinelli,I.、他(2023)。筋萎縮性側索硬化症におけるラパマイシンの無作為二重盲検プラセボ対照試験。Nat. Commun. 14:8. doi: 10.1038/s41467-023-40734-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mangul, S., Yang, H. T., Strauli, N., Gruhl, F., Porath, H. T., Hsieh, K., et al. ROP:多様なヒト成人組織にわたる1兆リードのソースを見つけるためのRNAシーケンスのダンプスターダイビング。ゲノム生物学 19:36.
PubMedアブストラクト|全文|Google Scholar
Martin, C. R., Osadchiy, V., Kalani, A., and Mayer, E. A. (2018). 脳-腸-マイクロバイオーム軸。Cell. Mol. Gastroenterol. Hepatol. 6, 133-148. doi: 10.1016/j.jcmgh.2018.04.003
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mawanda, F., and Wallace, R. (2013). 感染症はアルツハイマー病を引き起こすか?Epidemiol. Doi: 10.1093/epirev/mxs007.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
McLaughlin, R., Kin, N. M. K. N. Y., Chen, M. F., Nair, N. P. V., and Chan, E. C. S. (1999). アルツハイマー病はスピロヘータ症ではないかもしれない。Neuroreport 10, 1489-1491. doi: 10.1097/00001756-199905140-00018
クロスリファレンス全文|Google Scholar
Miklossy, J. (2011). アルツハイマー病-神経スピロヘータ症。コッホとヒルの基準に従ったエビデンスの分析。J. Neuroinflammation 8:90.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nair, S., Sobotka, K. S., Joshi, P., Gressens, P., Fleiss, B., Thornton, C., et al. リポ多糖によるミトコンドリア形態の変化は、in vitroおよびin vivoで炎症反応を調節するミクログリアの代謝シフトを誘導する。グリア 67, 1047-1061.
パブコメ抄録|全文|Google Scholar
Nandwana, V., Nandwana, N. K., Das, Y., Saito, M., Panda, T., Das, S., et al. 脳の発達と神経変性疾患におけるマイクロバイオームの役割。分子 27:3402.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nau, R., Sörgel, F., and Eiffert, H. (2010). 中枢神経系感染症の治療における血液・脳脊髄液・血液脳関門を介した薬剤の浸透。Clin. Microbiol. Doi: 10.1128/cmr.00007-10.
クロスレフ・フルテキスト|Google Scholar
Osuchowski, M. F., and Sharma, R. P. (2005). フモニシンB1は、BV-2細胞およびマウス培養アストロサイトにおいて壊死性細胞死を誘導し、BV-2細胞においては抗増殖性を示すが、N2A細胞および一次皮質ニューロンは抵抗性である。神経毒性 26, 981-992.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pisa, D., Alonso, R., and Carrasco, L. (2020). パーキンソン病:脳組織中の真菌および細菌の包括的解析。Int. J. Biol. 論文タイトル:「パーキンソン病:脳組織中の真菌と細菌の網羅的解析」。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Pisa, D., Alonso, R., Rábano, A., Rodal, I., and Carrasco, L. (2015). アルツハイマー病では異なる脳領域が真菌に感染している。論文誌5:15015.doi: 10.1038/srep15015.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Purzycki, C. B., and Shain, D. H. (2010). 真菌毒素と多発性硬化症:説得力のある関係。Brain Res. Bull. doi: 10.1016/j.brainresbull.2010.02.012
PubMed Abstract|全文|Google Scholar
Ring, R. H., and Lyons, J. M. (2000). 遅発性アルツハイマー病脳における肺炎クラミジア検出の失敗。J. Clin. Microbiol. 38, 2591-2594. doi: 10.1128/jcm.38.7.2591-2594.2000.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Roberts, R. C., Farmer, C. B., and Walker, C. K. (2018). ヒトの脳内マイクロバイオーム;私たちの脳内には細菌が存在する!ニューロサイエンス
Google Scholar
Ryu, K.-Y., Lee, H.-J., Woo, H., Kang, R.-J., Han, K.-M., Park, H., et al. ダサチニブは、AKT/STAT3シグナルを阻害することにより、LPS誘発ミクログリアおよびアストロサイトの神経炎症反応を制御する。J. Neuroinflammation 16:190. doi: 10.1186/s12974-019-1561-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Salter, S. J., Cox, M. J., Turek, E. M., Calus, S. T., Cookson, W. O., Moffatt, M. F., et al. 試薬や実験室の汚染は、シーケンスベースのマイクロバイオーム解析に決定的な影響を与える。BMC Biol. 12:87. doi: 10.1186/s12915-014-0087-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Senejani, A. G., Maghsoudlou, J., El-Zohiry, D., Gaur, G., Wawrzeniak, K., Caravaglia, C., et al. アルツハイマー病脳組織においてアミロイドマーカーと共局在するボレリア・ブルグドルフェリ(Borrelia burgdorferi)。J. Alzheimers Dis. 85, 889-903. doi: 10.3233/jad-215398.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
塩田聡、村上和彦、吉岩晃一、山本和彦、大野聡、黒田晃一、他(2011).日本におけるヘリコバクター・ピロリ感染とアルツハイマー病の関連. J. Neurol. 258, 1460-1463. doi: 10.1007/s00415-011-5957-5
パブコメ抄録|全文|Google Scholar
Silva, Y. P., Bernardi, A., and Frozza, R. L. (2020). 腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割。Front. Endocrinol. 11:25. doi: 10.3389/fendo.2020.00025
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Stoker, T. B., Mason, S. L., Greenland, J. C., Holden, S. T., Santini, H., and Barker, R. A. (2022). ハンチントン病:診断と管理。Pract. Neurol. 22, 32-41. doi: 10.1136/practneurol-2021-003074
CrossRef 全文|Google Scholar
Taylor, G. S., Vipond, I. B., Paul, I. D., Matthews, S., Wilcock, G. K., and Caul, E. O. (2002). C. pneumoniaeと遅発性アルツハイマー病との相関の失敗。神経学 59, 142-143.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Tetz, G. (2022). 論説:神経変性疾患:腸脳軸から脳マイクロバイオームまで。Front. Aging Neurosci. 14:52805. doi: 10.3389/fnagi.2022.1052805.
パブコメ抄録|全文|Google Scholar
Thomas, M., Ashizawa, T., and Jankovic, J. (2004). ハンチントン病におけるミノサイクリン:パイロットスタディ。Mov. Disord. 19, 692-695.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wawrzeniak, K., Gaur, G., Sapi, E., and Senejani, A. G. (2020). ボレリア・ブルグドルフェリの外膜小胞が宿主の酸化ストレス反応に及ぼす影響。抗生物質9:275.
パブコメ抄録|全文|Google Scholar
Westfall, S., Dinh, D. M., and Pasinetti, G. M. (2020). アルツハイマー病における潜在的脳内マイクロバイオームの調査:研究バイアスの意味合い。J. Alzheimers Dis. 75, 559-570.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wozniak, M. A., Cookson, A., Wilcock, G. K., and Itzhaki, R. F. (2003). 血管性痴呆患者の脳における肺炎クラミジアの不在。Neurobiol. 加齢 24, 761-765.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xie, J., Cools, L., Van Imschoot, G., Van Wonterghem, E., Pauwels, M. J., Vlaeminck, I., et al. ヘリコバクター・ピロリ由来の外膜小胞は、C3-C3aRシグナルを介してアルツハイマー病発症に寄与する。細胞外小胞12:e12306.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zarate, M. A., Rodriguez, M. D., Chang, E. I., Russell, J. T., Arndt, T. J., Richards, E. M., et al. 多剤耐性ブドウ球菌による胎児脳の低酸素後浸潤。論文誌7:6. doi: 10.1038/s41598-017-06789-6
クロスレフ・フルテキスト|Google Scholar
Zhang, W., Narayanan, M., and Friedlander, R. M. (2003). ALSモデルマウスにおけるミノサイクリンとクレアチンの相加的神経保護効果。Ann. Neurol. 53, 267-270.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:神経変性疾患、脳内マイクロバイオーム、アルツハイマー病、パーキンソン病、細菌、脳内常在菌、真菌、多発性硬化症
引用 Arabi TZ, Alabdulqader AA, Sabbah BN and Ouban A (2023) 脳内常在細菌と神経変性疾患:「脳マイクロバイオーム」理論。Front. Aging Neurosci. doi: 10.3389/fnagi.2023.1240945.
受理された: 15 June 2023; Accepted: 29 September 2023;
発行:2023年10月19日
編集:Norshamsiah Md:
マレーシア国立大学 Norshamsiah Md Din, マレーシア
査読者
マニシュ・クマール・トリパティ(エルサレム・ヘブライ大学、イスラエル
フィロズ・アクター(ストーニーブルック大学、米国
Copyright © 2023 Arabi, Alabdulqader, Sabbah and Ouban. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Abderrahman Ouban, aouban@alfaisal.edu
免責事項:本論文で表明されたすべての主張は、あくまで著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
糖尿病網膜症スクリーニングにおける人工知能の応用:サウジアラビアの視点
アブドゥルアジズ・A・バラカット、オマール・モバラク、ハルーン・アフメッド・ジャヴァイド、Mhd・ラシード・アワド、カラム・ハムウェヤ、アブデラフマン・ウーバン、セルワ・A・F・アル=ハザア
軽度認知障害と関連する前頭前野事象関連電位マーカー
Joel Eyamu、Wuon-Shik Kim、Kahye Kim、Kun Ho Lee、Jaeuk U. Kim
脳の老化と認知機能低下における細胞老化
Areez Shafqat、Saifullah Khan、Mohamed H. Omer、Mahnoor Niaz、Ibrahem Albalkhi、Khaled AlKattan、Ahmed Yaqinuddin、Tamara Tchkonia、James L. Kirkland、Shahrukh K. Hashmi
多重免疫組織化学を用いた次世代病理学: 単一細胞レベルでの組織構造のマッピング
Francesca Maria Bosisio、Yannick Van Herck、Julie Messiaen、Maddalena Maria Bolognesi、Lukas Marcelis、Matthias Van Haele、Giorgio Cattoretti、Asier Antoranz、Frederik De Smet
泌尿生殖器系新生物におけるクローディン:そのメカニズム、予後、治療の展望
タレク・ジアド・アラビ、ネダー・アシュラフ・ファウジー、ベラル・ネダル・サッバ、アブデラフマン・ウーバン
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
