
アトピー性皮膚炎における炎症のエピジェネティックな制御について
細胞・発生生物学セミナー
2023年4月27日オンライン公開
In Press, Corrected Proofこれは何だ?
レビュー
アトピー性皮膚炎における炎症のエピジェネティックな制御について

Author links open overlay panelSabah Akhtar a 1, Reem Khaled M.E. Alsayed a 1, Fareed Ahmad a b c, Ayda AlHammadi c, Sara Al-Khawaga c, Sara Mohamed A.M.? AlHarami d, Majid Ali Alam a b c, Khalifa Abdulla H.N. Al Naama c, Joerg Buddenkotte a b c, Shahab Uddin a b e, Martin Steinhoff a b c f g, Aamir Ahmad a b c
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.semcdb.2023.04.005Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
アブストラクト
アトピー性皮膚炎(AD)は、アトピー性湿疹とも呼ばれ、一般的でありながら、皮膚の根本的な炎症を伴う複雑な慢性かゆみ性皮膚疾患である。この皮膚疾患は世界中に広がっており、あらゆる年齢層の人々、特に5歳以下の子供たちが罹患しています。AD患者のかゆみとその結果生じる発疹は、しばしば炎症シグナルの結果であるため、緩和、ケア、治療のために炎症を制御するメカニズムを詳しく調べる必要がある。いくつかの化学物質や遺伝学的に誘導された動物モデルは、炎症性のAD微小環境を標的とすることの重要性を立証しています。エピジェネティックなメカニズムは、炎症の発症と進行のより良い理解に向けて注目されている。例えば、フィラグリンやヒトβ-ディフェンシンの減少やマイクロバイオームの変化によるバリア機能障害、高親和性IgE受容体の過剰発現をもたらすFc受容体のリプログラミング、好酸球数の増加やCD4 + T細胞によるIL-22産生の上昇などのADの病態生理に関与するいくつかの生理現象には、プロマーのメチル化やノンコーディングRNAによる制御などのエピジェネティック機構が背景にあります。これらのエピジェネティックな変化を元に戻すと、サイトカインIL-6, IL-4, IL-13, IL-17, IL-22などの分泌が変化し、炎症負荷が軽減することが確認されており、実験モデルではADの進行に効果があることが分かっています。ADにおける炎症のエピジェネティックなリモデリングを完全に理解することは、新しい診断、予後、治療法への道を開く可能性を持っている。
キーワード
アトピー性皮膚炎
炎症(Inflammation
エピジェネティック
バリア機能不全
ノンコーディングRNA
アトピー性皮膚炎:入門編
アトピー性皮膚炎(AD)は、一般にアトピー性湿疹と呼ばれ、身体の数カ所を覆う発疹を特徴とする炎症性慢性皮膚疾患です[1]。「皮膚炎」は皮膚の状態を意味し、「アトピー」はアレルギー反応によって引き起こされる病気を意味します。ADは、5歳児からよく再発し、時には成人まで続くこともあります[2]。ADは、他の非致死的皮膚疾患と比較して非常に高い有病率を持っており、全小児の15~20%、成人の最大10%が罹患し、罹患者の95%が5歳以下の早期発症を経験しています [1], [3], [4], [5]. 発作時には、ADは赤く、かゆみのある発疹となります。湿疹は、様々な物理的、内的要因によって引き起こされます。その結果、炎症が起こり、血流が増加し、痒みの衝動に駆られます [6]。湿疹の悪化は、痒みと掻破の苦悩のサイクルの一部となります。痒みと掻きのサイクルの原動力となる身体的、心理的な要素と戦うのは難しいことです。掻くことで一過性の緩和は得られるが、さらに炎症が進み、皮膚感染症を引き起こすこともある。ADの臨床管理は、治療法が確立されていないため困難です。有病率は、人種、性別、地理的な地域によって異なります。神経免疫回路や個々のシグナル伝達経路を標的とすることは、ADのそう痒症を制御するための選択肢となるようです [7] 。衛生用品や公害など、さまざまな環境要因がこの疾患の獲得に寄与する可能性があります。近年、そして産業ブームに伴い、ADの発症率は何倍にも増加しています[2]。ADは、患者さんとご家族のQOL(生活の質)に悪影響を及ぼすだけでなく、治療にかかる経済的負担も問題になっています。また、ADの有病率は先進国だけでなく、発展途上国でも増加しているようであり[4]、心配の種となっています[8]、[9]。ADの発症と進行は、AD由来のサイトカインが全身性の炎症性疾患や悪性腫瘍につながる可能性があるため、さらに懸念されます[10]。したがって、この疾患をより深く理解し、新しい治療法を見出すことが必要です。アトピー性皮膚炎における炎症
ADは重要な慢性または再発性の炎症性皮膚疾患で、しばしば喘息やアレルギー性疾患に先行する[11]。アトピー性皮膚炎の主な症状である病変や痒みは、慢性炎症が根底にあります [12], [13]。このように、炎症のプロセスは、ADの発症と進行に複雑に関連しています。免疫系は、病原体から人体を守る役割を担っています。身体が毒性化合物、病原体、損傷した細胞などの異物に遭遇すると、免疫系は治癒軸の開始をトリガーします[14]。このような免疫系へのトリガーは、有益である場合もあれば、有害である場合もある。急性炎症は怪我を治し、感染を抑えるが、慢性炎症は細胞や器官を損傷する可能性がある。血管と免疫細胞の反応の根本的な影響の物理的な現れには、熱、赤み、痛み、腫れが含まれます。さらに、炎症性疾患の性質上、併存疾患を伴うことが多い[15]。
ADでは、この疾患の病因につながる主な要因である免疫系の機能不全だけでなく、疾患が顕在化した後にさらなる合併症を引き起こします[16]。IL-17やIL-2などの多くの炎症性因子は、ADにおける免疫反応を促進します。これらの因子は皮膚バリアを損ない、アレルゲンや炎症に対してより敏感になり、これが疾患の獲得を開始させる。ADに関連する併存疾患は消化器系の合併症で、これらは腸内の病原性細菌の過剰な増殖により発生し [16] 、免疫寛容の喪失、制御性T(Treg)細胞の刺激の減少が顕著です。また、ADの免疫系への影響としては、血清免疫グロブリンE(IgE)の上昇、Th2サイトカインや胸腺間質リンパポエチン(TSLP)の増加、皮膚リンパ球関連抗原を発現するT細胞の増加などが挙げられます[16]。炎症に関連する遺伝子変異は、AD患者に特異的であることが注目されている。これらには、SPINK5、IgE受容体FcεRb、NOD1、NOD2、IL-4、-5、-9、-10、-12、-13、-18、-31、TSLP、TLR24およびTLR29の遺伝子に変異がある [16]. ここで重要なことは、我々の最近の臨床研究で、IL-12/23経路をターゲットにしてもAD患者には何の利益ももたらさないことが示唆されていることである[17]。このような臨床的な検証は、患者の転帰に影響を与えるために重要である。その他、多くの炎症関連サイトカインが、ADに関連する炎症に関与している可能性が示唆されている。IL-33の阻害は、ADの炎症における初期免疫反応のトリガーと関連している[18]。NLRP1 inflammasomeによって誘導されるIL-1ファミリーサイトカインは、ADの病因に関与している [19] 。IL-4とIL-13は、依然としてADにおける炎症の要であり[20]、[21]、IL-4受容体αのQ576->R576多型の役割は、炎症が著しく増加し、重度のADになる素因であることが示されている[22]。炎症の文脈では、いくつかの薬剤の送達成分である特定のナノ粒子の使用でさえも、炎症を誘発する可能性があるため、薬剤設計と送達において炎症を十分に理解する必要があります[23]。
炎症性皮膚疾患であるADの炎症は、何百もの出版物において中心的な論点となっている(それ以上ではない)。ADの炎症とそのメカニズムに関する詳細な背景情報を提供することは、このレビューの範囲を超えている。このテーマについては、多くの総説があり、読者はそれを参照することができる [6], [10], [24], [25], [26], [27], [28], [29]. ADにおける炎症に関する研究は次々と報告されているが、このテーマに関する総説ではまだ取り上げられていないであろう、ここ数ヶ月の間に出現した文献をごく簡単に概観する。特に、最近のADに関する研究は、ADのコントロールや治療のためのいくつかの薬剤の有効性を検証する傾向にあり、これらの薬剤が炎症を調節し、ADに対して保護的である可能性があるという中心的な前提がある。多くのin vitro実験が発表されていますが、in vivoモデルを用いてADにおける炎症と新規治療薬の保護効果を研究する研究もあります。最近報告された例としては(表1)、東洋医学のお茶の成分であるLycium barbarum抽出物 [30]、東アジアの珍味である食用鳥の巣 [31]、Grewia tomentosa Jussのエタノール抽出物 [32] などがある。[アジア原産の低木であるAngelica Yinzi [33]、カンナビノイド受容体2の天然アゴニストであるβ-caryophyllene [34]、ターメリックスパイスの成分であるbisdemethoxycurcumin [35], wheatgrass (Triticum aestivum L.), aronia (Aronia L.). )およびアロニア(Aronia melanocarpa)抽出物[36]、海藻Sargassum horneriの熱水抽出物[37]、生薬成分Vigna angularisのエタノール抽出物[38]、Dマンノース [39] はAD実験モデルマウスにおいて2,4-dinitrochlorobenzene(DNCB)によって生成される炎症性サイトカイン抑制に寄与しました; ジニトロフルオロベンゼン(DNFB)誘発ADマウスモデルにおいて、炎症性メディエーターおよび炎症性サイトカインを抑制するカルシウムベースの抗菌ペプチド化合物[40]と漢方薬のCortex Dictamni [41]; 1-クロロ-2,4-ジニトロベンゼン(CDNB)誘発in vivo ADモデルにおいて、炎症性サイトカインを抑制する花植物Scutellaria baicalensis由来のフラボンOroxylin A [42]; オキサゾロン誘発in vivo慢性耳皮膚炎症モデルにおいて炎症性サイトカインを抑制するホスホジエステラーゼ4(PDE4)阻害剤のorismilast [43]; カルボトリオール誘発マウスADモデルにおいてJAK-STAT3経路を阻害し炎症を抑制するオキシマトリン [44]、カルシポトリオール誘発ADモデルにおいて核輸送チェックポイント阻害剤 [45] およびIRAK4阻害剤 [46] が炎症を抑制することがわかった。これらの報告は、新規製剤のAD抑制能を探るだけでなく、化学物質誘発動物モデルの重要な役割を示唆しています。しかし、このようなモデルだけがAD研究に利用できるわけではなく、ADを「より正確に」模倣するための代替モデルも数多く研究されています。例えば、Torilis japonica抽出物 [47] は、3D皮膚モデルにおいて炎症性サイトカインおよびマトリックスメタロプロテアーゼから保護することが示されており、クリ科Castanea sativa [48] は、再構築したヒト皮膚ADモデルにおいて膜整合性を回復し黄色ブドウ球菌誘発効果を減少させることが示されている。さらに、ADにおける炎症を理解するために、遺伝子組み換えマウスモデルも研究されている。例えば、皮膚の炎症を起こしやすくするケラチノサイト特異的なDdx5欠失マウス [49] や、ADに似た顔の皮膚の炎症と引っ掻き行動、すなわち「引っ掻きを伴う顔のAD」またはFADSを引き起こす顔の皮膚線維芽細胞のIkk2欠失マウスFADS [50] が挙げられる。
表1. AD関連炎症の制御に関する最近の報告:in vivo研究からの証拠。
薬剤由来試験モデル主な結果参考文献Lycium barbarum抽出物東洋東洋医学の茶成分DNCB処理BALB/cマウス経口投与により炎症性サイトカインおよびケモカインの減少Bakら[30]Edible birds nest中国の珍味DNCB処理C57BLマウス局所投与によりDNCB誘発皮膚損傷および引っ掻き行動が逆転Laiら。 [31]Grewiaのエタノール抽出物 アジアの低木DNCB処理BALB/cマウス経口投与により炎症性サイトカインのmRNAレベルが低下し、NF-κBシグナルを抑制したLeeら[32]アンジェリカ・インジ 漢方薬成分DNCB処理C57BLマウス経口投与によりAD病変と肥満細胞の浸潤を抑制したLiuら。 [33]β-カリオフィレン植物由来のカンナビノイド受容体アゴニスト2DNCB処理BALB/cマウス局所投与による皮膚炎症の抑制Ahn et al.[34]Bisdemethoxy-curcumin ウコンの成分DNCB処理BALB/cマウス内服による炎症の抑制とNF-κBシグナルの抑制Wang et al. [35]ウィートグラス(Triticum aestivum L.)およびアロニア(Aronia melanocarpa)エキスイネ科およびバラ科の植物に属するDNCB処理BALB/cマウス経口投与によりバリア機能が回復し、IgEおよびIL-4を抑制Lee et al. [36]サルノコシカケ(Sargassum horneri)海藻DNCB処理BALB/cマウス熱水抽出物はIL-4、IL-5およびIgEWoを減少させた[37]Vigna angularisアジア伝統薬のハーブ成分DNCB処理BALB/cマウス内服は炎症性のサイトカインとケモカインを抑制したBak et al. [カルシウム系抗菌ペプチド化合物海産貝類から抽出したカルシウムと抗菌ペプチドの組み合わせDNFB処理BALB/cマウス局所投与による掻破行動と炎症性サイトカインの抑制Liu et al.〔38〕Calcium-based antimicrobial peptide compounds海産貝類から抽出したカルシウムと抗菌ペプチドの組み合わせDNCB-treated BALB/c mice [40]CortexDictamni漢方薬のDictamnus dasycarpus Turczの乾燥根皮ハーブDNFB治療マウス皮膚病変と炎症性サイトカインの減少Yangら[41]Flavone oroxylinアジア伝統医学のScutellaria baicalensisのAComponentCDNB治療BALB / cマウス炎症性サイトカインとケモカインの減少Leeら. [高活性PDE4阻害剤オキサゾロン投与BALB/cマウス経口投与による炎症性サイトカインの分泌抑制Silverbergら[43]Oxymatrineハーブの成分Sophora flavescens Alt...、 Sophora tonkinensis Gagnep、Sophora alopecuroidesCarbotriol投与C57BLマウス胃内投与により炎症性サイトカインが減少Han et al.[44]Nuclear transport checkpoint inhibitorAnti-inflammatory cell-penetrating peptideCalcipotriol投与C57BLマウス局所投与により皮膚炎症抑制Liu et al.
AD:アトピー性皮膚炎、CDNB:1-クロロ-2,4-ジニトロベンゼン、DNCB:2,4-ジニトロクロロベンゼン、DNFB.ジニトロフルオロベンゼン、IL-4:インターロイキン-4、IL-5:インターロイキン-5、PDE4:ホスホジエステラーゼ-4
レジェンドからフィギュアにアトピー性皮膚炎のエピジェネティクスについて
炎症の分子的・遺伝的マーカーは、従来から研究の中心であった。近年、炎症の基盤としてのエピジェネティクスの役割が認識されるようになった[51]。エピジェネティクスの研究は、現在、前臨床バイオマーカーの発見から、臨床試験と同様にトランスレーショナルスタディへと移行し [52], [53] 、エピジェネティクスの変化は、現在、個別化/精密医療戦略においても標的とされています [54]. エピジェネティクスとは、遺伝性があり、DNA/遺伝子配列の変化以外の事象によって引き起こされる遺伝子発現の変化に関する研究である[55]。皮膚関連疾患の発生率が工業化や汚染に伴い増加しているのは、これらの環境要因がエピジェネティックな制御を変化させるからである [56]。遺伝子発現は、ノンコーディングRNA、DNAメチル化、ヒストン修飾によって制御されている [57], [58], [59]。ADでは、免疫細胞における遺伝子およびエピジェネティックな発現の変化が証明されており、これが疾患発症に寄与している [56], [60]。低レベルのTreg細胞を発現している乳児は、ADを発症するリスクが高いことが観察されている[56]。Treg細胞の発現低下は、タバコの煙への曝露によって引き起こされる可能性があり、これはmiR-223の発現増加と相関し、FOXP3遺伝子のメチル化が増加する [56], [61], [62].
メチル化は、遺伝子の発現を決定する重要なエピジェネティックイベントである [63], [64]。AD患者におけるDNAメチル化の差異を健常対照者と比較して調べる試みがいくつかなされている。AD患者12名と健常者6名のDNAメチル化を比較するためにゲノムワイドメチル化プロファイリングを行ったそのような研究では、健常者と比較してAD患者には有意に異なるメチル化プロファイルが観察されました[65]。末梢血単核細胞では、FcεRIとIgE遺伝子の発現が増加し(DNAメチル化の減少を通じて)、これがアレルゲンに対する感受性を変化させる。ADのエピジェネティックな基盤を示す初期の研究の一つで、AD患者10人と健常対照者10人の単球のDNAメチル化を評価したところ、FCER1Gプロモーターの脱メチル化が報告された[66]。グローバルなDNAメチル化解析の結果、AD患者ではFCER1Gプロモーターが局所的に低メチル化されており、単球上での高親和性IgE受容体FcεRIの発現が増加していることが明らかになった(図1)。IgEの高値とADの重症度には正の相関があることから[67]、この研究はAD患者におけるIgE高値のエピジェネティックな基盤を提供し、いくつかの臨床試験でIgEを標的としたオマリズマブの評価につながりました [3] 。FCER1Gの脱メチル化のメカニズムは、後の研究で同様に研究されている[68]。ADにおけるメチル化とエピジェネティクスの差異をさらに証明するものとして、AD患者の病変部表皮では、健常対照者の表皮と比較して、様々なCpG部位で有意に異なるメチル化パターンが観察されました[69]。これらのメチル化されたCpGは、表皮の分化や自然免疫反応に関与する制御された遺伝子と部分的に相関していた。メチル化の違いから、DNAメチル化酵素の役割が注目されています。メチル化酵素は、メチル基を付加することで遺伝子のメチル化を触媒する酵素のことです。ADのマウスモデルだけでなく、ヒトモデルも評価した研究では、ADではDNAメチル化酵素1(DNMT1)レベルの低下が観察され、DNMT1の発現量が低いAD患者は、DNMT1が比較的高いAD患者と比較して、高いかゆみを示した [70].
ダウンロード : 高解像度画像ダウンロード(187KB)
ダウンロード フルサイズ画像をダウンロードする
図1. AD患者の単球におけるFCER1Gプロモーターの脱メチル化により、アレルギー性炎症に重要な役割を果たすIgE受容体FcεRIの発現が増加する。
皮膚の完全性は非常に重要であり、皮膚バリア機能障害はAD発症の初期段階であり、病的特徴でもある(図2)[5], [71].皮膚バリアは環境因子や外来因子によって制御されるため、エピジェネティックに制御される可能性がある [72]。皮膚バリアの完全性に関与する多くの因子の中で、ヒトβ-ディフェンシンは上皮に局在し、保護バリアとして働くことから、その役割が示唆されている [73] 。したがって、これらのヒトβ-ディフェンシンの発現が低下すると、ADにつながる有害な影響を及ぼす可能性がある。エピジェネティックな制御、特にプロモーターのメチル化を支持するために、重度のAD患者の病変皮膚と非病変皮膚サンプルのCpG3およびCpG4におけるメチル化頻度、およびこれらのペア組織とAD歴のない健康ボランティアの対照皮膚における同じメチル化頻度を比較した [74]. ADの病変部皮膚では、非病変部および対照皮膚と比較して、有意に高いメチル化が観察された。さらに、本研究のin vitroでの検討により、ヒトβ-ディフェンシン-1のプロモーターのCpG部位がメチル化されると、プロモーター活性が約86%低下し、その結果、発現量が低下することが確認された。
ダウンロード 高解像度画像ダウンロード(275KB)
ダウンロード フルサイズ画像をダウンロードする
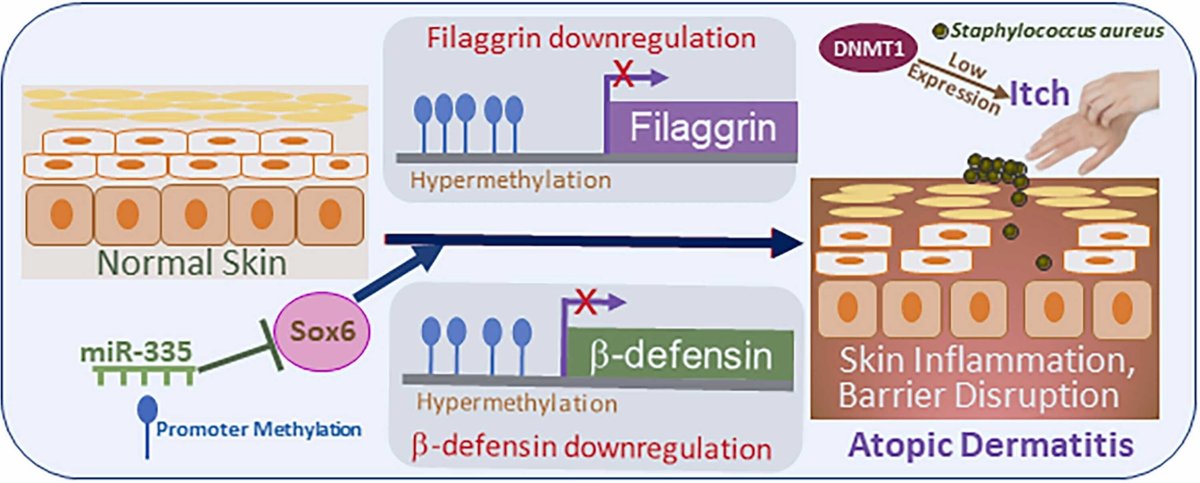
図2:皮膚バリア障害のエピジェネティックな基盤。AD患者の皮膚バリア障害や機能不全につながる多くの事象は、エピジェネティックな基盤を持っている。例えば、フィラグリンやβ-ディフェンシンのプロモーターが過剰にメチル化されると、炎症とかゆみを伴うAD患者の皮膚病変で観察されるように、それらのダウンレギュレーションが生じる。また、DNAメチルトランスフェラーゼ1(DNMT1)の低発現もかゆみと相関している。さらに、miR-335は正常皮膚では高発現であり、その低発現により標的であるSox6の抑制が解除され、皮膚バリアの崩壊につながる。また、ADの皮膚病変は、黄色ブドウ球菌のコロニー形成が顕著であることが多い。
ADのバリア機能における役割で注目されているもう一つの因子は、フィラグリン(FLG)である [75], [76].FLGは膜機能の維持に重要であるため、ADではその発現低下が見られる[77]。FLGのダウンレギュレーションのエピジェネティックな理由は、ADの病変部表皮では、重度のAD患者のマッチした非病変部表皮と比較して、その発現に関連する重要なCpG部位でDNAメチル化が増加していることだとも判明した [78]. このように、メチル化の差は、ADに関与する特定の遺伝子の発現の差を決定している。メチル化の差は、小児AD [79] や、アトピーの母親を持つ乳児におけるAD診断の可能性の増大 [80] と関連しているようである。
バリア機能障害は、マイクロRNA(miRNA)の調節という別のエピジェネティックな事象の現れであることもある。miRNAが介在するバリア機能に着目したある研究では、AD病変部の皮膚では、健康な皮膚と比較して、miR-335が失われていることが判明した[81]。miR-335の欠損は、皮膚バリアの破壊を媒介する標的SOX6の発現を増加させる結果となりました。この研究は、ベリノスタットがmiR-335を回復させることができるため、ADの治療にベリノスタットを使用することの利点も示唆した。さらに、ベリノスタットはヒストン脱アセチル化酵素(HDAC)阻害剤であり[82]、AD発症におけるもう一つのエピジェネティックな事象であるアセチル化が関与していることを示唆しています。数年前から、ADにおけるmiRNAの役割が認識されるようになった[83]。マイクロRNAであるmiR-155は、異常な過剰発現によってT細胞の増殖とTヘルパー17型(Th17)細胞の分化をそれぞれ促進するため、一定の炎症状態やADの攻撃性に寄与している[84]。miRNAによる制御は、エピジェネティックな制御の一種である。
利用可能な文献に基づくと、ADの疾患発症および疾患進行の基礎となるエピジェネティックなメカニズムを支持する十分な証拠がある [56], [85], [86], [87], [88], [89], [90], [91], [92], [93] 。NF-κBシグナルを乱し [94] 、サイトカイン分泌、特にIL-22 [95], [96] にも影響を与える免疫関連エピジェネティック変化に関するいくつかの最近の報告など。アトピー性皮膚炎における炎症とエピジェネティクスの関連性
この時点で、炎症がADの病態生理に不可欠な要素であることは明らかである。さらに、ADにおけるエピジェネティックな事象の役割がますます認識されつつあることから、ADにおける炎症とエピジェネティックスの間に何らかの関係があるのか、あるいは、簡単に言えば、ADにおける炎症のエピジェネティックな制御を示す証拠があるのか、という疑問が生じます。上述のように、FCER1Gのプロモーター低メチル化、すなわちエピジェネティックな事象が、AD患者の単球上で高親和性IgE受容体FcεRIを過剰発現させるメカニズムであることが示されている [66]. FcεRIはアレルギー性炎症に重要な役割を果たしており[97]、その欠損[98]や特異的標的[99]は炎症に影響を与えるため、炎症におけるこの受容体の役割を立証している。さらに、AD患者におけるメチル化によるこの受容体自身の制御は、ADにおける炎症のエピジェネティック制御の手がかりとなる。FCER1Gの脱メチル化と過剰発現は、ヒト単球における関連するFc受容体γサブユニット(FcRγ)関連受容体の過剰発現をもたらす [68] 。炎症におけるFcRγの役割もまた、Fc受容体一般と同様に知られている[100][101]。したがって、Fcファミリー受容体のエピジェネティックな過剰発現は、AD患者における炎症を媒介する。
ADにおける炎症とエピジェネティクスの領域で、最近出てきた興味深い概念は、ADにおけるマイクロバイオームの関与である [102], [103].多数の微生物種が人体に生息し、正常な人間の健康だけでなく、いくつかの病気にも影響を与えている [104], [105], [106]。マイクロバイオームは炎症に影響し、特定の細菌の存在は、さまざまな身体組織における炎症を媒介することができる炎症分子と相関している[107]。ヒトのマイクロバイオームを構成する微生物は、粘膜免疫と遠位の炎症に影響を与える[108]。ADでは、皮膚と腸の両方に存在する微生物がADの経過を決定する可能性がある [102]。皮膚マイクロバイオームは、病原性黄色ブドウ球菌のコロニー形成を抑制することでバリア機能の維持に重要な役割を果たすこともあり、さらに、Staphylococcus hominisやRoseomonas粘膜などの常在菌を適用することで、ADの重症度を下げることができます[109]。ADでは、マイクロバイオームの多様性の低下は疾患の重症度と相関し、ADのフレアは病原微生物の拡大と相関しています[110]。ADを含む炎症性疾患への影響に加えて、マイクロバイオームは人体内のエピジェネティックな再プログラミングにも影響を与え、マイクロバイオーム感受性の変化は、DNA/ヒストン修飾やノンコーディングRNAによる制御といった主要なエピジェネティックイベントに影響を与えます[111]。したがって、ADのエピジェネティックな制御におけるマイクロバイオームの役割が示唆されたことは驚くべきことではありません[112]。
好酸球数はAD患者において上昇する [113], [114]。さらに、好酸球顆粒タンパクのレベルは末梢血で上昇し、また皮膚病変に沈着し、これらのレベルの上昇は疾患と相関する [113]。好酸球は複数のメカニズムを通じて炎症に影響を与え [115], [116] 、このことが好酸球とADのような炎症性疾患を結びつけています。さらに、最近のエビデンスでは、バリア機能障害や上皮の完全性が低下した状態での好酸球増多が示唆されており [117]、この相関関係はAD患者においてまだより慎重に検討する必要がある。AD患者の好酸球内のエピジェネティックな変化を評価しようとした研究では、AD患者の好酸球から抽出したRNAを用いて、次世代シーケンサーを用いたmiRNAプロファイリングを実施しました[118]。この評価では、合計145人が対象となり、そのうち75人がADを呈していました。これらの患者の多くは、アレルギー性喘息および/またはアレルギー性鼻炎と診断され、ADとだけ診断された患者は15人でした。好酸球から得られた合計18種類のmiRNAは、異なる病態に特異的で有意な差異があることが判明し、中でもmiR-614はAD患者さんに特異的であることが判明しています。ちなみに、炎症やADにおけるmiR-614については、ヒトの異なるがんにおけるこのmiRNAに関するいくつかの報告を除いては、あまり知られていないため、このmiRNAに関するより詳細な研究は興味深いかもしれない。
最近の報告では、ノンコーディングRNAがADの炎症を制御していることがさらに証明された。この研究では、AD患者のPMBCにおいて、年齢と性別をマッチさせた健常対照者のものと比較して、発現量の異なるcircRNA(環状RNA)を見つけることに焦点を当てた [119]。合計88750個のcircRNAのうち、circRNA hsa_circ_0004287は、AD患者4人と健常対照者4人の比較からなる最初のマイクロアレイ解析で発現量が増加することが判明し、その後、AD患者36人と健常対照者18人で検証された。PBMCにおけるhsa_circ_0004287レベルの差は、AD患者と健常対照者を識別することができ、hsa_circ_0004287のアップレギュレーションはAD患者の皮膚病変で観察されました。しかし、機構的にはhsa_circ_0004287はもともと抗炎症性であることが判明したため、AD患者における過剰発現はフィードバック反応である可能性がある。 hsa_circ_0004287は免疫応答に関与することが知られているM1マクロファージの活性化を抑制し [120]、マクロファージにおける過剰発現は炎症皮膚マウスモデルにおいて皮膚炎症を抑制した。hsa_circ_0004287の発現は、炎症性サイトカインとして知られるIL-6 [121], [122] や、同じく炎症に関連するロングノンコーディングRNA(lncRNA)であるMALAT1 [123] と負の相関がある、 このことから、この抗炎症性circRNAはADにおいて発現量が増加しているが、内因性レベルではADの進行を抑制するには不十分であり、今後の研究では、このcircRNAのレベルをさらに上昇させ、ADにおいて治療上有用なものとすることに焦点を当てるべきであることが判明した。本研究では、circRNAに加えて、ADに関連する炎症を制御するlncRNAも同定し、ADの炎症をエピジェネティックに制御するノンコーディングRNAが何重にも存在することを明らかにしました。これらの知見を裏付けるように、MALAT1のダウンレギュレーションは、ADマウスモデルにおいて、炎症と関連するADを抑制するメカニズムであることが示されている[124]。
イヌのモデルであるが、ADにおける炎症のエピジェネティックな制御をより直接的に示す証拠として、イヌの表皮ケラチノサイト前駆細胞CPEKをインターフェロンγに曝露して前刺激し、その後、IL-4、IL-13、IL-31のカクテルに曝露して炎症刺激を行うと、多くの遺伝子が制御されることがわかった [125]。本研究の主な目的は、ルテオリン、ピセアタンノール、カンナビジオール(フラボノイド、スチルベン、カンナビノイドの代表)からなる栄養補助食品混合物がADの炎症に及ぼす可能性を評価することである。その結果、炎症を起こしたイヌのケラチノサイトにおいて、栄養補助食品混合物がccl2、ccl17、tslp遺伝子をダウンレギュレートすることが報告された。これらの遺伝子発現の変化のエピジェネティックな基盤を見つけるために、これらの遺伝子すべてについて異なるCpG部位でのメチル化を評価したところ、tslpの1つの部位でのみ、遺伝子発現の減少を説明する有意なメチル化の増加が見られた。イヌの単球マクロファージDH82を用いた同様の検討では、ccl2、ccl17、il31ra遺伝子に栄養補助食品ミックスが同様の効果を示したが、tslp遺伝子には認められなかった。さらに、これらの細胞では、各遺伝子の少なくとも1つのCpG部位のメチル化の増加が確認された。Ccl2 [126]、ccl17 [127]、tslp [128]、il31ra [129]はいずれも炎症に関連しており、この結果は、ADモデルにおける炎症のエピジェネティック制御を直接示す証拠である。
免疫系の調節障害は、ADの進行と関連しています[11]。特に、IL-4やIL-13などのTh2サイトカインの関与はよく知られている[130], [131]。ADでない新生児から採取した新生児胸腺T細胞は、成人AD患者由来のIgGに曝露するとIL-17とIL-10の発現が増加することが示されている [132], [133]。同様に、成人AD患者からのIgGは、IL-22産生T細胞の成熟に対する効果を通じて、胸腺によるIL-22の産生を誘導することもできる[96]。IL-22は、フェザキヌマブによるその標的遮断が有望であることから、AD患者における治療の重要な標的として浮上している [134], [135] 。抗IL-22モノクローナル抗体に対する良好な反応は、AD患者においてIL-22産生CD4 +およびCD8 +T細胞が著しく増加しているため、IL-22レベルが高いことを考慮すると理にかなっている [136]。さらに、ADにおけるIL-22の発現量増加に加えて、IL-22は炎症を調節することが知られており[137]、したがって、ADおよび関連する炎症においてこのサイトカインが重要であることを示すものである。IL-22を産生するCD4 +細胞の頻度増加のエピジェネティックな基盤として、調節不全のmiRNAが最近報告された [96] 。Small RNA-seqの結果、アップレギュレートされた5つのmiRNA(miR-181b-5p, miR-4497, let-7i-5p, miR-342-3p and miR-4492)とダウンレギュレートされた2つのmiRNA (miR-130b-3p and miR-26a-5p) が特定でき、ADとモックコントロールを識別することができました。miR-181b-5pは6.17倍の変化を示し、miR-130b-3pは-4.5倍の変化を示し、最もアップレギュレートされたmiRNAであった。さらに、AD患者のIgGに反応する新生児胸腺ガンマデルタT細胞-IL-22分泌のmiRNAベースのエピジェネティックシグネチャーも評価され、miR-4497が最も発現量の多いmiRNAとして、miR-130b-3pが最も発現量の少ないmiRNAとして報告されています [95]. 炎症における役割が報告されているため、これらの上位の調節されたmiRNAの調節は重要である [138], [139], [140].結論と今後の展望
ADは、生活の質に影響を及ぼす炎症性皮膚疾患である。その病態生理における炎症の寄与は確立されているが、近年の研究により、ADに関連する炎症に影響を与えるエピジェネティックな事象が明らかにされ始めている。ADの病態生理におけるエピジェネティックな事象の重要性が新たに認識されたことから、エピジェノムを修飾する可能性のある治療法に目を向けることは理にかなっています [141] 。ADのエピジェネティックな制御に関する理解が進むにつれ、HDAC阻害剤[142]のような特定のエピジェネティックな事象を標的とする治療法がAD治療に用いられることが期待されます。HDAC阻害剤belinostatのようなこれらの阻害剤の使用は、ADの治療において、アセチル化とノンコーディングRNAによる制御という2つの異なるエピジェネティックイベントに対処するユニークな機会を提供する可能性があります。ADにおけるマイクロバイオームの研究は、バリア機能障害、炎症、エピジェネティクスとマイクロバイオームが関連していることから、将来的に期待されるものであることは間違いない[143]。明らかに、エピジェネティックな事象は、診断、予後、治療のバイオマーカーとして利用できる可能性がある。例えば、hsa_circ_0004287は、抗炎症性であるにもかかわらず、AD患者で上昇することから、フィードバック機構、あるいはADに対する生理的防御の開始を示唆する。JAK-STAT経路と相関して炎症を制御するエピジェネティックなメカニズムがあるとすれば、その理解も重要である。JAK-STATシグナルは長い間AD研究の焦点となっており[144], [145]、さらにこのシグナルはADにおける炎症にも影響を及ぼしている[145], [146]が、ADにおけるこのJAK-STATを介した炎症が、エピジェネティック制御されているとしたらどのようにしてなのかは、全く知られてはいない。今後の研究の課題は、新たな手がかりから利益を得て、様々な炎症を制御するエピジェネティックな事象を制御するメカニズムを強化する戦略を開発し、AD患者の予後と転帰を改善することであろう。
資金提供
本研究は、医療研究センター(MRC)のルーチングラント(MRC-01-22-086 to AA, MRC-01-20-829 to MAA)およびMRCのInternal Research Grant Competition grant (IRGC-04-SI-17-151), Hamad Medical Corporation, Qatarから支援を受けています。本論文のオープンアクセス資金は、カタール国立図書館から提供されました。
CRediTの著者の貢献声明
AAh: Conceptualization and Supervision; SAk, RA and AAh: Writing - original draft; FA, AAl, SAl-K, SAl, MA, KA, JB, SU, MS and AAh: Writing - review & editing.
利益相反
Dr.シュタインホフ スタインホフは、ファイザー、サノフィ、リジェネロン、リリー、ノバルティス、ガルデルマ、レオ、メルク、エイボン、ピエールファーブル、ロレアル、BMS、マルホ、東レ、三菱、マルホ、キニクサ、ZymoGenetics、Almirallから報酬を得てコンサルタント業務を行っています; ファイザー、ノバルティス、ガルデルマ、レオ、エイボン、ピエールファーブル、ロレアル、BMS、マルホ、東レ、三菱、マルホ、ZymoGenetics、Almirallの諮問委員会を務めた;彼の研究は、ファイザー、ノバルティス、ガルデルマ、レオ、エイボン、ピエールファーブル、ロレアル、BMS、マルホ、東レ、三菱、マルホ、ZymoGenetics、Almirallにより支援を受けていました。他の著者はいずれも、他に報告すべき利益相反はない。
おすすめ記事
参考文献
[1]
S. シュテンダー
アトピー性皮膚炎
N. Engl. J. Med., 384 (12) (2021), pp.1136-1143
CrossRefView in ScopusGoogle Scholar
[2]
C. アヴェナ=ウッズ
アトピー性皮膚炎の概要
アム J. Manag Care, 23 (8 Suppl) (2017), pp. S115-s123
ScopusGoogle Scholarで見る
[3]
A. ウォレンベルグ、S.F.トムセン、J.P.ラクール、X.ジャウモン、S.ラザレウィッツ
アトピー性皮膚炎における免疫グロブリンEを標的とした治療:既存エビデンスのレビュー
世界アレルギー臓器学会誌,14(3)(2021),記事100519
PDFを見る記事を見るScopusGoogle Scholarで見る
[4]
S. ナッテン
アトピー性皮膚炎:世界の疫学とリスクファクター
Ann. Nutr. Metab., 66 (Suppl 1) (2015), pp.8-16
CrossRefView in ScopusGoogle Scholar
[5]
T. ツァコック、R.ウルフ、C.H.スミス、S.ワイディンガー、C.フローア
アトピー性皮膚炎:皮膚バリアとその先へ
Br. J. Dermatol., 180 (3) (2019), pp.464-474
CrossRefView in ScopusGoogle Scholar
[6]
S.G.クワトラ、L.ミゼリー、C.クリボーン、M.スタインホフ
アトピー性皮膚炎におけるかゆみと痛みの分子・細胞機構と新規治療法への示唆
Clin. Transl.Immunol., 11 (5) (2022), Article e1390
ScopusGoogle Scholarで見る
[7]
M. スタインホフ、F・アーマド、A・パンディ、A・ダツィ、A・アルハマディ、S・アルカワガ、A・アルマルキ、J・メン、M・アラム、J・ブッデンコッティー
アトピー性皮膚炎における掻痒感を制御する神経免疫コミュニケーション
J. Allergy Clin. Immunol., 149 (6) (2022), pp.1875-1898
PDFを見る記事を見るScopusGoogle Scholarで見る
[8]
T.F. Tsai, M. Rajagopalan, C.Y. Chu, L. Encarnacion, R.A. Gerber, P. Santos-Estrella, L.J.Q. Llamado, A.M. Tallman
アジアにおけるアトピー性皮膚炎の負担について
J. Dermatol., 46 (10) (2019), pp.825-834
CrossRefView in ScopusGoogle Scholar
[9]
C.Y. Chu, T.C. Yao, I.H. Shih, C.Y. Yang, C.L. Chin, S. Ibrahim, S. Thevarajah, L.K. Fon, M.H. Ho, C.C. Mo, C.P. Yu, S.K. Loo, T. Luger
乳幼児のアトピー性皮膚炎に対するPimecrolimusの治療:アジアの視点から
Dermatol. Ther. (ハイデ )(2023年)
Google Scholar
[10]
M. 板村、澤田陽子
全身性炎症性疾患の発症におけるアトピー性皮膚炎の関与
Int J. Mol. Sci.、23 (21) (2022)
Google Scholar
[11]
M. ボグニェヴィッチ、D.Y.レオン
アトピー性皮膚炎:皮膚バリアーの変化と免疫制御異常の疾患
Immunol. Rev., 242 (1) (2011), pp.233-246
ScopusGoogle Scholarで見る
[12]
D.Y. Leung, M. Boguniewicz, M.D. Howell, I. Nomura, Q.A. Hamid
アトピー性皮膚炎に関する新たな知見
J. Clin. インベスト, 113 (5) (2004), pp.651-657
ScopusGoogle Scholarで見る
[13]
J.K.ギトラー、A.シェマー、M.スアレス=ファリナス、J.フエンテス=ドゥクラン、K.J.グレウィッチ、C.Q.ワン、三井弘、 I.Cardinale, C.de Guzman Strong, J.G. Krueger, E. Guttman-Yasky。
T(H)2/T(H)22サイトカインと選択的表皮タンパク質の進行性活性化が急性および慢性アトピー性皮膚炎を特徴づける
J. Allergy Clin. Immunol., 130 (6) (2012), pp.1344-1354
PDFを見る記事を見るScopusGoogle Scholarで見る
[14]
L. Chen、H. Deng、H. Cui、J. Fang、Z. Zuo、J. Deng、Y. Li、X. Wang、L. Zhao
臓器における炎症反応と炎症関連疾患
Oncotarget, 9 (6) (2018), pp.7204-7218
CrossRefGoogle Scholar
[15]
W.H.Boehncke
乾癬患者における全身性炎症と心血管系合併症:原因と結果
Front Immunol., 9 (2018), p. 579
ScopusGoogle Scholarで見る
[16]
J. キム、B.E.キム、D.Y.M.レオン
アトピー性皮膚炎の病態生理:臨床への影響
アレルギー喘息プロック,40(2)(2019),84-92頁
Google Scholar
[17]
H. フセイン=エルアハメド、M.スタインホフ
アトピー性皮膚炎患者におけるウステキヌマブの有効性:リアルワールド・エビデンスの分析
J. Dermatol. Treat., 33 (4) (2022), pp.1838-1843
CrossRefView in ScopusGoogle Scholar
[18]
Z. Qiu, Z. Zhu, X. Liu, B. Chen, H. Yin, C. Gu, X. Fang, R. Zhu, T. Yu, W. Mi, H. Zhou, Y. Zhou, X. Yao, W. Li
アトピー性皮膚炎における皮脂-微生物代謝物-IL-33軸の制御異常が皮膚炎症を引き起こす
J. Exp. Med, 219 (10) (2022)
グーグルシュラー
[19]
H. ヴァーハー、K.キンゴ、P.コルバーグ、M.プック、L.ラーム、A.ラアネスー、A.レム、T.テンソン、K.アラスー、U.ムロウィッツ、S.ワイディンガー、K.キンゴ、A.レバノン
アトピー性皮膚炎患者において、S. aureusによる皮膚コロニー形成はNLRP1インフラマソーム活性化の増加をもたらす可能性がある
J. Invest. Dermatol. (2023)
グーグルシュラー
[20]
G.パッパ、D.スゴロス、K.テオドロプロス、A.カネレアス、E.ボジ、S.グレゴリウ、K.クラサガキス、A.C.カトウリス
アトピー性皮膚炎治療におけるIL-4/13軸とその遮断について
J. Clin. Med., 11 (19) (2022)
グーグルシュラー
[21]
K. Kim, H. Kim, G.Y. Sung
スキンオンチップによるインターロイキン-4およびインターロイキン-13誘発アトピー性皮膚炎ヒト皮膚相当モデル
Int J. Mol. Sci., 23 (4) (2022)
グーグルシュラー
[22]
B. ヤン、ウィルキー、ダス、ティミルシナ、ベインター、ウッズ、ダヤ、ブールグラ、マティアス、ライ、ペティ、ウェラー、H. Harb、T.A. Chatila、D.Y.M. Leung、L.A. Beck、 E.L. Simpson、 T.R. Hata、 K.C. Barnes、 W. Phipatanakul、 J.M. Leyva-Castillo、 R.S. Geha
IL-4Rα Q576R多型はアトピー性皮膚炎の重症度上昇と関連し、マウスにおけるアレルギー性皮膚炎を誇張する
J. Allergy Clin. イムノール(2023)
グーグルシュラー
[23]
J.K.チェ、J.Y.パク、S.リー、Y.A.チェ、S.クォン、M.J.シン、 H.S.Yun, Y.H. Jang, J. Kang, N. Kim, D. Khang, S.H. Kim.
メソポーラスシリカナノ粒子への血漿タンパク質の吸着量の増大がアトピー性皮膚炎を悪化させる件
Int J. Nanomed., 17 (2022), pp. 4599-4617
CrossRefView in ScopusGoogle Scholar
[24]
A. メジャシュ、M.ザヴァツカ、M.チャルビンスキ、M.トルゼチアク
アトピー性皮膚炎は単なる皮膚病なのか?
Int. J. Mol. Sci.、24 (1) (2023)
グーグルシュラー
[25]
P.D.アークライト、J.J.コップリン
アトピー性皮膚炎に関する10年にわたる研究の成果
J. Allergy Clin. Immunol. Pr., 11 (1) (2023), pp.63-71
PDFを見る記事を見るScopusGoogle Scholarで見る
[26]
B. ホーミー、M.スタインホフ、T.ルジッカ、D.Y.レオン
アトピー性皮膚炎を制御するサイトカインとケモカイン
J. Allergy Clin. Immunol., 118 (1) (2006), pp.178-189.
PDFを見る記事を見るGoogle Scholar
[27]
P.M.エリアス、M.スタインホフ
アトピー性皮膚炎における "外から内へ"(そして今は "外 "に戻っている)発症メカニズム
J. Invest Dermatol., 128 (5) (2008), pp.1067-1070
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
[28]
K.A.M. Al-Afif、M.A. Buraik、J. Buddenkotte、M. Mounir、R. Gerber、 H.M. Ahmed、 A.M. Tallman、 M. Steinhoff
アフリカ・中東におけるアトピー性皮膚炎の負担を理解するために
Dermatol. Ther. (ハイデ )、9(2)(2019)、223~241頁
CrossRefView in ScopusGoogle Scholar
[29]
J. Meng, Y. Li, M.J.M. Fischer, M. Steinhoff, W. Chen, J. Wang
トランジェント受容体ポテンシャルチャネルのTh2変調: アトピー性皮膚炎に対する未解決の治療法
フロント・イミュノール, 12 (2021), 記事 696784
ScopusGoogle Scholarで見る
[30]
S.G. Bak, H.J. Lim, Y.S. Won, S. Lee, S.H. Cheong, S.J. Lee, E.Y. Bae, S.W. Lee, S.J. Lee, Rho M.C.
アトピー性皮膚炎様皮膚炎症に対するLycium barbarum抽出物および単離スコポレチンの調節作用について
Biomed. Res Int, 2022 (2022年), p. 2475699
ScopusGoogle Scholarで見る
[31]
Q.W.S. Lai, Q. Fan, B.Z. Zheng, Y. Chen, T.T. Dong, K.W.K. Tsim
アジアの健康食品である食用燕の巣は、アトピー性皮膚炎の症状を回復させる抗炎症作用を有することがわかった: シグナル伝達カスケードの解析
フロントファーム、13(2022)、記事941413
ScopusGoogle Scholarで見る
[32]
H.P. Lee, W. Choi, K.W. Kwon, L. You, L. Rahmawati, V.D. Luong, W. Kim, B.H. Lee, S. Lee, J.H. Kim, J.Y. Cho
Grewia tomentosa Juss.のIgE介在性アレルギー反応およびDNCB誘発アトピー性皮膚炎に対する抑制作用について
プラント(バーゼル)、11(19)(2022年)。
グーグルシュラー
[33]
W. 劉、宋、羅、段、李、張、周、P.ユー
Angelica Yinziは、NLRP3インフラマソームの活性化を抑制し、MAPKs/NF-kBシグナル経路をダウンレギュレートすることにより、1-chloro-2,4-dinitrobenzene誘発アトピー性皮膚炎を緩和させる
サウジアラビア Pharm. J., 30 (10) (2022), pp.1426-1434
PDFを見る記事を見るCrossRefGoogle Scholar
[34]
S.S.Ahn、H.Yeo、E.Jung、S.Ou、Y.H. Lee、Y. Lim、S.Y. Shin
β-カリオフィレンは、ミトジェン活性化プロテインキナーゼ/EGR1/TSLPシグナル軸のダウンレギュレーションを通じて、2,4-ジニトロクロロベンゼン誘発アトピー性皮膚炎を改善させる
Int J. Mol. サイ, 23 (23) (2022)
グーグルシュラー
[35]
Y. Wang, P. Zhang, J. Zhang, T. Hong
DNCB誘発アトピー性皮膚炎に対するBisdemethoxycurcuminの抑制効果(マウス
モレキュールズ, 28 (1) (2022)
グーグルシュラー
[36]
J.H. Lee, J.Y. Lim, Y.D. Jeon, D.H. Yun, Y.M. Lee, D.K. Kim
ハトムギとアロニアの混合抽出物は、in vitroおよびin vivoで炎症反応と酸化ストレスを抑制し、アトピー性皮膚炎関連症状を改善する。
Antioxid. (バーゼル), 12 (1) (2022)
グーグルシュラー
[37]
G.E. Woo, H.J. Hwang, A.Y. Park, J.Y. Sim, S.Y. Woo, M.J. Kim, S.M. Jeong, N.Y. Sung, D.S. Kim, D.H. Ahn
2,4-dinitrochlorobezene 誘導マウスモデルにおけるsargassum horneri 熱水抽出物の抗アトピー活性について
J. Microbiol Biotechnol., 33 (3) (2023), pp.1-8.
ScopusGoogle Scholarで見る
[38]
S.G. Bak, H.J. Lim, E.J. Park, Y.S. Won, S.W. Lee, S. Lee, S.I. Park, S.J. Lee, M.C. Rho
アトピー性皮膚炎様皮膚炎症に対するVigna angularis抽出物およびその活性化合物hemiphloinの影響
ヘリヨン, 9 (2) (2023), 記事e12994
PDFを見る記事を見るScopusGoogle Scholarで見る
[39]
J. Luo, Y. Li, Y. Zhai, Y. Liu, J. Zeng, D. Wang, L. Li, Z. Zhu, B. Chang, F. Deng, J. Zhang, J. Zhou, L. Sun
D-マンノースはmTOR/NF-κB経路を介してDNCB誘発アトピー性皮膚炎マウスおよびTNF-α誘発ヒトケラチノサイトの炎症を改善させる
Int Immunopharmacol., 113 (Pt A) (2022), Article 109378
PDFを見る記事を見るScopusGoogle Scholarで見る
[40]
Q. 劉、李、王、何、姜、李、J.
カルシウム系抗菌ペプチド化合物は、BALB/cマウスにおいてTh細胞を介してDNFB誘発のアトピー性皮膚炎様皮膚病変を減弱させる
Int J. Mol. Sci.、23 (19) (2022)
グーグルシュラー
[41]
N. ヤン、シャオ、デン、リュウ
ネットワーク薬理学に基づく解析で、Cortex Dictamniのアトピー性皮膚炎に対する治療メカニズムを探る
J. Ethnopharmacol.、304(2023)、記事116023
PDFを見る記事を見るScopusGoogle Scholarで見る
[42]
Y.J. Lee, D.S. Im
アトピー性皮膚炎モデルマウスにおけるOroxylin aの抑制効果
炎症(2022年)
グーグルシュラー
[43]
J.I.シルバーバーグ、L.E.フレンチ、R.B.ウォーレン、B.ストローバー、K.キョーラー、M.O.A.ソマー、ペーアンドレス、ジェイ・フェルディング、ア・ヴァイス、ディー・トゥトゥクンカルダス、ティ・スカック・ニールセン、イー・ガットマン
強力かつ選択的なPDE4阻害剤であるorismilastの薬理作用について
J. Eur.Acad. Dermatol. Venereol. (2022)
グーグルシュラー
[44]
X. ハン、マー、ワン、ジン、ハン、リウ、リハ
SOCS1/JAK-STAT3経路に基づくマウスのアトピー性皮膚炎に対するoxymatrineの作用機序の解明
フロントファーム, 13 (2022), p.1091090
グーグルシュラー
[45]
Y. Liu, J. Zienkiewicz, H. Qiao, K.N. Gibson-Corley, K.L. Boyd, R.A. Veach, J. Hawiger
実験的アトピー性皮膚炎におけるゲノムによる炎症の制御
Sci. Rep., 12 (1) (2022), p. 18891
ScopusGoogle Scholarで見る
[46]
S. ラバザス、M.ヤルゴシュ、S.デュポン、F.ラベゲール、C.メネ、C.ヤガーシュミット、F.オーム、L.クプシック、I.ペレント、C.コッテロー、F.マルサイ、L.オステ、A.ファンデウォーター、 T.Christophe, S.De Vos, P.Fallon, F.Lauffer, P. クレマンラクロア、 K.Eyerich, R. Brys
IRAK4阻害は炎症性皮膚疾患の発症過程を抑制する
Sci. Transl. メド,15(683)(2023),p. eabj3289
ScopusGoogle Scholarで見る
[47]
ソ・J.W.、イ・H.J.、ユック・Y.M.、ナム・G.H.、キム・Y.M.
トリカブトエキスによるアトピー性炎症の抑制効果
Int J. Mol. Sci.、24 (3) (2023)
Google Scholar
[48]
S. カドー、M.ゴー、N.ベルテレミー、C.Y.シュー、L.ダヌー、N.ペレティエ、D.グドゥネシュ、C.ポンス、C.ルプランス、V.アンドレ=フライ、M.シモン、S.パン
アトピー性皮膚炎とスキンケア成分を研究するための炎症・感染したヒト表皮の再構築
Int J. Mol. Sci.、23 (21) (2022)
Google Scholar
[49]
X. 倪、徐、王、孔、欧陽、陳、閻、呉、陳、王、李、高、郭、崔、陳、石、朱、李、石、王、王、王、黄、黄、董、莱
IL-17DによるケラチノサイトのDDX5発現抑制はIL-36Rを介した皮膚炎症を増幅させる
Nat. 免疫学, 23 (11) (2022), pp.1577-1587
CrossRefView in ScopusGoogle Scholar
[50]
S. 布村、宇多田、北島郁夫、南里康弘、松田圭佑、江尻憲司、北島幹雄、池光浩、古賀誠、山本聡、本田裕之、武富浩、安藤哲也、S.J. Conway、出原啓之
ペリオスチンは、2型炎症経路の下流で、炎症とかゆみの異なるモジュールを活性化する
セル・レップ、42(1)(2023)、記事111933
PDFを見る記事を見るScopusGoogle Scholarで見る
[51]
D. バヤルサイハン
炎症におけるエピジェネティックメカニズム
J. Dent. Res, 90 (1) (2011), pp.9-17
CrossRefView in ScopusGoogle Scholar
[52]
M. ベルダスコ、M.エステラー
臨床エピジェネティクス:翻訳への機会をつかむ
Nat. Rev. Genet, 20 (2) (2019), pp. 109-127
CrossRefView in ScopusGoogle Scholar
[53]
A. アフマド
がんエピジェネティクス:臨床の視点
Curr. Cancer Drug Targets, 19 (7) (2019), pp.513-514
CrossRefView in ScopusGoogle Scholar
[54]
A. アフマド
肺がんの個別化治療におけるエピジェネティクス
アドバンス・エクスプレス(Adv. Exp. Med Biol., 890 (2016), pp.111-122
CrossRefView in ScopusGoogle Scholar
[55]
A. Ahmad、S. Azim、H. Zubair、M. A. Khan、S. Singh、J. E. Carter、R. P. Rocconi、A. P. Singh
がんの健康格差のエピジェネティックな基盤:遺伝的差異を越えて見る
Biochim Biophys. Acta Rev. Cancer, 1868 (1) (2017), pp.16-28
PDFを見る記事を見るScopusGoogle Scholarで見る
[56]
J.E. Kim, J.S. Kim, D.H. Cho, H.J. Park
皮膚炎症性疾患の分子メカニズム: アトピー性皮膚炎
Int J. Mol. Sci.、17 (8) (2016)
グーグルシュラー
[57]
Y. Lian、L. Meng、P. Ding、M. Sang
ヒトがん進展におけるMAGEファミリーのエピジェネティック制御-DNAメチル化、ヒストン修飾、ノンコーディングRNAなど
クリンです。エピジェネティクス, 10 (1) (2018), p.115
ScopusGoogle Scholarで見る
[58]
I. ガレエフ、Y.ギレバ、A.ジッザリア、O.ベイラーリ、V.パブロフ、M.アガヴェルディエフ、B.マゾロフ、I.ビガニャコフ、A.ヴァーディキアン、M.ジン、A.アフマド
ロングノンコーディングRNAの腫瘍学への応用
Noncoding RNA Res, 6 (3) (2021), pp.139-145.
PDFを見る記事を見るScopusGoogle Scholarで見る
[59]
M. ファルハン、M.F.ウラー、M.ファイサル、A.A.ファルーキ、U.Y.サビリェビッチ、B.ビアサック、A.アフマド
レスベラトロールの抗がん作用のエピジェネティックな基盤としてのメチル化およびアセチル化の差違
Med. (バーゼル), 6 (1) (2019)
Google Scholar
[60]
A.E.A.スレイス、C.M.ヘドリック
自己免疫・炎症性疾患におけるエピジェネティクスの役割
Front Immunol., 10 (2019), p. 1525
ScopusGoogle Scholarで見る
[61]
G. ハーバース、M. バウアー、M. ガッシュ、D. ヒンツ、S. レーダー、S. オレック、T. コハイダ、U. ロレ・カンプチク、M. フォン・ベルゲン、U. サック、M. ボルテ、 I. レーン
母体および臍帯血のmiR-223発現は、出生前のタバコ煙曝露および制御性T細胞数の低さと関連する
J. Allergy Clin. Immunol., 133 (2) (2014), pp.543-550
ScopusGoogle Scholarで見る
[62]
D. ヒンツ、M.バウアー、S.レーダー、S.オレック、J.ヒューン、U.サック、M.ボルテ、J.シーモン、I.レーマン、G.ハーバース
安定したFOXP3発現を持つ臍帯血Tregは出生前環境の影響を受け、1歳時のアトピー性皮膚炎と関連する
アレルギー, 67 (3) (2012), pp.380-389.
CrossRefView in ScopusGoogle Scholar
[63]
G.A. Dhar、S. Saha、P. Mitra、R. Nag Chaudhuri
DNAのメチル化と遺伝子発現の制御: 私たちの健康の守り神
Nucl.(カルカッタ), 64 (3) (2021), pp.259-270
CrossRefView in ScopusGoogle Scholar
[64]
A. アフマド
特集:がん進展のエピジェネティック制御:約束と進展
セミン・キャンサー・バイオロジー、83(2022)、pp.1-3
PDFを見る記事を見るGoogle Scholar
[65]
O.Y.オリソワ、N.G.コチェルギン、L.N.カユモワ、T.M.ザヴァリキナ、A.A.ドミトリーエフ、A.Y.アサノブ
アトピー性皮膚炎患者における皮膚DNAメチル化プロファイル: 症例対照研究
Exp. 皮膚科学, 29 (2) (2020), pp.184-189.
CrossRefView in ScopusGoogle Scholar
[66]
Y. Liang, P. Wang, M. Zhao, G. Liang, H. Yin, G. Zhang, H. Wen, Q. Lu
アトピー性皮膚炎患者の単球においてFCER1Gプロモーターの脱メチル化によりFcepsilonRIが過剰発現することが明らかになった
アレルギー, 67 (3) (2012), pp.424-430
CrossRefView in ScopusGoogle Scholar
[67]
J.G. Holm、T. Agner、M.L. Clausen、S.F. Thomsen
アトピー性皮膚炎患者における重症度の決定要因:アトピーマーチの構成要素との関連性
Arch. Dermatol. Res, 311 (3) (2019), pp.173-182
CrossRefView in ScopusGoogle Scholar
[68]
Y. Liang, B. Yu, J. Chen, H. Wu, Y. Xu, B. Yang, Q. Lu
胸腺間質リンパポエチンが抗原提示細胞上のFc受容体γサブユニット関連受容体をエピジェネティックにアップレギュレートし、デクチン-2を介してT(H)2/T(H)17極性を誘導すること
J. Allergy Clin. Immunol., 144 (4) (2019), pp.1025-1035
e7
ScopusGoogle Scholarで見る
[69]
E. ロドリゲス、バウレヒト、ヴァーン、クレッチマー、ホッツェ、ザイリンガー、クロップ、イリグ、シュラム、プロキッシュ、キューネル、ジーガー、ハーダー、シフェンテス、ノヴァック、ワイディンガー、S.
エピジェネティクスとトランスクリプトームの統合解析により、アトピー性皮膚炎に関連するDNAメチル化の組織特異的なパターンが明らかにされた
J. Invest Dermatol., 134 (7) (2014), pp.1873-1883
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
[70]
Y. 吉田、早川、藤代、池田、津島、平井、川崎、冨永、菅、高森、渡辺、関川、森本の各氏
社会的敗北ストレスは、皮膚樹状細胞におけるDNAメチル化酵素1のダウンレギュレーションとC-Cモチーフケモカイン受容体7のアップレギュレーションを介してアトピー性皮膚炎を悪化させる
バイオケムバイオフィジックス Res Commun., 529 (4) (2020), pp.1073-1079
PDFを見る記事を見るScopusGoogle Scholarで見る
[71]
B.E. Kim, D.Y.M. Leung
アトピー性皮膚炎における皮膚バリア機能不全の意義
アレルギー喘息免疫学. Res, 10 (3) (2018), pp.207-215
CrossRefView in ScopusGoogle Scholar
[72]
Y. 三田村、I. Ogulur、Y. Pat、A.O. Rinaldi、O. Ardicli、L. Cevhertas、M. C. Brüggen、C. Traidl-Hoffmann、M. Akdis, C.A. Akdis
環境因子やその他の外来因子による上皮バリアーの調節異常
コンタクトダーマ、85(6)(2021)、pp.615-626
CrossRefView in ScopusGoogle Scholar
[73]
P. チエオシラパタム、小川浩司、ニヨンサバ F. Niyonsaba
アトピー性皮膚炎におけるヒトβ-ディフェンシンの役割に関する最新の知見
Clin. Exp. Immunol., 190 (2) (2017), pp. 155-166
CrossRefView in ScopusGoogle Scholar
[74]
Y.H. Noh, J. Lee, S.J. Seo, S.C. Myung
プロモーターDNAメチル化はアトピー性皮膚炎におけるヒトβ-ディフェンシン-1欠損に寄与する
アニメーション Cells Syst. (ソウル), 22 (3) (2018), pp.172-177
CrossRefView in ScopusGoogle Scholar
[75]
R. 大澤、秋山雅史、清水宏之
フィラグリン遺伝子の欠損とアレルギー疾患発症のリスク
Allergol. Int, 60 (1) (2011), pp.1-9
PDFを見る記事を見るScopusGoogle Scholarで見る
[76]
A. サンディランズ、C.サザーランド、A.D.アーバイン、W.H.マクリーン
最前線に立つフィラグリン:皮膚バリア機能と疾患における役割
J. Cell Sci., 122 (Pt 9) (2009), pp.1285-1294
CrossRefView in ScopusGoogle Scholar
[77]
J.P. Thyssen、S. Kezic
表皮フィラグリン減少の原因とアトピー性皮膚炎の病態におけるその役割について
J. Allergy Clin. Immunol., 134 (4) (2014), pp.792-799
PDFを見る記事を見るScopusGoogle Scholarで見る
[78]
J. Lee、A. Jang、S.J. Seo、S.C. Myung
ヒト表皮ケラチノサイトにおけるフィラグリン遺伝子発現のエピジェネティックな制御機構
Ann. Dermatol., 32 (2) (2020), pp.122-129.
Google Scholar
[79]
K.D. Chen, Y.H. Huang, M.M. Guo, L.S. Chang, C.H. Chu, L.F. Bu, C.L. Chu, C.H. Lee, S.F. Liu, H.C. Kuo
DNAメチル化アレイにより、小児アトピー性皮膚炎の重症度を示すバイオマーカーとしてGolli-MBPが同定される
J. Invest Dermatol., 142 (1) (2022), pp.104-113
PDFを見る記事を見るCrossRefGoogle Scholar
[80]
M. シェデル、S.M.リーチ、M.J.ストランド、T.ダンホーン、M.マクベス、 A.V.Faino, A.M.Lynch, V.D.Winn, L.L.Munoz, S.M.Forsberg, D.A.Schwartz, E.W. Gelfand, P.J. Hauk
アトピー母親の分子ネットワークが乳児アトピーリスクに影響する
アレルギー, 78 (1) (2023), pp.244-257
CrossRefView in ScopusGoogle Scholar
[81]
W.C. Liew, G.M. Sundaram, S. Quah, G.G. Lum, J.S.L. Tan, R. Ramalingam, J.E.A. Common, M.B.Y. Tang, E.B. Lane, S.T.G.Thng, P. Sampath
Belinostatは、調節不全のmiR-335:SOX6軸を標的とすることで、アトピー性皮膚炎における皮膚バリア欠損を解消する
J. Allergy Clin. Immunol., 146 (3) (2020), pp.606-620
e12
ScopusGoogle Scholarで見る
[82]
M.T. Buckley, J. Yoon, H. Yee, L. Chiriboga, L. Liebes, G. Ara, X. Qian, D.F. Bajorin, T.T. Sun, X.R. Wu, I. Osman
ヒストン脱アセチル化酵素阻害剤belinostat(PXD101)はin vitroおよびin vivoで膀胱がん細胞の増殖を抑制する
J. Transl. Med, 5 (2007), p. 49
ScopusGoogle Scholarで見る
[83]
E. ディサナヤケ、井上雄彦
アレルギー疾患におけるマイクロRNAの役割
Curr. Allergy Asthma Rep., 16 (9) (2016), p. 67
ScopusGoogle Scholarで見る
[84]
L. Ma, H.B. Xue, F. Wang, C.M. Shu, J.H. Zhang
マイクロRNA-155はTヘルパー17型(Th17)細胞の分化と機能を調節することにより、アトピー性皮膚炎の発症に関与している可能性が示唆された
Clin. Exp. Immunol., 181 (1) (2015), pp. 142-149
CrossRefView in ScopusGoogle Scholar
[85]
Y. Liang, C. Chang, Q. Lu
アトピー性皮膚炎の遺伝学とエピジェネティクス-Filaggrinとその他の多型
クリンです。Rev. Allergy Immunol., 51 (3) (2016), pp. 315-328
CrossRefView in ScopusGoogle Scholar
[86]
J.S.マーヴィス、J.S.マクギー
DNAメチレーションと炎症性皮膚疾患
Arch. Dermatol. Res, 312 (7) (2020), pp.461-466
CrossRefView in ScopusGoogle Scholar
[87]
L. ビン、D.Y.レオン
アトピー性皮膚炎の遺伝学的・エピジェネティック研究
アレルギー喘息Clin. Immunol., 12 (2016), p.52.
ScopusGoogle Scholarで見る
[88]
A.D.シュミット、C.デ・グスマン
アトピー性皮膚炎におけるエピジェネティクスを強く、現在理解している。
Exp. 皮膚科学, 30 (8) (2021), pp.1150-1155
CrossRefView in ScopusGoogle Scholar
[89]
L. メーバス、S.ヴァイディンガー、H.エメルト
炎症性皮膚疾患の病態に関与するエピジェネティックな因子について
J. Allergy Clin. Immunol., 145 (4) (2020), pp.1049-1060
PDFを見る記事を見るScopusGoogle Scholarで見る
[90]
Z. ムー、チャン(J. Zhang
アトピー性皮膚炎における遺伝、環境、エピジェネティクスの役割について
アドバンス・エクスプレス(Adv. Exp. Med Biol., 1253 (2020), pp.107-140
CrossRefView in ScopusGoogle Scholar
[91]
B. ネドシツコ、E.レシュカ、D.グトフスカ・オウシアク、M.トルゼチク、M.ランゲ、J.ヤルチャック、M.ニエドシツコ、E.ヤブロンスカ、J.ロマントフスキ、D.ストラパギエル、J.スココフスキ、A.シーキエルジッカ、R.J. ノヴィツキ、 I.T. ドブルツキ、A.ザリクザンスカ、 L. カリンフスキ
アトピー性皮膚炎の遺伝的・エピジェネティックな側面
Int J. Mol. サイエンス, 21 (18) (2020)
グーグルシュラー
[92]
F. ギブソン、A.ハンリー、N.グルビッチ、N.グランバーグ、M.ウー、M.コラード、R.M.アラニ
自己免疫疾患および炎症性皮膚疾患におけるエピジェネティックな制御障害
クリンです。Rev. Allergy Immunol., 63 (3) (2022), pp. 447-471
CrossRefView in ScopusGoogle Scholar
[93]
C.H. Baloh、R.A. Mathias
アトピーの遺伝的・エピジェネティックな基盤に関する最近の進歩
J. Allergy Clin. Immunol., 151 (1) (2023), pp.60-69
PDFを見る記事を見るScopusGoogle Scholarで見る
[94]
A.A. Eapen、S. Parameswaran、C. Forney、L.E. Edsall、D. Miller、O. Donmez、K. Dunn、X. Lu、M. Granitto、 H. Rowden、 A.Z. Magier、 M. Pujato、 X. Chen、 K. Kaufman、 D.I. Bernstein、 A.L. Devonshire、 M. E. Rothenberg、 M.T. Weirauch、 L. C. Kottyan
アトピー性皮膚炎患者におけるCD4+ T細胞のエピジェネティックおよび転写調節障害
PLoS Genet, 18 (5) (2022), Article e1009973
CrossRefView in ScopusGoogle Scholar
[95]
B.O.ファガンデス、T.R.デ・ソウザ、A.ナシメント、L.A.フェルナンデス、F.D.R.スグノット、R.L.オルファリ、青木V、デュアルテA、サナバ二S、ビクター J.R.A.
成人アトピー性皮膚炎(AD)患者由来のIgGは、非アトピー性新生児胸腺γδT細胞(γδT)に皮膚ホーミング特性を持つIL-22/IL-17分泌プロファイルを誘導し、miRNAを介したエピジェネティックな影響を与える
Int J. Mol. Sci.、23 (12) (2022)
Google Scholar
[96]
T.R.デ・ソウザ、B.O.ファグンデス、A.ナシメント、L.A.フェルナンデス、F.D.R.スグノット、R.L.オルファリ、青木V、デュアルテA、サナバ二S、ビクター J.R.A.
成人アトピー性皮膚炎(AD)患者由来のIgGは胸腺IL-22産生およびCD4+ T細胞上のCLA発現を誘導する:miRNAを介したエピジェネティックな影響の可能性
Int J. Mol. Sci.、23 (12) (2022)
Google Scholar
[97]
H. Jo, K. Shim, D. Jeoung
アレルギー性炎症におけるFcepsilonRIとスフィンゴシン・シグナル伝達のクロストーク
Int J. Mol. Sci.、23 (22) (2022)
Google Scholar
[98]
Y. 陳、宋、李、侯、張、張子、胡、江、楊、鄒、龐、張、張子、楊、王、王丙
FcepsilonRI欠損によるシリカによる肺の炎症と線維化の緩和効果
エコトキシコール Environ. セーフ, 244 (2022), 記事 114043
PDFを見る記事を見るScopusGoogle Scholarで見る
[99]
G.K.アーサー、G.クルーゼ
Fcepsilonribetaによる高親和性IGE受容体の輸送およびシグナル伝達の制御とアレルギー性炎症におけるFcepsilonribetaのスプライシングの潜在的影響
Int J. Mol. Sci., 23 (2) (2022)
Google Scholar
[100]
P. アンドリュー、M.ヨハンソン、N.I.アファラ、F.プッチ、T.タン、S.ジュナンカー、L.コルツ、J.ラム、D.タウフィク、D.G.デナード、L.ナルディーニ、K.E. de Visser、M. De Palma, L.M. Coussens
FcRgammaの活性化は炎症に伴う扁平上皮の発がんを制御する
キャンサーセル, 17 (2) (2010), pp.121-134
PDFを見る記事を見るScopusGoogle Scholarで見る
[101]
S. ベン・ムカデム、M・ベンハモウ、R・C・モンテイロ
炎症性疾患におけるFc受容体の関与の解明:メカニズムから新たな治療手段へ
Front Immunol., 10 (2019), p. 811
Google Scholar
[102]
A. Pothmann、T. Illing、C. Wiegand、A.A. Hartmann、P. Elsner
マイクロバイオームとアトピー性皮膚炎:レビュー
Am. J. Clin. Dermatol., 20 (6) (2019), pp.749-761
CrossRefView in ScopusGoogle Scholar
[103]
M.R. Williams、R.L. Gallo
アトピー性皮膚炎における皮膚マイクロバイオームの役割について
Curr. Allergy Asthma Rep., 15 (11) (2015), p. 65
ScopusGoogle Scholarで見る
[104]
T. アル・キリム、A・アフマド
がん・マイクロバイオームの難問への展望
マイクロマイクロ研究、4(2022)、17-21頁
Google Scholar
[105]
G.A. Ogunrinola, J.O. Oyewale, O.O. Oshamika, G.I. Olasehinde
ヒトマイクロバイオームとその健康への影響
Int J. Microbiol, 2020 (2020), p. 8045646
ScopusGoogle Scholarで見る
[106]
Y. ファン、O.ペデルセン
ヒトの代謝の健康と病気における腸内細菌叢
Nat. Rev. Microbiol, 19 (1) (2021), pp.55-71.
CrossRefView in ScopusGoogle Scholar
[107]
Z. アル・バンダー、M.D.ニタート、A.ムーサ、N.ナダープール
腸内細菌叢と炎症:概論
Int J. Environ. Res Public Health, 17 (20) (2020)
グーグルシュラー
[108]
J.C.クレメンテ、J.マナソン、J.U.シェール
全身性炎症性疾患における腸内細菌叢の役割について
BMJ, 360 (2018), p. j5145
CrossRefGoogle Scholar
[109]
A.S. Paller、H.H. Kong、P. Seed、S. Naik、T.C. Scharschmidt、R. L. Gallo、T. Luger、A. D. Irvine
アトピー性皮膚炎患者におけるマイクロバイオームについて
J. Allergy Clin. Immunol., 143 (1) (2019), pp.26-35
PDFを見る記事を見るScopusGoogle Scholarで見る
[110]
U. ヴォーリナ
アトピー性皮膚炎におけるマイクロビオーム
Clin. Cosmet. Invest. Dermatol., 10 (2017), pp.51-56
CrossRefView in ScopusGoogle Scholar
[111]
V. ウー、T.アレンガット
腸内細菌叢によるエピジェネティクス制御
腸内細菌, 14 (1) (2022)
2022407
Google Scholar
[112]
P. Chen, G. He, J. Qian, Y. Zhan, R. Xiao
炎症性皮膚疾患における皮膚微生物叢の役割の可能性
J. Cosmet. Dermatol., 20 (2) (2021), pp.400-409
CrossRefView in ScopusGoogle Scholar
[113]
D. サイモン、L.R.ブラセン、H.U.サイモン
好酸球とアトピー性皮膚炎
アレルギー, 59 (6) (2004), pp.561-570
ScopusGoogle Scholarで見る
[114]
K.M.ライファーマン
アトピー性皮膚炎における好酸球について
J. Allergy Clin. Immunol., 94 (6 Pt 2) (1994), pp.1310-1317
PDFを見る記事を見るScopusGoogle Scholarで見る
[115]
M. 永田、中込一郎、相馬哲夫
好酸球性炎症のメカニズム
Asia Pac. アレルギー, 10 (2) (2020), 記事e14
CrossRefGoogle Scholar
[116]
C. ロンバルディ、A.ベルティ、M.コッティーニ
好酸球の新たな役割:好酸球性関連炎症疾患の標的治療への示唆
Curr. Res Immunol., 3 (2022), 42-53ページ
PDFを見る記事を見るScopusGoogle Scholarで見る
[117]
A.D. Doyle, M.Y. Masuda, G.C. Pyon, H. Luo, A. Putikova, W.E. LeSuer, S. Flashner, M.A. Rank, H. Nakagawa, H. Kita, B.L.Wright
洗剤曝露による食道上皮のバリア機能障害と好酸球性炎症の誘発
アレルギー, 78 (1) (2023), pp.192-201
CrossRefView in ScopusGoogle Scholar
[118]
É. ベランジェ、A.M.マドール、A.M.ブシェ・ラフルール、M.M.シモン、T.クワン、T.パスティネン、C.ラプラス
アトピーマーチに含まれるアレルギー疾患において、好酸球のマイクロRNAが調節的な役割を果たす
Int J. Mol. サイエンス, 21 (23) (2020)
グーグルシュラー
[119]
L. 楊、傅、韓、張、夏、朱、黄、蕭、余、高、梁、李、周の各氏。
Hsa_circ_0004287はアトピー性皮膚炎および乾癬において、N(6)-メチルアデノシン依存的にマクロファージが介在する炎症を抑制する
J. Allergy Clin. Immunol., 149 (6) (2022), pp.2021-2033
PDFを見る記事を見るScopusGoogle Scholarで見る
[120]
A. アフマド
制御不能なマイクロRNAを介した免疫抑制性腫瘍関連マクロファージのエピジェネティック制御機構
Semin Cell Dev. Biol.、124(2022)、pp.26-33
PDFを見る記事を見るScopusGoogle Scholarで見る
[121]
S. アーマド、S. マンズール、S. シディキ、N. マリアッパン、I. ザファル、A. アーマド、A. アフマド
炎症のエピジェネティックな裏付け:肺疾患、肺がん、COVID-19の間の点をつなぐ
セミン・キャンサー・バイオロジー、83(2022)、384-398頁
PDFを見る記事を見るScopusGoogle Scholarで見る
[122]
T. 田中、楢崎正剛、岸本哲也
炎症・免疫・疾患におけるIL-6
コールドスプリングハーブ(Cold Spring Harb. Perspect. Biol.、6 (10) (2014), p. a016295
CrossRefView in ScopusGoogle Scholar
[123]
S. ビスワス、A.A.トーマス、S.チェン、E.アレフ・エシギ、B.フェン、J.ゴンダー、B.サディコビッチ、S.チャクラバルティ
MALAT1:糖尿病性網膜症における炎症のエピジェネティック制御因子
Sci. Rep.、8 (1) (2018), p. 6526
ScopusGoogle Scholarで見る
[124]
兪 浩彦、趙 悟、張 兪、王 怡、李 兪、芳 兪
モリンダ・オフィシナリス抽出物は、MALAT1/miR-590-5p/CCR7軸を制御することでアトピー性皮膚炎に対する保護作用を示す
J. Cosmet. Dermatol. (2023)
グーグルシュラー
[125]
M. マッシミーニ、E.ダッレ・ヴェドーヴェ、B.バケッティ、F.ディ・ピエロ、C.リベッコ、C.ダダーリオ、M.プッチ
ポリフェノールとカンナビジオールはイヌのアトピー性皮膚炎に関連するTh1/Th2炎症遺伝子の転写制御を調節する
Front Vet. Sci.、8(2021)、記事606197
ScopusGoogle Scholarで見る
[126]
W.Ft カーソン、S.E.サルターグリーン、M.M.スコラ、A.ジョシ、K.A.ギャラガー、S.L.クンケル
CCL2によるマクロファージ炎症反応の増強は、miR-9の発現量増加とERK1/2リン酸化酵素Dusp6のダウンレギュレーションと相関している
細胞免疫学, 314 (2017), pp.63-72
PDFを見る記事を見るScopusGoogle Scholarで見る
[127]
K.M. Lee、A. Jarnicki、A. Achuthan、A.J. Fleetwood、G. P. Anderson、C. Ellson、M. Feeney、L. K. Modis、J. E. Smith、J. A. Hamilton、A. Cook
炎症と痛みに関わるCCL17
J. Immunol., 205 (1) (2020), pp.213-222
グーグルシュラー
[128]
H. カバタ、A.L.フラマー、T.マフラコイヴ、森山聡、H.R.ロデワルド、S.F.ツィーグラー、D.アルティス
TSLP受容体の標的欠失により、2型気道炎症を促進する細胞機構が明らかになった
粘膜免疫学, 13 (4) (2020), pp.626-636
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
[129]
A. ダツィ、M.スタインホフ、F.アーマド、M.アラム、J.ブッデンコッティー
インターロイキン-31:炎症と治療における「かゆいところに手が届く」サイトカイン
アレルギー, 76 (10) (2021), pp.2982-2997
CrossRefView in ScopusGoogle Scholar
[130]
L.M. Roesner、T. Werfel、A. Heratizadeh
アトピー性皮膚炎における適応免疫系と治療への示唆
エキスパート・レヴュー・クリニック(Expert Rev. Clin. 免疫学, 12 (7) (2016), pp.787-796
ScopusGoogle Scholarで見る
[131]
E.B. Brandt、U. Sivaprasad
Th2サイトカインとアトピー性皮膚炎
J. Clin. 細胞免疫学, 2 (3) (2011)
Google Scholar
[132]
F.D.R. Sgnotto, M.G. de Oliveira, A.A.L. Lira, A.H.S. Inoue, T.O. Titz, R.L. Orfali, L. Bento-de-Souza, M.N. Sato, V. Aoki, A.J.S. Duarte, J.R.Victor.
アトピー性皮膚炎患者由来のIgGは、乳児の体内TCD4およびTCD8細胞においてIL-17およびIL-10産生を誘導する
Int J. Dermatol., 57 (4) (2018), pp.434-440
CrossRefView in ScopusGoogle Scholar
[133]
L.S.サントス、F.D.R.スグノット、T.R.ソウザ、R.L.オルファリ、青木V、A.ドゥアルテ、J.R.ビクタ
アトピー性皮膚炎患者由来のIgGは、非アトピー性乳児胸腺不変ナチュラルキラーT(iNKT)細胞にIL-4、IL-17およびIL-10を産生させる
Int J. Dermatol., 59 (3) (2020), pp.359-364
CrossRefView in ScopusGoogle Scholar
[134]
P.M.ブルナー、A.B.パヴェル、S.カトリ、A.レナード、K.マリク、S.ローズ、S.ジム、オン、A.S.ベカリア、C.トレイドル=ホフマン、G.K.シンガー、D.バウム、P.ギロー、M.サリバン・ワーレン、J. Fuentes-Duculan, X. Li, X. Zheng, Y. Estrada, S. Garcet, H.C. Wen, J. Gonzalez, I. Coats, I. Cueto, A.U. Neumann, M.G. Lebwohl, J. G. Krueger, E. Guttman-Yasky
アトピー性皮膚炎患者におけるベースラインIL-22発現量は、フェザキヌマブに対する組織応答を層別化する
J. Allergy Clin. Immunol., 143 (1) (2019), pp. 142-154
PDFを見る記事を見るScopusGoogle Scholarで見る
[135]
M. ジン、ユンJ.
ベンチからクリニックへ:アトピー性皮膚炎におけるIL-22シグナル伝達経路の治療標的化の可能性
Immune Netw., 18 (6) (2018), Article e42
ScopusGoogle Scholarで見る
[136]
K.E. Nograles, L.C. Zaba, A. Shemer, J. Fuentes-Duculan, I. Cardinale, T. Kikuchi, M. Ramon, R. Bergman, J.G. Krueger, E. Guttman-Yasky
アトピー性皮膚炎において、IL-17産生TH17T細胞が減少しているにもかかわらず、IL-22産生「T22」T細胞がIL-22の上昇を説明する。
J. Allergy Clin. 免疫学, 123 (6) (2009)
1244-52.e2
Google Scholar
[137]
T. アルシャド、F・マンスール、R・パレク、S・マンズール、V・リスカ、A・ダブル
創傷治癒と組織再生におけるインターロイキン22の刃傷沙汰的役割
フロント・イミュノール, 11 (2020), p.2148
ScopusGoogle Scholarで見る
[138]
H. Zhao、Y. Guo、Y. Sun、N. Zhang、X. Wang
miR-181a/b-5pはエンドカンを標的としてモノクロタリン誘発肺動脈性肺高血圧症における炎症反応を改善する
J. 細胞生理学, 235 (5) (2020), pp.4422-4433
CrossRefView in ScopusGoogle Scholar
[139]
S.D. Gurien, M. Aziz, H. Jin, H. Wang, M. He, Y. Al-Abed, J.M. Nicastro, G.F. Coppa, P. Wang
細胞外マイクロRNA 130b-3pはeCIRPによる炎症を抑制する
EMBO Rep., 21 (1) (2020), Article e48075
グーグルシュラー
[140]
H. グプタ、ルビオ、シトー、バロ、シテロ、マドリッド、クアンバ、ヒメネス、マルティアニェス-ベンドレル、バリオス、パンタノ、ブリマコンベ、ブスタマンテ、バサト、マヨール
マラリア原虫バイオマスの血漿中MicroRNAプロファイリングとマラリア疾患の重症度との関連性
エマージェンシー・インフェクツ. Dis., 27 (2) (2021), pp.430-442
CrossRefView in ScopusGoogle Scholar
[141]
J.Z. Yi, J.S. McGee
エピジェネティック修飾療法:炎症性皮膚疾患の治療における新たな道筋
Exp. 皮膚科学, 30 (8) (2021), pp.1167-1176
CrossRefView in ScopusGoogle Scholar
[142]
S. クア、G.スブラマニアン、P.サンパス
Belinostatのアトピー性皮膚炎改善への再利用について
Dermatol. Ther. (ハイデ)、11(3)(2021)、655~660頁
CrossRefView in ScopusGoogle Scholar
[143]
R. ダーレンスキー、A.L.コジルスキー、J.W.フルール、L.カラバロ
アトピー性皮膚炎におけるバリア障害と皮膚微生物叢の関連性(グローバルな視点から):アンメットニーズと未解決問題
J. Allergy Clin. Immunol., 148 (6) (2021), pp.1387-1393
PDFを見る記事を見るScopusGoogle Scholarで見る
[144]
K. Szalus, M. Trzeciak, R.J. Nowicki
アトピー性皮膚炎におけるJAK-STAT阻害剤の病態から臨床試験結果まで
微生物, 8 (11) (2020)
Google Scholar
[145]
L. Bao, H. Zhang, L.S. Chan
慢性炎症性皮膚疾患アトピー性皮膚炎におけるJAK-STATシグナル伝達経路の関与について
Jakstat, 2 (3) (2013), 記事 e24137
CrossRefView in ScopusGoogle Scholar
[146]
A. ツィオッカ、M.キリアゾプルー、G.コントクリストプルー、E.ニコライ堂、A.ストラティゴス、D.リゴプルー、S.グレゴリウ
アトピー性皮膚炎治療におけるJAK/STAT経路とその選択的阻害:システマティックレビュー
J. Clin. Med, 11 (15) (2022)
Google Scholar
引用元: (0)
1
平等な貢献者
© 2023 The Authors. 発行:エルゼビア・リミテッド
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
