
産業用蓄電池について(充電・放電反応、標準電極電位)(記事4)
蓄電池についていろいろと書いていくにあたり、まずはその構造や機能の説明をしていきたいと思います。
産業用では歴史も長く有名な鉛蓄電池について、です。
蓄電池についてお客様からは、分かりにくいというお言葉をよく頂きます。
ですからなるべく細部まで、簡単な言葉で書くようにします。
〇蓄電池の種類
私たちの身の回りには、さまざまな名称の蓄電池が存在しています。
アルカリ電池やリチウムイオン電池はよく目にするでしょう。全個体電池や燃料電池なんていう表示も、たまに目にすることでしょう。
蓄電池は大きく分けると、化学電池と物理電池という2つのグループに分けられます。
・化学電池・・・・・化学変化のエネルギーを電気のエネルギーへと変換する電池
・物理電池・・・・・太陽などの光や周囲の熱といった物理的なエネルギーを、電気のエネルギーへと変換する電池
化学電池はさらに細かく細分されます。
・一次電池・・・・使い切りの電池
・二次電池・・・・充電して繰り返し使える電池
・燃料電池・・・・電池の外部から化学反応する物質を供給し続けることで発電する電池
産業用で現在主流なのは、二次電池の鉛蓄電池と呼ばれるものです。
普及し始めているリチウムイオン電池もあります。
ここからは、現在まだまだ主流となっている鉛蓄電池を取り上げます。
鉛蓄電池がどういった用途に使われているのかを、まずは見ていきましょう。
その後、蓄電池の内部はどういう仕組みになっているのか、を見ていきます。
その後、リチウムイオン電池や全個体電池なども書いていければ、と思います。
〇蓄電池の構成部品
まず、蓄電池の構成部品を簡単に書いておきます。
・正極板
・負極板
下の写真の左側が正極板、右側が負極板です。
型式SNSX-150という鉛蓄電池になります。
正極板についている白いものは、セパレータの残りです。
きれいに剝がれなかったものが、こびりついてます。

あとは、電解液とセパレータを準備すれば、蓄電池が出来上がります。
下の写真は、セパレータに希硫酸の電解液をたっぷりと染み込ませたものです。これを先ほどの正極板と負極板の間にはさみ込むと、蓄電池ができます。


はさみ込んだものが、下の写真です。

電圧を測定すると、2.09 Vあることが確認できます。

これを数枚、並列に並べて容器に入れると蓄電池の完成です。
下の図では、正極板が6枚並列に取り付けられています。

負極板は7枚あります。

セパレータは12枚あります。
正極板と負極板とセパレータで1組の電池です。
1組の電池で12.5Ah 2.09 Vの電池となります。
この電池はSNSX-150という蓄電池ですので、容量は150Ahとなります。
つまり、12.5 Ah×12組=150 Ahということです。
Ahとは、蓄電池の容量を示す単位です。
150 Ah(10時間率)という書き方をします。
15 Aで10 h(10時間)の放電が可能、という意味です。
1組だけでも蓄電池にはなりますが、ため込める電気の量が少なくなります。
12.5 Ah(10時間)となるので、1.25 Aで10 時間放電が可能、ということになります。
並列に組み合わせることで、ため込める電気の量が増えます。
下の写真は、蓄電池用のケースとその蓋です。


このように容器に入れて、蓋をすれば蓄電池が完成します。
型式SNSX-150の産業用鉛蓄電池では、以下のようになります。
正極板の厚さは5 mm
負極板の厚さは2 mm
電解液を含んだセパレータの厚さは2 mmです。


〇電解液について
まずは電解液について書いていきます。
鉛蓄電池の電解液には濃度36 %程度の希硫酸を使用しています。
この電解液の性質が分かると、蓄電池がだいぶ分かりやすくなってくると思います。
常温での真水は、水の分子が無数に存在しています。
肉眼では見えないほど小さいです。
これを容器の中に入れると、水分子が容器の中を動き回ります。
その中にわずかに、水素イオンH⁺と水酸化イオンOH⁻が存在しています。
水は極性溶媒です。
極性つまりプラス、マイナスの極性をもつ分子(有極性分子)から構成されているからです。
例えば水の中にマイナスイオンを入れたとします。
(説明のため、あくまで例えばです。)
すると、イオンの周りには水分子のプラス側が集まってきます。
こうして有極性分子と緩く結合して、安定した状態となります。
水分子の数のほうが圧倒的に多いので、ほかの水分子はそのままです。
このイオンが水溶液中を移動するときも、この緩い結合のまま一緒に移動します。

大量の水に硫酸を入れたものが希硫酸になります。
水中では、硫酸H₂SO₄は水素イオンH⁺と硫酸水素イオンHSO₄⁻に分かれます。
すると、H⁺ と HSO₄⁻のまわりにそれぞれ有極性分子の水が集まってきて、緩く結合します。
これが水和と呼ばれる現象です。
こうなると、HSO₄⁻はほかのHSO₄⁻と切り離されます。
H⁺も同様です。
俗にいう 水に溶けた状態 になります。
しかし通常、硫酸を水に溶かした化学式は、この水和は記載していません。
以下のように書きます。
H₂SO₄ + H₂O → H⁺ + HSO₄⁻
H⁺ + H₂O →H₃O⁺ となりますが、有極性分子のH₂Oは記載していないので、H⁺と記載しています。
イオン単体で水中に存在するのではなく、イオンの周りに有極性分子がいて安定している状態であることを、覚えておいてください。
※無極性分子については、ここでは記載しません。
あれ、SO₄²⁻じゃないの?と疑問に思うかもしれません。
希硫酸は水溶液中では、まずH⁺とHSO₄-へと電離します。(1段目の電離)
もっともっと水で薄めて薄めて、としてやると、HSO₄-からH⁺がとれてSO₄²⁻となります。(2段目の電離)
H₂SO₄がH⁺とSO₄²⁻に分かれるのは、硫酸の濃度がかなり薄い時です。
先ほどの水分子やイオンがなぜ動き回っているのかを書いておきます。
原子や分子は、マイナス273.15 ℃になると動かなくなると言われています。
逆にこれよりも温度が上がると、分子や原子の格子が振動し始めます。
温度が上がるということは、例えば太陽からの熱をもらったり、木を燃やした火から熱をもらったりと、他から発生したエネルギーを熱としてもらっています。
例えば水溶液を容器に入れて、25 ℃の室内に置いたとします。
室内を25 ℃にするためにはエアコンをつけるなり太陽の熱を取り込むなりしなければなりません。
空気中にも酸素分子や窒素分子、他にも分子や原子があります。これらがこの熱を受け取って振動し熱を発します。空気中ならこれらの分子はあちらこちらへ運動し動き回ります。受け取った熱エネルギーを使って動き回るためです。そして温度が低いものに当たると、そこへ熱エネルギーを渡します。
この熱が水溶液の容器に達すると容器の分子の格子が振動し、熱が容器内部の水溶液へと伝わっていきます。そして水分子やイオンがこの熱を受け取り動き回るというわけです。
つまり、常温の水分子やイオンはエネルギーを持っている、ということになります。
イオンというのは、電気的にプラスやマイナスの性質をもったものです。
原子が電子を余分に受け取れば、電子の持つマイナス電荷の総数が陽子のプラス電荷を上回ります。
すると電気的にはマイナスの性質を持つことになります。
逆に電子が減れば、電気的にプラスの性質を持つことになります。
イオンは溶液中を動きまわっていますが、プラスイオンとマイナスイオンは互いに引き合います。
よって、溶液全体で見れば電気的には中性です。プラスマイナスゼロ、となります。
〇鉛蓄電池の放電、充電の仕組み
この水溶液中に、正極及び負極に異なる金属(フェルミ準位が異なる金属)を配置すると、蓄電池ができます。
※フェルミ準位については電気について(記事1)に書いています。興味があればご覧ください。
簡単に書くと、鉛蓄電池は以下のように作られます。
1. 鉛合金製の金属板表面に、鉛の粉と希硫酸をペースト状にしたものを塗り、乾燥させます。(この段階で金属板表面に酸化鉛が生成されます。)
2. この板を正極と負極に分けます。
3. この板の間にセパレータという小さい穴がたくさん空いた絶縁体をはさみ、重ね合わせます。
4. それを容器に入れます。
5. この容器に希硫酸溶液を入れます。
これで鉛蓄電池の出来上がりです。
この状態で鉛蓄電池を充電してやれば、化学変化を起こして電力をため込みます。
充電をすることで、正極板の酸化鉛は二酸化鉛に、負極板の酸化鉛は鉛へと変化します。
〇鉛蓄電池の放電について
充電した鉛蓄電池の正極と負極に、負荷(例えばランプ)を接続すると放電を始めます。
その時には鉛蓄電池内部でどんな反応が起きているか、以下の点に注目しながら見てみましょう。
・鉛蓄電池に使用されている鉛は、酸化数=+2のときが最も安定している。
・酸化数=0の鉛Pbと、酸化数=+4の二酸化鉛PbO₂は、ともに酸化数=+2のPb²⁺に変化する傾向にある。
(PbO₂とは、1個のPb⁴⁺と2個のO²⁻の結合)
・負極では電子を一番放出しやすい物質が電子を放出する。(酸化反応)
・正極では、電子を一番受け取りやすい物質が電子を受け取る。(還元反応)
1. 負極反応
Pb + HSO₄⁻ →PbSO₄ + H⁺ + 2e- (放電前 → 放電後 となります。)
(Pb →Pb²⁺ + 2e-) ※1
2. 正極反応
PbO₂ + 3H⁺ + HSO₄⁻ + 2e- →PbSO₄ + 2H₂O (放電前 → 放電後 となります。)
(Pb⁴⁺ + 2e- →Pb²⁺) ※2
1. 負極反応から詳しくみていきましょう。
実際には、※1の反応がメインですが。
負極板表面にはPb、つまり鉛があります。
鉛蓄電池の負極では、電子を放出してイオンになりやすい物質は鉛です。
鉛は電子を2個放出して、Pb²⁺になりたくて仕方ないのです。
チャンスが来ればすぐに電子を放出します。
(正極と負極に負荷が繋がれば放電、つまりPb²⁺になれるチャンスです。)
鉛は電子を放出しPb²⁺となるといったん水溶液中に溶け出します。
ですが、極板付近にいるHSO₄⁻とすぐに結合しPbSO₄つまり硫酸鉛へと変化します。
そして極板表面にくっつきます。
負極板内へ放出された電子は、正極板へと移動していきます。




2. 正極反応
こちらも※2の反応がメインですが、みていきましょう。
正極板のPbO₂もPb²⁺になる機会をうかがっています。
PbO₂ はPb₄⁺ と 2個のO²⁻の結合ですから、電子を2個もらえればPb²⁺になれます。
また、正極板では一番電子を受け取りやすいのがPb⁴⁺となっています。
鉛蓄電池に負荷を接続すれば、負極から負荷を通って電子が2個来ます。
するとPb⁴⁺は電子を2個受け取りPb²⁺となり溶液中に溶け出します。
そしてすぐに溶液中のHSO₄⁻と結合しPbSO₄となり正極板にくっつきます。
ここは負極での反応と似ています。
また、反応によって酸素イオンと水素イオンが結合して水がどんどん生成されます。



これが正極及び負極での反応です。
水溶液中のHSO₄⁻がどんどんと消費されて、PbSO₄へと変化していきます。
反応によってHSO₄⁻がどんどん減少し反対に水が増えていくので、硫酸濃度がどんどん薄くなります。
この変化が続いている間、鉛蓄電池は放電し続けます。
このように、正極板及び負極板表面にくっついて反応する二酸化鉛や鉛のことを、活物質と呼びます。
また硫酸水素イオンも、活物質になります。
※補足です。(活性化エネルギーについてです。)
正極及び負極では、溶け出したPb²⁺が溶液中のHSO₄⁻と結合して硫酸鉛ができます。
この反応のようにある物質が他の物質へと変化するためには、何らかのエネルギーを与えてやらないと変化しません。まあ当然ですが。
身近な例だと水がわかりやすいです。
H₂分子とO₂分子が近くによってきたからといっていきなり結びついてH₂Oつまり水になることはないです。
H₂ガスが空気中でO₂(他の支燃性ガスでも可)と混ざり静電気や火種によって燃焼爆発して、水が発生します。
といっても、周囲温度が200 ℃くらいでも変化しません。
火種がなくても500 ℃程度の温度になれば、自然に発火、爆発します。
つまり燃焼させるためには、外部から高温の熱を加えるなどして、分子を今よりも高いエネルギー状態にする必要があります。
化学反応というのは、分子同士が衝突することで起きます。
ただぶつかるだけではなく、ある程度激しく衝突する必要があります。
衝突したときに発生するエネルギーがある一定値を超えた時に初めて反応が起きます。
各分子間で電子のやりとりをして違う物質に変化するために、それだけのエネルギーが必要だ、と見てもいいですが。
このエネルギーの一定値のことを、活性化エネルギーと呼びます。
当然ですが反応物質によってこの値は変わります。

外部から熱を与えれば、分子は今よりもエネルギーを得ます。
その状態で分子同士が衝突すると、元の物資とは別の物質へと変化します。
つまり、物質は元のものから他のものへと変化する際には、活性化エネルギーというものを得て、一度エネルギーが高い状態(活性化状態)を経由する必要がある、ということです。
活性化エネルギーが不要であるなら、H₂分子とO₂分子が触れた瞬間に勝手に燃焼するはずです。
活性化状態では別の物質へと変わりかけています。
ですがエネルギーが高いためにとても不安定な状態です。
ここで、エネルギーを熱として放出することで、安定した状態の別の物質へとなります。
元の状態と、反応後の安定した状態とのエネルギーの差を、反応熱と呼んでいます。
後ほど出てくるので、ここで補足しておきます。
触媒を使うと、活性化エネルギーの必要量が下がります。
触媒とは、触媒が直接的に反応に関与しながらも、もっと早く反応が進むように働くもの、のことです。
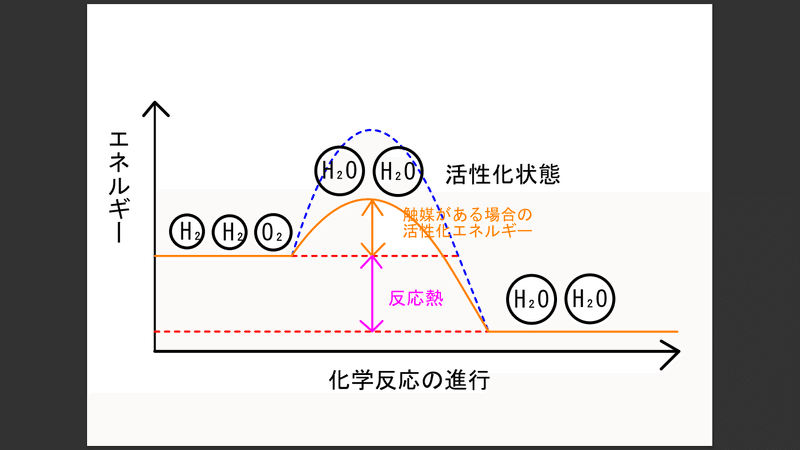
上の説明ではかなりわかりにくいと思いますので、具体例を書いておきます。
水素ガスと酸素ガスが水になるときを例にしましょう。
今、水素ガスと酸素ガスの混合気体に、暖めた銅の粉を入れたとします。
すると銅の表面には、酸素と銅が結合した酸化銅の膜ができます。
しかしその膜の一部は水素によって還元されて、結果として水ができます。
すると反応した部分の銅が空きます。
ここに再び酸素がきて反応して酸化銅ができます。
そして水素が・・・・・・と繰り返します。
爆発して水ができる経路とは別ですよね。
そして結果として、必要なエネルギーも少なくて済みます。
この銅が、触媒になります。
熱量について、さらに補足です。
水素ガスと酸素ガスが反応して水ができるときには、下のような関係ができます。
H₂ + 1/2 O₂ → H₂O + 284 KJ/mol
・1 mol(モル)の水素が燃焼すると、水1 molができて、284 KJの熱量が発生する、ということです。
molというのは、物質の単位量のことです。
ある粒子が 6.0221367 × 10²³ 個集まったときに、その粒子が1 mol存在している、という単位です。
さきほどの284 KJとは、電子がもつエネルギーに置き換えてみると、どうなるのでしょうか。
電子の世界では、eVというものがよく使われます。
電気素量 e の電荷を持つ電子1個が1 Vの電位差で加速されて得る運動エネルギーの大きさのことです。
1 eV = 1.60218 × 10⁻¹⁹ J です。
これではあまりに小さすぎるので、1 molで見ましょう。
電子1 molがもつ電気量は、1 F=96485 Cとなります。
1.60218 × 10⁻¹⁹ (1 eVのエネルギー)× 6.0221367 × 10²³(個) =9.648547 × 10⁴ ≒ 96485
これを水1 molあたりに当てはめると、以下のようになります。
エネルギー(J)= 電荷(C) × 電位差(V) の関係があります。
エネルギー(J) / 電荷(C) = 電位差(V) となります。
284 × 1000(J/mol) / 2 × 96485(C/mol) = 1.4717(V)≒ 1.47(V)
つまり、H₂ + 1/2 O₂ =H₂O + 1.47 V となります。
水素分子1molが燃えて水になるときには、電子を1.47 Vで加速できるだけのエネルギーが出る、ということです。
蓄電池という装置はこの電子ボルトのエネルギーを取り出して負荷を動かしています。
ちなみに1 eVは熱に換算すると、10000 Kに相当します。
約10273 ℃です。
かなりの高温ですが、電子はこのエネルギーを周囲に放出します。
たとえば室温25 ℃であれば、電線や金属は触ると少し冷たいと思います。
この電線内の電子を加速して電子にエネルギーを与えても、電線内を移動する際に金属原子や負荷へとそのエネルギーを放出します。
このエネルギーのかなりの量が負荷へと供給されます。
結果として、電線や負荷の温度が上がっていきます。
またこの数値を見れば、電気回路に負荷を接続せず短絡させることがいかに危険かがわかると思います。
水素ガスの総量が増えれば増えるほど、大きな熱量を出します。
さて。では鉛蓄電池ではどのようになるのでしょうか。
鉛蓄電池に負荷を接続すると、電力を取り出すための反応が起き始めます。
・負極板ではイオンになりやすいPbが電子を2個放出してPbイオンとなり、溶液中に溶け出します。
そしてPb²⁺イオンと反応しやすいHSO₄⁻イオンと反応して、PbSO₄となります。
この時に活性化エネルギーが必要になります。
常温ではイオンは水溶液中を活発に動き回っています。周囲温度からエネルギーを受け取っているので、活発に動き回れるからです。
Pb²⁺イオンは溶液に溶け出したときに、このHSO₄⁻イオンと近づき、激しくぶつかることでエネルギーを得ます。
これが活性化エネルギーとなりPbSO₄へと変化するわけです。
発熱反応ですから、電圧に換算して考えると電子ボルトのエネルギーを発生することになります。
発熱と言ってはいますが、エネルギーを何らかの形(例えば熱や電子ボルト)で出す(発する)ということです。
化学エネルギーを電気エネルギーとして取り出しているのが、蓄電池の放電ということになります。
〇鉛蓄電池の充電について
鉛蓄電池に負荷を接続してある程度放電した後は、充電をする必要があります。
鉛蓄電池をある程度放電させると、正極板及び負極板表面にかなりの硫酸鉛がつきます。
これを分解して放電前の状態にできれば、再び電池として使用できるからです。
分解をするためには、当然ですが外部的な力を加えないと何も反応が起きません。

※ここで少し吸熱反応について書いておきます。
上の図は水 H₂Oを例にしたものです。
H₂Oを分解してH₂とO₂にするためには、反応熱に相当するエネルギーが必要になります。
単純に考えれば、水をかなり高温にすれば分解できるはずです。
100 ℃を超える程度では、水が水蒸気になるだけで分解はできません。
分解を可能にするには、2000 ℃以上の温度が必要と言われています。
さすがに高温すぎますよね。
ですが、それに代わる方法として電気エネルギーを投入するという方法もあります。
水に正極と負極の極板を入れて、ある程度の電圧をかけてやればH₂とO₂に分解できます。
理論上は1.23 Vです。
しかしこの電圧では分解がとてもゆっくりです。
反応をもっと活発にするためには、それよりも高い電圧をかける必要があります。
また、純粋な水では電気を通しにくいのでイオンを水に溶かして電気を流しやすくする必要があります。
このように、放っておいては自然に起こるはずのない反応を強制的に起こすためには、外部から熱なり電気なり何らかのエネルギーを加える必要があります。
物質の結合には電子がかかわっています。ですからこの電子を奪ってやれば、物質の結合を解くことができます。
電子を奪えるだけのエネルギーを与えてやればいいわけですね。
上の水の分解の例では、以下のような関係ができます。
H₂O + 237.18 KJ(電気エネルギー(もしくは熱エネルギー))
→ H₂ + 1/2 O₂
つまり電気エネルギーや熱エネルギーなど、なんらかのエネルギーを吸収すると、水は水素ガスと酸素ガスへと変化できます。
このような反応を、吸熱反応と呼んでいます。
※補足です
水の電気分解は、正極と負極で以下のようになります。
正極 : H₂O → 1/2O₂ + 2H⁺ + 2e
負極 : 2H⁺ + 2e → H₂
反応には電子2個が必要だとわかります。
水を電気分解するためには、1 molの水に対して室温で237.18 KJが必要とされています。
外部から何らかのエネルギーを与えないと、反応しないということです。
電圧をかけて電子にエネルギーを与えてそれを使うとすると、どの程度のエネルギーにすればいいのでしょうか。
エネルギー(J)= 電荷(C) × 電位差(V) の関係があります。
エネルギー(J) / 電荷(C) = 電位差(V) となります。
237.18 × 1000(J/mol) / 2 × 96485(C/mol) = 1.22910(V)≒ 1.23(V)
つまり外部から1.23 Vをかけてやれば、水が電気分解できます。
1.23 Vで電子を加速させて、そのエネルギーを電子を介して水に与える必要がある、ということです。
もうお分かりかと思いますが、鉛蓄電池を充電する場合も同様のことが言えます。
放っておいたのでは起こるはずのない酸化還元反応を起こしたいために、熱エネルギーではなく電気エネルギーを投入する、ということです。
反応熱に相当するエネルギーを、電気的エネルギーで賄おう、ということです。
鉛蓄電池の外部に充電器を準備して、蓄電池の正極、負極に蓄電池自体の電圧よりも高い電圧をかけます。
すると各極板に電気エネルギーが投入されます。
そしてそれを感じた溶液中のイオンが極板付近のごく近くによってきて、極板の物質と電子の受け渡しが始まる、という仕組みです。
極板の物質及び極板付近の物質で一番電子を放出しやすい又は受け取りやすい物質が反応する、という感じですね。
〇充電と電気二重層の形成
では鉛蓄電池を充電する時には、蓄電池内部でどんなことが起きているのかを見ていきましょう。
1. 正極反応PbSO₄ + 2H₂O → PbO₂ + 3H⁺ + HSO₄⁻ + 2e- (充電前→充電後となります。)(Pb²⁺ →Pb⁴⁺ + 2e- ) ※1
2. 負極反応
PbSO₄ + H⁺ + 2e- → Pb + HSO₄⁻ (充電前→受電後となります。)
(Pb²+ + 2e- → Pb) ※2
1. 正極反応から詳しくみていきましょう。
※1がメインです。
鉛蓄電池をある程度放電させると、正極板表面には硫酸鉛PbSO₄がかなり付着します。
放電後は充電をしたいのですが、その時の蓄電池内部の変化を詳しく見ると、以下のような流れになります。

①放電終了後で、回路が開放された状態では希硫酸の電解液中には電位の差が生まれません。
②外部電源を接続して回路のスイッチをONにしてみます。
この時、仮に1 V程度の低い電圧をかけたとしましょう。
すると電解液中の有極性分子の水およびイオンが正極および負極付近に一瞬で集まります。
正極付近数 nmというごくわずかな隙間に水分子と HSO₄⁻イオンが集まります。
そして負極付近の数 nmに水分子と H⁺イオンが集まります。
1 V程度をかけると、この水分子とイオンが、極板の電圧と引き合います。
極板内の 動くことができる電子 は無数に存在しています。
ですが水溶液中のイオンおよび水分子の数は、電極内の電子の数よりもかなり少ないです。
この状態で極板に水分子やイオンが接触しても、極板内のすべての電子と電気的に釣り合うことはできません。
極板表面の面積にも限りがありますので。
よって、極板に水分子やイオンが限界までくっついたら、それ以上の反応はおきません。
また、極板と水溶液の間には大きな電位の差が生まれます。
よって、1 V程度の電圧をかけると、一瞬だけ電流が流れますが、それ以降は電流も流れなくなります。
コンデンサと似たような動きですね。
下の図のように、数 nmの電位の層は電気二重層と呼ばれます。
小さい電圧をかけたから、電気二重層が形成された、ということです。

③電気二重層ができるのは極板付近だけです。
電解液の大部分は、電位差がほぼありません。
電気二重層をもう少し詳しく見ておきましょう。
まずは、以下のことを思い出してください。少し前に書きましたが、硫酸を水に溶かすと水中で H⁺ と HSO₄⁻に分かれます。
するとそれぞれ有極性分子である水と緩く結合します。

それを踏まえた上で、下の図を見てください。
下は電気二重層の内訳です。
水色の部分は、HSO₄-と有極性分子の水が結合したものです。
紫色の部分は、H⁺イオンと有極性分子の水が結合したものです。

・電気二重層の内、極板付近はヘルムホルツ層と呼ばれています。
イオンがとても少なく有極性分子が多く存在しています。
ここでは極板と水溶液との間で急激な電位の差ができます。
・その外側が拡散二重層と呼ばれています。
ヘルムホルツ層で完全に遮断されなかった電場が影響する層です。
この電場によってイオンが引き付けられる力が働きます。
また、イオンはそれ自身が持つ熱によって動き回り均一に広がろうとします。
この2つの力が釣り合っている層が、この拡散二重層です。
この電気二重層の外側の溶液層は、電位の差がほとんどありません。
④この状態からさらに電圧を十分に上げてやると、ようやく電子の授受が始まります。
極板についた硫酸鉛の電気分解が始まるわけです。
この状態でも、電解液の大部分では電位の差は生まれません。
⑤十分高い電圧で充電を進めていくと、極板付近に電荷がたまってきます。
電荷がたまるというのは、電気分解によってプラスイオンやマイナスイオンが生成されて、電荷(イオン)がたまっていく、ということです。
負極なら、HSO₄⁻というマイナスの電荷がどんどん増えていきます。
するとこの電気的な偏りを中和するように、電極から離れた場所のイオンが移動してきます。(この離れた場所を、沖合なんて呼びます)
イオンつまり電荷が移動してくるということは、電気が流れるということです。
イオンは沖合から一気に移動してくるわけではありません。
下の図のようなイメージです。
①充電が続くと極板付近のイオンに電気的な偏りができます。
すると、その少し沖合のイオンが極板付近へ移動して電気的な偏りを無くします。
②すると①の付近にイオンの偏りができるため・・・・といった具合に、③、④という順番で沖合からイオンが移動します。
また、1、2、3といった具合に、極板付近の生成物が沖合へと移動していきます。

このようにして電気が流れ続け、充電が継続されます。
つまり充電するためには、十分に高い電圧をかける必要がある、ということです。
低い電圧では、電気二重層が維持されたままになります。
コンデンサと同じで、ここに直流の電圧をかけても電流が流れないため、充電ができません。

先ほどの蓄電池では、セパレータの厚みは2 mmでした。
1 nmは100000 mmです。
つまり電解液中では、ごくわずかの範囲でしか反応が起きていないことになりますね。
この中で一番電子を放出しやすい物質、つまりイオン化傾向が一番大きい物質が電子を放出してイオンとなります。
PbSO₄(Pb²⁺ + SO₄²⁻)、H₂Oの中では、Pbが一番電子を放出しやすいので、Pb²⁺が電子を放出してPb⁴⁺となります。
また、SO₄²⁻もマイナスイオンとして安定である度合が高いので、なおさら電子を放出してイオンになりたがります。
その後H⁺と結びついてHSO₄⁻となります。
Pb⁴⁺はとても不安定で、水を加えると加水分解という反応がおきます。その結果、Pb⁴⁺ + 2H₂O → PbO₂ + 4H⁺ という現象がおきます。
・補足です。
充電を続けると硫酸鉛がほぼ分解されますが、それでも充電を続けるとどうなるでしょう。
正極付近の水溶液内にはHSO₄⁻とH⁺イオン、水分子があります。
この中でHSO₄⁻はイオンでいる傾向が強いため、水分子が分解されます。
H₂O → 1/2O₂ + 2H⁺ + 2e
酸素分子が正極板から発生し、電子2個が正極板内へ渡されます。
2. の負極反応も見ていきましょう。
こちらも、※2の反応がメインとなります。
鉛蓄電池をある程度放電させると、負極板表面にも硫酸鉛がかなり付着します。
充電器を接続して電圧をかけてやることで、負極板と水溶液が接しているわずか数 nm内にある H⁺イオンと水分子が反応します。
下の図はイメージですが、こんな感じで外部から強制的に、電子を使って電気エネルギーを送り込むことで物質を変化させています。




PbSO₄、H⁺、水分子の中で、一番イオンとして安定する度合が高いものが電子を受け取ります。
この場合も、PbSO₄が電子を受け取れば、Pbは金属として負極板にくっついて現状よりは安定な状態になれます。
またSO₄²⁻もイオンとして安定する度合が高いため、電子を受け取ることになります。
繰り返しになりますが、外部から電子が送られてくるから変化します。
変化せざるを得ないからです。
電子が来なければ、この反応は起きません。
負極板付近の水溶液内にはHSO₄⁻イオンが増えていきます。
充電初期は極板付近にHSO₄⁻が多く、極板から離れた場所の水溶液はHSO₄⁻が少ないです。
水溶液中では、この濃度差を埋めるように濃い方から薄い方へとイオンが移動していきます。
電気的な偏りを中和するように、と見てもいいです。
・補足です。
正極と同様に、硫酸鉛がなくなってきた状態でもさらに充電を続けると、どうなるでしょうか。
充電終期の負極板付近の水溶液内には、HSO₄⁻と水分子が多い状態です。
H⁺もいます。
こちらでもHSO₄⁻はイオンでいる傾向が強いため、充電器から送られてくる電子を水素イオンが受け取ることで、水素ガスが発生します。
2H⁺ + 2e → H₂
〇鉛蓄電池の電圧について(標準電極電位の話です)
鉛蓄電池の電圧は、約2 Vです。
鉛蓄電池に負荷を接続していない状態の電圧です。開路電圧という呼び方をします。
これは、どんな小さいものでも、あるいはどんなに大きなサイズのものを作ったとしても、鉛蓄電池である限りは1個2 Vです。
理由としては、電極電位というものが関係しています。
鉛蓄電池に使用されている鉛は、酸化数=+2のときが最も安定しています。
ですから、酸化数=0の鉛Pbと、酸化数=+4の二酸化鉛PbO₂は、ともに酸化数=+2のPb²⁺に変化する傾向にあります。
また、正極板、負極板ではそれぞれ電子を一番放出しやすい物質が電子を放出し(酸化反応)、電子を一番受け取りやすい物質が電子を受け取ります。(還元反応)
・鉛蓄電池の正極板にはPbO₂、二酸化鉛がペーストされています。
この極板を希硫酸溶液に浸すと、次のようなことがおきます。
PbO₂ + 3H⁺ + HSO₄⁻ + 2e- →PbSO⁴ + 2H₂O
(放電前 → 放電後 となります。)
(Pb⁴⁺ 2e- →Pb²⁺)
二酸化鉛が電子を受け取り鉛イオンとなり水溶液内へ溶け出します。
その後すぐに水溶液内の硫酸水素イオンと結びついて硫酸鉛として極板表面にくっつきます。
すると正極板はプラスに帯電します。極板内の電子(マイナスの電気特性)が2個減ったので。
つまり、二酸化鉛→鉛イオンになるときには極板と水溶液との間に電位の差ができることになります。
・負極には鉛がペーストされています。
この極板を希硫酸の水溶液に浸すと、つぎのようなことが起きます。
Pb + HSO₄⁻ →PbSO₄ + H⁺ + 2e-
(放電前 → 放電後 となります。)
(Pb →Pb²⁺ + 2e-)
鉛が電子を放出して鉛イオンとなり水溶液内へ溶けだします。
その後すぐに水溶液内中の硫酸イオンと結びついて硫酸鉛として極板表面にくっつきます。
すると、負極板はマイナスに帯電します。極板内に電子(マイナスの電気特性)が2個増えたので。
また水溶液はプラスに帯電します。
つまり、鉛→鉛イオンになるときに極板と水溶液との間に電位差ができることになります。
結果として、水溶液とそれぞれの極板との間には電位の差ができます。電圧が発生するということです。
この電位の差を、『電極電位』と呼んでいます。
・ここでのポイントは、これらの反応の際に帯電した電圧の大きさは、どのくらいなの?ということです。
この電圧の大きさが分かれば、鉛蓄電池の電圧が分かりますからね。
では、その電圧を測定すればいいのですが、いかんせん基準がないと測定のしようがありません。
数値や大きさは、ある基準を決めてそれよりもどれだけ大きいか、小さいか、というものだからです。
ですので、蓄電池の世界でも、電圧の基準が定められています。
先ほどと同様にして得られた水素と水素イオンとの反応に対する電極電位を、0.000 Vと定めています。
つまり、これと比較することで、他のすべての電極電位は数値をもてるということです。
ですから、電極電位は絶対値ではなく、水素電極との比較値ということになります。
〇鉛蓄電池の正極板での電極電位は、1.685 V
〇鉛蓄電池の負極板での電極電位は、-0.355 V となります。
鉛蓄電池は、正極板と負極板を電槽(蓄電池の容器)に入れ、そこへ水溶液を入れる構造でしたよね。
そして、正極板と負極板の間には、セパレータという布のような小さい穴の空いたもので仕切っています。
つまり、正極板側の水溶液と負極板側の水溶液は、セパレータの小さい穴を通して接しています。
ですから、この水溶液自体はどちらも同じ電圧になります。
イオン自体はプラスやマイナスの電荷を持っていますが、お互いに引かれ合ったり反発しあうように動きます。
すると結果的には全体として電位の差がなくなり、電気的に中性となります。
さきほどは、正極及び負極付近の水溶液はプラスやマイナスの電荷を帯びる、と書きました。
しかし水溶液中では、例えば電気的にプラスの電荷のイオンが出現しても、
それに相対するようにマイナスの電荷をもつイオンがよってきてもしくはマイナスのイオンのそばに移動して引き合うことで全体として電位的には中性になります。
水溶液の大部分は電気的には中性となります。電位の差ができるのは、正極及び負極板と希硫酸水溶液が接するほんとうにごくわずかの部分だけです。
よって、電位に差ができるのは正極板と負極板ということになります。
どのくらいの電位差かというと、1.685 V-(-0.355 V)=2.04 V
これが鉛蓄電池の電圧ということになります。
もし100 Vの鉛蓄電池が欲しい場合、2 Vの鉛蓄電池を50個直列に接続する必要があります。
自動車用の12 Vの鉛蓄電池は、あらかじめ2 Vの鉛蓄電池を6個直列に接続したものを容器に収納して、12 V電池として販売しています。
・セパレータが必要な理由
鉛蓄電池を図解で書くと、正極と負極は距離が離れています。
ですが実際の鉛蓄電池は、正極板と負極板を重ね合わせるくらい密着させて、それをケースに入れています。
セパレータが無いと、間違いなく短絡します。
やはり鉛蓄電池も製品ですので、なるべく小型にしたいので、こういったものが必要となります。
〇水の電気分解について
鉛蓄電池は水溶液を使用しています。
約1.23 Vの電圧を水にかけると、理論上は水は電気分解によって酸素と水素になります。
といっても純粋な水はイオン濃度がかなり低いです。水分子ばかり存在していて、イオンとして存在しているものが極少なので、電圧をかけても電流が流れません。
電流が流れるには電荷の動きが必要ですが、水中では電子はありませんからイオンが移動しなければ電荷は移動しません。ですがその電荷の担い手のイオンが極少では、電流が流れません。
ですから水中にイオンの数を増やすために、水酸化ナトリウム水溶液や希硫酸水溶液にして水の中にイオンの数を増やして、水の電気分解の電圧を測定します。
先ほど書いたとおり、鉛蓄電池の電圧は2.04 Vです。
普通に考えれば、鉛蓄電池自身の電圧で、水溶液を電気分解してしまうんじゃないか、と思いますよね。
水溶液が電気分解されれば、水の量が減ってしまい蓄電池の機能が失われるばかりか、水素ガスが発生して危険です。
ですが、実際にはそうなりません。
二酸化鉛は理論上よりも高い電圧をかけないと電極から酸素がすぐには発生しません。
同じように、鉛も理論上よりも高い電圧をかけないと電極から水素がすぐには発生しません。
このような理論値と実際の値との違いを、蓄電池の世界では『過電圧』と呼んでいます。
この種類の金属は水素過電圧が大きい、などという使い方をします。
・つまり、鉛蓄電池は酸素過電圧及び水素過電圧がともに大きいため、鉛金属の反応がどんどん起こります。
水の電気分解が起きないわけではありませんが、鉛蓄電池から電気を取り出す上では許容レベルになる、ということです。
このような特徴のため、鉛蓄電池は公称2 Vという高い電圧となっています。
この記事が気に入ったらサポートをしてみませんか?
