
イオン化エネルギー
※期間限定無料。本記事は電子書籍出版後に有料記事になります。予めご承知おきください。2021/8月現在
原子から電子1コを取り去って、1価の陽イオンにするために必要なエネルギー を『イオン化エネルギー』といいます。
原子核には陽子があるため、+の電気をもっています。電子は−の電気をもっているため、引き合う力があります。

電子を原子核から取り去るためには、引力以上の力が必要になります。引き離すために必要なエネルギーで、これが イオン化エネルギー です。

○イオン化エネルギーの大小
次にイオン化エネルギーの大小について考えてみましょう。
イオン化エネルギーの大小関係について表した図を見てみると、周期表で右上ほど大きくなっていることがわかります。例えば、右上にあるヘリウムH eは最大の値です。逆に、左下のカリウムKなどは小さい値と言えます。

これはなぜなのでしょうか??
ここで、引力の強弱の要因を考えなければいけません。
○引力の強弱の要因とイオン化エネルギー
もう少し詳しくみて深く考えてみましょう。
そもそも、イオン化エネルギーは静電気的な引力に逆らって電子を引き離すために必要なエネルギーでした。ここで、原子核からの引力の強弱について考えてみましょう。この引力の強弱はどのような要因で決まってくるのでしょうか?
主な要因は2つあります。「原子核からの距離」と「+の量」です。原子核からの距離が遠くなれば引力は小さくなります。また、+の量が増えれば、引力は大きくなります。これらを考えるポイントにしてみましょう。
周期表の横でみるとき、すなわち同一周期でみると、右にいくほど大きくなりやすいです。

例えば、HとHeで比べると、Heのほうが大きいです。右にいけばいくほど、陽子の数が増えるため、プラスの量は大きくなります。引力が大きくなりますから、イオン化エネルギーは大きくなります。
次に、縦でみるとき、すなわち同族でみると、下にいくほど小さくなりやすいです。
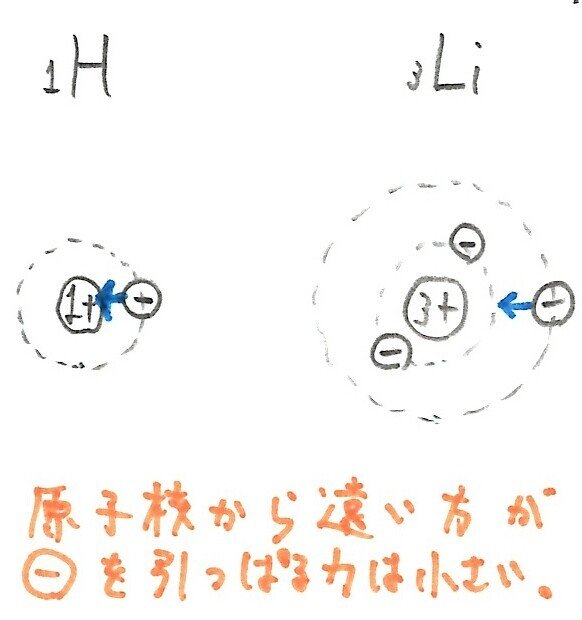
例えば、HとLiで比べると、Liのほうが小さくなっています。下にいけばいくほど、電子の数は増えて電子殻は厚みを増しますから、原子核からの距離は遠くなります。よって、引力は小さくなり、イオン化エネルギーも小さくなります。
まとめ
〇イオン化エネルギーは、原子から電子1コを取り去って、1価の陽イオンにするために必要なエネルギー のことです。
〇ざっくり言うと、周期表で右上ほど大きくなる傾向があります。
この記事が気に入ったらサポートをしてみませんか?
