
中央病院・東病院の2つの拠点備え 日本のがん医療と研究を強力にリード@国立がん研究センター
急速に進化するがん医療。1960年代、がんは不治の病ともいわれていた。がん患者の5年生存率は2023年現在、約64%にまで上昇。国家プロジェクトとして歩んだ、がん対策の軌跡と国立がん研究センターの歩みについて伺った。
がん医療・研究の拠点となる国立の機関として創設
― 国立がん研究センターについて教えてください。
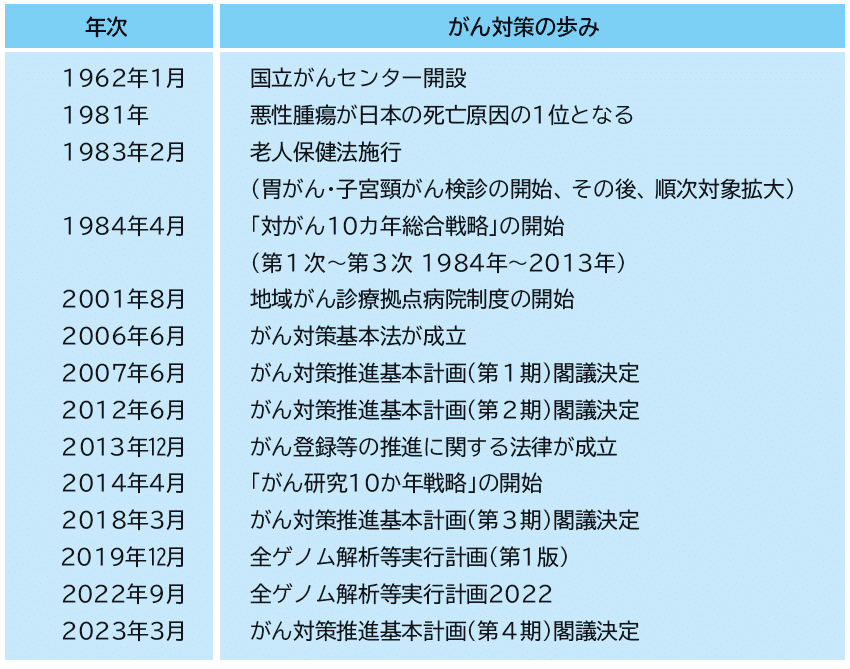
設立は1962年。わが国のがん医療・がん研究の拠点となる国立の機関として創設され、以来、日本のがん医療と研究を強力にリードしてきました。設立当時、がんは「不治の病」とされ、その克服は国民的な課題でした。がんの実態を理解した上で、予防・診断・治療の充実を目的に、全国から優秀な医師・研究者らを集めて開設されました。
1984年から厚生省による「対がん10カ年総合戦略」が始まります。第1期「がんの本態解明」(84~93年)、第2期「解明から克服」(94~2003年)、第3期「罹患率、死亡率の激減」(04~13年)と10年ごとに目標のステージを上げてきました。
「対がん10カ年総合戦略」の第2期から文部省、科学技術庁も参画し、国立がん研究センターは「総合戦略」プロジェクトとともに歩んできました。
第3期の途中(06年)、「がん対策基本法」が成立します。当時、現職の山本孝史民主党参議院議員のがん告白をきっかけに、30年近く進めてきたプロジェクトを見直すことになりました。それまでの基礎研究の積み上げに加え、患者目線を取り入れ、医療者と患者が相互に理解し、国民全体でがんを解決しようという内容です。
新しい医療技術を臨床現場に届ける使命
現在は研究、臨床に加えて教育にも力を入れています。メインとなるのが情報提供と研修。正しい情報を提供し、どこでも誰でも等しく質の高いがん医療にアクセスできる「がん医療の均てん化」が理念のひとつ。全国に450を超す、がん診療連携拠点病院などが設置され、日本中で標準治療を受けられる環境の整備が進んでいます。そのために必要な人材育成や、がん登録実務者の認定・研修制度にも取り組んでいます。
まず東京都中央区築地に研究・臨床を行う中央病院が立ち上がり、1992年、千葉県柏市に東病院ができました。根底に「がん医療の均てん化」という課題があったと思います。拠点病院は作ったけれど有機的・機能的に全国をまとめるために、少し環境の違う2カ所で実践する意味合いもあったと思います。
在宅医療や地域医療との連携を考えた場合、柏だとイメージしやすい。医療は継続するもので、国立がん研究センターで完結するものでなく、患者が地元に戻ってからの地域との連携も必要です。基本法の成立もあり「がんを治療する」にとどまらず「治療後のサバイバーシップ(がんと長期的に、どう向き合い共生するか)」という点についても考慮する必要がありました。
がんを発症しても6~7割は5年生存できるようになったわけですが、逆に3割は現在も救えていません。それを解決するゲノム医療のような新しい医療技術を臨床現場に届ける開発研究が国立がん研究センターの役目です。
両病院がシームレスに連携しそれぞれの役割を果たす
両病院が機能的にオーバーラップしながらシームレスに連携して役割を担っています。東病院がより開発的な段階の研究に軸足を置き、中央病院は患者さんに届ける出口部分(臨床研究)により重きを置いているといえます。
中央病院の特徴のひとつが希少がんセンターです。いわゆるアンメットメディカルニーズ(医療提供が不十分な)の希少がん、小児がんについて開発研究に取り組んできました。現在、研究の中心はゲノム医療。希少がんでもゲノム情報を集めながら、患者さんごとのデータを登録し、その情報の中で治療薬の開発を進めるマスターキープロジェクトという取り組みが進められています。
希少がんの中でも、さらに数の少ない小児がんも同様です。私たちは小児がん医療の中央機関として、国立成育医療研究センターとの協働によりゲノム解析に基づいた開発研究も推進しています。さらに15の小児がん拠点病院と連携し、小児がん医療の一層の充実にも貢献したいと考えています。
開発研究の中心は「がんゲノム医療」
― がんゲノム医療について教えて下さい。
がんゲノムを調べることで、効果が大きく、副作用の小さい治療法を決めることができます。発がんや悪性度の維持の原因となっている分子を同定し、その分子の働きを抑えることで、がんを抑制するわけです。
ゲノム解析の結果、たとえばEGFR遺伝子の異常が発見されればEGFRタンパク質の阻害薬が有効と判断できますし、ALK遺伝子の異常が発見されればALKタンパク質の阻害薬、免疫の調節異常が発見されれば免疫チェックポイント阻害薬の投与が考えられます。
私たちが初めてゲノム解析の威力を痛感したのは自治医科大学(現・国立がん研究センター研究所長)の間野博行先生らが2000年代に行った臨床研究でした。先生は重篤の肺腺がんの患者から原因となるALK融合遺伝子を世界で初めて発見。血液がんのために開発されていたALKタンパク質阻害薬を投与したところ、病変部が劇的に縮小し、心臓のまわりにたまっていた水もなくなりました。
がんゲノムをていねいに調べることで、従来の治療薬を、より効果的に使えることがわかったわけです。
実際、肺腺がん(非小細胞肺がん)患者の化学療法による2年生存率12%に対し、ALK陽性肺腺がん(肺腺がんの約5%)を対象とする、分子標的薬アレクチニブを使った治療法の3年生存率は78%という、めざましい実績を残しています。
もちろん、課題は、まだまだ多い。そのひとつは遺伝子パネル検査が全ゲノムの0.02%程度しか見ていないことです。全エクソン(遺伝子の中で遺伝情報がコードされている部分)検査は、それより多いとはいえ、全ゲノムの1.5%程度しか見ていません。
対して全ゲノム検査を実行できれば、現時点では、ほとんどわかっていない未知の領域を探索できますから、新規創薬標的・テーマの発掘が格段に飛躍することが期待されています。
がん組織を調べると、がん細胞以外に正常組織や免疫細胞など他の細胞も密集しています。がん細胞は周辺細胞との相互作用を介し、免疫細胞からの攻撃に対抗し、自らが成育しやすい環境を作ります。
より適切な治療には免疫系や周辺環境の解析も必要です。今後扱う情報が指数関数的に増えていくため、AIによる技術開発も進行中です。
2018年3月、中央病院・東病院とも、がんゲノム医療中核拠点病院に指定されました。がんゲノム医療拠点病院や連携病院とも協力しながら、がんゲノム医療が適切に提供されるよう努めるとともに、情報共有や人材育成にも力を入れています。
今後、予防的観点のゲノム研究が急速に発展
今や国民の2人に1人が一生に一度はがんにかかります。現在、年間100万人近くの方が新たにがんと診断されていると推定されており、高齢化の進展に伴い、がん罹患数は今後も増え続けることが想定されています。
国立がん研究センターの使命としては個々のがん患者に対してゲノムなどの情報に基づき適した治療を提供することに加え、がんの発症予防という観点からも、がんの高リスク群を同定し、適切な予防法を開発・実践することが求められます。
高齢になると多くの人が、がんになる遺伝子変異を持っており、がんのリスクは高まります。老化とは遺伝子変異が増えるということですが、必ずしもがんを発症するわけではありません。がんを発症する人としない人の違いがわかれば、予防・治療につながります。
今後、予防的観点のゲノム研究が急速に発展するでしょう。外科的視点では低侵襲な治療に一層の磨きをかけ、内視鏡・ロボット手術、IVR、AI を活用した技術支援の開発・研究に取り組んでいます。
がん医療の中核拠点として、予防から治療、治療後のサバイバーシップまで見据え、「社会と協働し、全ての国民に最適ながん医療を提供すること」を目指しています。

1982年東京大学医学部医学科卒業。同附属病院助手、米国マサチューセッツ工科大学がん研究センター研究員を経て、1995年国立がんセンター研究所に着任。2016年より現職。
※『名医のいる病院がん治療編 2024』(2023年12月26日発売)から転載
