
175)がん細胞と老化細胞を排除するフェロトーシス誘導療法
体がみるみる若返るミトコンドリア活性化術175
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【人間は老化細胞とがん細胞の蓄積で死亡する】
私たちの体は多数の細胞で成り立っています。このような正常な細胞の集まりの中で、加齢とともに異常な細胞が出現してきます。一つは老化細胞で、もう一つはがん細胞です。
老化した細胞が増えれば、組織の機能は低下し、免疫力などの生体防御力が低下すると感染症に罹りやすくなり、がん細胞の増殖を止めることができなくなります。さらに心臓や呼吸器などの全身臓器の機能が低下するとその個体は老衰で死亡します。
がん細胞は増殖と細胞死の制御ができなくなった細胞で、正常な細胞や組織を侵略するように数を増やしていきます。正常組織を破壊するので、がん細胞が多く増えると宿主は死亡します。つまり、個体の死は老化細胞とがん細胞の蓄積が原因となります。(図)

【老化細胞の蓄積は組織機能を障害する】
老化細胞は増殖を停止した細胞です。老化細胞が組織に蓄積すると、周りの正常細胞に様々な悪影響を及ぼすことが知られています。老化細胞はサイトカイン、成長因子、ケモカイン、プロテアーゼなどの多くの成分を分泌しています。これらの因子は老化関連分泌表現型(senescence-associated secretory phenotype :SASP)と呼ばれ、老化細胞の周囲の組織に炎症や機能障害を引き起こす可能性があります。つまり、老化細胞が蓄積すると老化関連分泌表現型(SASP)の産生によって、その組織の機能が障害され、細胞の老化やがん化を促進します。(図)

【がん細胞は鉄を多く取り込んでいる】
私たちの体内には、体重60kgで平均4g程度(2~6gくらい)の鉄が存在します。鉄は全て食事から体内に摂取しています。鉄は酸素などの小さな分子と強く特異的に結合する性質があります。体内の鉄の60%くらいはヘモグロビンのヘムとして存在します。ヘム(Heme)は2価の鉄原子とポルフィリン(プロトポルフィリンIX)から成る錯体で、赤血球中のヘモグロビンは、ヘムの鉄原子が酸素分子と結合することで酸素を運搬します。

ミトコンドリアの電子伝達系(呼吸鎖)にあるシトクロムというタンパク質はヘムを含んでおり、これがエネルギー生成の過程で電子を輸送します。
鉄イオンは細胞の呼吸、核酸合成、増殖などに必須な補助因子として重要な役割を果たしています。したがって、細胞増殖が亢進したがん細胞は鉄の需要が増え、鉄の取り込みが増えています。
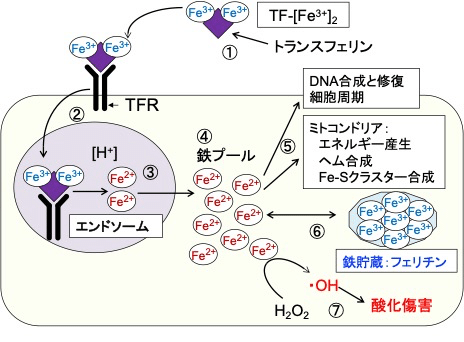
血液中では鉄イオンはトランスフェリンというタンパク質に結合して細胞まで運ばれます。1つのトランスフェリンに2つの3価鉄(Fe3+)が結合します。トランスフェリンは細胞膜にあるトランスフェリン受容体と結合して細胞内に取り込まれ、リソソーム内の酸性の環境で鉄イオンが解離し2価の鉄(Fe2+)になります。フリーの2価鉄イオンは細胞質鉄プールとして蓄積され、DNA合成、細胞周期の制御、ミトコンドリアでのATP産生などに必須の働きを担っています。
増殖活性の高いがん細胞は、細胞膜のトランスフェリン受容体の発現量が増え、正常細胞に比べて鉄の取込みが増えています。さらに、細胞内の鉄イオンの調節に破綻をきたし、酸化還元活性のあるフリーの2価鉄イオン(Fe2+)が過剰に存在する状況になっています。(図)
【老化細胞は鉄が多く蓄積している】
細胞は老化に伴って鉄の含有量が増える傾向があります。この現象は「鉄蓄積」と呼ばれ、以下の理由やメカニズムによって説明されます。
1)リサイクル機能の低下:老化に伴い、細胞のリサイクル機能(特にマクロファージによる鉄のリサイクル)が低下します。この結果、古い赤血球から放出された鉄が適切に再利用されず、体内に蓄積されやすくなります。
2)フェリチンの増加:フェリチンは鉄を貯蔵するタンパク質ですが、老化によりフェリチンのレベルが上昇し、細胞内の鉄の貯蔵量が増加します。
3)酸化ストレスの増加:老化により酸化ストレスが増加し、これが鉄の代謝に影響を与えることがあります。酸化ストレスは鉄の放出や蓄積を促進し、細胞内の鉄濃度を上昇させることがあります。
4)ミトコンドリア機能の低下:ミトコンドリアの機能が低下すると、鉄の代謝が乱れ、細胞内に鉄が蓄積しやすくなります。
加齢に伴う鉄蓄積は昆虫からヒトに至る多くの動物種の様々な組織で認められており、かなり一般化できる現象です。例えば、キイロショウジョウバエの鉄蓄積量は加齢に伴い増加し続け老齢期には若齢期の2~3倍に達します。同様な加齢に伴う鉄蓄積は、マウスやラットの肝臓、脳、腎臓でも認められています。
【鉄を利用してがん細胞と老化細胞を排除する】
鉄を利用してがん細胞や老化細胞を除去する方法については、近年の研究において注目されています。このアプローチは「フェロトーシス(ferroptosis)」と呼ばれる細胞死の一形態に関連しています。
フェロトーシスは、鉄依存性の脂質過酸化を伴う細胞死の一種です。このプロセスでは、鉄が脂質過酸化を促進し、細胞膜に損傷を与えて細胞死を引き起こします。
がん細胞は鉄が多く蓄積しており、この鉄と反応して活性酸素を産生する物質を使って、がん細胞に選択的にフェロトーシスによる細胞死を誘導する治療法が研究されており、一部はすでにがん治療として使用されています。
老化細胞は、通常の細胞よりも酸化ストレスに対して脆弱であり、フェロトーシスにより選択的に除去することが可能と考えられています。
老化細胞を選択的に排除する薬物をSenolytic drug(老化細胞除去薬)と言います。「seno=老化」と「lytic = 溶解」を組み合わせた用語です。
Senolytics(老化細胞除去薬)という用語は、2015年にカークランド(JamesnL. Kirkland)とチコニア(Tamara Tchkonia)によって導入されました。この二人はメイヨークリニック(Mayo Clinic Robert and Arlene Kogod Center on Aging)の研究者です。
老化細胞は増殖を止めていますが、細胞死も抑制されていて、老化関連分泌表現型 (SASP)を産生し続けるので、周囲の正常細胞に悪影響を及ぼします。そこで、老化細胞の細胞死(フェロトーシス)を誘導して老化細胞を除去しようという考えです。(下図)

この記事が気に入ったらサポートをしてみませんか?
