自己免疫の自己組織化臨海理論
トピックスを見る
研究論文
自己免疫の自己組織化臨界理論
角山健、宮崎由美、塩沢俊一
概要
背景
原因不明である自己免疫の原因を、免疫「系」の異常という別の角度から調査している。
方法論/主な知見
抗原の反復免疫により、自然発症の自己免疫疾患でないマウスに全身性の自己免疫疾患を引き起こす。CD4+T細胞の過剰刺激は、T細胞受容体(TCR)の改訂を受け、自己抗体を誘導する能力を持つCD4+T(aiCD4+ T)細胞の発生につながった。aiCD4+ T細胞は、交差反応ではなくde novo TCR修正によって誘導され、その後CD8+ T細胞を過剰に刺激し、抗原特異的細胞傷害性Tリンパ球(CTL)になるよう促した。これらのCTLは抗原交差提示によってさらに成熟し、全身性エリテマトーデス(SLE)のような自己免疫組織傷害を引き起こすようになった。
結論/意義
全身性自己免疫症は、抗原による反復免疫によって宿主の免疫「系」を、その自己組織的臨界を超えるレベルまで過剰に刺激した必然的な結果であると思われる。
引用元津山紘一・宮崎泰・塩澤慎一 (2009) 自己免疫の自己組織化臨界理論.PLoS ONE 4(12): e8382.
編集者Derya Unutmaz, ニューヨーク大学, アメリカ合衆国
受領2009年9月11日、受理。2009年11月30日発行2009年12月31日発行
Copyright: © 2009 Tsumiyama et al. 本論文は、Creative Commons Attribution Licenseの条件の下で配布されるオープンアクセス論文であり、原著者および出典を明記することを条件に、いかなる媒体においても無制限の使用、配布、および複製を許可するものである。
資金提供本研究は、文部科学省グローバルCOEプログラム、独立行政法人科学技術振興機構の助成を受けて実施したものです。研究助成機関は,研究デザイン,データ収集と分析,発表の決定,原稿の作成には一切関与していない.
競合する利益著者らは、競合する利害関係がないことを宣言している。
F. Macfarlane Burnetの「免疫のクローン選択説」や、その後のV(D)J組み換えや免疫反応の多様性と個別性に関する分子生物学的発見以来、自己免疫の発生機構は依然として不明なままである。自己免疫という言葉は、今ではすっかり定着しているが、本研究では、自己免疫の病態を異なる角度から捉え、免疫「系」の完全性を検証しようと試みた。私たちが選んだ方法は、自動車の性能をテストするように、定常状態をはるかに超えるレベルまで抗原によってシステムを最大限に刺激することであった。自己免疫疾患に罹患していないマウスに抗原を繰り返し投与し、完全に再現性のある実験を行ったところ、予想に反して、自己組織化した臨界状態を超えて免疫系を過剰に刺激すると、必然的に全身性の自己免疫に至ることを発見しました。その後の詳細な分子生物学的解析により、第一に、自己抗体が抗原との交差反応ではなく、de novo T細胞受容体(TCR)の改訂によって誘導されることを明らかにした。第二に、抗原交差提示を介したエフェクター細胞傷害性Tリンパ球(CTL)の最終成熟が、自己免疫組織傷害を引き起こすための必須条件であることが明らかになった。最も重要なことは、自己免疫は「自己免疫」から生じるのではなく、正常な免疫応答が自己組織化の臨界点を超えて最大限に刺激されたときの自然な結果として生じるということである。
自己抗体の誘導
抗原で強く刺激するとT細胞は無感作になるという一般的な観察[1]と一致して、スタフィロコッカス・エンテロトキシンB(SEB)を2回免疫すると、BALB/cマウスのSEB反応性Vβ8+CD4+T細胞が無感作になることが確認された。しかし、これらの細胞は、SEBでさらに8×免疫した後、アネルギーから回復して分裂し、IL-2を産生した(図S1A)。これには、IgG-およびIgM-リウマチ因子(RF)、抗Sm抗体、特に、ヒトの自己免疫に典型的に見られるガラクトース欠損IgGに対して反応するRFなどの自己抗体の誘発が伴っていた[2](図1A)。自己抗体は、免疫抗原がT細胞に正しく提示される限り、オバルブミン(OVA)またはキーホールリンペットヘモシアニン(KLH)()を含む他の従来の抗原によっても誘導され得る(図S1B)。繰り返し免疫したマウスのCD4+ T細胞は、CD45RBlo、CD27loおよびCD122hiを発現して完全に成熟し(データは示されていない)、これらのプライムされたCD4+ T細胞は養子移入後にナイーブなレシピエントにRF生成を付与しうる(図1B)。自己抗体の誘導は、以下の理由でCD8+T細胞またはMHCクラスI制限抗原提示とは無関係である。まず、RF抗体と抗dsDNA抗体の両方が、β2-ミクログロブリン(β2m)欠損のBALB/cマウスにOVAを繰り返し免疫することにより一貫して誘導されることが可能である。β2m欠損マウスはCD8+ T細胞が欠損しており、脾臓T細胞の0.8%未満に減少している[3](図S3)。第二に、自己抗体を誘導する能力は、OVA免疫化BALB/cマウスからCD4+ T細胞を介してのみβ2m欠損マウスに移行可能であった(図1C)。このように、繰り返し免疫されたマウスからのCD4+ T細胞は、自己抗体を誘導する能力を獲得する。我々は、このコミュニケーションにおいて、これらを自己抗体誘導CD4+ T (aiCD4+ T)細胞と呼んでいる。
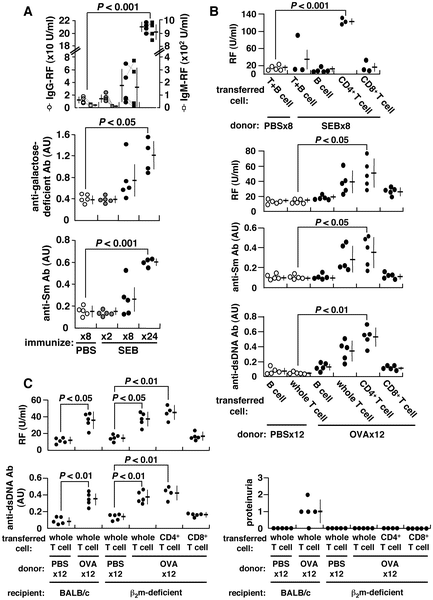
図1.自己抗体とタンパク尿の誘発。
BALB/c マウスに 25 µg SEB、500 µg OVA または PBS を 5 日ごとに i.p. で繰り返し注射した。(A)血清 IgG-および IgM-RF、抗ガラクトース欠損 IgG、抗 Sm 抗体を ELISA 法を用いて測定した。任意単位(AU)1.0は、原型となる自己免疫性MRL/lprマウスの血清から得られた力価に相当する。各マウスからのデータは点線で結ばれている。(B)SEB-、OVA-またはPBSで免疫したBALB/cマウスの脾臓B、T、CD4+ TまたはCD8+ T細胞のナイーブBALB/cマウスへの養子縁組移植。レシピエントマウスには,細胞移植の 24 時間後に 25 µg SEB または 500 µg OVA を i.p. 単回注射し,2 週間後に自己抗体を測定した.(C)OVAで免疫したBALB/cマウスの細胞をβ2m欠損マウスに養子移入した。
doi:10.1371/journal.pone.0008382.g001
自己抗体誘導のメカニズム
aiCD4+T細胞の特徴をさらに明らかにするために、相補性決定領域3(CDR3)のスペクトラタイピングによってTCRレパートリーを調べた[4]。VβおよびJβの組み合わせ評価により、PBSで8倍、またはSEBで2倍免疫したマウスのCD4+脾臓細胞のCDR3長さプロファイルは、多様で偏りのないTCRレパートリーの典型である通常のガウス曲線に適合した(図2A)。しかし、SEBで8回免疫したマウスの脾臓細胞は、胸腺細胞ではなく、歪んだ長さのプロファイルを示し、脾臓の末梢でTCRの改訂が進行していることが示唆された。V(D)Jリコンビナーゼ複合体の構成要素をコードする遺伝子は、リコンビネーション活性化遺伝子1および2(RAG1/2)、ターミナルデオキシヌクレオチジル転移酵素(TdT)および代理TCRα鎖(pTα)[5](図2B)など、SEBで8×免疫したマウスで特異的に再発現された(図2)。RAG1遺伝子は、rag1/gfpノックインマウスにSEBで8×免疫した後、in vivoで発現しています[6](図2C)。これらのマウスでは、脾臓のGFP発現Vβ8+CD4+T細胞の増加に連動して、血清RFが増加した。V(D)J組み換えが脾臓の末梢で起こったことを直接証明するために、我々はライゲーション媒介PCR(LM-PCR)を用いて、組み換えシグナル配列(RSS)に挟まれた組み換えコードV領域を持つ鈍端DNA断片を検出した [7], [8].SEBで8回免疫したマウスの脾臓細胞において、TCRα可変領域2(TCRAV2)に相当する再配列中間体を同定した(図2D)。これらの知見は、従来の抗原を繰り返し免疫することで、TCRの改訂を受け、B細胞を刺激する能力を持つaiCD4+ T細胞の生成が誘導されることを示している[9]。この観察は、このような体細胞突然変異がリンパ球で頻繁に起こることを示す以前の知見と一致しており、このプロセスは自己免疫の発症における主要な確率的要素であると考えられている[10], [11]。したがって、抗原による免疫と完全成熟の誘導を繰り返すことによってCD4+ T細胞を過剰に刺激すると、必然的にTCRの修正を受け、自己抗体を誘導する能力を持つaiCD4+ T細胞が生成されることになるのである。重要なことは、このようなaiCD4+ T細胞はde novo TCR revisionによって誘導されるが、抗原との交差反応によって誘導されるのではないことを本研究が示していることである。

図2.抗原の反復免疫に伴うTCRの修正。
(A) PBSで8回、SEBで2回または8回免疫したマウスのTCR CDR3長プロファイル。脾臓CD4+T細胞のTCRレパートリーは、SEBで8回免疫した後のみ歪んでいた。(B) PBS または SEB を注射した BALB/c マウスの脾臓における V(D)J リコンビナーゼ複合体および関連分子の発現。(C) rag1/gfpノックインマウスのVβ8+CD4+T集団におけるGFP+細胞。SEBで8回免疫したrag1/gfpノックインマウスに誘導されたIgG-RF(左下)。また、Vβ8+CD4+T細胞の中でGFP+T細胞の割合が増加した(平均±SD、4-5マウス/群)。(D)SEBで8×免疫したマウスの脾臓におけるTCRα鎖の改訂は、TCRAV2に隣接するRSSにおけるdsDNA切断のLM-PCR検出により、PCR-増幅TCRα一定領域(TCRAC)をDNA品質管理として決定された。
doi:10.1371/journal.pone.0008382.g002
自己免疫組織傷害の誘発
OVAの反復免疫は、自己免疫組織傷害とIgG、SmおよびdsDNAに反応する自己抗体の産生をも引き起こす(図3および図S2A)。血清免疫複合体(IC)、蛋白尿、および腎臓におけるICとOVAの沈着は、OVAで12×免疫したマウスで認められた(図3A)。腎臓には典型的なびまん性増殖性糸球体病変が認められ、これらの糸球体にはCD8+T細胞が浸潤していた。これらの観察は、典型的に末梢血中のCD8+ T細胞の増加と腎臓へのCD8+ T細胞の浸潤を示すループス患者で観察される臨床的特徴と類似している[12], [13].OVAで12×マウスを免疫すると、V(D)Jリコンビナーゼ複合体の再発現及び脾臓の拡大(図S4A)、並びにループス腎炎の自己免疫組織傷害に独特に関連している抗dsDNA抗体の増加(図S2A)をもたらした(14)。病理所見では、腎臓のびまん性膜性(ワイヤーループ)および/または増殖性糸球体腎炎(図3A)、肝胆管周囲の形質細胞の浸潤(図S4B)、脾臓の著しい胚中心を有する拡大したリンパ濾胞(図S4B)、?唾液腺へのリンパ球の時折の浸潤(データは示さず)、甲状腺へのリンパ球の浸潤、耳介の皮膚真皮への好中球とマクロファージの血管周囲の浸潤(図S4B)。SLEの診断法であるループスバンドテストは、表皮-真皮接合部の皮膚で陽性であった(図3B)。

図3.自己免疫組織傷害の誘発。
BALB/c マウスに500μg OVAを5日ごとにi.p.注射した。(A)最終免疫の2日後に測定した血清ICはAUで表した。最終免疫後9日目に評価したタンパク尿:グレード1、2、3はそれぞれ尿タンパクの30-100 mg/dl、100-300 mg/dl、300-1000 mg/dlを表す(左上)。PBSまたはOVAで12回免疫したマウスの腎臓の代表的な病理組織学(左下)(H&E染色、バー=20μm;原倍率400倍):同じ倍率で見られた好酸球を含む細胞浸潤を伴う糸球体の膨張。OVAで12×免疫したマウスの検体(右下)において、抗CD8α(53-6.7)および抗IFNγ(R4-6A2)モノクローナル抗体を用いて連続組織切片で染色した沈着IC、IgG、C3およびOVA(上右)(バー=50μm;元の倍率×200)、糸球体に浸潤した細胞(バー=20μm;元の倍率×300)の免疫組織化学的染色結果。(B)抗IgG抗体および抗C3抗体で染色したループスバンドテスト(バー=20μm;原倍率×400)。
doi:10.1371/journal.pone.0008382.g003
もっと見る "
自己免疫組織傷害のメカニズム
IFNγが自己免疫組織の傷害に関連して増加することは、以前に示されている[15]-[17]。これと一致して、我々は、IFNγ+CD8+T細胞の数が、制御性TまたはTヘルパー17細胞ではなく、OVAで12×免疫化後に増加することを見出した(図4Aおよびデータ示さず)。また、適応免疫に必要なIFNγ産生エフェクター/メモリーCD8+ T細胞の拡大も観察された[18] (図4A)。これらのIFNγ産生CD8+T細胞は、OVA免疫マウスのOVA沈着糸球体に浸潤していることが観察された(図3A)。以下の観察結果から、CD8+ T細胞は組織傷害に必要であることがわかった。第一に、CD8+ T細胞の移入は、細胞移入後のレシピエントマウスの脾臓における新しいIFNγ+CD8+ T細胞の生成と同様に、マウスの腎臓病変を誘発しうる(図4B)(図S5)。第二に、OVA免疫した野生型マウスからβ2m欠損マウスへのCD8+ T細胞の移植により、自己免疫組織傷害は誘導されない(図1C)。そして最後に、CD8+T細胞移植は、レシピエントマウスにおいて自己免疫組織傷害を誘発するために、少なくともOVAによる1×ブースター免疫化を伴わなければならない(図S6)。これらの知見は、自己免疫組織傷害の誘導には、関連する抗原が標的器官に正しく提示されることを条件として、完全成熟したIFNγ産生エフェクターCD8+ T細胞が必要であることを示すものである。これらは、CTLの特徴として確立されているものであり、新規のものではない。しかし、我々は、(1)CTLは「自己免疫」ではなく「免疫」プロセスによって誘導されること、(2)CD8+T細胞が過剰に刺激されて成熟したエフェクターCTLになると、必然的に自己免疫組織傷害が起こることを明らかにする。後者は、CTLがどのように誘導されるかにかかわらず、CTL過剰誘導の結果が免疫組織傷害であることを意味する。

図4.CD8+ T細胞の膨張と抗原交差提示。
(A)脾臓細胞を、ブレフェルディンA(10 µg/ml)存在下、50 ng/ml ホルボルミリスチン酸(PMA)および500 ng/ml イオノマイシンで4時間刺激し、細胞内IFNγを染色(上段)した。ナイーブ(CD44lowCD62Lhigh)、エフェクター(CD44highCD62Llow)、メモリー(CD44highCD62Lhigh)画分に分類されるCD8+ T細胞のサブセット(中)。ナイーブまたはエフェクター/メモリーCD8+ T細胞集団内のIFNγ+細胞のフローサイトメトリー。脾臓細胞をCD44 MACSビーズを用いてナイーブ(CD44low)細胞とエフェクター/メモリー(CD44high)細胞に分離し、CD8+T集団内のIFNγ+細胞を評価した(下)。(B)OVA免疫BALB/cマウスの脾臓細胞のナイーブレシピエントへのアダプティブトランスファー。レシピエントには細胞移植の24時間後に500μgのOVAを注射し、2週間後に蛋白尿を調べた。(C) OVAのCD8+T細胞への交差提示。OVA免疫マウスまたはコントロールマウスの脾臓CD11c+ DCを、1 mg/ml OVA存在下(OVA(+))または非存在下(OVA(-))で、クロロキン(CQ)(20 μg/ml)と3時間インキュベートし、次にDO11.10トランスジェニックマウスのKJ1-26+CD8+ T細胞と24時間共培養してCD69の表面発現(上図参照)を検討した。OVAまたはPBSによる免疫の3時間前に、マウス1匹あたり250μgのCQを投与し、in vivoでの交差提示を阻害した。12×免疫後のIFNγ+CD8+T細胞(中)、自己抗体および蛋白尿(下)。(D) CD8+ T細胞媒介の自己免疫組織傷害に対する自己抗体誘導CD4+ T細胞の必要性。BALB/c マウスをKLHで12×免疫し、CD4+ T細胞をMACSビーズを用いて単離した。細胞は、OVAで8×免疫した抗CD4抗体処理レシピエントマウスに移植した。成熟CTL、すなわちIFNγ+CD8+T細胞の割合とタンパク尿は、KLHによる1×のブースター免疫の2週間後に測定した。
doi:10.1371/journal.pone.0008382.g004
もっと見る "
抗原クロスプレゼンテーション
次に、CTLの誘導と組織傷害に抗原交差提示が必要であることを示す。これを検証するために、OVAで12×免疫したマウスのOVAパルスした樹状細胞(DC)を、OVA反応性TCRを排他的に発現するOVA-TCRトランスジェニックマウスのT細胞と共培養した [19].我々は、OVA反応性DO11.10 CD8+T細胞が、OVAパルスしたDCとの共培養により活性化されることを示す(図4Cおよび図S7)。さらに、自己免疫組織傷害とIFNγ+CD8+T細胞の増加は、自己抗体の生成ではなく、抗原交差提示の阻害剤であるクロロキン(CQ)の添加によって共に抑制された(図4C)。このことから、IFNγ産生CD8+T細胞の増殖と自己免疫組織傷害には、抗原交差提示が必要であることが示された。
aiCD4+T細胞はCD8+T細胞による組織傷害の誘発を助ける
CTLは自己免疫においてどちらかといえば受動的な役割を果たしているように思われるので、次に、自己免疫組織傷害の誘発にaiCD4+ T細胞の助けが必要であるかどうかを研究した。抗CD4処理は、OVA免疫BALB/cマウスにおけるIFNγ産生CD8+T細胞の生成及び自己免疫組織傷害をほぼ無効にするので(図S8)、このCD4+T細胞媒介ヘルプがaiT細胞又は抗原特異的T細胞によって媒介されるかどうかを調べるために、KLHで12×免疫したマウスからCD4+T細胞をOVAで8×免疫したCD4+T枯渇BALB/cマウスに移植した(図4D)。OVAで8×未満の免疫では完全成熟IFNγ+ CTLが発達しないので(図S9)、この実験は、TCR改訂を受けたaiCD4+ T細胞がOVA特異的CTLの成熟を促進する能力を試験することが可能である。その結果、移植後のこれらのマウスでは、自己免疫組織傷害とOVA特異的IFNγ+CD8+T細胞の両方が生じたことから、CD8+T細胞の成熟と自己免疫組織傷害には、de novo TCR revisionを受けたaiCD4+T細胞が必要であることが示された(図4D)。
今回の発見は、CD4+ T細胞は通常、単一の抗原に繰り返しさらされると活性化誘導細胞死(AICD)を介して死滅するが、親和性の低い「交差反応性」TCRを持つナイーブCD4+ T細胞は、同じ抗原に繰り返しさらされることで活性化され、弱いTCRシグナル伝達により生き残り、最終的に自己反応性を獲得するという現在のコンセンサスと一致している[20]。しかし、我々はここで、aiCD4+ T細胞は交差反応によってではなく、de novo TCRの改訂によって誘導されることを示す。こうして生成されたaiCD4+ T細胞は、自己抗体だけでなく、CD8+ T細胞の完全成熟を誘導し、ヒトのSLEに似た自己免疫組織傷害を引き起こすのです。このように、aiCD4+ T細胞の誘導は重要なステップであり、その後のエフェクターCTLの誘導は自己免疫の発達における重要な次のステップである[21], [22].したがって、自己免疫がどのように引き起こされるかという問題は、免疫抗原に対する宿主の定量的反応、すなわち宿主の抗原提示・交差提示能力に帰着する。そして、麻疹ウイルスのようなある種の抗原が自己免疫を引き起こす能力は、その抗原提示能力と連動して、ある種の宿主のCD4+および/またはCD8+ T細胞を、その免疫系の完全性を超えて過剰に刺激する能力に起因する可能性があるということになる。生体は常に広範な環境抗原にさらされている。これは、最近、麻疹ウイルスワクチンを接種していない日本の若年成人の亜集団の間で麻疹ウイルス感染が再発していることに例証されるとおりである。そこで、我々は、宿主の免疫「系」が外界からの妨害、すなわち抗原への反復暴露により、自己組織化臨界を超えるレベルまで過剰に刺激されると、必然的に全身性の自己免疫が起こると結論し、ここに自己免疫の原因を説明する「自己組織化臨界理論」を提唱するものである。
倫理に関する声明
本研究は、施設動物管理使用委員会の承認を受け、神戸大学動物実験規程に準じて実施した。
試薬
CD4に対するAPC(アロフィコシアニン)結合抗体(RM4-5)、およびCD62Lに対するPE結合抗体(MEL-14)、CD69(H1・2F3)、はBioLegend(カリフォルニア州サンディエゴ)から購入、CD44に対するFITC結合抗体(IM7・8・1)、DO11.FITC結合抗体(IM7・8・1)は、BioLegend(カリフォルニア州サンフランシスコ)より入手しました。10クロノタイピングTCR(KJ1-26)およびPE結合ラットIgG1アイソタイプコントロールはCALTAG Laboratories(Burlingame、CA)から;CD8αに対するPE-Cy5(フィコエリスリン-シアニン5)結合抗体(53-6.7)、Vβ8 TCRに対するPE結合抗体(F23.1)およびIFNγ(XMG1.2) はBD PharMingen(サンディエゴ、CA)より購入した。
動物実験
BALB/c 雌マウス(日本エスエルシー、浜松市)および DO11.10 TCR トランスジェニックマウス [19] (ジャクソン研究所、バーハーバー、ミシガン州)、 BALB/c 背景の β2m 欠損マウス [3] および rag1/gfp ノックインマウス [6] による動物実験 は施設審査委員会の承認のもとに実施された。マウス(8週齢)に25μg SEB(Toxin Technologies, Sarasota, FL)、500μg OVA(Grade V; Sigma, St.Louis, MO)、100μg KLH(Sigma)またはPBSを5日ごとにi.p.注射により免疫化した。
腎臓および真皮の凍結切片を、ヤギ抗C3(Bethyl laboratories, Inc, Montgomery, TX)およびAlexa Fluor 488標識抗ヤギIgG抗体(Molecular Probes, Eugene, OR)、Alexa Fluor 594標識抗マウスIgG抗体(Molecular Probes)またはウサギ抗OVA抗体(Sigma)を用いてC3、IgGまたはOVAの染料で染色した。CD8またはIFNγ染色については、腎臓のパラフィン包埋切片をCD8α(53-6.7;BD PharMingen)またはIFNγ(R4-6A2;BD PharMingen)に対するラット抗体で染色した後、VECTASTAIN Elite ABC rat IgG kit(Vector, Burlingame, CA)と反応させた。
細胞内IFNγを検出するために、細胞(1×106/ml)をブレフェルジンA(10μg/ml;シグマ)の存在下、50 ng/ml ホルボールミリステートアセテート(PMA;シグマ)および500 ng/ml イオノミシン(シグマ)で刺激した。4時間後、細胞を抗CD8抗体で染色し、2%ホルムアルデヒドで固定、0.5%サポニン(シグマ)で透過処理し、IFNγを染色した。
養子細胞移植のために、B、T、CD4+ TおよびCD8+ T細胞は、MACSビーズ(Miltenyi Biotec、ドイツ)を用いて90%以上の純度で脾臓から分離された。この細胞を、i.p. (5×106/mouse) または i.v. (2.5×107/mouse) 注射でナイーブBALB/c またはβ2m 欠損マウスに移植した。移植24時間後に25 μg SEBまたは500 μg OVAを単回i.p.投与し,2週間後に血清,尿および臓器を調査した.
BALB/c マウスに200μgの抗CD4抗体(GK1.5; BioLegend)をi.p.注射し、OVAによる8×免疫の24時間後にCD4+ T細胞を枯渇させた。4日後、KLHで12×免疫したマウスからのCD4+ T細胞をCD4+ T枯渇マウスに移した。レシピエントマウスは、細胞移植の24時間後に100μg KLHの単回i.p.注射を受けた。
メディエーターのアッセイ
血清は、Sm抗原(ImmunoVision, Springdale, AR)を用いた抗Sm抗体、RF(Shibayagi Co., Gunma, Japan)、RF for galactose-deficient IgG(Eisai Co., Ltd., Tokyo, Japan)およびS1 nuclease(Promega, Madison, WI)による消化後のdsDNA(Worthington Biochemical Co.)血清ICはヤギ抗C3抗体(Bethyl Lab.)を用いて検出した。
CDR3長さのスペクトラタイピング
胸腺細胞およびCD4+脾臓細胞からのcDNAは、Cβ-およびVβ8特異的プライマーを用いたPCR増幅に供された。増幅産物は、3つの蛍光標識されたJββプライマー、Jβ1.1、Jβ1.3およびJβ2.4を用いてランオフ反応にかけられ、GeneScanソフトウェア(パーキンエルマー・アプライド・バイオシステムズ、エメイビル、カリフォルニア)[4]により解析された。
RT-PCR
Total RNAをcDNAに逆転写し、PCRで増幅した[23]。生成物を電気泳動で分画し、ナイロン膜(Roche Diagnostics, Mannheim, Germany)に移した。この膜をフルオレセイン末端標識プローブとハイブリダイズさせ、アルカリホスファターゼ(ALP)標識抗フルオレセイン抗体とGene Images CDP-Star 化学発光反応(Amersham Pharmacia Biotech, Piscataway, NJ)により可視化した。プライマーとプローブは以下の通りである。RAG1用の5′-CCAAGCTGCAGACATTCTAGCACTC-3′(フォワード)、5′-CAATGCCTTCACGTCGATCC-3′(リバース)および5′-AACATGCTGCCTTGCCGTCTACCCT-3′(プローブ)[24]。RAG2についての5′-CACATCCACAAGCAGGAAGTAC-3′(フォワード)、5′-GGTTCGACATCTCCTACTAAG-3′(リバース)及び5′-GCAATCTTCTAAAGATTCCTGCTACCT-3′(プローブ)[24]。TdTのための5′-GAACACTCGAAGCCTTCC-3′(フォワード)、5′-CAAGGCATCCGTGAATAGTTG-3′(リバース)および5′-ATTCGTCACCCATTGGCAGAAC-3′(プローブ)。pTα用の5′-CAACTGGTCATGCTTCTCC-3′(フォワード)、5′-TGGCTGTCGAAGATTCCC-3′(リバース)および5′-CCTGCTCTGCCACCCATCACTGCT-3′(プローブ)。
LM-PCR
DNA (1 µg) を T4 ligase (Takara Bio Inc, Shiga, Japan) を用いて 20 µM BW linker にライゲーションした [25].一次PCRは、200ngのライゲーションDNA、BW-1HRプライマー(5′-CCGGGAGATCTGAATTCGTGT-3′)[24]を用いて実施した。TCRAV2の3′フランキング配列に特異的なプライマー(5′-AGATGATACAGACAAAATGTGAGC-3′)および2UのAmpliTaq Gold DNA polymerase(Applied Biosystems, Foster City, CA)である。最初のPCR産物(1/100に希釈)1μl、BW-1HR、およびTCRAV2の3′フランキング配列に特異的なネスト化プライマー(5′-TATTGGATGCTAACAAGTGCTTTC-3′)を用いて第2のPCRが行われた。増幅されたDNAを膜に移し、TCRAV2に特異的なフルオレセイン末端標識プローブ(5′-TAACATAAGAATGCACCGCTTACC-3′)およびALP標識抗フルオレセイン抗体を用いて可視化した。コントロールTCRAC領域のプライマーは、5′-CAGAACCCAGAACCTGCTGTG-3′および5′-ACGTGGCATCACAGGGAA-3′を用いて増幅された。TCRA遺伝子セグメントの命名法は、ImMunoGeneTics(IMGT)データベース(http://imgt.cines.fr)に従った。
抗原クロスプレゼンテーション
OVA反応性CD8+ T細胞は、MACSビーズ(Miltenyi Biotec)を用いてDO 11.10マウスの脾臓から分離した。CD11c+ DC (4×105/well) をMACS beads (Miltenyi Biotec) を用いて分離し、1 mg/ml OVAと3時間インキュベートした後、DO11.10 CD8+ T (KJ1-26+CD8+) 細胞 (2×105/well) と24時間共培養してDO11.10 CD8+ T細胞のCD69の発現を検討した。培養上清中のIL-2およびIFNγをELISA法(Biosource, Camarillo, CA)により測定した。
自己抗体の有無は各免疫の2日後に、タンパク尿とIFNγ+CD8+T細胞は最終免疫の9日後に調査した。
統計解析
統計解析はスチューデントのt検定で行い、データは平均値±SDで表した。
図S1.
自己抗体の誘導は、T細胞への抗原の正しい提示に依存する。(A)BALB/c マウスに 25μg の SEB または PBS を 5 日ごとに i.p. で繰り返し注射し,最終免疫の 9 日後に得られた選別 Vβ8+CD4+splenocyte をプレート結合 2μg/ml 抗 CD3(145-2C11; Cederlane, Ontario, Canada)および 5μg/ml 抗 CD28(37.51; BD PharMingen)抗体で24時間刺激した。培養上清はIL-2を測定した(平均±SD、5マウス/グループ)、または細胞をカルボキシフルオレセインジアセテートスクシンイミジルエステル(CFSE; Molecular Probes)で標識し、さらに72時間培養した後にフローサイトメトリーで測定した。(B) RFの誘導には正しい抗原提示が必要である。B10.D2 および BALB/c マウス(SEB の提示が効率的)および C57BL/6 (B6)マウス(SEBの提示が非効率的)に SEB を 8 回免疫した後の RF の誘導。
doi:10.1371/journal.pone.0008382.s001
(1.17 MB TIF)
図S2.
抗原を繰り返し免疫した場合の自己抗体の生成。(A)8週齢のBALB/cマウスに500μgのOVAを5日ごとにi.p.注射し、それぞれの免疫の2日後に血清RF、抗Sm、抗dsDNA抗体(上)および血清IgG、抗OVA抗体(下)をELISAで定量した。任意の単位(AU)1.0は、MRL/lprマウスの血清における同等の力価である。血清IgGはELISA法(Bethyl Laboratories)で定量し、抗OVA抗体はマウス抗OVAモノクローナル抗体(OVA-14;Sigma)をレファレンスとして用いて定量した。(B)BALB/cマウスに100μgのKLHを5日ごとにi.p.免疫し、免疫2日後に血清中のRFと抗Sm抗体をELISA法で測定した(AU 1.0 = MRL/lprマウスの血清中に検出された同等物)。
doi:10.1371/journal.pone.0008382.s002
(1.00 MB TIF)
図S3.
CD8+T細胞欠損マウスにおける自己抗体の誘導 β2m欠損マウスに500μgのOVAをi.p.注射で5日おきに免疫し、IgG-RF、抗dsDNA抗体、タンパク尿を測定した。
doi:10.1371/journal.pone.0008382.s003
(0.69 MB TIF)
図S4.
OVA免疫BALB/cマウスのV(D)Jリコンビナーゼ複合体の発現と病理組織学的所見。(A) RT-PCRを用いて検出した、OVAで12回免疫した後のV(D)Jリコンビナーゼ複合体の発現(左上)。OVAで12回免疫したrag1/gfpノックインマウスのCD4+T細胞におけるGFP+細胞(左下)。PBS-およびOVAで免疫したマウスの脾臓の外観と重量および代表的な低倍率図(右、平均±SD、9マウス/群)。OVAで免疫したマウスでは、顕著な胚中心を持つリンパ濾胞の拡大が見られた(H&E染色、バー=200μm;原倍率×20)。(B)OVAで12倍免疫したマウスの代表的な腎臓および腎外組織病理学。腎臓のワイヤーループ状の巨大な膜性糸球体腎炎(左上)(PAS染色、バー=20μm、原倍率400倍)、胆管周囲の形質細胞浸潤(中上)(バー=20μm、原倍率400倍)、脾臓の白色パルプにおけるリンパ濾胞の拡大(右上)(バー=200μm。40倍)、甲状腺への単核球の局所浸潤(左下)(bar = 50 µm、原倍率100倍)、耳介皮下組織への炎症細胞のびまん性浸潤(右上)(bar = 50 µm、原倍率200倍)などがある。
doi:10.1371/journal.pone.0008382.s004
(6.01 MB TIF)
図S5.
細胞移植後のレシピエントマウスにおけるIFNγ産生CD8+ T細胞のde novo生成。細胞移植の2週間後にレシピエントマウスのCD8+ T集団内のIFNγ+細胞の割合を調べた(平均±SD、5マウス/グループ)。
doi:10.1371/journal.pone.0008382.s005
(0.73 MB TIF)
図S6.
CD4+またはCD8+T細胞の移入による、抗ds DNA抗体または組織傷害を誘発する能力のそれぞれへの移入。OVA免疫マウスからナイーブBALB/cマウスへの細胞の養子移入、OVAの1×ブースター注射(500μg、移入後24時間)あり、またはなし。2週間後に自己抗体と蛋白尿を測定。
doi:10.1371/journal.pone.0008382.s006
(0.70 MB TIF)
図S7.
T細胞の抗原特異的活性化とDC上のMHCクラスIの発現。(A) 脾臓細胞を1mg/mlのOVAとともに、またはOVAなしで24時間培養し、CD4+ TまたはCD8+ T細胞上のCD69の発現をフローサイトメトリーにより調べた。(B)PBS-またはOVA-免疫マウスからのDC(PBS DCまたはOVA DC)を、クロロキン(CQ)(20μg/ml)の存在下または非存在下で2時間、OVA(1mg/ml)で3時間インキュベートした。OVA-および/またはCQ-パルスDCを、ビオチン結合抗H-2kd抗体(SF1-1.1;BD PharMingen)およびPE結合ストレプトアビジン(BioLegend)を用いて染色した。
doi:10.1371/journal.pone.0008382.s007
(1.62 MB TIF)
図S8.
自己免疫組織傷害を誘発するためのCD4+ T細胞ヘルプの必要性。OVAによる6×、9×、12×免疫の24時間前に、200μg抗CD4抗体(Ab)(GK1.5;BioLegend)で処理することにより、マウスからCD4+ T細胞を枯渇させた。対照マウスには、200μgのラットIgG(CALTAG Lab.)を注射した。(A) 抗CD4 Abによる3回目の処理の9日後に、CD4+ T細胞が脾臓で5.56±2.30%、末梢血単核細胞(PBMC)で3.42±1.02%まで枯渇したことを示す代表的なフローサイトメトリープロットである。(B)マウスに抗CD4抗体を添加した、または添加せずにOVAで12×免疫し、CD8+ T集団内のIFNγ+細胞数(左上と左下)(平均±SD、5マウス/群)とタンパク尿(右下)を評価した。
doi:10.1371/journal.pone.0008382.s008
(2.02 MB TIF)
図S9.
自己抗体誘導CD4+ T細胞の自己免疫組織傷害への要求に関する研究。BALB/cマウスがOVAで少なくとも10×免疫されるまで、OVA特異的成熟IFNγ+CD8+T細胞または自己免疫組織傷害のいずれも観察されなかった。OVAで6×、8×、10×、12×免疫した後、脾臓IFNγ+CD8+ T細胞の割合(左、平均±SD、4または5マウス/群)およびタンパク尿(右)を調べた。
doi:10.1371/journal.pone.0008382.s009
(0.67 MB TIF)
この研究を紹介してくれたSSの恩師、故岡林篤名誉教授に捧げます。近畿大学医学部免疫学教室の宮澤正明教授、熊本大学大学院医学研究科免疫学講座の佐伯信夫教授には、有益な助言、成果の承認、マウスの提供をいただいた。また、β2m欠損マウスを提供していただいた近畿大学辻川幸先生、rag1/gfpノックインマウスを提供していただいた熊本大学大学院医学研究科五十嵐英也先生に感謝する。また、rag1/gfpノックインマウス、CDR3スペクトラタイピング、LM-PCRの研究を行った当科大学院生の滝本舞、中島敏恵、有益な議論を行った神戸大学リウマチ内科の橋本明博士、原稿を確認したMarc Lamphier博士に謝意を表する。
実験の構想・設計を行った。SS.実験を実施した。KT YM.データ解析。KT YM SS.論文執筆。KT SS.
この記事が気に入ったらサポートをしてみませんか?
