ウィルスの複製におけるバイオリズムの役割
ウイルスの複製における概日時計経路の役割
概要
生物学的および行動学的プロセスの日周振動は、生物の生理学、特に感染性物質に反応する免疫系の機能を駆動する概日時計回路によって制御されている。概日リズムは、薬理学的薬剤の薬物動態と薬力学、およびワクチン誘発性免疫反応の両方に影響を与えることが知られている。ウイルス増殖の制御において概日リズム経路が果たす役割をより良く理解することは、これらの疾患の臨床管理に影響を与えるであろう。本総説は、さまざまなウイルス病原体と体内時計の相互作用に関する実験的および臨床的証拠をまとめ、ウイルス-宿主生物相互作用における体内時計の役割に関する研究を継続することの重要性を強調するものである。
はじめに
ほぼすべての生物は時刻を認識し、24時間周期の内因性概日時計によって対応している。この時計は事実上すべての組織に存在し、階層的に組織化されている。脳の視床下部の視交叉上核(SCN)にある中枢ペースメーカーが光信号を感知して統合し、外界の昼夜サイクルと時刻を合わせ、神経信号とホルモン信号を与えて末梢組織の時計を同期させる[1]。細胞レベルでは、分子時計は、遺伝子転写、タンパク質翻訳、細胞内シグナル伝達、代謝、組織特異的機能などを含む幅広い細胞機能において概日振動を作動させ維持している[2]。感染症やワクチン接種に対する宿主の自然免疫反応や適応免疫反応など、私たちの生理機能の多くの側面で概日リズムが見られます[3]。
哺乳類では、分子時計は転写因子と抑制因子のネットワークによって促進され、日々のリズムを刻む遺伝子発現を駆動している。概日リズム遺伝子の発現は、転写活性化因子CLOCK (circadian locomotor output cycles kaput) とBMAL1 (brain and muscle ARNT-like 1) がE-boxモチーフに結合し、CLOCK/BMAL1依存性の転写を抑制する抑制タンパク質period (PER1-3) とcryptochrome (CRY1-2) を発現駆動する転写-翻訳フィードバックループ (TTFL) により生み出されています。転写抑制因子REV-ERB α/β (reverse erythroblastosis virus alpha and beta) と活性化因子RORα (retinoic acid-related [RAR] orphan receptor-alpha) は、時計機構を微調整するための追加のフィードバックループを提供している[2]。最近の研究では、mRNAとタンパク質のリズミカルな発現の間に断絶があることが報告されており[4, 5]、複数の細胞機能の概日制御におけるタンパク質活性を規定する転写後および翻訳後経路の役割が強調されている(図1)。過去5年間、いくつかの研究により、概日リズム経路が、ウイルスの複製に不可欠な無数の宿主因子を制御することにより、ウイルス感染に影響を与える役割があることが示されている[6, 7]。

宿主細胞の概日リズムとウイルス感染。脳の中心部にあるマスタークロックは、睡眠-覚醒、絶食-摂食のサイクルを地球の自転と一致させている。概日時計は全身の組織に存在し、リズミカルな環境変化を予測するタイムキーパーのネットワークを構成している。細胞は自律的に動作する内因性の分子時計を持っており、これによって時間を把握することができる。哺乳類では、分子時計はいくつかの転写-翻訳フィードバックループによって組織化されている。リズミカルなmRNAとタンパク質の間の断絶は、ウイルス複製に不可欠な複数の細胞プロセスの概日制御において、タンパク質活性を規定する転写後経路と翻訳後経路の役割を浮き彫りにしている。BioRender.comで作成されました。
ウイルスは、宿主の資源に依存して複製・増殖する偏性寄生生物である。典型的なウイルスのライフサイクルは、ウイルス粒子が宿主の因子(通常は標的細胞の表面に発現する「ウイルス受容体」と呼ばれる)と結合することから始まる[8]。ウイルス粒子が細胞内に侵入し、ウイルスカプシドが分解されると、ウイルスゲノム(RNAまたはDNA)が細胞内に放出され、宿主の転写および翻訳機構を利用して複製サイクルが開始される(図2)。ウイルスの複製が宿主に絶対的に依存していることを考えると、ウイルスはリズムのある細胞環境を予測し、概日リズムが人間の生理機能にもたらす予測可能性を利用するように適応してきたと考えることができる。このことが進化的に有利に働くかどうかは、ウイルスの集団レベルでの存続戦略にかかっていると思われる。例えば、A型インフルエンザのような「ヒット・アンド・ラン」型のウイルスは、短い複製サイクルによって、粘膜表面で新しいウイルスを作り出し、その後に感染させるのが最も効果的である。一方、ヘルペスウイルスやB型肝炎ウイルスに見られるような「生涯続く」複製戦略では、宿主の免疫反応を回避したり弱めたりしながら、感染細胞のリザーバーを維持する必要がある。このような持続的なウイルスに対しては、ウイルス遺伝子の発現を概日リズムと連動させることが一つの選択肢となる。
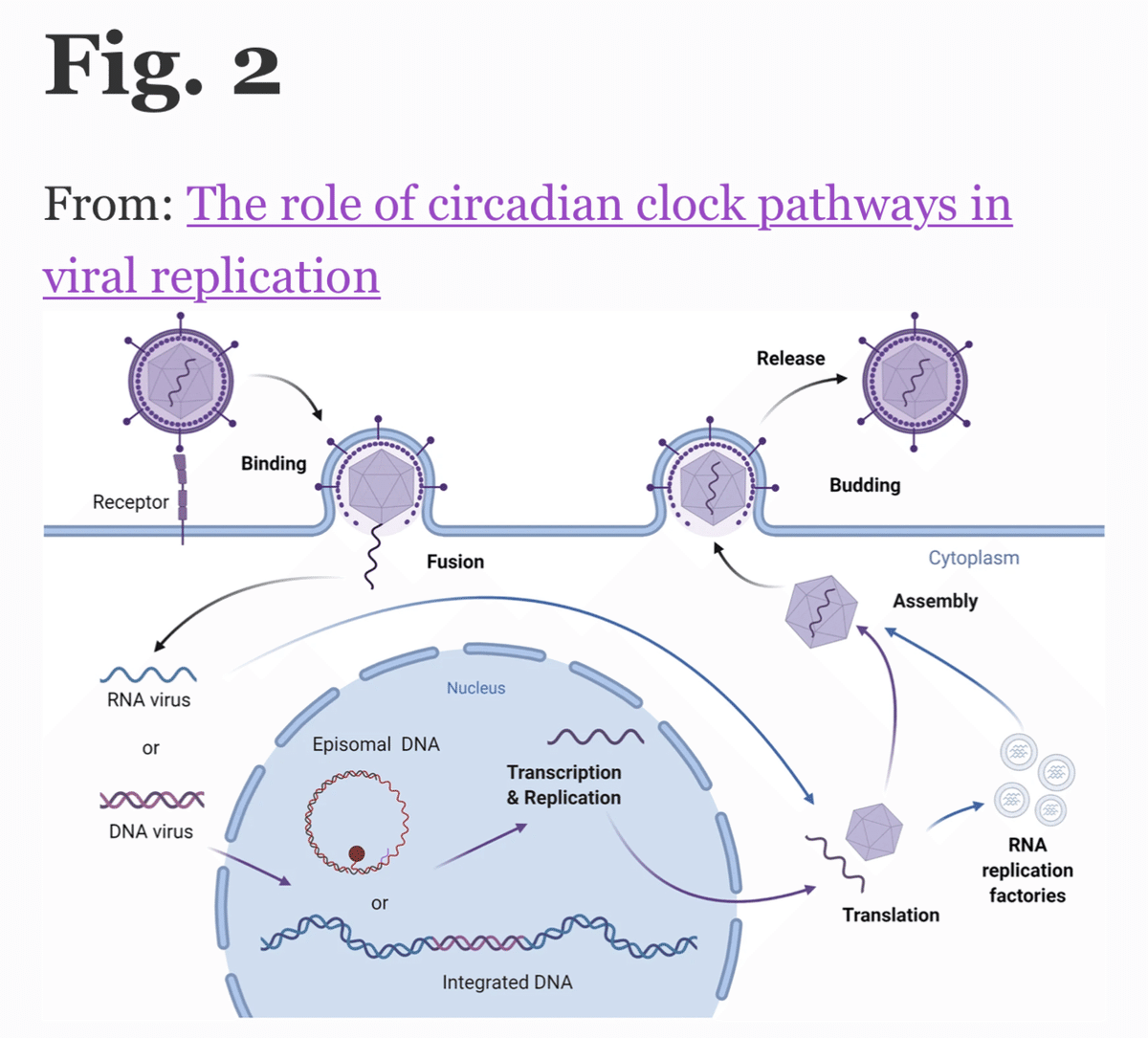
ウイルスの複製ライフサイクル:ウイルスはRNAまたはDNAの遺伝情報をタンパク質の被膜またはカプシドに包み、これらの粒子は細胞表面の受容体と結合し、カプシドの被覆を解除して遺伝物質の放出を促す粒子の内部化を可能にする。RNAウイルスは、細胞質内に「複製工場」を生成し、ウイルスの翻訳と新しい粒子の組み立てを促進させる。DNAウイルスの大部分は核内で複製され、ウイルスタンパク質の翻訳とゲノムの複製の後、新しいウイルス粒子が組み立てられ、放出されてライフサイクルを完了する。BioRender.comで作成されました。
細菌感染に対する自然免疫の制御における概日時計の影響は、最近になってウイルスに対する適応免疫に影響を与えることが報告され、この分野については他の文献で広くレビューされている[9,10,11,12,13,14,15,16]。ここでは、様々な組織部位におけるウイルスと体内時計の相互作用を研究した最近の報告を要約し、今後の研究の鍵となる領域について議論する。
中枢神経系と表皮に感染するウイルス
単純ヘルペスウイルス(HSV)は、世界的に流行している性感染症の病原体である。HSV-1は冷え症の原因となり、HSV-2は性器ヘルペスのほとんどの症例を引き起こす。Edgarらは、BMAL1ノックアウトマウスにおいて、Murid Herpesvirus-4 (MuHV-4) とHSV-1の複製が著しく増強されることを観察した[17]。野生型動物では、安静期の初めにMuHV-4を接種した場合、活動期の初めに接種した場合と比較して、高いウイルス量となった。また,同じ研究で,MuHV-4感染により,感染時期に関係なくBMAL1の発現が誘導されることが示され,ヘルペスウイルスが宿主の細胞時計に影響を与え,あるいは上書きしている可能性が示唆された [17].興味深いことに,HSV-1がCD4+およびCD8+T細胞枯渇マウスの視交叉上核に感染することが報告されており,HSVが概日時計を擾乱する潜在的なメカニズムを提供している [18].KalamvokiとRoizmanは、HSVがコードするタンパク質ICP0がCLOCK:BMAL1ヒストンアセチルトランスフェラーゼ複合体と相互作用し、クロックのサイレンシングやクロック変異体の発現がウイルスの複製を減少させることを示し[19、20]、さらにヘルペスウイルスと概日時計経路との相互作用を裏付ける証拠を示した。Matsuzawaらは、HSV-2感染症が活動期に比べ休止期に感染したマウスでは重症化しないこと、HSV-2侵入受容体Nectin1(Pvrl1)の発現がリズミカルで、そのプロモーター領域へのCLOCK結合により制御されることを示した[21]。興味深いことに、同じ研究で、HSV-2感染を防ぐのに必要なアシクロビルの用量は、活動期には安静期に比べて4倍も多いことが示された[21]。
呼吸器感染症
ヒトの肺疾患は、症状の重症度や呼吸機能にしばしば概日変化を示し、BMAL1が呼吸器系の炎症を制御していることが実証されています[22]。A型インフルエンザウイルス(IAV)は呼吸器系の死亡・罹患の主要原因であり、IAV感染における概日経路の役割が検討され[23, 24]、マウスでBMAL1を喪失すると喘息様の気道変化が大きくなり、ウイルス性の急性気管支炎が悪化すると報告されました。さらに、マウスの活動期前に感染させた場合、安静期に比べて生存率が高くなった。Senguptaらは、異なる時点で感染マウスをサンプリングしても、ウイルス量に差は見られなかった。活動期の開始時に感染すると、ウイルス量とは無関係に肺の炎症が増加したことから、インフルエンザ感染後のより深刻な結果は、宿主寛容と免疫活性化経路の時間帯に依存した制御によってもたらされることが示唆された。最近の研究では、新生児期の高酸素症が、マウスにおけるIAVからの概日リズムによる防御を消失させることが報告されている[25]。肺胞2型(AT2)細胞におけるBMAL1の欠失は、高酸素曝露した動物で観察されたIAV関連死亡率の増加を再現し、肺胞2型細胞における時計が、肺への早世曝露の長期的影響を媒介する役割を示すものであった。
現在では、免疫系は概日時計によってゲートされていることが広く認識されており [26]、最近の報告では、英国バイオバンクの30万人以上の参加者において、複数の免疫パラメータに有意な日中の変動が見られ、自然免疫反応と適応免疫反応の日周性が強調されています[27]。Phillipsらは、ヒトの参加者において、午前中のワクチン接種がA型肝炎ワクチンとインフルエンザワクチンの両方に対してより大きな抗体反応を誘発したことを報告した[28]。その後、高齢者における年1回のインフルエンザワクチン接種に対する抗体反応に対する時間帯の影響を調べた大規模な無作為化試験では、午前中の接種(午前9~11時)は午後の接種(午後3~5時)に比べてウイルス特異的抗体反応が増加することが示されました[29]。これらの知見は,ワクチン接種の時間帯を変更することが,ワクチン効果を高め,より高い予防効果を得るための簡単で実用的な手段を提供する可能性を示唆している.別のインフルエンザワクチン接種研究では、ワクチン接種よりもむしろ試料採取の時間が抗体反応により大きな影響を与えたと報告された[30]。
COVID-19の原因物質である重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)は、現在までに数百万人の人々に影響を及ぼしている。学際的なアプローチと共同作業により、COVID-19の大流行に立ち向かうための新しい治療法やワクチンの開発がかつてないスピードで進んでいます。SARS-CoV-2ウイルスタンパク質のインタラクトームのマッピングにより、66の薬物投与可能な宿主因子が同定され[31]、これらの宿主遺伝子の30%がマウス肝臓で律動していることから[32]、SARS-CoV-2複製の概日制御が可能であり、クロノセラピーがCOVID-19治療に有用であることが示された[32, 33]。McNaughtonらは、鼻咽頭スワブサンプルの30,000以上のポリメラーゼ連鎖反応(PCR)テストを調査し、24時間にわたる陽性結果の頻度に2倍の変動があり、陽性のピークは午後早い時間(午後2時頃)であることを観察した[34]。この観察を確固たるものにするには、異なる時間帯のウイルスRNAをモニターする他の研究からの証拠が必要であるが、これらの診断アッセイは感染性ウイルスではなくSARS-CoV-2 RNAを測定することを忘れないことが重要であり[35]、今後の研究では感染率への影響を解釈するために上気道における感染性ウイルスの概日依存性を評価する必要がある。
最近、Zhuangらは、SARS-CoV-2感染に対する肺上皮細胞の感受性を調節するBMAL1の役割を報告した[36]。この研究では、BMAL1 のサイレンシングにより、ウイルス受容体であるアンジオテンシン変換酵素 2 (ACE2) の発現が減少し、肺上皮細胞へのウイルスの侵入が減少した。しかし、SARS-CoV-2の侵入に関与する因子や機構はまだ特定されておらず[37,38,39]、BMAL1によって制御されている宿主経路は広範に知られているので、ACE2以外にも概日依存または非依存の経路がSARS-CoV-2の侵入に貢献していると思われる。さらにこの研究では、BMAL1のサイレンシングや薬理学的阻害が、幅広い抗ウイルス活性を持つインターフェロン刺激遺伝子(ISG)の転写を誘導することが示された[40]。また、別の研究により、マウス皮膚モデルにおけるI型IFN応答の薬理学的活性化後のISG転写における時間的日差も示された[41]。末梢組織におけるベースラインのIFN発現とISGタンパク質レベルが概日リズムを示すかどうかは、まだ確立されていない。宿主のI/III型IFN反応の大きさが、細胞がウイルスに遭遇する時間帯によって異なるのか、またそれが複製や病気の進行に影響を与えるのか、さらなる研究が必要である。
SARS-CoV-2は主に上部および下部気道に感染するが、いくつかの証拠から、腸の上皮細胞内でウイルスが複製されることが証明されている[38, 42, 43].全身および局所レベルでの免疫機能および体内時計の調節における腸内細菌叢の役割 [44,45,46] および SARS-CoV-2 感染が腸内細菌叢に障害を与えることを考えると [47] 、特に高齢者および免疫不全患者において、個人に合わせた栄養および補給による腸内細菌叢の多様性の改善が、疾患の重症度を下げるために有効である可能性はもっともらしいと言えるでしょう。
SARS-CoV-2に対するワクチン開発は、かつてないスピードで進み、いくつかのワクチンが承認され、新たな感染の発生を遅らせ、病気の重症度を減少させている [48, 49]。2700人以上の医療従事者を対象とした最近の観察研究では、mRNAまたはアデノウイルスベースのワクチンを接種した被験者において、午前中と比較して午後に抗スパイク抗体レベルが上昇することが示されました[50]。これは、不活化SARS-CoV-2ワクチンを接種した医療従事者の小規模コホート(n = 66)の独立した報告とは対照的で、午前中に接種した参加者で抗スパイク抗体の増加を示した [51]。これら2つのCOVID-19ワクチン研究の違いは、ZhangらがSARS-CoV-2コード化タンパク質の範囲に対して多型応答を誘導すると思われる不活化全ウイルス免疫原を研究した、異なるワクチン製剤を反映していると考えられる。IAVおよびSARS-CoV-2ワクチンに対する抗体反応に対する投与時間の影響を比較する場合、研究対象のコホート、特に免疫状態に関して考慮する必要がある。インフルエンザワクチンに対する反応は記憶反応の刺激を伴うが、2021年初めに接種した医療従事者のコホートでは血清陰性の参加者が含まれていたであろう。ワクチン反応に影響を与えることが知られている参加者の睡眠とシフト勤務のパターン [52,53,54] が得られなかったという、これらのワクチン研究の限界を認識することは重要である。さらに、どちらのコホートも小児や高齢者、免疫不全者などのハイリスクグループを含んでいない。医療従事者を対象とした最近の研究では、交代勤務を行う参加者は、交代勤務を行わない参加者と比較して、COVID-19検査陽性と関連することが示されたことは注目に値する[55]。自然免疫およびワクチンによるSARS-CoV-2免疫の概日リズムの調節を評価するために、さらなる研究が必要である。
肝移植性感染症
B型肝炎ウイルス(HBV)は、世界で2億7千万人以上が慢性的に感染しており、肝硬変や肝細胞がん(HCC)の主要な原因となる世界的に重要な病原体である[56]。現在の治療法はウイルスの複製を抑えるだけで、肝細胞にウイルスDNAが残存しているため、治癒は望めない。肝臓の遺伝子の約20%は概日パターンで発現していることから[57]、ウイルスは肝臓の代謝のリズムの変化に対応し、持続するように進化してきたことが示唆されている。最近の研究では、HBVの侵入に不可欠なウイルス受容体(タウロコール酸ナトリウム共輸送ポリペプチド-NTCP)が、同期したヒト肝細胞で概日パターンを示すことが報告された。重要なことは、BMAL1がウイルスゲノムに直接結合することによってHBVの転写を活性化することである。REV-ERBリガンドを用いたBMAL1の薬理学的阻害は、ヒト肝キメラマウスモデルにおいてin vitroおよびin vivoでHBV転写とウイルス抗原の産生を抑制した[58]。興味深いことに、複数のE-boxモチーフがヘパドナウイルス科のメンバー間で保存されており、この小型DNAウイルスのファミリーを制御する概日経路の役割が進化的に保存されていることと矛盾しない。
概日制御の下にあるプロセスの幅広さを考えると、ウイルスは概日時計を標的とすることで、複製に有利な細胞環境を効率的に誘導することができるだろう。初期の研究では、HBV制御Xタンパク質(HBx)の過剰発現により、中核的な概日遺伝子の発現が乱されることが報告されている[59]。さらに、B型慢性肝炎の肝臓では、非感染者と比較して、いくつかの中核的な時計遺伝子の転写物が摂動していた(BMAL1の減少、REV-ERBの増加)[58]。いくつかの研究がHCCと概日リズムの乱れとの関連を報告していることから [60, 61]、HBV特異的な時計の乱れとその病原性の因果関係を推測することは魅力的であり、さらなる研究が必要である。
HBVとは対照的に、HCVはRNAウイルスであり、ヒトの肝細胞の細胞質で複製されるため、肝時計との相互作用はHBVとは異なることになる。肝移植を受けた末期肝不全のHCV患者における興味深い臨床観察によると、手術が午前中に行われた場合は午後に比べてウイルスのリバウンドが速く、HCV複製の時間依存性が示唆されている[62]。さらに、BMAL1とREV-ERBαが、肝細胞へのウイルス粒子の侵入やRNAゲノムの複製など、HCVのライフサイクルのいくつかのステップに影響を与えることが報告された。CRISPRノックアウトによるBMAL1の欠失、合成アゴニストによるREV-ERBの過剰発現または活性化は、HCVと、複製に同じ脂質シグナル経路を共有する関連フラビウイルスであるデングとジカの複製を阻害した[63].Benegiamoらは、HCVコアタンパク質の発現が、in vitroモデルにおいてPER2およびCRY2タンパク質レベルを低下させることを示した[64]。肝臓における概日経路の擾乱は肝疾患に寄与する可能性があるため[65]、HCVによる概日障害の結論には、複製ウイルスとin vivoモデルを用いたさらなる研究が必要であろう。
免疫系に感染するウイルス
ヒト免疫不全ウイルス1型(HIV-1)は、治癒療法もワクチンもない、生命を脅かす病原体である。抑制的な抗レトロウイルス療法(ART)を受けているHIV感染者では、ウイルスゲノムは、長期間の潜伏感染CD4+ T細胞に残存している[66]。ART中のHIV感染者における末梢のウイルスRNAレベルとサンプリングの時間帯との関連が示され、BMAL1の発現は、スプライシングされていないウイルスRNAのレベルの上昇と関連していた[67, 68]。同じ研究で、BMAL1結合E-boxモチーフがウイルスゲノムのロングターミナルリピート(LTR)に同定され、BMAL1とCLOCKの異所性共発現はLTR活性を高め、この表現型はE-boxが変異したときに失われた[67]。別の研究では、転写抑制因子REV-ERBの遺伝的サイレンシングがHIV-LTR活性を増加させ、BMAL1を抑制するREV-ERBの薬理学的活性化が、初代CD4+T細胞およびマクロファージにおけるウイルス複製を減少させることが実証された[69]。興味深いことに,HIV-1 LTRのモチーフ分析により,多様なHIVサブタイプにおいて,RORE(ROR response element)やグルココルチコイド応答要素を含む追加の概日リズム制御要素が発見された.これらの時計モチーフのいくつかは、HIV-1転写を駆動する他の宿主因子の結合部位と重なっていることから、時計成分が他の宿主転写因子に代わって「シフトワーク」を行い、HIVのリズム転写を駆動しているのではないかと推測される。一方、HIVにコードされた遺伝子であるウイルスタンパク質転写活性化因子(Tat)は、N-methyl-d-aspartate受容体経路を通じて、臨床的に適切な濃度でin vitroおよびin vivoで概日リズムをリセットすることが示されている[70]。Tatタンパク質が概日リズムの調節に果たす役割は、誘導性Tatトランスジェニックマウス系でさらに実証され、コントロールマウスと比較して概日方向の車輪走行と運動活性の低下が観察された[71]。
結論と今後の方向性
すべてのウイルスは、新しい粒子の組み立てに必要なタンパク質を合成するために、宿主細胞の翻訳機構を利用する必要があります。生理的な条件下では、細胞のプロテオームは哺乳類ラパマイシン標的複合体(mTORC)によって調整され、翻訳後修飾を受けてタンパク質合成と分解のバランスをとり、恒常性を維持する[5]。BMAL1、PER、CRYがmTORCの活性を調節し[72,73]、それらの遺伝子破壊がタンパク質のホメオスタシスを阻害するという最近の報告は、プロテアソーム活性とATPやアミノ酸などの生合成資源のリズム的発現におけるこの経路の役割を強調するものである[76,77,78,79,80]。多くのウイルスが mTORC シグナルを阻害して、ウイルスのタンパク質合成を促進・維持することは興味深い [81] が、感染時の mTORC 活性とストレス応答における内因性振動の影響については、まだ調査されていない。
概日性の因子とタイミングは、生活のあらゆる側面を調節することが示されており、これがウイルス感染にも当てはまることは当然である。これまでに研究されたほとんどすべてのウイルスの複製には、DNAベースかRNAベースかにかかわらず、また急性感染症か慢性感染症かにかかわらず、時間依存性があることが明らかになってきており、感染に対する概日性の影響はどこにでもあることが示唆されている。薬剤感受性に見られる日内変動は、抗ウイルス剤の投与を最適化するために「クロノセラピー」的アプローチを適用する機会を示唆している。同様に、抗ウイルス抗体反応に及ぼす時間帯の影響をモニタリングすることで、ワクチンの有効性を簡単に改善できる可能性がある。
以下略
この記事が気に入ったらサポートをしてみませんか?
