
【高校生物】細胞④「タンパク質とはどのような物質で、何に使われているのか?」
~プロローグ~
「科学と芸術はいずれも秩序だった複雑さと関係がある。」ランスロット・L・ホワイト
タンパク質(protein)は、“最も重要なもの”というギリシア語(proteios)が語源となっている。細胞の乾燥重量のほとんどを占めるタンパク質は、細胞を構成する素材であるだけでなく、その機能のほとんどを担っている。有機化学者フィッシャーは、アミノ酸同士をペプチド結合で繋げば、タンパク質に似た物質をつくることができることを発見した。1940年代の終わりから、多くのタンパク質がアミノ酸に分解された。生化学者サンガーは、インスリンを小さな鎖に切って、ペーパー・クロマトグラフィーで分析した。サンガーは、8年かけて、インスリンのアミノ酸の並び順を決定した(インスリンが2つのポリペプチド鎖からなることを明らかにしたのはサンガーである)。サンガーは色々な動物のインスリンの構造を決定し、1958年にノーベル化学賞を受賞した。サンガーは、その22年後、1980年にファージのDNAの塩基配列を決定し、2度目のノーベル化学賞を受賞した。
★テストに出やすいワード
①αヘリックス構造・βシート構造
②サブユニット
③ペプチド結合
④カルボキシ基
⑤アミノ基
要点:アミノ酸はアミノ基とカルボキシ基をもち、ペプチド結合で長くつながることができる。
(1)アミノ酸
● アミノ酸は、1個の炭素原子にアミノ基(-NH2)、カルボキシ基(-COOH)、水素原子、側鎖(Rと表記される)が結合したものである。
*側鎖はアミノ酸の種類により異なる。
*一般的なアミノ酸の定義は「アミノ基とカルボキシ基の両方をもつ有機化合物」。
*以下はアミノ酸のイメージ。アミノ酸の描き方は、問題文の指示(例)に合わせること。

もう少し詳しく描くと
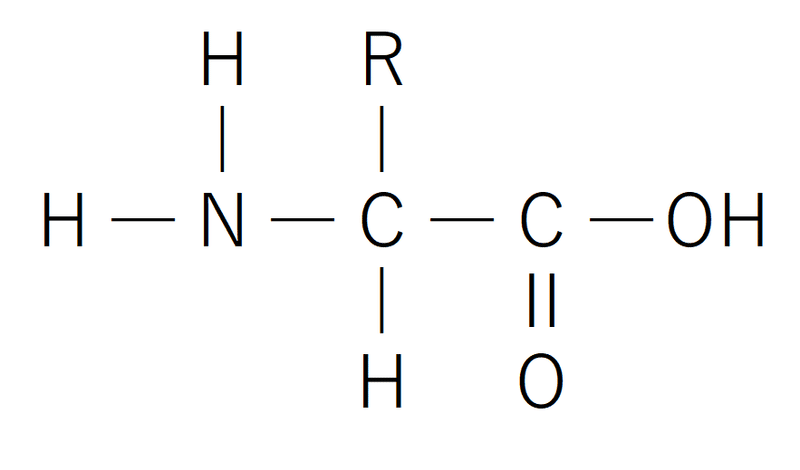
発展:アミノ酸の分類
アミノ酸は、側鎖の化学的な性質によって、(1)非極性アミノ酸と(2)極性アミノ酸に大別される(生命現象は水の中で起こっているので、一般に、中性付近の水と、側鎖との相互作用という観点から分類がなされている)。
(1)非極性アミノ酸:グリシン、アラニン、ロイシン、イソロイシン、バリン、フェニルアラニン、プロリン、メチオニン。いずれも中性アミノ酸。これらのアミノ酸の側鎖は、水分子との水素結合の形成に関与せず、疎水性アミノ酸に分類される。
(2)極性アミノ酸:水分子と水素結合を形成することができる。次の3種に分類される。
①中性アミノ酸:セリン、トレオニン、チロシン、アスパラギン、グルタミン、トリプトファン、システイン。
②酸性(水中で負電荷を帯びる)アミノ酸:アスパラギン酸、グルタミン酸。
③塩基性(水中で正電荷を帯びる)アミノ酸:ヒスチジン、リジン、アルギニン。
なお、極性アミノ酸は一般に親水性アミノ酸に分類されるが、大きな疎水性基をもつチロシンとトリプトファンは水に対する溶解度が低く、疎水性アミノ酸に分類される。

(2)ペプチド結合
● 一方のアミノ酸のカルボキシ基と、他方のアミノ酸のアミノ基の間で、水1分子が取れて結合することができる。この結合をペプチド結合という。また、多数のアミノ酸がペプチド結合して長い鎖状になったものをポリペプチドという。
以下は、アミノ酸①(側鎖R1)とアミノ酸②(側鎖R2)がペプチド結合する時のイメージ。ペプチド結合の形成に伴い、水が生じていることに注意。

雑談:一般に、タンパク質やペプチドなどにおいてアミノ酸残基間を結ぶアミド結合(ーNHーCOー結合)をペプチド結合と呼ぶ。ペプチド結合のCーCOーNHーCの6個の原子はほぼ同一の平面にあり、ふつうは立体障害の少ない安定なトランス型(C=OとNーHが逆方向になる)の配置が好まれる(下図左)。ただし、プロリンの場合はシス型をとることもある(下図右)。高校生はまったく気にする必要はない。

雑談:プロリンは正確にはイミノ酸である(プロリンなど、ーNHーとカルボキシ基をもつ化合物は、習慣的にイミノ酸と呼ばれている)。イミノ酸はアミノ基をもたないが、ふつうプロリンもアミノ酸に含める。

<Q.ポリペプチドとタンパク質ってちがうの?…同じと考えてよい。一般に、何かしらの機能をもったポリペプチドをタンパク質と呼ぶことが多い。>
雑談:「蛋白質」という語は、「卵白のもと」を表している。語源はドイツ語のEiweiss(卵白)の漢字訳であるが、すべての生物体がタンパク質でできていることを考えれば、あまり良い訳ではない。
雑談:有機化学者フィッシャー(化学で学ぶ「フィッシャー投影式」のフィッシャー)は、糖の研究で成果を出した後、タンパク質の研究にフィールド移した。タンパク質の研究についてフィッシャーは次のように述べている。「是こそは宏大な難問題。これに較べると以前の砂糖の研究の如きはただ一場の児戯に等しいのみである。」「しかし辟易してはならない。万難を排し、全力を挙げて、有機化学の精髄を尽くして、これに当らねばならない。」そしてフィッシャーは、ポリペプチドの合成に成功したのである。ちなみに「プリン化合物」はフィッシャーの命名である。また、酵素と基質の関係を錠と鍵の関係のように類推したのも彼である。
要点:タンパク質の構造には四つの階層(一次~四次構造)がある。
(1) 一次構造:アミノ酸の配列順序。
(2) 二次構造:部分的な立体構造(αヘリックス構造・βシート構造)。
*αへリックス構造(αらせん構造)やβシート構造(βジグザグ構造)が二次構造の例(よ~~~く問われる!!)。

*二次構造は、となりあった鎖の間で形成される水素結合によって形成される。
雑談:αヘリックス構造とβシート構造が広く存在するのは、両方とも、ポリペプチド主鎖の(ペプチド結合の所にある)C=OとNーHの間の水素結合によって生じ(下図)、側鎖が基本的に関与していないからである(したがってαヘリックス構造とβシート構造は、様々なアミノ酸配列で形成され得る)。

雑談:αヘリックス構造は毛、爪などに大量に含まれるα-ケラチンで発見された。それから1年もせずに、絹の主成分であるフィブロインでβシート構造が発見された。
雑談:αヘリックス構造は、アミノ酸残基3.6個で1回転するらせん構造であり、主鎖のC=Oが、4残基後のNーHと水素結合を形成している。βシート構造は、鎖間が水素結合を形成することによりシート状になり(βシート構造のそれぞれのポリペプチド鎖は、隣の鎖のペプチド結合との間に水素結合を作る)、しかもそれに、ひだが生じた構造となっている。
雑談:αヘリックス構造やβシート構造は、それをもつタンパク質がDNAと結合する時にも使われている(多くの転写因子は、「DNA結合構造モチーフ」を1つ、または複数もつ。そのようなモチーフはαヘリックス構造やβシート構造を使ってDNAの溝に結合する)。
*DNA結合構造モチーフとは、DNA結合タンパク質の、DNA結合領域におけるDNAとの結合に関与する特定のアミノ酸配列から成る部分のこと。「ヘリックス-ターン-ヘリックス」や、「ジンクフィンガー(Znフィンガー)」など、様々なものが見つかっている。大学内容なので知らなくてよい。
雑談:αヘリックス構造やβシート構造の、「α」、「β」は、タンパク質のX線回折像の分類に由来する。αは折りたたまれた構造を意味し、βは伸びた構造を意味する。
(3) 三次構造:立体構造全体
*1本のポリペプチド鎖がとる三次元的な立体構造を三次構造という。鎖の部分ごとに二次構造が形成されていき、それらが組み合わさって三次構造が形成されることが多い。
*硫黄(S)を含むアミノ酸(システイン)どうしの間でできる結合をSーS結合(ジスルフィド結合)といい、SーS結合は三次構造の形成に重要である。
雑談:S-S結合とは、2つのシステイン残基のSH基が酸化され
ーSH+HSー → ーSーSー
のような反応で共有結合を形成したものをいう。タンパク質中のS-S結合は分子の安定化に役立っている。タンパク質の合成過程で、相対するシステインの間でS-S結合が形成される。
*疎水性のアミノ酸は水を嫌がり、ポリペプチドの内側に入り込む傾向がある。このような疎水結合もタンパク質の立体構造の形成に重要である。
*リボソームによってポリペプチドが合成された後、シャペロンという別のタンパク質によって正常な立体構造に折りたたまれることもある。
雑談:疎水結合とは、厳密には、「分子中に、水との親和性が低い無極性の部分がある場合に、見かけ上、水溶液中で溶媒との境界が小さくなるようにたがいに集合して安定化する現象」のこと。

(4) 四次構造:複数のサブユニットによって形成される立体構造。
*タンパク質によっては複数のサブユニットからなるものがあり、その複数のサブユニットからなるタンパク質全体の立体構造を四次構造という(三次構造をとった複数のポリペプチドがさらに会合して四次構造が形成される)。
*すべてのタンパク質が四次構造をとるわけではない(たとえば、ミオグロビンは三次構造までしかとらないが、ヘモグロビンは4つのサブユニットからなる四次構造をとる)。

● まとめ

問題:以下の文章のうち、タンパク質の二次構造を説明したものはどれか。
①ポリペプチド鎖を構成するアミノ酸の種類と配列順序。
②αヘリックスやβシートなどの部分的な立体構造。
③ポリペプチド鎖全体が示す立体構造。
⓸複数のポリペプチド鎖が結合した構造。
答え:②
● タンパク質は高温や酸などによって水素結合などが切れて正常な立体構造を失う(これを変性[性質が変わる]という)。ふつう変性したタンパク質はそのはたらきを失う(これを失活[活性を失う]という)。
発展:シャペロン
● シャペロン(分子シャペロンともいう)は、タンパク質の正しい立体構造形成(フォールディング)を助けるが、最終的な構造体には組み込まれないタンパク質の総称である。
● すべてのタンパク質が正常な立体構造の形成にシャペロンの助けを必要とするわけではない。自然に正しい立体構造に折りたたまれるタンパク質も多い(たとえば、疎水性のアミノ酸は、水を避け、ポリペプチドの内側に自然に配置される)。
● シャペロンの中には、熱変性によって異常に折れ曲がってしまったポリペプチドを元に戻す働きを持つものもある。そのようなシャペロンは高温で合成が促進される(ピンチになった時やってくるヒーローのようである。なお、そのような高温で合成が誘導されるタンパク質はヒートショックタンパク質と呼ばれる)。
講義動画【シャペロン】
発展:インスリンができるまで
タンパク質は、いろいろな処理を受けてから、機能をもつようになる場合がある。インスリンの例がたまに問われる。流れだけチェックしておけばよい。
(1)インスリンは、はじめ、大きなポリペプチドであるプロインスリンとして合成される。
下図はプロインスリンのイメージ。ピンクの部分は最終的に取り除かれる領域。

(2)プロインスリンは折りたたまれる(SーS結合によって安定化する)。

(3)タンパク質分解酵素により切断される(インスリンの完成)。下図はインスリンのイメージ。

雑談:漫画『GTO』には、ヒトは死んだら「タンパク質のカタマリ」になるというセリフがあるが、生きている時でも生物はタンパク質のカタマリである(水を除けば)。生命現象のほとんどすべてを担っているのはタンパク質であると言ってもよい。
要点:抗体は免疫グロブリンというタンパク質からなる。免疫グロブリンには可変部と定常部がある。
● 体液性免疫にはたらく抗体は、免疫グロブリンとよばれるタンパク質で、H鎖(長いのでヘビー)2本、L鎖(短いのでライト)2本の、計4本のポリペプチド鎖からなる。それぞれの鎖には可変部と定常部がある。
● 可変部とよばれる部分は抗体によってアミノ酸配列が異なっていて、それぞれ特有の立体構造をもつ(可変部の構造によって結合できる抗原が異なる)。
● 抗体は可変部で抗原と特異的に結合する。
● 抗体は描けるようにする(H鎖、L鎖、可変部、定常部を指し示せるように)。

*一般に、可変部は結合する抗原によって異なる。定常部は動物種によって異なる。たとえば、同じウイルスAに対するヒトの抗体とウサギの抗体を考える。両方の抗体で、可変部には共通性がある(どちらもウイルスAに結合する)。しかし、定常部はヒトの抗体とウサギの抗体で異なる。
● 免疫グロブリンは、遺伝子の再編成によって多様性を獲得する(B細胞が成熟する過程で、免疫グロブリン遺伝子の再編成が起こる)。
発展:遺伝子の再編成
遺伝子断片がV、D、Jなどとグループを形成しており、各グループから1つずつ遺伝子断片が選ばれ、残りの遺伝子領域はDNAの切断により捨てられる。これにより持っているDNA断片の種類より多くの種類の遺伝子を作り出すことができる。
この大発見は、利根川進(とねがわすすむ)によるものである。なお、生物基礎では、ほぼすべての体細胞は同じゲノムをもつと習うが、B細胞やT細胞などのリンパ球は、成熟の過程で遺伝子の再編成を行うので、ゲノムがほかの体細胞と異なる。
*下図は遺伝子の再編成のイメージ。まるでマクドナルドでセットを注文するように、組み合わせは膨大になる(何種類かの飲み物、何種類かのバーガー、何種類かのサイドメニューから、それぞれ1つずつを選ぶと、その組み合わせは膨大になる)。

雑談:利根川進は、1987年にノーベル生理学・医学賞を受賞した。その時、選考委員の一人は利根川の研究を「100年に一度の偉大な研究」と評したという。下図は利根川進のノーベル賞受賞理由に取り上げられた総説論文の一部( "Somatic Generation of Antibody Diversity", Nature 302,575-581(1983) S. Tonegawa )。写真は国立科学博物館より。

講義動画【遺伝子の再編成】
問題:免疫グロブリンの遺伝子のうち、H鎖の可変部をコードする部分は3つの領域(V、D、J)から、L鎖の可変部をコードする部分は2つの領域(V、J)からなり、さらにこれらの領域は多数の小領域で構成されている。 可変部をコードする部分では、それぞれの領域において、小領域が1つずつ選択されて連結され、抗体を産生する情報をもつ新たな遺伝子となる。 ある生物で、H鎖のそれぞれの領域が100、10および4種類、L鎖が300および5種類の小領域から構成されているとすると、この生物は、理論上何種類の抗体をつくれるか。ただし、遺伝子の再編成によって、各小領域から1つの断片が選ばれ、連結するものとする。なお、多様な抗体ができるしくみには、遺伝子の再編成のみが関わるとしてよい。
答え:600万種類
H鎖の可変部を決定する遺伝子は100種類、10種類、4種類の断片から1つずつ選ばれるので、
100×10×4=4000種類
この遺伝子が転写、翻訳されてH鎖の可変部のアミノ酸配列(そして立体構造)が決定する。
L鎖も同様に、300×5=1500種類
したがって理論上4000×1500=600万種類の可変部をつくることができる。
発展:モノクローナル抗体
● 単一クローンの抗体産生細胞が分泌する抗体をモノクローナル抗体という。モノクローナル抗体は、ただ一つの抗原決定基だけを認識する。
● ハイブリドーマ(抗体産生細胞とがん細胞を融合させて作る)にモノクローナル抗体をつくらせることができる。
雑談:1975年にケーラーとミルシュタインが、細胞融合法を用いて、抗体産生細胞と骨髄腫細胞を融合させてハイブリドーマをつくることが可能であることを報告した。
雑談:ハイブリドーマは、増殖回数に限りのある細胞と、無限増殖能をもつがん細胞(腫瘍細胞)を融合させることによってつくられる細胞である。ほとんどの場合、骨髄腫由来のがん細胞(腫瘍細胞)と単一の抗体産生細胞の融合によって作られた細胞を指す。
● 永続的に増殖能をもつ骨髄腫細胞と、抗体産生細胞との間で融合細胞を作ると、目的の抗体を産生しつつ無限に増殖するハイブリドーマを作製することが出来る。
*融合を行った後、骨髄腫細胞を選択的に殺す試薬を用いて、融合しなかった骨髄腫細胞を殺す。また、融合しなかった抗体産生細胞は寿命でまもなく死滅する。結果、ハイブリドーマだけを得ることができる。
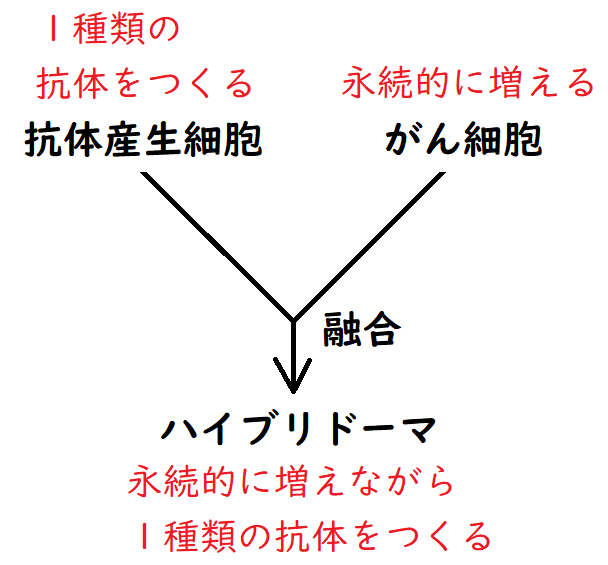
雑談:モノクローナル抗体は、B細胞1個は1種類の抗体しかつくらないという性質を利用して人工的につくられる。①まず、動物に抗原を注射する。②抗体産生細胞(B細胞)の住処である脾臓を切除し、抗体産生細胞を得る。その細胞と、骨髄腫細胞とを融合させることで、ハイブリドーマを得ることができる。
雑談:骨髄腫は、B細胞に由来する細胞の悪性増殖を基本とする疾患の総称である。一般に、骨髄腫細胞は増殖しながら免疫グロブリンを連続産生することができるが、モノクローナル抗体を得るためにハイブリドーマを作製する際は、抗体を産生しない特別な骨髄腫細胞を融合のパートナーとして選ぶ。
雑談:細胞の融合には、ポリエチレングリコールなどが用いられる(細胞浮遊液にポリエチレングリコールを加えて、細胞膜を融合しやすいように変形させる)。2個の細胞を融合させると、はじめ、核を2つもつ細胞ができる。この細胞はやがて有糸分裂に進み、2つの核を分けていた膜は消えて、すべての染色体が1つの核にまとまり、雑種細胞になる。融合に使った細胞の一方が腫瘍細胞のとき、できた雑種細胞はハイブリドーマと呼ばれる。
雑談:現在では研究・臨床応用などに用いられている抗体の大部分はモノクローナル抗体である。この抗体は免疫学の研究だけでなく、生体や細胞に微量しかない物質の検出、同定、精製、生体内での局在を調べるのに有力な手段である(抗体の、特定の物質としか結合しない性質が利用されている)。生物学、医学研究に広く使われているのみならず、がんをはじめ各種の病気の診断、治療、毒素の中和などに幅広く実用化されている。ケーラーとミルシュタインはこの画期的な方法の発明により1984年にノーベル生理学・医学賞を受賞した。
雑談:(ケーラーとミルシュタインによってモノクローナル抗体の作製法が発明される以前、)抗原を動物体に免疫する従来の方法では、得られる抗血清(抗原で刺激[免疫]した動物から採取された血清)は、異なる抗原決定基に対応する多種の抗体産生細胞から産生される抗体の混合物(ポリクローナル抗体)であった。そのため、単一抗原決定基のみに結合する抗体(モノクローナル抗体)を得ることは事実上不可能であった。
雑談:これまでにマウス由来のモノクローナル抗体は比較的容易に作製されているが、ヒト由来のモノクローナル抗体についてはほとんど成功例がない。
雑談:僕の研究室の先輩、同期の方も、モノクローナル抗体を作製なさっていました。発生中の胚の、どこに、注目しているタンパク質があるかを調べるためのツールとするためです。
発展:キメラ抗体
マウスなどの抗体の可変部を、ヒトの抗体の定常部に結合させた抗体をキメラ抗体という。マウスの細胞を用いてモノクローナル抗体を得て、それをそのまま人に投与しても、異種タンパク質として排除されてしまう(マウスの免疫グロブリンは、ヒトにとって異物である)ので、効果的ではない。そこで、抗原結合に関わる可変部をそのままにして、(抗原として認識されやすい)定常部を、ヒトの免疫グロブリンの定常部で置換した抗体(キメラ抗体)が作製されている。

要点:受容体は特定の情報を受け取るタンパク質あり、細胞膜上や細胞内に存在する。
● 受容体は、細胞(細胞膜上や細胞内)に存在し、細胞外の物質をシグナルとして選択的に受容するセンサータンパク質である(たとえるなら、細胞外からやってくるボールのような物質をキャッチするグローブみたいなタンパク質が受容体である。受容体はそれぞれ特有の立体構造をもち、決まった形のボール[シグナル分子]とだけ結合する)。
雑談:細胞表面の受容体だけで、ヒトの全タンパク質の30%を占めるとも言われている。
発展:Gタンパク質
Gタンパク質共役型受容体は、Gタンパク質というタンパク質の助けを借りて機能する。Gタンパク質共役型受容体は、多くのホルモン(アドレナリンなど)や神経伝達物質など、外界からのシグナルへの応答のほとんどを仲介している。
①GDPが結合しているGタンパク質は不活性型である。
②シグナル分子がGタンパク質共役型受容体に結合すると、Gタンパク質共役型受容体はGタンパク質と結合し、Gタンパク質のGDPがGTPに置き換えられる(Gタンパク質共役型受容体は、Gタンパク質に結合しているGDPを遊離させ、代わりにGTPを結合させる)。これによってGタンパク質は活性化される。
*Gタンパク質はスイッチのように機能している。GDPとGTP、どちらが結合するかによって、オフとオンが切り替わる。
③活性化したGタンパク質は、膜面に沿って拡散し、酵素と結合して、活性を変化させる。これがきっかけとなって、細胞応答が導かれる。
*その後(図示していないが)Gタンパク質はGTPを分解し、GDPにする(Gタンパク質はGTPアーゼ活性をもつ。これでスイッチがオフになる)。そうしてGタンパク質は不活性型に戻り、酵素と別れる(①へ戻る)。
下図はイメージ。

雑談:知らなくてよいが、実際はGタンパク質はα、β、γの3種のサブユニットからなる(βサブユニットとγサブユニットは強固に結合し、一体となっている)。Gタンパク質共役型受容体がGタンパク質のGDPをGTPに置き換えると、αサブユニットはβγ複合体から離れる。αサブユニットとβγ複合体は、様々な酵素やイオンチャネルに結合し、下流のシグナル伝達経路を活性化させる(下流のシグナル伝達分子の活性を調節する。たとえばβγ複合体はイオンチャネルに結合し活性を調節する)。
αサブユニットはGTPアーゼ活性を持ち、すぐにGTPを分解する(つまり、このシグナル伝達系には、終結機構が内在していることになる)。
その後、αサブユニットとβγ複合体は再び結合し、休止状態に戻る(GDP結合型のαサブユニットは、βγ複合体に強い親和性をもつ)。下図はイメージ。

雑談:上図のβγ複合体は、一般に、カリウムチャネルを「活性化」し、カルシウムチャネルを「阻害」する(2021年、このことをコラム内で逆に書いている高校教科書があったので、疑問に思い教科書会社にメールしたところ、内容が訂正された)。
雑談:Gタンパク質についての知識問題が出ても、解けなくてよい(ただし、Gタンパク質は、広範なシグナル伝達経路を活性化する、生物学上非常に重要なタンパク質である。視覚、味覚、嗅覚といった感覚受容体もGタンパク質共役型受容体である。Gタンパク質共役型受容体の構造と機能を明らかにしたレフコウィッツとコビルカは、2012年にノーベル化学賞を受賞している)。
雑談:Gタンパク質共役型受容体は、7回膜を貫通する特徴的な構造をしている(下図はイメージ)。

雑談
まだわかっていないこと
● どのようにタンパク質は正しく(しかもすばやく)折りたたまれるのだろうか?シャペロンの研究も進んでいるが、根本的な問題は未解明である。
● どうして生物はタンパク質でできているのだろうか。
● いつ、どのように地球上にタンパク質が生じたのか(隕石からアミノ酸が発見されている)。
● タンパク質の立体構造から、その機能を推定するにはどうすればよいのか?もっと言えば、タンパク質の一次構造からそのその機能を推定するにはどうすればよいのか。
● 抗体はどのようなことに利用できるのか?抗体は非常に高い特異性を持ち、決まった立体構造の物質としか結合しない。たとえば、新型コロナウイルスSARS-CoV-2の構成成分である蛋⽩質を抗体を⽤いて検出することができる。
