直腸がんTNT試験のまとめと雑感 in 2024.4
Ann Oncol. 2016;27:834-42. Polish II試験
Ann Oncol. 2019;30:1298-1303. (長期報告)
Lancet Oncol.2021;22:29-42. RAPIDO試験
Ann Surg. 2023;278:e766-e772. (長期報告)
J Clin Oncol.2022;40:1681-1692. STELLAR試験
Lancet Oncol. 2021;22:702-715. PRODIGE 23試験
J Clin Oncol 2023;41, LBA3504-LBA3504. (長期報告・抄録)
N Engl J Med 2023;389:322-334. PROSPECT試験
Ann Gastroenterol Surg. 2023;7:968-976. ENSEMBLE-1試験
先日外科の先生より直腸がんでTNT (Total Neoadjuvant Therapy)をお願いしたい人がいると言われた。これまでCapecitabine併用のNACRT→Opeはやったことがあるが、まだ本邦で標準治療とされていないTNTは経験が無かったので、主だった論文(上記)に目を通してみることにした。
そもそもだが、日本と海外では直腸がんの標準治療が異なる。
日本の標準治療は切除(±側方郭清)→術後補助であるのに対し、海外はNACRT→切除→術後補助である。NACRTは、肥満患者を多く抱える海外では骨盤内の十分な郭清が困難であることが多く、微小残存病変に由来する再発を減らすことを目的として開発された。一方、日本においてNACRTは主に切除marginが厳しい症例などに縮小を期待して行われるため、その目的が異なる。手術単独で成績が良好な日本であえてTNTを導入する理由が希薄であることが、本邦でTNT開発が進まない理由の一つと言える。
とはいえ海外はNACRT, TNT前提で開発が進んでいるため、日本だけガラパゴス治療を続けては今後海外との共同研究が立ち行かなくなってしまう。そこで日本でもこれまでの臨床成績を考慮しつつ、TNT戦略を取り入れる努力が行われている。
さて、上記文献の内、ENSEMBLE-1のみ単群Phase II試験であり比較試験ではないが日本の試験として重要なので含めてある。それ以外はPhase III試験。以下に簡単にまとめてみた。
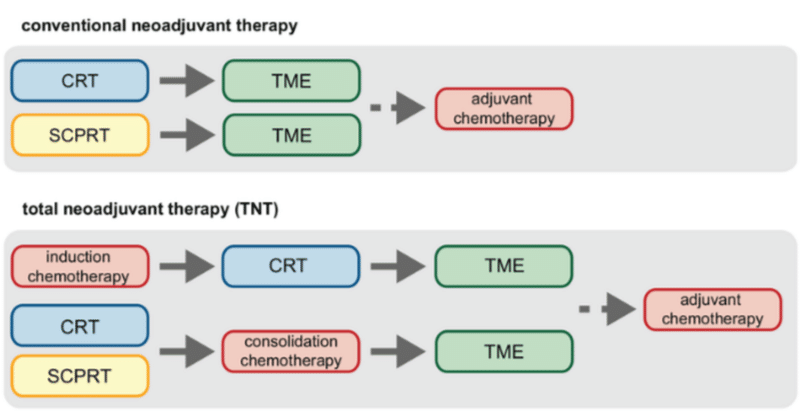
TNTと一口に言ってもそれぞれの試験の目的が異なることに注意が必要。
あえてまとめるならPolish II, RAPIDO, STELLARはいずれも、標準治療に対する短期照射+NACの試験である。短期照射は過去に長期照射との比較で長期予後や合併症に差が無い(ただし局所のpCR割合は低い)可能性が報告され、治療期間・医療経済性などの利点から開発が進められてきた治療法である。CRT~術後補助まで直腸がんの治療期間が非常に長いことが、患者に肉体的・精神的・あるいは経済的負担となっていると考えられているためだ。
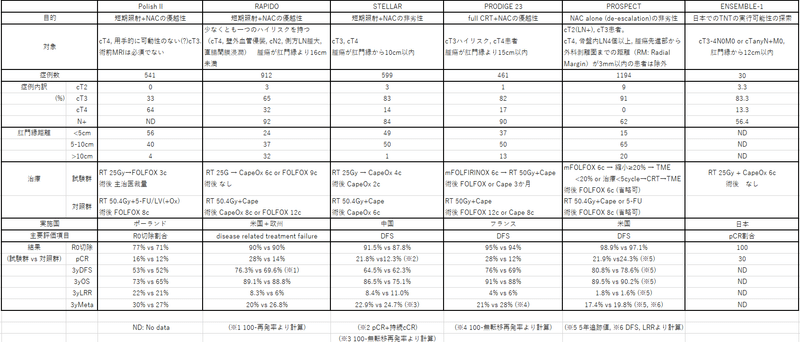
上記3試験は概ね「短期照射で治療効率を上げつつ、術前chemoにより治療強度を保ち遠隔転移再発を防ぎたい」というのが目的。対象にはハイリスクの直腸がん患者も含まれている。いずれの試験も3yOSで有望な結果が出ているが、Polish II試験は試験群の術前FOLFOXが3 cycleしか入らず、Adjuvantもほとんど入っていないことなどから治療強度が足りてない印象で、局所再発も遠隔転移再発もあまり改善していない。pCR割合の改善もRAPIDO, STELLARと比べると弱い。(OSの差も追加報告では消失している) 一方RAPIDO, STELLARはpCR割合が改善、遠隔転移再発率も低下し期待通りの結果を得ている。(なおRAPIDO試験の追加解析ではpCRに至ればCRTでもTNTでも予後は変わらないと報告されている)
これらの試験から読み取れることは、術後chemoを術前に持ってくるTNT戦略は確かにOSを改善させうるということであり、治療強度や継続性も術後に行うより保たれているということである。ただしRTを短期照射にしていることからpCR割合, 局所・遠隔再発率のbenefitがマチマチで、AdjuvantをTNTに変えたことが、どこにどう影響したかが分かりにくくなっている。
そこで次のPRODIGE 23試験では、放射線治療は試験群・対照群共にCape + RT 50Gyとし、試験群にもAdjuvantも設けて両群とも前後6ヶ月のchemo期間を確保したことで、純粋に術前FOLFIRINOXの上乗せ効果を見にいけるデザインとなっている。結果はpCR, 局所・遠隔再発共に成績が改善し、ハイリスク患者にTNT強化戦略は有効であることが示された。OSはまだimmatureであるが、概ねTNT戦略の有効性は確立されたと言っても良いだろう。
その上で行われたPROSPECT試験であるが、こちらは予後の良い症例に対するde-escalation戦略の試験である。TNT戦略を用いればCRTをFOLFOXで代用できるのではというコンセプト。結果的にこの戦略もpositiveとなった。
TNTの有効性が不明瞭な10年以上前にこのコンセプトを組んで臨床試験を行ったグループは先見の明があると思う。日本のENSEMBLE-1試験もこれに続いた形である。海外でのimpactも確保しつつ日本でTNTを導入するならという視点も取り入れて治療内容と対象が設定されている。既にENSEMBLE-2の症例集積は終わっており今後発表が待望される。
さて以上を読んだうえで、現在の日本においてTNT戦略はどうすればいいかという点だが、正直答えが無い。やはり日本の実臨床でTNTを導入するには治療対象・内容・期間、側方郭清(LLND)追加の有無など不明確なことが多くあり、すぐに応用するのは難しいと感じる。ただ個人的にはTNTを導入する一番の価値はW&W (Watch & Wait: 術前治療でclinical CRに至った症例に手術を行なわず経過観察を行うこと。もしがんが消失していれば手術の侵襲を回避でき、患者のQOLに大きく貢献する)ではないかと考えるので、もし外科医がその戦略を考えているのであれば柔軟に対応したい。対象症例やレジメン等のエビデンスは不足しているが、例えば術後のCapeOxを半分術前に持ってくるくらいの対応は実臨床でも検討しうると考えた。(それかPRODIGE 23に準じてmFOLFIRINOXを行うか)
今後ENSEMBLE-2、JCOG 2010, 2207などの結果が出れば具体的な対象でTNTが検討可能となる。今のところ実臨床ではこれまでの結果を参照しつつ、症例別に対応していくしかないだろうか。
以下メモ: 日本で行われている主なTNT関連臨床試験
・ JCOG2010 試験 (Phase II + III 単群検証的試験)
対象: cT2-3N0M0 下部直腸がん, 腫瘍径≤5cm
症例数: 105例予定
試験群: CRT (50.4Gy/28Fr+Cape) → CapOx 4 cycle → W&W or 切除
目的:TNTとW&W戦略の有効性と安全性の検証
主要評価項目:PII部分 : 最終効果判定時の cCR 割合, PIII部分: OS
・ JCOG2207 試験 (Phase III)
対象: cStage III下部直腸がん
症例数: 420例予定
試験群: RT (25Gy/5Fr) + CapOx 6 cycle → TME±LLND
※ 試験群のLLNDは臨床的に側方LN陽性の場合に施行。
対照群: TME+LLND → Adjuvant CapOx 8 cycle
目的:試験群の対照群に対するOSの優越性の検証
主要評価項目:OS
・ ENSEMBLE(-2) 試験 (Phase III)
対象:cT3-4N0 or TanyN+, AV≤12cm 直腸がん
症例数: 608例予定
試験群:RT (25Gy/5Fr) → CAPOXIRI 6 cycle
対照群:RT (25Gy/5Fr) → CapOx 6 cycle
目的:試験群の対照群に対する長期予後改善の検証
(生存期間延長および生存患者の肛門機能とQOLの維持)
主要評価項目:organ preservation-adapted DFS
・ NOMINATE 試験 (Randomized Phase II)
対象: cT3-4Nany, AV≤5cmの直腸がん
症例数: 66例予定
試験群 A: CRT (50.4Gy/28Fr+Cape) + CapOx 6 cycle
試験群 B: CapOx+Bev 3 cycle → CRT → CapOx 3 cycle
※ 共にcCR or near-cCRの場合、NOM (非手術管理)が選択可能
目的:NOMの観点から2つのTNTレジメンから最適な治療を選択する
主要評価項目:pCRまたは2年以上のcCRを達成した患者の割合
・ TEGAFIRI+RTによるTNT試験 (Phase II)
対象:高遠隔転移リスク(T4b, LLN+, EMVI+)直腸がん
症例数:30例予定
試験群 :CRT (50.4Gy/28Fr+TEGAFIRI) → FOLFOX 3 (or CapOx 2) cycle → 手術 →Adjuvant FOLFOX 9 (or CapOx 6) cycle
目的:TEGAFIRI+RT レジメンの安全性と実行可能性の評価
主要評価項目:NAC完了時のAE発生割合
・ VOLTAGE 試験 (Phase I + II) (Clin Cancer Res 2022;28:1136-1146.)
対象:cT3-4N0-2M0, AV≤12cm 直腸がん
症例数:44例
試験群 :CRT (50.4Gy/28Fr+Cape) → Nivo 5 cycle → 手術 →Adjuvant
目的:CRT後にニボルマブと外科的切除を併用した治療の有効性を探索
主要評価項目:pCR割合
この記事が気に入ったらサポートをしてみませんか?
