COVID-19では微小塞栓症に関連して肺血栓塞栓症が想定外に多いのでは? -Radiologyからの報告を元に (4月23日)
(4/27誤字等を訂正)
COVID-19の合併症として、全身の塞栓症、特に肺血栓塞栓(PTE)が結構あるのでは?となってきています。
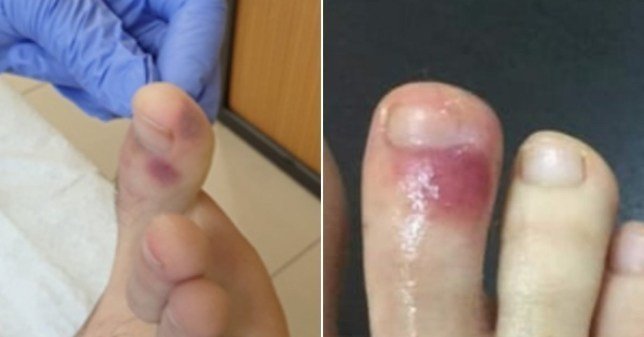
治療を考える上でも、微小血管塞栓は最近話題になってきてい、ここ数日だと足趾の症状が取り上げられています。
Bruises on feet 'could be sign of coronavirus', Spanish doctors claim | Metro News
https://metro.co.uk/2020/04/15/bruises-feet-sign-coronavirus-12557291/?ITO=squid
(下記figureはリンク先より引用)
ちょっと、議論の進展が速すぎて、付いて行けてないのですが、下記、勉強用のメモ
Radiologyからの報告
4月23日のRadiology誌でCOVID-19による血栓塞栓とCT画像所見についてのSpecial ReportがオランダのNational Institution for Public Healthからの報告として掲載されました。
Diagnosis, Prevention, and Treatment of Thromboembolic Complications in COVID-19: Report of the National Institute for Public Health of the Netherlands | Radiology
https://pubs.rsna.org/doi/10.1148/radiol.2020201629
そして、これを待っていたかの様に、同日のRadiologyからCOVID-19関連血栓塞栓症例のresearch letterやcase imageが公開されています。
Pulmonary, Cerebral, and Renal Thromboembolic Disease Associated with COVID-19 Infection | Radiology
https://pubs.rsna.org/doi/10.1148/radiol.2020201623
Acute Pulmonary Embolism Associated with COVID-19 Pneumonia Detected by Pulmonary CT Angiography | Radiology
https://pubs.rsna.org/doi/10.1148/radiol.2020201544
Acute Pulmonary Embolism in COVID-19 Patients on CT Angiography and Relationship to D-Dimer Levels | Radiology
https://pubs.rsna.org/doi/10.1148/radiol.2020201561

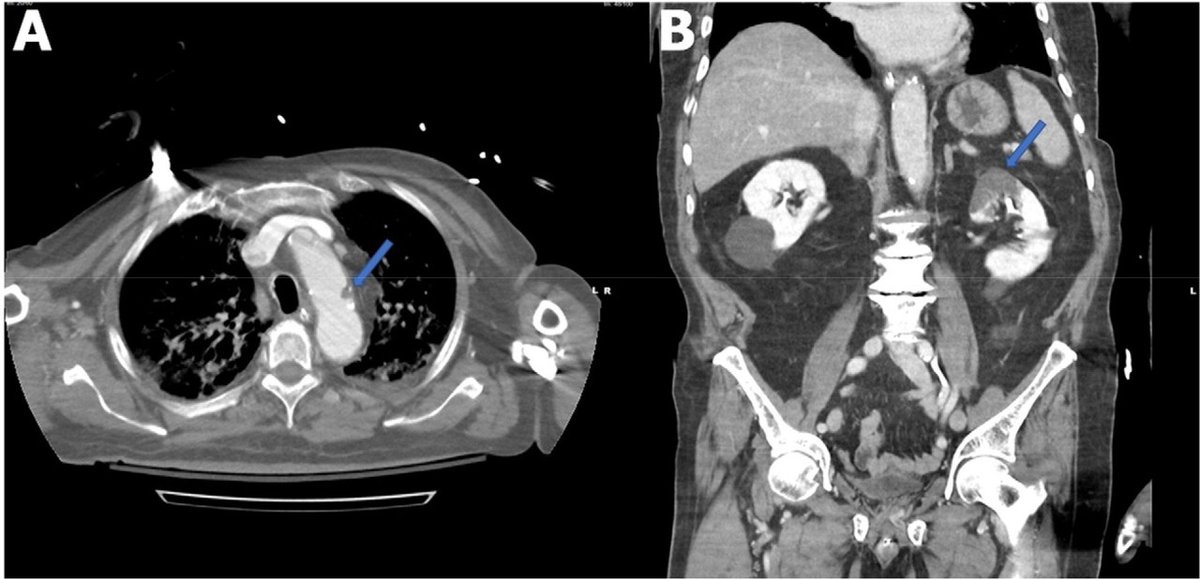
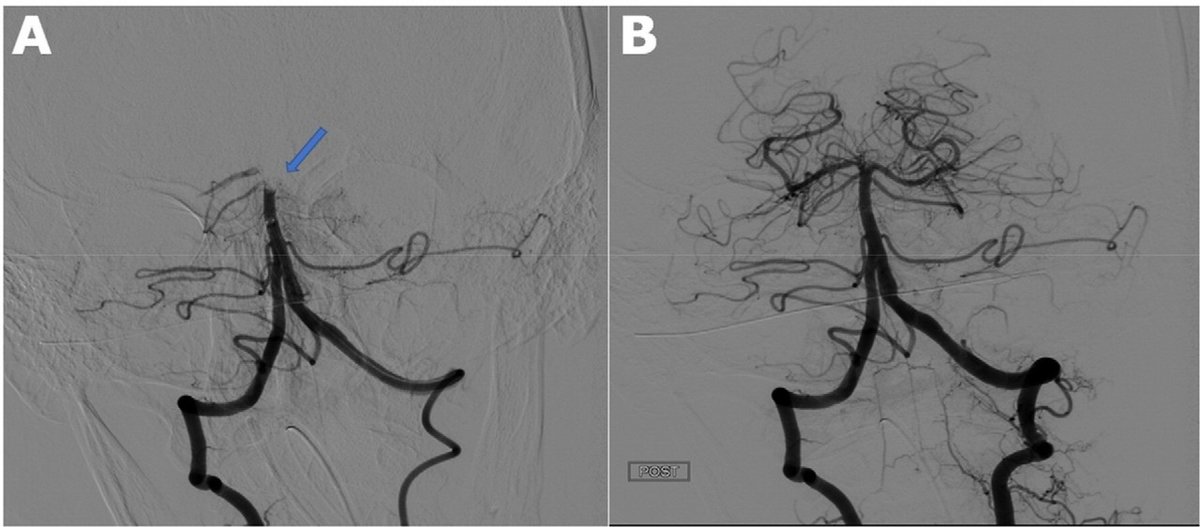
(Pulmonary, Cerebral, and Renal Thromboembolic Disease Associated with COVID-19 Infection | Radiology
https://pubs.rsna.org/doi/10.1148/radiol.2020201623 より引用
多臓器塞栓症を起こしている)
患者のinclusion criteriaが少し不明確でして、論文を読み込めていませんが、造影CTが必要だと臨床的に判断された人の23-30%近くにPTEを認めた?、との報告もあり、ちょっと想定外の頻度の高さです。
論文概説
COVID-19ではD-dimerが死亡率と相関していそうだ、との報告がチラホラ出てきている。
それを受けて、COVID-19による呼吸機能障害はARDS単体では無く、microvascularな塞栓による働きでは?と考えられている。
下記の2症例の臨床経過とd-dimerを提示している。
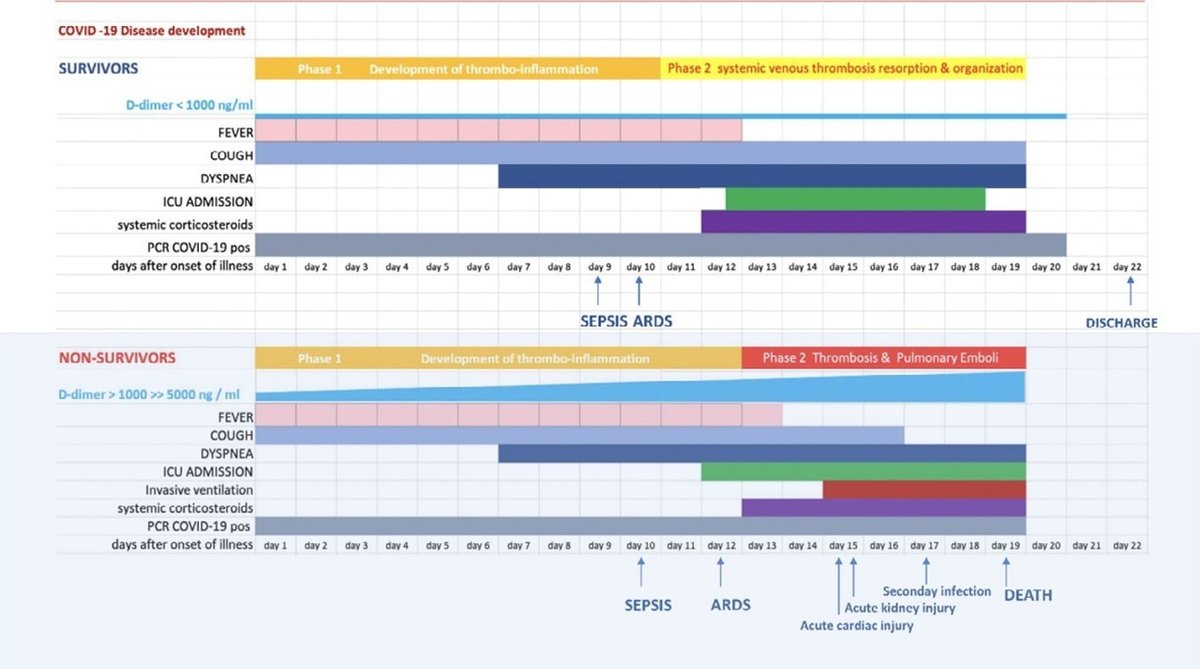
病理報告によると、過去のSARSの報告ではCOVID-19患者においてはDAD・microvascular thrombosisの組み合わせが報告されているが、COVID-19ではDADは同じコロナウイルスのSARSの報告ほど厳しくなく、多臓器のsmall vessel thrombosisが主体(誤訳かも)が主体との様子。
Diffuse alveolar damage (DAD) is common autopsy finding in COVID-19 patients (18, 19). One series (19) describes the pulmonary histopathology in SARS1 (N=44) and SARS2 (COVID-19) (N=4) patients (Table 2) with both infections showing DAD, pulmonary microvascular thrombosis and necrosis in mediastinal lymph nodes and the spleen. However, only COVID-19 patients showed small vessel thrombosis in multiple organs.

過去の検討によるとIL-6のレベルの上昇と乖離して、先行したD-dimer上昇が見られる症例がある様で、全身炎症に伴う二次性の凝固能亢進とは別個の血管壁炎症に伴う凝固能以上が示唆される、との事。
Zhou and colleagues (11) showed that the increase in IL-6 was discrepant with the elevations in D-dimer; IL-6 levels appeared to increase only 13 days after disease onset, whereas D-dimer levels were already 10-fold increased by that time. This observation suggests that the very high D-dimer levels observed in COVID-19 patients are not only secondary to systemic inflammation, but also reflect true thrombotic disease, possibly induced by cellular activation that is triggered by the virus.
最近、良く言われる様になってきた、COVID-19肺炎像におけるGGO近傍のCT画像の血管肥厚はthrombo-inflammatory プロセスが原因かもしれない。一方、subsegmental vessel enlargement (3mmより大きい血管)については充血と血流量の増量だと。
Vessel enlargement was described in the vicinity of areas with GGO, which is compatible with thrombo-inflammatory processes (35-40). Subsegmental vascular enlargement (more than 3 mm diameter) in areas of lung opacity was observed in 89% of patients with confirmed COVID19 pneumonia. All the CT’s were done without contrast. Although in situ thrombosis is certainly a possibility, these findings could be due to hyperemia and increased blood flow (Figure 2) (35)
実際の症例として初期COVID-19にCT造影perfusionを施行した症例が提示されているが、確かに病変に対応して、perfusion deficitが見られている。

D- dimerが高い症例や上昇傾向にある症例については、PTE/DVTの検査(造影CT)適応閾値を下げて検査する事を最後に提言している。

この記事が気に入ったらサポートをしてみませんか?
