イベルメクチンのメタ解析サイトに要注意②RCTについて
前回の記事でhttps://ivmmeta.com/のメタ解析の問題点について、観察研究とRCTを統合していることなどの問題点を述べた。しかし、24個のRCTのメタ解析(下図)が有効性を示しているという反論が予想される。以下、この解析の問題点を述べる。

メタ解析の問題について
まずメタ解析自体の問題については前回と共通している。
①死亡、入院、症状改善、ウイルス量低下などの異なるアウトカムをまとめてメタ解析しており不適切。
②バイアスのリスクが評価されていない(以下に具体的に見ていく)
③出版バイアス
有効性が示された研究が出版されやすく、有効性が示されなかった研究結果は出版されにくいという傾向がある。特に小規模な研究でその傾向が強く、公表されている結果だけに着目すると効果を過大評価する可能性がある。Funnel plotを見たいとこだが割愛。しかしただの私見だが、COVID研究はNegative resultでも出版される可能性が高く、出版バイアスは働き難い気がする。
個々のRCTの問題について
①バイアスの懸念
RCTだからと言って鵜呑みにせず、質を評価する必要がある。JAMAに出版された研究に対するFLCCCからの批判の声が強くあった。しかし、それまでに発表された研究にもデザインの基本的な点から問題点があるものが多い。むしろJAMAの論文に比べてその報告自体の質が低く、吟味が難しい。プロトコールも公開されていないか内容が薄い。
サイトに含まれている24件のRCTはJAMA論文も含んでいるため、それ以外の23件を見ていく。
以下がバイアスのリスク評価のまとめである(注1)。赤色(バイアスのリスクが高いもの)や黄色(バイアスのリスクの評価が困難)が多いのがわかるだろう。また、1件の研究は論文やプレプリントでさえ存在せず、結果を発表した動画のみ。さらに4件(Asghar、Raad、Mahmud、Chahar)は臨床試験データベースに結果がupされているだけで、詳細な報告やプロトコールがなく、評価が難しい.

ランダム割り付けが不適切(登録番号の偶数・奇数や日付の偶数・奇数で割付)またはその方法が報告されていない研究が多い。ランダム化の方法が不適切だと研究参加者がランダムに割付されず、背景因子にばらつきが生じる可能性がある。例えば日付の偶数・奇数に基づくとどちらの群に割付されるか研究参加前にわかってしまい、患者や担当医師の意思で特定の群に割り付けられるように調整することが起りうる。
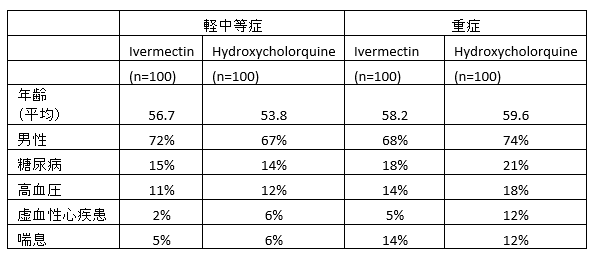
例えば以下のElgazzarの研究ではイベルメクチンで有意な死亡率の低下がみられたが、ランダム割り付けの方法が不明である。患者背景をみると対照群(HCQ)で虚血性心疾患の割合が多い。この偏りがイベルメクチンに有利に働いた可能性がある(注2)。

非盲検化(プラセボの使用なし)
複数の研究でプラセボが用いられていない。プラセボが使用されないと、特に主観的なアウトカム(症状改善など)に対する効果を過大評価する可能性がある。
②介入群や対照群が受けた治療がバラバラ
含まれた研究の中で、介入群にドキシサイクリンの併用、また対照群で別の治療を受けているものがあり、イベルメクチンそのものの効果の解釈が難しい。対照群の治療が悪影響を与えた可能性や、細菌合併症にドキシサイクリンが効果を与えた可能性も否定できないかもしれない、
以下はAndrew HillのレビューにあるForest plot(死亡がアウトカム)に介入群と対照群が受けた治療の情報を加えたもの。

③サンプルサイズが少ない
小規模の研究のメタアナリシスで統計的に有意な劇的な効果がみられたものが、後の大規模RCTで否定された例が多くあり、注意が必要である。
These considerations argue for skepticism regarding evidence summaries that generate apparent benefits, or harms, of therapy with what appear to be satisfactorily narrow CIs on the basis of small trials with relatively
few events. Examples of meta-analyses generating apparent beneficial or harmful effects refuted by subsequent larger trials, include magnesium for mortality reduction after myocardial infarction [6,7], angiotensin-convertingenzyme inhibitors for reducing the incidence of diabetes
[8,9], beta blockade for cardiovascular mortality reduction in patients undergoing noncardiac surgery [10,11], nitrates for mortality reduction in myocardial infarction [12,13], aspirin for reduction of pregnancy-induced hypertension [14,15], albumin for mortality reduction in the critically ill [16,17], and a number of mental health interventions [18]
小規模RCTのメタアナリシスで見られた死亡率低下が後の大規模RCTで見られなかった一例。 pic.twitter.com/bfygbc5iwk
— st@公衆衛生・疫学某所 (@styh131582) February 5, 2021
その一つの要因としてFragilityという概念がある。これは統計的に有意な差がみられても、その結果がごく少数の参加者によって大きく左右されてしまっていることにより起きる。詳細は参考文献を参照(注3)。他にも大規模の研究ほど高い水準で行われる傾向があることも関係しているだろう。
さて、上記の様にRCTのメタ解析といっても複数の注意すべき点があり、このサイトやFLCCCが主張するほどの頑強なエビデンスは今のところないと思われる。そろそろ結果が公開される予定の複数のRCTがあるはずだがぜひそれらに注目したい。
注1:Risk of bias評価は基本的にAndrew Hillのレビューでの評価を用いた。すべての研究を詳細に確認できていない。Babolaの研究のランダム割り付けの評価をUnclear→Lowに変更してる(記述があったため)。Hillのレビューに含まれていないものは私が行った。本来は2人以上でやるものなので参考程度。また、Andrew Hillと同様にRoB2ではなく、以前のCochrane risk of bias assessment toolを用いている。
https://assets.researchsquare.com/files/rs-148845/v1_stamped.pdf
注2:背景因子の偏りはランダム割り付けの方法がきちんと行われていても偶然起こり得る(というか多くの因子を調べると偶然によって必ずばらつきがみられるはず)。RoB2などによると偶然によって起きた偏りはバイアスではなく、95%信頼区間に反映されるので考慮しなくてよい。これは小規模研究でも同様らしい。(2011年のGrade guideline 6によると偶然による偏りもバイアスを起こすかような記述があり、私は最近まで誤解していた)。https://sites.google.com/site/riskofbiastool/welcome/rob-2-0-tool/current-version-of-rob-2?authuser=0
注3:Fragilityの参考文献
https://pubmed.ncbi.nlm.nih.gov/24508144/
https://www.jclinepi.com/article/S0895-4356(19)31082-0/fulltext
https://www.sciencedirect.com/science/article/pii/S0895435618308187
この記事が気に入ったらサポートをしてみませんか?
