高校無機化学#6(17族)~ハロゲン化水素②~
①HF
(性質)
前回はHFの製法を考えた。今回はHFの性質をみていこう。
フッ化水素の重要な性質は、ガラスを溶かすということである。ガラスの主成分は二酸化ケイ素SiO2である。ゆえに、この反応式は次のようになる。

HFが気体状態なら上の反応、水溶液状態なら下の反応が起こる。入試でよく問われるのは、ヘキサフルオロケイ酸が生成する下の反応だが、反応の仕組みを理解するために2つとも理解しておきたい。
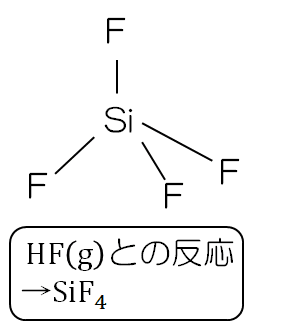
では、まず、気体状態のHFが起こす反応の仕組みについて考えよう。下図を見てほしい。

まず、話の本筋ではないが、SiO2の結晶は正四面体が連続した構造となっている。これは、のちにも出てくるので確認しておこう。
つぎに、各元素の電気陰性度に注目して見ると、F > O > H > Siとなっている。
つまり、Fにとって、自分より電気陰性度の小さいOが、自分の結合相手であるHよりも電気陰性度の小さいSiと結合しているということになる。言い換えると、Hよりも電子を引っ張りやすい相手であるSiが、自分よりも電子を引っ張るのが弱いOに引っ張られているという状況だ。この状況は、力関係からおかしいということが分かるだろうか。
その結果、OとFが入れ替わる反応が起こり、下図のようにSiF4が生成するのだ。

次に、水溶液中のHFが起こす反応の仕組みについて考えよう。
気体状態のHFが起こす反応で、SiF4が生じるまでは同じである。しかし、気体状態と水溶液中の絶対的な違いがある。それは、「未反応のHFが残っているか」ということだ。
気体状態では、SiF4になった以外のHFは気相中に拡散して、それ以上反応することがない。一方、水溶液中では、気体状態に比べて、HFは拡散していない。
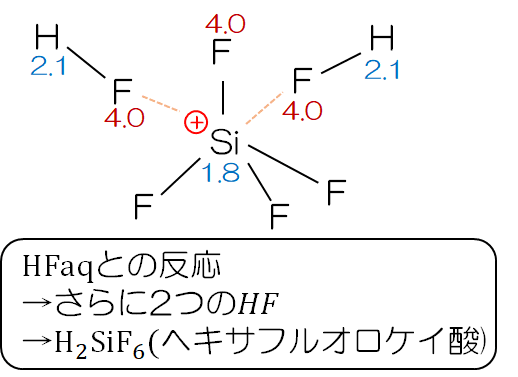
ここで、中心のSiはOに電子を引っ張られているため、かなり正に帯電している。そのため、さらに2つのHFと反応して、正八面体型のH2SiF6ヘキサフルオロケイ酸になる反応が連続で起こるのだ。
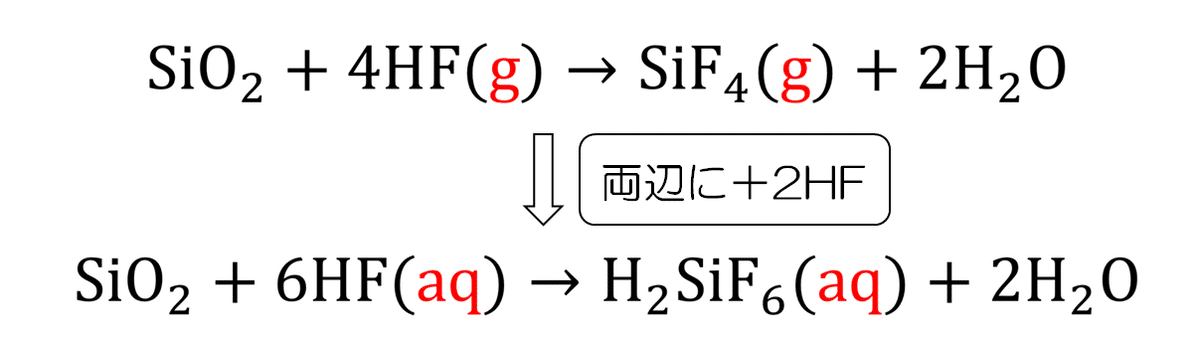
このとき、共有結合の結晶であったSiO2が、ただの分子結晶である、SiF4やH2SiF6に変化する。この結果、ヒトの目には、ガラスが溶けだしたように見えるのである。
これでHFに関してはおしまい。次回は楽めかも。
この記事が参加している募集
この記事が気に入ったらサポートをしてみませんか?