
6-3. 中和反応
こんにちは、おのれーです。
今回は、酸と塩基を反応させるとどのようなことが起こるのか、ということについて考えていきたいと思います。
■酸に塩基を加えていくと起こることとは?
酸性の水溶液に、塩基性の水溶液を混ぜていくと、どのようなことが起こるでしょうか?
↓
↓
↓
こたえは、「中和」です。酸性のものと塩基性のものが反応すると、互いの性質を打ち消し合う反応が起こります。
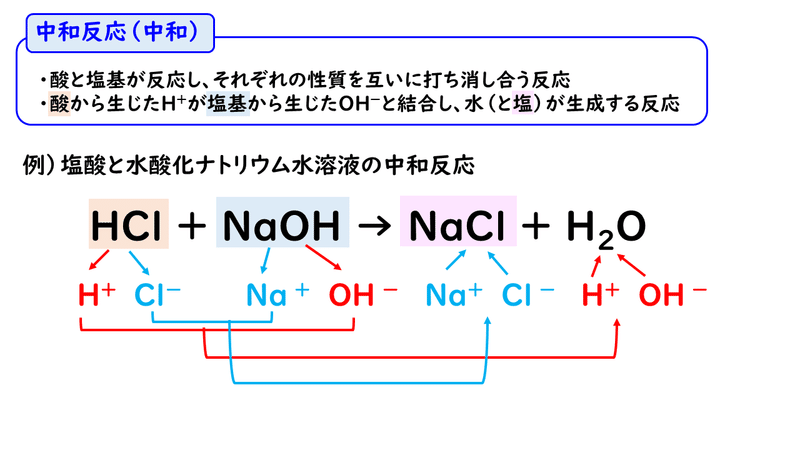
例えば、塩酸と水酸化ナトリウム水溶液の反応で考えてみましょう。
塩酸も、水酸化ナトリウム水溶液も、「飲め!」と言われたら、「えっ…」とひるむでしょう。塩酸は胃液の成分ではありますが、濃いものでは火傷をしますし、水酸化ナトリウム水溶液はタンパク質を溶かす性質もあるため、目に入ったら失明の恐れがあるくらい強力な薬品です。
ちなみに、私は大学生の時にうっかり塩酸(うすめてはいましたが)が口に入ってしまったことがあるのですが、痛いくらいに酸っぱかったです(危険なので、絶対真似しないでください)。
そんな塩酸と水酸化ナトリウム水溶液ですが、混ぜると、次のような反応が起こります。
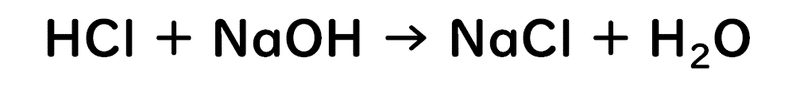
生成物に注目してください。
「NaCl+H2O」って、「塩化ナトリウム+水」ってことなので、つまりは「食塩水」ができているんです。
塩酸と水酸化ナトリウムを混ぜた後は、ただの食塩水になってしまうのですね。
ただし、ただ混ぜたら食塩水になるわけではありません。混ぜ合わせる量によって、混ぜた後の水溶液の成分や性質は変わってくるので気をつけましょう。
下に示すのは、うすい塩酸4滴に、同じ濃度の水酸化ナトリウム水溶液を滴下した実験の結果を表したものです。

A~Cのように、水酸化ナトリウム水溶液の量が塩酸よりも少ない時は、塩酸を中和しきれずに酸性を示します。Dでちょうど量がつりあうとぴったり中和をして中性となり、E~Fのように加えた水酸化ナトリウム水溶液の量が塩酸の量を上回ってしまうと、塩基性を示すようになります。
このように、ぴったりと中和させられるのは、ほんの一瞬のことなので、必ずしも「塩酸と水酸化ナトリウム水溶液を混ぜたら食塩水だからなめても大丈夫」ということにはならないので気をつけましょう。
■中和とはどのような反応か?
では、中和という反応を、水溶液中にあるイオンに注目をして考えてみましょう。
ここでも、塩酸HClと水酸化ナトリウム水溶液NaOHの反応についてみてみましょう。
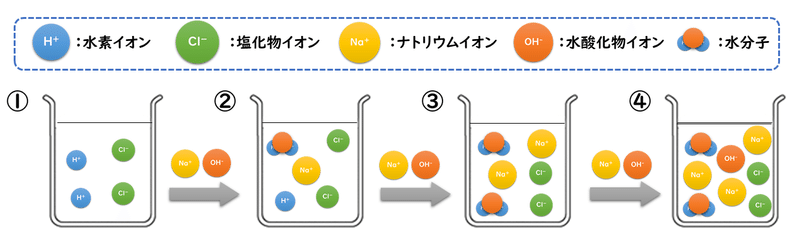
上図の①は、水溶液中にあるのが塩酸(塩化水素)だけのときです。塩酸の電離度は1ですので、水溶液中ではほとんど電離してH+とCl-に分かれています。
ここにNaOHを少しだけ加えて、②の状態にします。このとき、塩酸が電離して生じていたH+と、加えたNaOHが電離して生じたOH-が中和反応して、水H2Oが生じます。
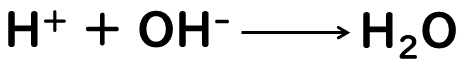
しかし、まだ塩酸が電離して生じたH+は余っている状態なので、全体としてはまだ酸性の水溶液のままです。
さらにNaOHを加えて③の状態にすると、塩酸が電離して生じていたH+と、加えたNaOHが電離して生じたOH-がちょうどぴったり反応してすべてH2Oになってしまい、水溶液は中性になります。このように、酸と塩基がちょうど反応した地点のことを「中和点」と呼んでいます。
中和点を超えて、さらにNaOHを加えると、④のようにNaOHが過剰の状態になり、水溶液中のOH-の量が多くなるので、塩基性の水溶液になります。
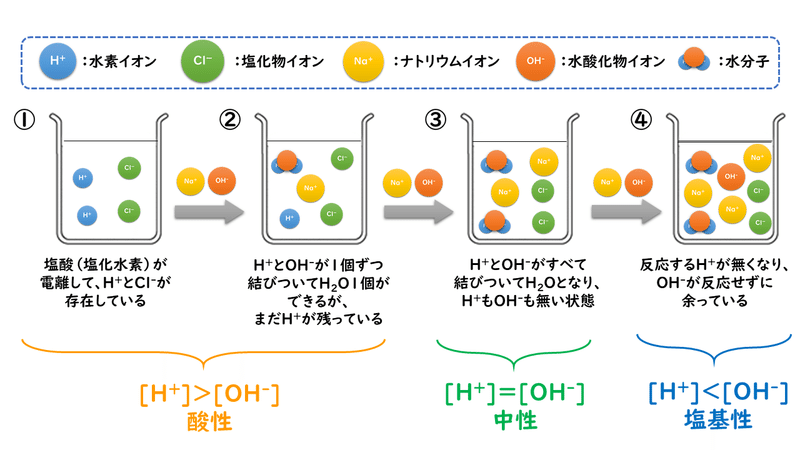
このように、「酸と塩基がちょうど中和するとき量的関係」というのは、「酸から出たH+の数=塩基から出たOH-の数」という関係にあるときです。ですから、中和点というのは、「酸から出たH+と塩基から出たOH-がちょうどぴったり全部H2Oになったところ」と考えることができます。
ただし、水溶液の性質は必ず中性になるとは限りません。このことについてはこの章の後半で見ていくので、今は「ふ~ん」と飛ばしておいてください。
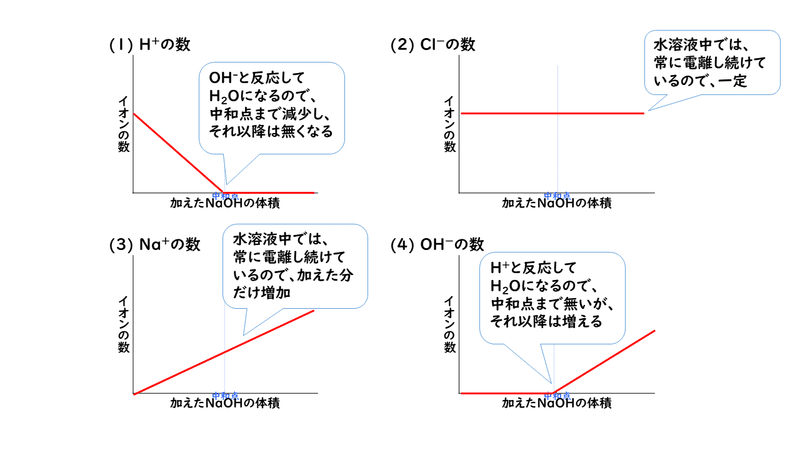
下に示すのは、この反応で出てくるイオンの変化の様子です。中和点を境にH+とOH-の量が入れ替わっていくこと、反応に直接関係しないNa+は加えた分だけ増え続け、Cl-は常に一定になるということを、上のビーカーの図と照らし合わせながら確認してみましょう。
ではここで、中和反応の化学反応式を書く練習をしてみましょう。コツは、次の通りです。
① 反応物をイオンに分けて書く
② H+とOH-を結び付けてH2Oをつくり、残されたイオン同士を結び付けて塩(えん)をつくる
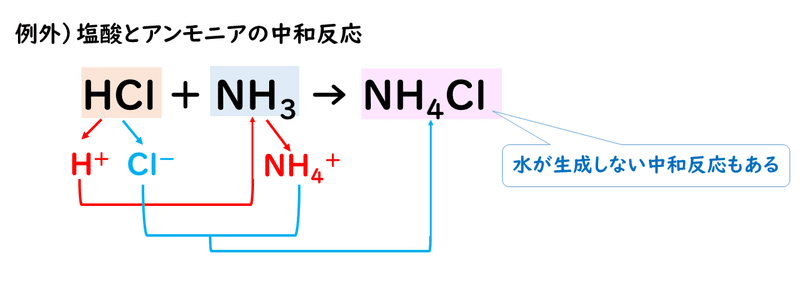
つまり、中和反応は、それまで結合していた陽イオンと陰イオンが分かれて、陽イオンは別の陰イオンと、陰イオンは別の陽イオンと新たに結びついて別の物質をつくる反応だといえます。
ちなみに中和反応の際できる水ではない方のイオン性物質のことを「塩(えん)」といっています。
では、あともう2題練習してみましょう。
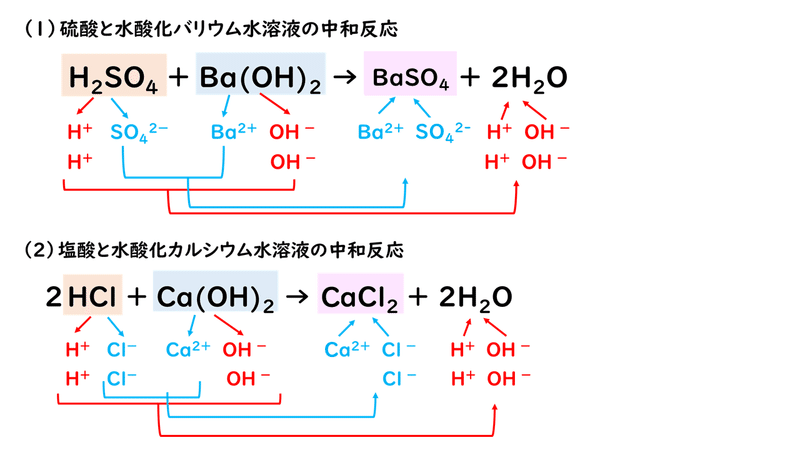
分からなくなったら、とにかくイオンに分けて、陽イオンと陰イオンの組み合わせを変えるパズルなのだと考えて、手を動かしてみることです。イオンや組成式の理解があやしい人は、いったんそこに戻って練習してみましょう。
■身近なところで利用されている中和反応
実は、中和反応は化学実験だけでなく、様々なところで利用されています。そのいくつかを紹介したいと思います。
(1)消臭
トイレの臭いの原因といえば、アンモニア。アンモニアの水溶液は塩基性を示すので、クエン酸で中和させることにより、臭いの原因であるアンモニア中和されてクエン酸三アンモニウムという臭わない物質に変化させ、消臭することができます。
また、足の臭いなど、体臭の原因になる物質は酸性を示すものが多いので、塩基性を示す重曹の水溶液が臭いを抑えるのには効果的です。
(2)胃薬(制酸剤)
胃の中には、胃液というpH=1に近い強い酸性の消化液が存在します。そこで、胃の粘膜が弱っている時などには、炭酸マグネシウムや炭酸水素ナトリウムなどの塩基性を示す物質が入った胃薬で中和して、胃酸のはたらきを抑え、痛みを和らげることがあります。
(3)自然環境の改善
草津温泉など、強酸性の温泉が川に流れ込むと、その川の水は農業用水として利用できなかったり、生態系に悪影響を与えたりします。そこで、塩基性を示す石灰石を川に投入して中和反応を起こし、強い酸性を和らげるという取り組みがされています。
(4)土壌の改良
酸性を示す畑の土には、そのままだと作物が育ちにくいので、塩基性を示す石灰や消石灰などを混ぜて中和させることがあります。
(5)ミカンの缶詰の製造
ミカンの缶詰は、うす皮がきれいにむけていますね。あれは、一つ一つ徹作業できれいにむいているわけではありません。まず、アルカリ性を示す溶液に外皮をむいたミカンを浸します。すると、その水溶液の性質によって、うす皮が溶けて無くなります。そのままだと食べられないので、その後、酸性の溶液で中和させて、シロップとともに缶詰めにしています。
このように、私たちの意外と身近なところに、中和反応はたくさん使われています。化学の力ってすごいですね。
今回はここまでです。
最後にワンポイントチェック
1.中和とはどのような反応か?
2.中和点における、H+とOH-の量の関係はどうなっているか?
3.中和反応が身近なところに使われている例には何があったか?
お疲れさまでした。
次回は、中和の際に生じる塩(えん)について深く突っ込んでいきたいと思います。頑張りましょう!
←6-2. 水素イオン濃度とpH | 6-4. 塩とその性質→
この記事が気に入ったらサポートをしてみませんか?
