次世代の糞便微生物叢移植: 細菌を移植するかウイルスを移植するか
記事内容へスキップ
記事情報へスキップ
ワイリーオンラインライブラリー
先端科学早見表 2301097
レビュー
オープンアクセス
次世代の糞便微生物叢移植: 細菌を移植するかウイルスを移植するか
https://onlinelibrary.wiley.com/doi/10.1002/advs.202301097?af=R

ユー・ユー, ウェイホン・ワン, ファミン・ジャン
初出:2023年11月01日
https://doi.org/10.1002/advs.202301097
について
セクション
要旨
糞便微生物叢移植(FMT)は、ディスバイオシスに関連する疾患に対する有望な治療アプローチとして浮上してきた。しかし、臨床における糞便移植は、その受容性と再現性の点で限界がある。その結果、FMTに代わる2つの解決策が開発された。すなわち、細菌群集またはビロームの移植である。細菌を移植する先進的な方法には、主に洗浄微生物叢移植と細菌芽胞処理がある。ビロームの移植もまた研究されており、糞便からビロームをろ過する糞便ビローム移植が開発されている。これらのアプローチは、研究の異質性を最小限に抑えつつ、患者や医療提供者により受け入れやすい選択肢を提供するものである。一般的に、世界的な傾向として、次世代のFMTの進化は、主に細菌またはビロームの移植に焦点を当てた糞便微生物叢成分移植である。
1 はじめに
ヒトの腸内細菌叢は、細菌、古細菌、ウイルス、真菌、真核寄生虫、原虫、およびそれらのゲノムから構成される複雑なコミュニティである[1, 2] 。 [糞便微生物叢移植(FMT)は、健康なドナーの糞便調製物を移植することで、バランスの崩れた腸内細菌叢の組成と機能を再構築することができるため、腸内細菌叢異常症に関連する疾患に対する有望な治療法である [4, 5] 。 [6]最近の系統的レビューによると、FMTは2011年から2021年にかけて、世界の臨床現場で85の特定疾患の治療に用いられたことが報告されている[7]。特に、FMTは再発性のクロストリジウム・ディフィシル感染症(CDI)の治療に非常に有効であり、治癒率は約90%である[8]。
ヒトの糞便1グラムあたりには、≈1011個の細菌細胞、108~109個のウイルス様粒子(ほとんどがバクテリオファージ)、≈107個の結腸細胞、≈108個の古細菌、≈106個の真菌、原生生物、および代謝産物が含まれている[9-11]。例えば、ファーミキューテス門に由来する代謝産物、特に短鎖脂肪酸や二次胆汁酸は、宿主の恒常性維持において複数の有益な役割を担っている。これらの役割には、腸管バリアの強化や炎症の緩和などが含まれる[12, 13]。しかし、投与量や送達経路[14]が異なるFMTの方法は、研究チームによって臨床反応が異なる原因となっている[15]。このような不均一性は、研究の再現性に課題をもたらす。医薬品開発が自然製剤からより精密な成分へと進化していくのと並行して、FMTも同様の軌跡をたどることが予想される。現在、焦点はより精密で有効な微生物成分の移植へと移っている。腸内細菌叢の主要な構成要素である細菌とビロームの両方が、FMTの有効性に極めて重要な役割を果たすと考えられている[16, 17]。このような背景から、研究者や臨床医は細菌やビロームを移植する方法に注目している[18-21]。
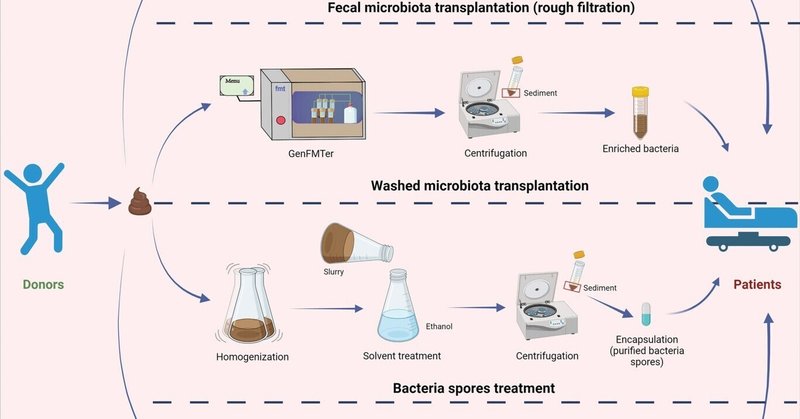
腸内細菌叢に細菌が豊富に存在することから、細菌がFMT関連の研究の大半の焦点となっている[22]。細菌を移植することは、方法論の改善によりFMTを洗練させる有望な戦略として浮上している[23-25]。検討事項の提供を伴う自動洗浄プロセスは、洗浄微生物叢移植(WMT)と呼ばれ[26]、2019年にFMT標準化研究会のコンセンサスとして発表された。 [27] WMTの主な目的は、細菌断片、代謝産物、可溶性分子、タンパク質、ウイルスを可能な限り除去することを含む洗浄済み糞便微生物叢調製物を用いて濃縮細菌を移植することであり、同時にすべての真菌および寄生虫卵を確実に除去することである(図1)。 [26]細菌を移植するもう一つの方法として、化学的および物理的方法を取り入れた調製によって細菌の芽胞を濃縮する細菌芽胞処理がある(図1)[25]。近年、腸内細菌叢におけるウイルス群の重要性も認識されつつある[28, 29]。細菌群集とウイルス群集の両方の移植を同時に考える場合、糞便をそのまま移植することになり、医師や患者にとっては受け入れがたいことである[30-32]。研究目的でビロームを分離することは、ビロームのメカニズムや潜在的な応用を調査することを可能にする解決策となりうる。腸内ビロームの主成分は原核生物ウイルスであり[33]、その中でもバクテリオファージが支配的である。腸内バクテリオファージの総数は≈1015と推定されている[34]。近年、細菌に起因する有害事象(AE)を排除するために、ドナーの糞便からビローム(ウイルス、代謝産物、細胞残骸を含むが、無傷の細菌細胞は含まない)を患者に移植する糞便ビローム移植(FVT)または糞便濾過液移植(FFT)への関心が高まっている(図1)。 [19, 35] 2017年、OttらはFFTによるCDI治療の臨床的成功を報告し[19]、ビロームの潜在的利益に関するさらなる研究に拍車をかけた[22]。 注記:理解を容易にするため、FFTと同様の概念と方法を共有する糞便ビロームの移植方法を総称してFVTという用語を使用する。
詳細は画像に続くキャプションを参照。
図1
図ビューアで開く
パワーポイント
キャプション
メカニズムが部分的に定義されている現段階では、次世代FMTは以下の基準を満たす可能性がある:健康なヒトドナー由来の未培養微生物、組成の相対的特異性、臨床試験による高い安全性、送達経路としての消化管。これらの基準は、より正確な組成と洗練された方法論によって試験の不均一性を減らしながら、既知および未知の有益な成分を糞便移植に保持することを目的としている。一般に、次世代のFMTは、特定の微生物叢成分を移植する方向、すなわち、主に細菌とビロームを標的とした微生物叢成分移植に向かって進んでいる。この総説では、細菌とビロームの移植に関わる方法がこれらの条件を満たしている。その主成分は異なるが、そのメカニズムは相互に関連しており、さらなる探求に値する。配合(またはカクテル)細菌[36]、バクテリオファージカクテル治療[37]、バクテリオファージコンソーシア治療[38]など、明確に定義された再現可能な構成要素を持つ特定の有望な製品は、このレビューでは除外していることは注目に値する。
本総説では、医学史におけるFMTのマイルストーン、およびFMTに関連する安全性と規制の懸念について論じた。また、FMTが直面している課題を示し、その方法を改善することの重要性を強調した。最後に、細菌またはビロームの移植に関する最先端の研究について、その方法論、応用、安全性、潜在的メカニズム、研究技術、展望を含めて論じた。その目的は、微生物叢を利用した治療法の今後の発展のための指針を提供し、臨床医学の一分野としての微生物叢医学[39]の科学的説明を充実させることであった。
2 FMTの発展
2.1 医学史におけるFMTのマイルストーン
医学史におけるFMTの最初のマイルストーンは、中国伝統医学における古代の記録である。この古代の医学史によると、漢方医は食中毒やひどい下痢の患者を治療するために、経口ヒト糞便懸濁液を使用していた[5]。この歴史的記述は、原料としてヒトの糞便を使用していること、消化管を介した投与であること、新鮮な糞便水または発酵した糞便に存在する微生物叢を介した有効性、古代の文献における処方、方法、適応症、有効性の明確な記述など、FMTの使用を確認するいくつかの基準を満たしている[5]。
1958年には、偽膜性腸炎の治療として浣腸によるFMTが初めて報告された[40]。 1983年には、Schwanらが同種FMTで治療に成功した再発性CDIの最初の症例を報告した[41]。2013年には、Surawiczが主導したガイドラインにより、再発性CDIの治療にFMTが初めて推奨された[42]。これは、FMTが民間療法から専門家チームによる推奨に変わった画期的な出来事である。現代医学では、FMTによる治療が検討されている疾患の範囲は大幅に拡大しているが、CDIは依然として唯一の確立された適応症である[4, 5] 。2023年8月現在のデータによると、clinicaltrials.govのウェブサイトでFMT治療の臨床試験が最も多く登録されている疾患はIBDである。2011年から2021年までに、FMT研究に関連する英語の論文が合計2,400本発表されている[43]。FMTはまた、腸以外に発生するいくつかの疾患に対する治療法の可能性も指摘されている。特定の腸臓器軸という概念は、これらの臓器と腸との間の疾患発症メカニズムにおける潜在的な相関関係を反映するために提唱されている。よく知られた例としては、腸-脳軸(自閉症やうつ病など)、[44, 45] 腸-心軸(心筋炎や高血圧など)、[46, 47] 腸-肺軸(肺炎など)、[48] 腸-肝軸(非アルコール性脂肪性肝炎など)、[49, 50] 腸-免疫軸(全身性エリテマトーデスなど)がある。注目すべきは、研究者が腸内細菌叢と体内の様々な臓器との間に新たな関連を発見しているため、腸-臓器軸の範囲が絶えず拡大していることである。
人間は他人の排泄物が嫌いなはずで、この現実から逃れようとしてきたが、成功したことはない。大腸経内視鏡的経腸チューブ(TET)は、微生物叢懸濁液の新たな送達法として報告された[54]。CDI[55]やIBD[24, 56]などの重篤な腸疾患患者に対する微生物叢の送達に用いられている。この革新的なアプローチは、治療の安全性を高めるだけでなく、生理学的原則にシームレスに合致している。中国で大腸TETが広く採用されていることは、その臨床的汎用性の高さと、盲腸でのin situサンプリングなど様々な困難なシナリオに対処する上で大きなメリットをもたらすことを強調している[54]。 [同様にヒトにおいても、腸から直接採取したサンプルは、便サンプルと比較して、プロファージ誘導の有病率が高いことが示された[58]。以上のことから、大腸TETは、ビロームと宿主との複雑な相互作用を将来的に調査するための有望な方法として浮上する可能性がある。
もう一つのマイルストーンは、FMTの薬剤承認である。調製された糞便微生物叢は、2022年にオーストラリアで、2023年に米国で、それぞれ生きたバイオ治療製品の1つとして承認されている[59]。寄贈された糞便から採取された芽胞も、2023年に米国食品医薬品局(FDA)から最終承認を受けた[21]。
2.2 安全性と規制の懸念
システマティックレビュー[60]では、2000年から2020年までに報告された5688例のFMT関連AEが要約されている。このレビューによると、FMT関連AEはFMT手技の19%で観察され、最も頻繁に報告されたFMT関連AEは下痢(10%)と腹部不快感/痛み/けいれん(7%)であった。重要なことは、FMTに関連した重篤なAEが1.4%の患者で報告されていることである。これらの重篤なAEには、上部消化管送達ルートに関連した致死的な誤嚥性肺炎に起因するFMT関連の死亡5例(2例は特定の因果関係があり、1例はおそらく因果関係がある)[61-63]のほか、大腸内視鏡検査でFMTを実施した際の鎮静中の誤嚥[64]、および病原性細菌種の伝播[65]が含まれる。 [65] 病原性細菌種の伝播の症例が2019年に報告されており[65]、この症例では患者がFMTを受けた後に広域β-ラクタマーゼ産生大腸菌菌血症を発症した。ゲノムシークエンシングにより、因果関係がドナーと関連していることが確認された。FMTに関連した死亡例はこれが初めてではなかったが、これを契機に、米国や他の国々でFMT実施に必要な管理要件が変更された[66-68]。上記のFMT関連AEが報告されたにもかかわらず、FMTの全体的な安全性プロファイルは良好である[69]。FMTの長期安全性に関するデータは不十分であるが、細菌の免疫原性はヒトへの感染や長期にわたって安定している[70]。
FMTの安全性をさらに確実にするためには、方法論に注目することが重要である。発表されたFMTに関するガイドラインやコンセンサスのほとんどは、手作業による方法を用いており[26]、記載されたFMTの方法論はまだ粗雑であった[66-68, 71-73] 。米国のChenのグループによる実臨床では、学術センターでFMTを受けた患者は、個人診療所で治療を受けた患者と臨床的特徴において有意な差があった。 [74] 重要なことは、FMTの有効性は、糞便製剤の製造工程、投与量、送達経路などの様々なパラメータによって影響を受ける可能性があることである。2020年11月までに、FMTに関する30のランダム化比較試験(RCT)を含むシステマティックレビューは、研究に統一され標準化された方法が必要であることを示唆した[75]。応答者と非応答者のドナーの異なる微生物分類が観察されたにもかかわらず、一貫性のない結果が得られたのは、調査基準が異なるためであった。このような矛盾は、FMTを規制する負担を増大させ、国によって規制や倫理的配慮が異なることにつながる可能性がある。
2013年以降、FDAは標準治療が奏効しないCDIの治療に対して、「施行裁量」のもとでFMTの使用を許可している[76, 77]。 2022年11月、オーストラリア医薬品庁は、再発性CDIの治療薬として、ドナー由来の微生物ベースの治療製品であるBIOMICTRAの登録を承認し、オーストラリア医薬品登録簿に登録された。それ以前は、FMTはオーストラリアでは治験薬とみなされていた[79]。FMTは、FDAがRebyota(RBX2660)を承認する2023年まで、医薬品として承認されなかった[59]。このマイクロバイオータに基づく生きたバイオ治療薬は、ヒトの便から調製され、幅広い微生物のコンソーシアムから構成されており、再発性CDIに対する抗生物質治療を受けた18歳以上の患者におけるCDIの再発予防を適応症としている。中国では、FMTは国家衛生委員会の監督のもと、CDIやその他多くの疾患に対して許可された医療療法である[18]。重要なことに、2020年、FDAはFMTを通じてSARS-CoV-2が患者に伝播する潜在的リスクに関する警告を発した。予防措置として、FDAはさらなる安全プロトコルの追加を推奨し、その中には、ドナーのさらなる提供を排除すること、最初の陽性反応前4週間以内に罹患したドナーから提供された便に由来するFMT製品の臨床使用を控えることが含まれていた。世界保健機関(WHO)が2023年5月5日にCOVID-19パンデミックの公式終息を宣言し、長期管理段階に移行したとはいえ、我々は糞便を介したSARS-CoV-2感染のリスクに関して警戒を怠らない必要がある。便バンクの設立は、ドナーのスクリーニングプロセスを標準化し、治療結果や潜在的な副作用をモニタリングする上で重要な役割を果たしている[80]。2012年以降、アメリカのOpenBiome、オーストラリアのBiomeBank、オランダのDonor Feces Bank、China Microbiota Transplantation System (FmtBank)[7]など、世界中で20以上の便バンクが設立されている。
3 糞便細菌移植の発展
3.1 WMTの方法と送達ルート
2014年以降、中国では自動精製システム(GenFMTer、南京、中国)を使用した微生物叢調製が使用されている[51, 56, 81]。これに続いて、遠心分離と懸濁を含む3つのラウンドが行われ、糞便から微生物叢が自動的に洗浄される(表1)。微生物叢を洗浄する方法は、より大きな粒子、繊維、未消化の食物を除去するための手作業による懸濁とろ過のステップのみを含む従来の粗FMTプロセスとは異なる(図1)[82]。2018年、Zhangら[5]は、手作業によるFMTを中止し、手順の標準化を推進する時期であると提案した。自動洗浄プロセスに基づくFMTの改善された方法論と関連する配送の考慮は、WMTと呼ばれ[26]、2019年にFMT-標準化研究会によって発表された[27]。
表1. 糞便移植の準備方法。
項目 WMT[5, 18] 細菌芽胞処理[86] FVT[19]
条件 GMP GMP バイオセーフティキャビネット
糞便重量 ≥50 g ≥50 g ≥50 g
由来 同種異系 同種異系
設備 GenFMTer Undefined ブレンダー、特注空気圧ろ過システム
プロセス
懸濁液:糞便100gあたり500mLの滅菌生理食塩水の割合。
精密ろ過:使い捨て無菌クローズドループシステム(GenFMTer)内で多段階自動ろ過。
遠心分離および洗浄。
懸濁液:糞便入り生理食塩水。
溶媒処理:スラリーを100%エタノールで50%(wt/wt)にする。
遠心分離および懸濁。
懸濁液:糞便50gあたり500mLの滅菌生理食塩水の割合で。
遠心分離し、上清を回収する。
異なる孔径のろ過。
GMP、適正製造規範。
WMTは、手動のFMTに比べて洗練された方法を提供するだけでなく、安全で便利な送達経路を提供する。TETは、手技によるFMTの現在の臨床的要件と限界に対応する送達ルートである[83]。TETでは、内視鏡支援によるチューブの深部腸への留置、その後の固定が行われる。TETは、腸内の留置位置によって、腸中部TETと大腸TETに分類される[84]。大腸TETは、移植部位を正確に特定でき、サンプリング時間を標準化できるため、異なる研究の空間的・時間的不均一性を低減できる[85]。WMTの定量的方法、自動精製システム、送達アプローチの改良により、研究の不均一性が低減し、安全性が向上している。
3.2 洗浄微生物叢移植の有効性と安全性
潰瘍性大腸炎(UC)およびクローン病(CD)患者において、WMT が AE を減少させる独立した因子であることが、2 件の先行研究[24, 56]で報告されている。最新の研究[18]では、WMTの安全性データを更新し、手技によるFMTと比較した。その結果、UC 患 者では手動 FMT の 35.5%(11/31)から WMT の 7.2%(65/902)に、CD 患者では手動 FMT の 21.7%(15/69)から WMT の 4%(35/882)に、それぞれ AE 発生率が減少した。動物実験[26]では、WMTの安全性が向上したのは、洗浄を繰り返すことにより、増加する炎症性代謝産物(ロイコトリエンB4、コルチコステロン、プロスタグランジンG2など)やウイルスが除去されたためと説明されている。
興味深いことに、難治性UC患者において、新鮮なWMTは新鮮なFMTと比較して少ない治療回数で同じ寛解期間を達成した(表2)[23]。この研究では、この患者は大腸TETを介したWMTをわずか2コース行っただけで、同じ8ヵ月の寛解期間を達成したのに対し、経皮的内視鏡的膀胱チューブを介したFMTを60回行っただけで同じ期間を達成した。臨床においては、治療回数と入院期間の両方を減らすことが、患者のコンプライアンス向上に寄与する。IBDに対するWMTの反応性を示すバイオマーカーは不明であるが、カンジダ菌量の減少は疾患の重症度改善と正の相関がある[87]。再発性真菌感染症に罹患した難治性UC患者も、WMTにより治癒に成功している(表2)[88]。
表2. 細菌またはビロームの移植に関する臨床研究および動物実験の概要。
疾患 研究の種類 対象者 ドナー 提供経路 結果
細菌移植
CDI 二重盲検無作為化プラセボ対照試験[21] 182例(SER-109(N=89)、プラセボ(N=93)) 健常人 カプセル CDIの再発率は、SER-109群(12%)がプラセボ群(40%)より有意に低かった。ほとんどのAEは軽度から中等度であり、両群で同様であった。
UC 実臨床試験[56] 109例 健常人 大腸TET;中腸TET WMT後1ヵ月および3ヵ月でそれぞれ74.3%(81/109例)および51.4%(56/109例)、WMT後1ヵ月および3ヵ月でそれぞれ 25.7%(28/109例)および20.2%(22/109例)が臨床的寛解を達成した。1~5年の追跡期間中に17.4%のAEが発生した。1ヵ月を超えるAEは観察されなかった。
症例報告[23] 難治性UC患者1名 健常人 大腸TET;胃カメラ 経皮的内視鏡的噴門チューブによるFMTを2ヶ月間で60回施行し、8ヶ月間の臨床的寛解を得た。その後、WMTを7コース施行した(計10回のWMT、8回は大腸TETによる)。2コースのWMT後、患者は8ヵ月間の臨床的寛解を達成した。最後の2コースのWMTによって誘発・維持された寛解期間は、合計45ヵ月に達した。
症例報告[88] 再発性真菌感染を合併した難治性UC患者1例 健常人 経鼻空腸チューブ UC(E3、活動性重症、Mayo score=11)、C. glabrata感染、副腎皮質機能不全、骨粗鬆症、大腿骨頭壊死、乾癬、橋本甲状腺炎、中等度栄養失調と診断された。WMTを5回行い、その後シクロスポリンを追加投与したところ、便の回数は1日10~15回から2週間後には1日2回に減少した。糞便真菌培養は、最初のWMTから3ヵ月後と6ヵ月後も陰性であった。
CD 実臨床試験[24] 139例 健常人 中腸TET WMT後1ヵ月間に13.6%の軽度AEが発生した。1ヵ月を超えるAEは観察されなかった。臨床的奏効率および臨床的寛解率は、AE発現群で45%(9/20)および20%(4/20)、AE非発現群で75.6%(90/119)および63.0%(75/119)であった。
高脂血症 実臨床試験[98] 177 例(高脂血症 40 例、正常血中脂質 87 例、低脂血症 50 例) 健常人 経鼻空腸チューブ;大腸 TET 高脂血症群では、WMT 後 33-47 日(35.14%;p<0.001)で高脂血症が正常値に減少し、LDL-C は 34-63 日(33.33%;p=0.013)で正常値に変化した。低脂血症群では、WMT後33~47日以内(p=0.006)に36.36%、34~63日以内(p=0.005)に47.06%が正常値に変化した。血中脂質正常群と動脈硬化性心血管病の低リスク群では、WMT後の変化は統計学的に有意ではなかった。
高血糖 実臨床試験[89] 195例(高血糖20例、正常175例) 健常人 経鼻空腸チューブ;大腸TET WMT後、高血糖患者の72.22%の空腹時血糖は≈1ヶ月以内に正常値まで低下した(p < 0.001)。2ヵ月以内には、有意な脂質降下作用(p = 0.043)が認められた。6ヵ月以内に有意な血圧降下作用(収縮期血圧、p = 0.048)がみられた。
糖尿病 動物実験+ランダム化二重盲検プラセボ対照試験[90]。
動物試験1:マウス(M)-正常グルコース(NG)群(n = 13)、M-糖尿病(DM)群(n = 13)、M-遠位対称性多発神経炎(DSPN)群(n = 13)。
動物実験2: M-NG群(n=6)、M-DSPN群(n=6)。
RCT:WMT群(n=22)、プラセボ群(n=10)。
動物試験:健常人、DSPNではないがDM患者、DSPN患者。
RCT:健常人。
動物試験:経口投与。
RCT:腸中部TET。
動物試験: 遠位対称性多発神経炎を合併した糖尿病患者の糞便をマウスに移植したところ、糖尿病に関連した表現型が移行した。
RCT:84日後、WMTを受けた群ではプラセボ群と比較していくつかの良好な結果が観察された。神経障害症状、神経障害性疼痛、不安レベル、睡眠の質、末梢神経の電気生理学的機能の改善などである。特筆すべきは、中等度から重度の神経障害性疼痛の緩和で、プラセボ群では14.29%に過ぎなかったのに対し、WMT群では53.3%が緩和を経験し、両群間に有意差が認められた。さらに、感覚神経伝導速度はWMT群で有意に増加した。
高血圧実地試験[96] 260例(高血圧73例、正常血圧187例) 健常人 経鼻空腸チューブ;大腸TET WMT後、退院時の血圧は入院時よりも有意に低下した(収縮期血圧の変化: 収縮期血圧の変化:-5.09±15.51、p=0.009;拡張期血圧の変化:-7.74±10.42: -7.74 ± 10.42, p < 0.001). 降圧薬を服用していない高血圧患者でも、収縮期血圧(β=-8.969、標準誤差=4.256、p=0.040)と拡張期血圧(β=-8.637、標準誤差=2.861、p=0.004)の低下が大きかった。
ALS症例報告[99] 1例 健常者 大腸TET;中腸TET 便秘、バランス障害や歩行障害などのALS症状は、WMTの初回コースから良好にコントロールされていた。数ヵ月後、転倒事故により抗生物質が投与され、その後筋緊張が最悪の状態に戻ったが、レスキューWMTにより速やかに改善し、再び疾患の進行を止めることに成功した。微生物分析の結果、WMT治療後の患者の腸内細菌叢の多様性と組成は、健康なドナーに近いことが示された。
ASD実地研究[101] 42人の小児患者 健常者 大腸TET 異常行動チェックリスト、小児自閉症評 価尺度、小児睡眠障害尺度のスコア、便秘と便 形異常のある小児の割合、WBCとグロブリン レベルはすべて、WMT後のASD小児で有 意に低かった。
WMTにより、腹痛の100%(2/2)、下痢の86.7%(13/15)、腹部膨満の69.2%(9/13)、血便の50%(1/2)が改善した。44.4%(8/18)の患者が再発することなく腹部症状から回復し、ICU退院後最低12週間生存した。38.9%(7/18)の患者は、追跡調査中に下痢回数の増加、腹痛、血清アミラーゼ増加、発熱など、WMTに関連したAEを認めた。
放射線腸炎 実臨床試験[105] 5例 健康人 中腸TET;胃カメラ検査 3/5例はWMTに反応し、WMT後8週までに放射線治療腫瘍学グループ (RTOG/EORTC)の晩期毒性グレードがベースラインから1グレード低下したと定義された。WMTによる死亡および感染性合併症は認められなかった。症例4で軽度のAEが1件発生したが、この症例はWMT直後に一過性の吐き気を経験し、24時間以内に自己回復した。
GVHD 実臨床試験[51] 8例 健常人 経鼻十二指腸チューブ 全例が1回目のWMT後に臨床症状の寛解を得た。下痢のあった患者では、WMT後に便の量と回数が3~4回/日に減少した。1回目のWMT後2週間の経過観察で、2人の患者の下痢と他の5人の患者の腹痛はすべて消失した(3人の患者はこの期間内にWMTとは無関係に死亡した)。WMTを受けなかった患者と比較して、これら8人の患者はより高い無増悪生存期間を達成した。
ウイルスの移植
CDI 実臨床試験[19] 5 例 健常人 経鼻空腸チューブ 5 例すべてにおいて、FVT により正常な便習慣が回復し、CDI の症状が最低 6 ヵ月間消失した。レシピエントから採取した糞便サンプルの細菌系統学およびビロームプロファイル解析により、FVT後の微生物群およびウイルス群構造の縦断的な変化が示された。
T2Dおよび肥満 動物試験[20] 40匹のマウスを、低脂肪食(除脂肪コントロール)、高脂肪食(HF)、HF+アンピシリン、HF+アンピシリン+FVT、HF+FVTの5群に分け、14週間経口投与した。FVTは、細菌性およびウイルス性の腸内細菌叢成分、血漿メタボローム、肥満およびT2D関連遺伝子の発現プロファイルを有意に変化させた。
SIBO 動物試験[106] 36匹のマウスを標準食(SD)と高脂肪食(HFD)の2つの食餌群(n = 18ずつ)に分け、HFDを30日間経口摂取させた18匹のマウスでは、FVTは全 FMTと同様の結果をもたらした。FVTは、SDレシピエントにおける常在小腸細菌群集組成の集団密度を有意に変化させなかった。しかし、FVTは小腸細菌組成の移行を誘導し、HFDマイクロバイオームのそれに類似させた。FVT後、HFDを摂取したレシピエントの回腸の細菌密度は減少した。
抗生物質関連ディスバイオシス 動物実験[107] 16匹の抗生物質投与後マウスを2群に分けた: FVT(n=8)またはコントロールとして熱およびヌクレアーゼ処理したFVT(n=8)。 抗生物質投与前のマウス16匹を経口投与 自家由来のビロームの移行により、抗生物質投与後のマウスの細菌群集は再構築され、抗生物質投与前の状態に近い微生物叢プロファイルが得られた。この効果は、非生存性ファージを投与したマウスでは観察されなかった。ビロームのメタゲノム解析から、糞便中のバクテリオファージの存在量と多様性は、FVT群と対照群で経時的に異なることが示された。注目すべきは、FVTによって導入されたファージは、それを投与されたマウスに持続したことである。
NEC動物試験[108] 59頭の早産帝王切開分娩子豚を4群に分けた:直腸FMT投与群(n = 16)、直腸FVT群(n = 14)、胃オロ投与群(n = 13)、生理食塩水投与群(n = 16)健常哺乳子豚 浣腸;経口投与 胃オロFVTはNECを完全に予防し、顕微鏡検査で確認された。経口胃FVTは、コントロールと比較して、回腸粘膜のウイルス多様性を増加させ、プロテオバクテリア相対量を減少させた。粘膜免疫の誘導はFMTに反応して観察されたが、FVTには反応しなかった。オロ胃FVTはまた、体成長率、小腸の相対重量、小腸透過性、粘膜の完全性を含む一連の安全性パラメーターにおいて、FMTよりも良好であった。
CDI、Clostridiodes difficile感染症。UC、潰瘍性大腸炎。CD、クローン病。ALS、筋萎縮性側索硬化症。ASD、自閉症スペクトラム障害。GVHD、移植片対宿主病。SIBO、小腸細菌過剰増殖。NEC、壊死性腸炎。
代謝性疾患においては、最新の研究により、糖尿病の改善におけるWMTの有効性と安全性が実証されている[89, 90] 。動物実験では、遠位対称性多発神経炎を合併した糖尿病患者の糞便をマウスに移植すると、糖尿病の表現型が移行することが観察された。この移行は、腸管バリアーの障害、抗原負荷の上昇、全身性の炎症など、いくつかの潜在的なメカニズムに起因すると考えられる。具体的には、リポポリサッカライド(LPS)は腸管バリアーを破って血流に入ることができた。その後、LPSはToll様受容体4依存的にIL-1β、IL-6、IL-8、TNF-αなどの炎症性サイトカインの産生を誘導し、それによって炎症が促進され、膵島β細胞の損傷が悪化し、その結果、糖尿病の進行が加速された[91]。同じ研究のRCTセグメントでは、凍結WMTが患者の神経障害性疼痛を改善できることが実証された。WMT群では、プラセボ群と比較して神経因性疼痛の有意な改善がみられた(WMT群:53.3% vs プラセボ群:14.29%)[90]。WMT後のこの改善は、腸内細菌叢の酪酸産生能の増加とLPS産生の減少に起因する可能性がある。別の研究では、高血糖患者の72.22%が新鮮なWMT後1ヵ月以内に空腹時血糖値を正常値に回復させたことが報告されている[89]。さらに、WMT後の血圧低下に対する長期的(約6ヵ月間)な効果も高血糖患者で示されている(表2)。 [動物モデルにおけるこれまでの研究から、腸内細菌叢が血圧の調節に関与していることが示唆されている。 [94]。SCFAの減少は神経炎症を引き起こし、血圧にさらに影響を及ぼす可能性がある[95]。臨床では、最近の研究で、新鮮なWMTが高血圧患者に対して短期降圧効果を有することが示された(表2)[96]。ベースラインと比較して、WMT後の高血圧患者では、Senegalimassilia種の存在量が増加し、Parasutterella種およびSolobacterium種の存在量が減少した。これらの種のうち、Solobacterium種は動脈硬化性心血管系疾患との関連が証明されている[97]。脂質異常症患者を対象とした別の研究では、高脂血症患者の35.14%が新鮮なWMT後1ヵ月で血中脂質値が正常に戻ったことが示された[98]。 低脂血症群[98]では、WMT後1ヵ月で36.36%、2ヵ月で47.06%がそれぞれ正常になった(表2)。
最近の症例報告では、筋萎縮性側索硬化症(ALS)の進行を止めるのにWMTが有効であるという臨床的証拠が示され、マイクロバイオームとメタボロームの傾向は、疾患状態の改善と一致していた(表2)[99]。同様に、ASD患者では、マイクロバイオータの組成の変化が、この広汎性発達障害の重要な特徴として研究者により認識されている。 [100] ASDの小児を対象としたレトロスペクティブ研究では、新鮮なWMTによってASDの症状、胃腸障害、睡眠障害、全身性炎症が改善されることが実証されている(表2)[101]。その潜在的なメカニズムは、WMTによって、微生物叢の形成不全と関連するp-クレゾール硫酸や5-ヒドロキシトリプタミンの産生が緩和されることに起因しているのかもしれない[102, 103]。
WMTの方法論は、抗生物質関連下痢症[104]、放射線腸炎[105]、GVHDの治療に関する研究(表2)に記載されているように、2014年以降、中国で広く用いられている[51]。上述のように、WMTは多くの疾患の治療において有効性と安全性を示しており(図2)、研究者にその可能性への確信を与えている。
詳細は画像に続くキャプションにある
図2
図ビューアで開く
パワーポイント
キャプション
3.3 細菌芽胞処理の方法論と送達経路
移植用の細菌を濃縮するもう一つの方法は、糞便から細菌の芽胞を精製することである[25]。細菌の芽胞は、抗生物質治療によって生じるような過酷な環境において生存する手段である。抗生物質では芽胞を死滅させることができないため、このことは臨床医にとって大きな課題となっている。 [21, 110] 非毒素原性細菌の芽胞を精製する方法(図2)には、溶媒処理(50%エタノール中での凍結融解の後、室温で70%エタノール中で2時間の組み合わせ)と精製工程(遠心分離によるペレット化、生理食塩水による洗浄でエタノールを除去、滅菌グリセロールによる再懸濁)が含まれ、植物性細菌、真菌、寄生虫、ウイルスを除去する(表1)。 [これらの工程の後、患者に精製された細菌芽胞を含むカプセルを経口投与する[25, 86]。
3.4 細菌芽胞治療の有効性と安全性
細菌芽胞の精製は、主にCDIの治療と再発予防に用いられている(図2)[21, 110] C. difficileはグラム陽性で芽胞を形成し、毒素を産生する偏性嫌気性細菌である。胞子被膜は、宿主や自然環境からの化学的障害からC. difficileを守る物理的バリアである。2015年にGerdingら[110]は、非毒素原性C. difficile M3株の芽胞を投与することで、CDIの再発を予防できることを報告した。彼らは、非毒素原性C. difficile株M3が毒素原性C. difficileと消化管内で同じ代謝ニッチまたは付着ニッチを競合できると仮定した。最近、SER-109と呼ばれる経口マイクロバイオーム治療薬[21, 86]が開発され、ドナーの≈34の異なる属の生きた精製ファーミキューテス菌胞子から構成され、必須栄養素をC. difficileと代謝的に競合させ、C. difficileによるコロニー形成に対する抵抗性を再確立するために胆汁酸プロファイルを調整する。精製されたファーミキューテス属細菌の芽胞は、CDIの治療において高い有効性と安全性を示している(表2)[111]。2023年4月、SER-109(商品名:Vowst)は、CDIの再発予防を適応症とする経口マイクロバイオータ医薬品としてFDAの承認を取得した。SER-109はC. difficileを死滅させるのではなく、腸内細菌叢のバランスを回復させると考えられているからである。実用的な芽胞の組成はドナーによって異なる可能性があるが、溶媒処理と精製工程を含む改良された方法論は、ドナーのスクリーニングだけに頼ることなく安全性を高めることができる[21]。その上、経口投与とカプセル調製は治療用量の定量化を容易にし[25]、研究の不均一性を低減するのに役立つ。
3.5 糞便細菌移植の将来
糞便から細菌を濃縮してもWMTの有効性が低下しないことが研究で示されているが[24, 56]、ウイルス、微生物分泌物、代謝産物などの一部の物質がほとんど洗い流されていることは注目に値する。より正確な移植用細菌の探索は、微生物叢に基づく療法の開発における新たな傾向である。菌株レベルの多様性と相補性は、FMTの結果を決定する最も強い要因であると考えられており[16]、より正確なシーケンス戦略は、有効性の評価や患者に最も適した濃縮菌の選択に貢献するであろう[112, 113] 。VE303のような、定義された細菌コンソーシアムからなる生きたバイオ治療製品も、安定した有効な結果を示している[36, 114] 。既存のシークエンシング技術は、腸内細菌叢に存在する生物を同定し、その機能的可能性を推測するには十分であるが、どの種がより活性が高く、ヒトの体内で特定の機能的貢献をしているかをピンポイントで特定するには不十分である。この限界に対処するためには、メタトランスクリプトーム解析の導入など、成熟したマルチオミクスシーケンス戦略を採用することができる[115]。その上、ヒトの腸内細菌叢は非常に複雑で不均一な生態系であり、同じ個人の細菌叢の中でさえも大きなばらつきがある。 [116]。ばらつきを抑えた精緻なサンプル採取プロセスや、絶対的マイクロバイオーム測定などのデータ解析技術の向上など、実験デザインに細心の注意を払うことは、大規模で多様な集団全体での定義された細菌コンソーシアムの有効性の証明に関連する課題の克服にも貢献することができる[117]。
4 移植糞便ウィロームの開発
4.1 FVTの方法論と送達経路
バクテリオファージは1915年に発見され[118]、その直後に赤痢の治療への利用が報告されたことから、ウイルス治療の歴史は少なくとも20世紀にまでさかのぼることができる[119]。バクテリオファージは、遺伝子の水平伝播の主要なベクターとして、細菌の進化、多様性、代謝に強い影響を与えることができる。 [35] 近年、研究者らは、腸内ビロームが再発性CDI、[121] IBD、[122, 123] メタボリックシンドローム、[124] GVHD、[125] さらにはがんなど、いくつかの疾患と関連していることを発見している[126] 。再発性CDIに関する研究[17、121、127]では、FMTの恩恵を受けたレシピエントは、Microviridaeの相対的な存在量が増加し、Caudoviralesの存在量が減少していることが示された。これらの結果は、Microviridae科とCaudovirales目がFMTの有効性に極めて重要な役割を果たす可能性を示唆した。さらに、Broeckerら[128]は、安定したバクテリオファージがFMT後少なくとも4.5年間存在し続け、細菌群集よりもFMTの成功との相関が高いことを観察した。ビロームの回復とCDIの再発との間の負の相関は、FMTにおけるビロームの重要な役割をさらに証明することができる。例えば、ある研究[121]では、細菌群集のみが回復したCDI患者は疾患の再発に苦しんだと報告している。FMTに反応しなかったメタボリックシンドロームの患者では、レシピエントとそれぞれのドナーが共有するウイルス群集の差がより大きかった[124]。
ビロームの可能性を示すもう一つの切り口は、疾患と健康におけるビロームの特性の違いである。いくつかの研究で、IBD患者では健常人に比べてCaudoviralesの濃度が増加していることが示されている[123, 129, 130] 。さらに最近の研究[131]では、UC患者のビロームをマウスに移植すると、DSS大腸炎の重症度が悪化し、大腸の長さが短くなり、TNF-αやIL-1βなどの炎症性サイトカインの産生が増加することが示されている。この研究では、リポ多糖のようなビロームの調製に含まれる内毒素の干渉は除外されており、熱で死滅させたビロームを投与したマウスは、UC患者のビロームをそのまま投与したマウスに比べて大腸炎の重症度が軽減していた[131]。これまでの研究では、主に細菌マイクロバイオームの役割に焦点が当てられてきたが [134, 135] 、最近の研究では、腸管GVHDとヘルペスウイルス科およびアデノウイルス科のウイルスとの関連が同定されている [136-138] 。 [139] GVHDの治療には一般的に免疫抑制剤が使用されるが、ある研究では、FMT前のGVHD患者において、バクテリオファージと比較して真核ウイルスの存在率が高いことが明らかにされており [125] 、これは免疫抑制剤の使用と関連している可能性がある。 [140] 同種造血幹細胞移植後のGVHDを発症していない患者と比較して、腸管GVHD患者はファージの豊富さが減少し、DNAウイルス(アネロウイルス科、ヘルペスウイルス科、パピローマウイルス科、およびポリオーマウイルス科)の数と検出率が継続的に増加している。 [141]。最新のメタアナリシスでは、主に酪酸産生菌に関連するウイルスが大腸がん患者で減少していることが判明した[126]。F. prausnitziiのような酪酸産生菌には抗腫瘍原性があり、大腸がんの発症予防に寄与する可能性がある[142]。
FVTは、FMTに代わる可能性のある方法として浮上してきた。糞便マイクロバイオーム全体を移植するのとは異なり、FVTはドナーの糞便中のビロームの移植に焦点を当てている。糞便ビロームを調製するために、細菌よりも小さな孔径のフィルターを用いた無菌調製プロセスにより、ドナーの糞便から細菌を除去する(表1)[19]。これにより、潜在的に有害な細菌を除去しながらビロームを保持することができる。従って、FVTは侵襲性細菌感染のリスクを低下させる可能性がある[17, 143]。注目すべきは、FVTの送達経路が経鼻空腸チューブ[19]、胃管[131]、浣腸など、研究によって異なっていることである(表2)[144]。
4.2 FVTの有効性と安全性
2017年の予備調査では、新鮮な無菌糞便濾過物(糞便ビロームを含む)がCDI患者の症状を緩和する可能性があることが言及された(表2)[19]。この研究はサンプル数が少なく、非ランダム化であったが、患者に大きな利益をもたらしたことから、研究者はFVTをさらに研究する自信を得た。
代謝性疾患では、マウスの研究[20]で、FVTが2型糖尿病(T2D)と肥満の症状の軽減を誘導することが実証された。彼らは、HFDを与えられたマウスの細菌群集の減少したシャノン多様性指数が、痩せたドナーからのFVTを受けると正常レベルに回復することを観察した。また、回腸組織において、Lepr、Klb、Ppargc1a、Igfbp2などの遺伝子発現が増加していることがわかった(表2)。重要なことに、以前の研究[145-148]では、上記のすべての遺伝子とT2Dに対する保護または低体重との間に正の相関があることが証明されている。最近の研究でも同様の結果が得られており、ウイルス誘発性の摂動がin vivoで糞便微生物叢を変化させ、これだけでマウスの痩せ型と肥満型の両方の表現型を誘導するのに十分であることが示されている[149]。さらに、高脂肪食は肥満とT2Dのリスクを高めるだけでなく、腸内細菌叢の組成と機能を破壊し、小腸細菌過剰増殖(SIBO)を含む様々な胃腸障害を引き起こす。マウスを用いた研究[150]では、高脂肪食を30日間摂取させた後、回腸の絨毛間帯がSIBOの特徴である濃密な微生物叢で占められることが観察された[151]。これらのマウスはドナーとなり、標準食または高脂肪食のマウスに糞便移植を行った。研究者らは、FMTとFVTの両方が、健康なマウスの腸内細菌叢を高脂肪食に関連した成分に変換できることを発見した。興味深いことに、FMTとFVTはレシピエントに対して同様の効果を示したが、異なる食餌を与えたマウスでは異なる結果が得られた。高脂肪食を与えたレシピエントの細菌密度は減少したが、標準食を与えたレシピエントの細菌密度は減少しなかった(表2)。この結果は、FMTとFVTの両方がSIBOマウスの正常化に同様の効果をもたらす可能性を示唆している。SIBOは、IBS患者の最大78%において同定されている[152, 153] 。しかしながら、ある研究では、SIBO患者の43.7%(35/80人)が抗生物質治療終了9ヵ月後に再発を経験していることが示されている。他の研究では、特定の疾患の治療には直接関与していないものの、特定の食餌の効果を再現するFVTの可能性が示された。そのような研究のひとつは、緑茶ポリフェノールを摂取させたマウスから調製したFMTまたはFVTが、黄砂誘発大腸炎マウスに及ぼす影響について検討したものである。しかし、FMT後に観察された改善の程度は、FVTよりも優れていた。さらに最近の研究では、A. muciniphilaの相対存在量が高いマウス由来のFVTが、レシピエントにおける常在腸A. muciniphilaの増殖を促進することが示された。驚くべきことに、これは受胎率の改善にもつながった。
また、広域抗生物質によって引き起こされる腸内細菌叢異常症に対処するための戦略も必要である。動物実験[107]では、自己由来のFVT(抗生物質治療前に採取し凍結保存)が抗生物質治療後に腸内細菌叢を再形成できることが示された(表2)。15日間の初回経口投与後、FVTを投与したマウスでは、初期微生物叢と比較して、豊富な分類群(糞便OTUの14%およびセカリス由来OTUの36%)の差が少なかったのに対し、熱処理またはヌクレアーゼ処理したFVTを投与したマウスでは、その差はそれぞれ87%および50%であった。本研究は、抗生物質使用後の腸内細菌叢異常の予防におけるFVTの可能性を示唆した。
FVTは、早産児における壊死性腸炎(NEC)の予防に有効である可能性がある。 [早産子豚を対象に実施された研究から、早産子豚のNECを予防するために、健康な哺乳子豚から糞便材料を採取し、凍結ビロームを用いたFVTを行うことが有効であることが示された[108]。しかしながら、直腸投与FMTは対照群と比較してNECの重症度と発生率を減少させることができなかった(表2)。新生児室におけるNECの微生物叢の特徴として認識されているのは、プロテオバクテリアの相対量の増加とバクテロイデーテスの相対量の減少である。興味深いことに、口内胃FVTは回腸粘膜におけるウイルスの多様性を増加させ、プロテオバクテリアの相対量を減少させたことから、早産児におけるNEC予防のための有望な介入としてのFVTの可能性が強調された。 [108]重要なことに、この研究では、遺伝子発現に有意な変化は観察されなかったことから、ビロームが粘膜免疫を誘導するために宿主免疫細胞に実質的な影響を及ぼさなかったことが示唆された。この知見は、FVTが組織の遺伝子発現を変化させることによってT2Dを改善しうるという、先に議論された研究とは対照的である [20] 。
4.3 糞便ウイルス体移植の将来
糞便ウイルソームの移植は、いくつかの疾患の治療に大きな可能性を示しているが(図2)、その概念はまだ初期段階にある。腸内ビロームの大部分を占めるバクテリオファージは、移植ビロームの有効性に寄与するのに十分かもしれない[160, 161]が、無菌濾過中の代謝産物、タンパク質、細菌断片の寄与を排除することはできない[162, 163]。ひとつは、細菌の細胞壁成分やDNA断片が、宿主の反応を刺激することで効果を発揮していることである[162, 163]。もうひとつは、バクテリオファージと腸内細菌叢との相互作用によって、初期の腸内細菌叢異常が解消されることである[160, 161]。これらのファージは、CDIや抗生物質耐性菌感染症のような病原体主導型の疾患との闘いに有望である。さらに、不適切なウイルス群の導入によって腸内細菌叢障害を悪化させる危険性もある。ヒトの腸内には、パピローマウイルス、ヘルペスウイルス、肝炎ウイルス、ボカウイルス、エンテロウイルス、ロタウイルス、サポウイルスなど、多くの病原性真核ウイルスが存在する。 [169] FMT後にノロウイルス胃腸炎を発症したことから、FMTを介したCDI患者へのノロウイルス感染が報告されている。例えば、バクテロイデーテス(Bacteroidetes)、ファーミキューテス(Firmicutes)、ベルーコミクロビア(Verrucomicrobia)、およびフソバクテリア(Fusobacteria)は、これらの溶原性ファージゲノムをゲノムに挿入することにより、FMT後に抗菌ペプチド耐性amiABCを獲得した[17]。
ファージの特性は、移植ビロームの発達が移植細菌と密接に絡み合っていることを示唆している。このことは、移植細菌に焦点を当てた現在進行中の研究の方向性が、ビロームの役割にも光を当てる可能性があることを示唆している。しかし、有効性、メカニズム、塩基配列の同定、その他ビロームに関連する技術的側面において、まだ大きな進歩が必要である。微生物叢医学は、新たな臨床医学の一分野[39]として、FMTを中核として様々な微生物叢関連技術を統合し、FVTが直面する課題を軽減するための中核的な力として教育を採用することができる。
5 マイクロバイオームのシーケンスとビッグデータ解析技術
微生物の大規模な発見と特性解析が可能な次世代シーケンサー(NGS)技術の普及により、マイクロバイオーム研究は急速に進展している。16S rRNAシーケンス[171]、ショットガンメタゲノムシーケンス(全DNAを対象)[172]、RNAシーケンス[173]を用いて、移植細菌のメカニズムを研究することができる。重要なことは、16S rRNAシーケンシングでは株レベルの変化を検出できないのに対し、ショットガンメタゲノムシーケンシングとRNAシーケンシングでは検出できるということである[174]。株レベルの微生物叢プロファイリングに基づいて、ビッグデータ解析を行うことで、メタゲノミクスの品質管理指標を用いて中核となる腸内細菌叢を同定することができる[175-177]。 [178]。ショットガンメタゲノムシーケンスとRNAシーケンスは、ビロームの移植メカニズム(それぞれDNAウイルスとRNAウイルス)を研究することができる[172, 173]が、DNAまたはRNAウイルスだけではビローム全体を表現することはできない。また、短いリード長や長いシーケンス時間[179]といったNGSの特性は、ビロームの偏った断片的な知識を提供することになる。オックスフォード・ナノポア・テクノロジー(ONT)は、1分子リアルタイム(SMRT)シーケンス技術の1つである[180]。改良されたシーケンスは、1つのウイルス粒子内の変異全体をカバーするゲノム長リード[181]、およびエピジェネティック修飾に関する情報を提供することができる[182]。 [181]。さらに、ハイブリッドおよび超深度メタゲノムシークエンシングは、ビロームのゲノムおよび機能的側面の包括的理解を提供するための重要なシークエンシング戦略である[183, 184]。シークエンシング技術が進歩し続けるにつれて、一般にビッグデータと呼ばれるデータの指数関数的な増加につながり、この豊富な情報を処理および解析するための堅牢な方法の開発が不可欠となる。ビッグデータを扱うこれらの分析戦略は、腸内マイクロバイオームと人体との間の複雑な相互作用の探求を大幅に強化する可能性を秘めている[185]。さらに、マイクロバイオームを通じて精密医療を可能にし、正確な薬剤選択[186]や、がん治療へのテーラーメイドのアプローチ[187]などの医療応用が期待されている。
6 同種または自家移植
移植に使用されるほとんど全ての細菌とビロームは、同種移植で提供された糞便から採取される(表2)。Keらによって提案された興味深いアイデアは、宿主の便サンプルを最適な健康状態で収集し、将来の自家移植のために凍結保存する便バンクを利用した、個人的な微生物ノアの箱舟の作成を提案している[189]。しかしながら、宿主因子に加えて環境因子や食事も腸内マイクロバイオームに大きな影響を与える可能性があるため、便採取に最適な健康状態を決定するにはさらなる研究が必要であることに留意することが重要である[190-192]。中国の少なくとも792人の健康な成人を対象としたいくつかの研究では、農村部と都市部の住民の間で、ビローム、マイコバイオーム、およびアーキオームに有意な差があることが示されており[190-192]、地理、都市化、および食事がマイクロバイオームに強い影響を与えている。
7 結論
FMTが多くの疾患に対して臨床の場で大きな可能性を持つことが、ますます多くの研究によって示されてきている。CDI、抗生物質関連ディスバイオシス、代謝性疾患などを含むディスバイオシス関連疾患に対する次世代のFMTは、おそらく細菌(WMTや精製細菌胞子を含む)またはビローム(FVTを含む)の移植を伴うものと思われる。現在行われている研究のほとんどは、移植の準備に同種移植の糞便を使用しているが、将来的には自家移植も選択肢のひとつになるかもしれない。開発された微生物叢移植や微生物叢に基づく薬剤はすべて、医師の決定に従って大腸TETを通じて投与することができる。すべての変異を含むゲノム長リードを提供する新しいシークエンシング技術は、FMTの開発を改善するのに役立つだろう。まとめると、次世代のFMTは、主に健康なドナーから濃縮された細菌またはビロームを移植するために前進している。
謝辞
本総説の執筆にあたり、Sheng Zhang、Yun Wang、Qianqian Liの各氏には専門的かつ建設的な助言をいただき、またZhili Zhang教授には言葉を磨いていただいた。本研究は、中国国家重点研究開発プログラム(2021YFA0717004)および南京医科大学範大明全人的統合医療研究基金の支援を受けた。
利益相反
Faming Zhangは、GenFMTerおよび経内視鏡的経腸チューブとそれに関連するデバイスのコンセプトを考案した。残りの著者は、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
著者貢献
Y.Y.は情報収集を行い、原稿を執筆した。W.W.は原稿を修正した。F.Z.は、本研究のコンセプトを考案し、原稿を修正し、貴重な示唆を提供した。すべての著者が原稿を読み、掲載版に同意した。
略歴
画像
Faming Zhangは中国南京医科大学医学部教授。彼のチームは革新的なマイクロバイオームと消化管介入療法に焦点を当てている。中国微生物叢移植システムを率い、全国で難治性腸内細菌感染症に対する非営利の洗浄微生物叢移植を行っている。微生物叢医学を新たな臨床分野として提唱し、確立した。
参考文献
PDFダウンロード
戻る
その他のリンク
ワイリーオンラインライブラリーについて
プライバシーポリシー
利用規約
クッキーについて
クッキーの管理
アクセシビリティ
ワイリーリサーチDE&Iステートメントと出版ポリシー
発展途上国へのアクセス
ヘルプ&サポート
お問い合わせ
トレーニングとサポート
DMCAと著作権侵害の報告
チャンス
購読エージェント
広告主・企業パートナー
ワイリーとつながる
ワイリーネットワーク
ワイリープレスルーム
著作権 © 1999-2023 John Wiley & Sons, Inc. すべての著作権はワイリーに帰属します。
この記事が気に入ったらサポートをしてみませんか?
