シロイヌナズナのROSと細菌のT2SS間の負のフィードバックループによって制御される共生生活様式
本文へスキップ
ネイチャー・コミュニケーションズ
検索
ログイン
コンテンツ
Natureについて
掲載
記事
PDFダウンロード
記事
オープンアクセス
公開:2024年1月11日
シロイヌナズナのROSと細菌のT2SS間の負のフィードバックループによって制御される共生生活様式
https://www.nature.com/articles/s41467-024-44724-2

フレデリクソン・エンティラ、シャオウェイ・ハン、...津田健一 著者一覧を見る
ネイチャーコミュニケーションズ15巻、論文番号:456(2024) この記事を引用する
メトリクス詳細
要旨
植物微生物群は、植物の健康を促進する作用があるにもかかわらず、潜在的に有害な微生物も含んでいる。このような条件下で、植物免疫がどのように微生物叢を制御して植物の健康を促進するのかは、まだほとんど分かっていない。我々は、健康なシロイヌナズナから分離した常在細菌が、免疫受容体に依存した多様なパターンの活性酸素種(ROS)産生を引き起こすこと、また特定の常在細菌、特にXanthomonas L148を選択的に阻害するNADPHオキシダーゼRBOHDを完全に阻害することを見出した。ランダム変異導入により、我々は、タイプII分泌システム(T2SS)コンポーネントをコードするL148 gspEが、rbohD変異体植物に対するXanthomonas L148のダメージ効果に必要であることを見出した。インプラントでの細菌トランスクリプトミクスから、RBOHDがgspEを含むほとんどのT2SS遺伝子の発現を抑制することが明らかになった。gspEが活性酸素または突然変異によって阻害された場合、L148のコロニー形成は細菌性病原体から植物を保護した。このように、シロイヌナズナの活性酸素と細菌のT2SSの間の負のフィードバックループは、潜在的に有害な葉の常在菌を手なずけ、宿主に有益な微生物に変える。
他の人が見ている類似コンテンツ
植物NADPHオキシダーゼRBOHDは葉における微生物叢のホメオスタシスに必要である
論文 2021年6月30日
セバスチャン・プファイルマイヤー、ガブリエラ・C・ペッティ、...ユリア・A・フォアホルト
日和見性キサントモナス病原体からのT2SS依存的酵素分泌によって引き起こされる葉のマイクロバイオーム・ディスバイオシス
論文公開 2024年01月03日
セバスチャン・プファイルマイヤー、アンニャ・ヴェルツ、...ユリア・A・フォアホルト
植物免疫の一部としての一般的な非自己応答
論文 2021年05月17日
ベンジャミン・A・マイヤー, パトリック・キーファー, ... ユリア・A・フォアホルト
はじめに
自然界では、植物は植物微生物叢と呼ばれる多様な微生物を宿主としている1。植物微生物叢は総体として植物の健康に寄与しているが、相互扶助的な微生物から通性微生物、病原性微生物まで様々な微生物から構成されている2。微生物の相互扶助性、通性、病原性は、宿主や環境条件によって異なる3,4。従って、植物微生物叢は単に有益な微生物の集まりではなく、様々な要因が植物微生物叢内の微生物の性質に影響を与え、結果として植物の健康を決定する。
微生物分子を認識すると、植物は一連の免疫応答を活性化する5。パターン・トリガー免疫(PTI)として知られる免疫の第一層では、細胞膜に局在するパターン認識レセプター(PRR)が微生物関連分子パターン(MAMP)を認識する。例えば、PRRであるFLAGELLIN SENSING 2 (FLS2)とEF-TU RECEPTOR (EFR)は、それぞれシロイヌナズナの細菌由来オリゴペプチドflg22とelf18を感知する6,7。BRI1-ASSOCIATED RECEPTOR KINASE 1 (BAK1)とその近縁ホモログBAK1-LIKE 1 (BKK1)は、FLS2やEFRなどのLRR-RLK型PRRの共受容体として機能している8。LysM-RLK CHITIN ELICITOR RECEPTOR KINASE 1 (CERK1)は、真菌のキチンや細菌のペプチドグリカンに対する必須の共レセプターである9。活性化されたPRRは、活性酸素種(ROS)の産生、カルシウムの流入、MAPキナーゼの活性化、転写のリプログラミング、防御植物ホルモンや特殊な代謝産物の産生など、様々な免疫反応を引き起こす10。PTIは病原体抵抗性だけでなく、健全な微生物叢の維持にも寄与していることは、PTI応答が著しく低下したA. thalianaの遺伝子型の葉で観察された、微生物叢の形成異常や病徴によって証明されている11,12。しかしながら、PTIに関連する免疫応答が、微生物病原体を制御し、健全な微生物叢を維持する分子メカニズムは、依然として不明である。
PTIの顕著な出力のひとつは、細胞膜に局在するNADPHオキシダーゼRESPIRATORY BURST OXIDASE HOMOLOG D (RBOHD)の活性化であり、このオキシダーゼは細胞外で活性酸素O2-を生成し、アポプラストでスーパーオキシドジスムターゼを介してH2O2に容易に変換される13。細胞外活性酸素は、細胞膜に局在するセンサーによって感知され、細胞内に移行して植物の免疫応答を媒介することができる14。細胞外活性酸素はまた、微生物に直接細胞毒性を及ぼすこともできる15。活性酸素は、病原体に対する抵抗性だけでなく、植物微生物叢の組成や機能も制御する。例えば、RBOHDを介した活性酸素産生は、A. thalianaの根圏におけるシュードモナドを抑制する16。RBOHDはまた、Xanthomonas L131とその近縁株であるL148を抑制することで、A. thalianaの葉におけるdysbiosisを禁止している。このことは、合成細菌群集を接種したrbohD変異体植物において、発病に関連したそれらの豊富なコロニー形成によって示されている17。植物のRBOHDが介在する活性酸素は、有益な細菌であるBacillus velezensisにおいて植物ホルモンであるオーキシンの産生を誘導し、A. thalianaにおいて根のコロニー形成を促進する18。これらの研究は、植物微生物叢の制御におけるRBOHDを介した活性酸素産生の重要性を例証している。しかしながら、活性酸素が微生物の代謝と成長をどのように特異的に制御しているのかは、まだ不明である。さらに、活性酸素は生物に対して一般的な細胞毒性を示すが、すべての微生物が植物が産生した活性酸素に感受性を示すわけではない。例えば、細菌病原体Pseudomonas syringae pv. tomato DC3000(Pto)の増殖は、A. thalianaのRBOHDの変異によって影響を受けなかった19。このことは、活性酸素が微生物に対してさまざまな作用を示すことを示しているが、この選択性の根拠を探る必要がある。
細菌病原体がエフェクタータンパク質を分泌して宿主植物に効率よく感染するためには、分泌系が重要である。その中でもIII型分泌系(T3SS)は、多くの植物病原細菌の必須病原性コンポーネントとしてよく知られている20。T3SSの重要な機能は、III型エフェクター(T3E)を宿主細胞に直接導入することであり、それによって植物の免疫を抑制し、病原性を促進する20。窒素固定根粒菌の中にも、マメ科植物宿主との共生を促進するためにT3SSを利用するものがある21,22。細胞内のヌクレオチド結合ドメインであるロイシンリッチリピートレセプター(NLR)によって認識され、エフェクタートリガー免疫を活性化するT3Eも数多く同定されている23。これらのことは、宿主と細菌の相互作用にT3SSが極めて重要であることを示している。T3SSに加えて、II型分泌系(T2SS)が多くの植物病原性細菌の病原性に必要であることが示されており、宿主のバリアを分解し、病原性を促進する酵素を分泌する機能がある20。興味深いことに、根の常在菌であるDyella japonica MF79は、A. thalianaの非免疫抑制性常在菌の根のコロニー形成を助ける免疫抑制因子を放出するために、T2SSの構成要素gspDとgspEを必要とする24。しかし、植物の免疫機構が微生物叢のT2SS活性を制御しているのか、またどのように制御しているのかは不明である。
本研究では、RBOHDを介した活性酸素に着目し、健康なアケビから分離した常在菌に対するアケビ免疫応答の影響を調べた。細菌ランダム変異導入スクリーニングとin planta細菌トランスクリプトミクスを用いて、RBOHDが介在する活性酸素が、潜在的に有害なXanthomonas L148のT2SSを直接抑制し、Xanthomonas L148を常在菌にすることを明らかにした。さらに、この「飼いならされた」Xanthomonasは、細菌病原体Ptoに対する宿主抵抗性を増加させた。
結果
異なる常在細菌は、異なるメカニズムで多様な活性酸素産生パターンを引き起こす
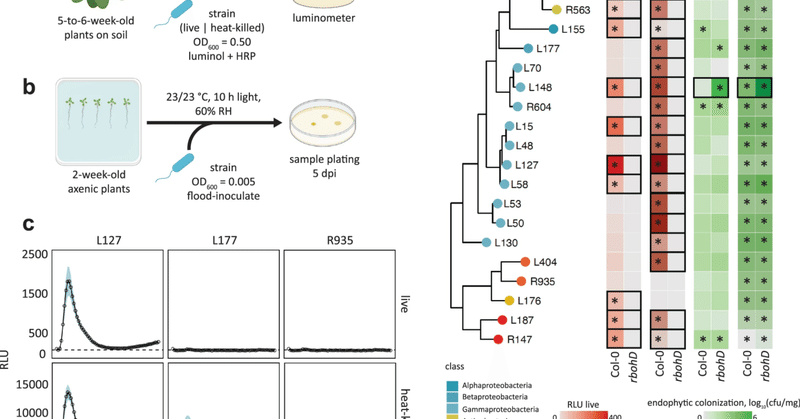
我々は、アブラナ科植物の葉において、異なる常在細菌のコロニー形成によって引き起こされる免疫応答の変化を、活性酸素産生を指標として調べた。まず、fls2、efr、erk1、fls2 efr cerk1 (fec)、bak1 bkk1 cerk1 (bbc)、rbohD変異体、およびCol-0野生型の葉において、MAMPs flg22、elf18、およびキチンヘプタマーに応答した活性酸素産生を測定した。活性酸素産生は、対応する(共)受容体およびRBOHDに依存しており、本実験系が適切であることが示された(図1aおよび補足図S1)。次に、同じ変異体パネルの葉で、分類学的に多様な20種類の常在細菌(生きたまま、あるいは熱で殺したもの)に対する活性酸素産生を測定した(図1d)。常在細菌は、以前に健康なA. thalianaの葉や根、土壌25から分離され、植物と細菌の共トランスクリプトミクス26に用いられた。これらの常在細菌は、RBOHD依存的に多様な活性酸素産生パターンを引き起こしたが、これは葉から分離した菌株の熱死細胞を用いた最近の知見と一致している17。例えば、Pseudomonas L127は、生菌と加熱死菌の両方で活性酸素産生を引き起こしたが、加熱死菌の方がより強い活性酸素産生を引き起こした。一方、Burkholderia L177は、加熱死菌のみが活性酸素産生を誘発したが、生菌は誘発しなかった。さらに、フラボバクテリウムR935は、生菌でも加熱死菌でも活性酸素産生を誘発しなかった(図1dおよび補足図S2)。活性酸素を誘導する能力や、これらの常在菌が分離された由来組織を予測する明らかな系統学的特徴は観察されなかった。また、常在菌が誘導する活性酸素のMAMP(共)レセプターに対する依存性も異なっていた。例えば、生きたExiguobacterium L187と熱で殺したExiguobacterium L187の両方による活性酸素産生はEFRに依存していたが、FLS2とCERK1には依存していなかった。常在細菌による活性酸素産生に対するこのEFR依存性は、他の株でも観察された。その多くは、efr葉ディスクに対する活性酸素バーストは減少または消失していたが、fls2とcerk1に対してはかなりの活性酸素シグナルが検出されたからである(補足図S2)。これらの結果は、EFRを介したEF-Tu由来ペプチドの認識が、A. thaliana葉における常在細菌による活性酸素産生の主要なメカニズムであることを示唆している。しかしながら、fecおよびbbc変異体植物において活性酸素を刺激するシュードモナスL127のような常在細菌も存在したことから(補足図S2)、flg22、elf18、ペプチドグリカン以外のMAMPが常在細菌によって誘導される活性酸素産生に関与している場合もあることが示された。
図1:モノアソシエーションにおける微生物叢メンバーの免疫原性およびコロニー形成プロファイル。
図1
5~6週齢のCol-0植物の葉ディスクを生菌または熱死菌細胞(OD600 = 0.5)で処理したときの活性酸素バーストアッセイ(a)、および2週齢のCol-0植物に5dpiで洪水接種(OD600 = 0.005)したときの微生物叢メンバーのコロニー形成能(b)の模式図。c Pseudomonas L127、Burkholderia L177、Flavobacterium R935について、それぞれ免疫活性株、侵食性株、静止性株という異なる挙動を示す代表的な株の活性酸素バーストプロファイル(活性酸素バーストプロファイルの全容は補足図S2を参照)。結果は、平均値の標準誤差を示すエラーバーと影を付けたLOESS(Locally Estimated Scatter Plot Smoothing)を用いて折れ線グラフで示した。d Col-0およびrbohD植物の葉における、選択された微生物叢メンバーの系統関係、および生細胞と熱キル細胞を用いた対応する活性酸素バーストプロファイルのヒートマップ表示、およびそれぞれのコロニー形成能力;*は、モックと問題の細菌株との間の形質の有意な遺伝子型内差を示す;□は、Col-0とrbohD植物との間の形質の有意な株内差を示す(Tukeyのポストホック検定による両側ANOVA、P≦0.05)。実験は、活性酸素アッセイでは8生物学的複製を、コロニー形成アッセイでは3-4生物学的複製を、それぞれ少なくとも2回繰り返した(コロニー形成プロフィールの全容は補足図S3、含まれる菌株の詳細な説明は補足データ1を参照)。一部の図はBioRenderで作成した。
フルサイズ画像
植物由来の活性酸素は常在菌のコロニー形成に異なる影響を与える
生きている常在細菌と熱で死滅させた常在細菌のすべてによる活性酸素産生は、RBOHDに完全に依存していることがわかり、RBOHDが主にこれらの常在細菌によって引き起こされる植物の活性酸素産生に関与していることが示された。RBOHDを介して植物が産生した活性酸素は、常在菌のコロニー形成に影響を与える可能性がある。次に、Col-0野生型、rbohD、およびfls2、efr、fec、bbc変異植物の葉において、さまざまな常在菌の総菌価と内生菌価を測定した。寒天平板上で14日間植物を生育させ、個々の常在細菌を洪水接種した後、菌力価を測定した(図1b、補足図S3)。驚いたことに、MAMP(共)受容体変異体の一部では、Col-0野生型植物と比較して、いくつかの常在菌のコロニー形成が増加していることが観察されたものの、rbohD変異が常在菌のコロニー形成全体に及ぼす影響も、内生常在菌のコロニー形成に及ぼす影響も、ほとんど検出できなかった(図1dおよび補足図S3)。また、活性酸素免疫原性と常在菌のコロニー形成能との間に有意な関係は見られなかった(補足図S4)。一方、rbohD変異体では、Xanthomonas L148の全コロニー化およびエンドファ イティコロニー化の両方が、Col-0野生型植物と比較して劇的に増加した(図1dおよび補 足図S3)。このことは、RBOHDが介在する活性酸素がXanthomonas L148のコロニー 化を抑制することを示唆しており、最近の知見と一致している17。
Xanthomonas L148はrbohD変異体に有害であるが、Col-0野生型植物には有害ではない
rbohD変異体植物の葉に生きたXanthomonas L148をコロニー形成させると、無症状の野生型Col-0植物とは対照的に、接種後5日(dpi)以内に宿主の死亡に至った(図2a)。直交系では、葉にXanthomonas L148を浸潤させ、3dpi後にrbohDでのみ病害様症状を観察した(図2b-d)。このことから、Xanthomonas L148の病原性はROS経路によって抑制されている可能性が示唆された(図2e)。さらに、Xanthomonas L148は3dpiの時点で、Col-0と比較してrbohD変異体では葉の表面にとどまるだけでなく、アポプラストに積極的にコロニー形成した(図2f)。以上より、Xanthomonas L148は潜在的に病原性を有し、その悪影響はRBOHDの欠如に依存することが明らかとなった。
図2:Xanthomonas L148はrbohD変異体には有害であるが、Col-0野生型植物には有害でない。
図2
a-c 代表的な画像(a)と、植物の健全性パラメータとしての緑色組織面積の定量化(c)。寒天平板上で生育させた14日齢のCol-0およびrbohD植物に、モックおよび生熱死(HK)Xanthomonas L148(OD600=0.005)をフラッド接種した。b-d モック、Xanthomonas L148、Pto(OD600 = 0.2)を手で浸潤した葉(d)の代表的な画像(b)と緑色組織の割合の定量。e 5-6週齢のCol-0およびrbohD植物体の葉ディスクを生きたままおよび熱で殺したXanthomonas L148(OD600=0.5)で処理した葉のROSバーストプロファイル(少なくとも4回の独立した実験)。 5)(8生物学的複製を用いた少なくとも4回の独立実験、n≧40および32、それぞれCol-0およびrbohD植物)。 f, 寒天平板で生育させた14日齢のCol-0およびrbohD植物にXanthomonas L148を浸水接種した際の感染動態(OD600 = 0.005)。葉のサンプルは0~3dpiで採取し、全体および内生コンパートメントについて調べた(3~4生物学的複製を用いた2回の独立実験、n=14、9、9、21、0、1、2、3dpi)。cとdの結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)にまたがり、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。e, f)の結果は、LOESS(Locally Estimated Scatter Plot Smoothing)を用いた折れ線グラフで示し、エラーバーと影は平均値の標準誤差を示す。異なる文字は統計的に有意な差(P≦0.05)を示す。
フルサイズ画像
キサントモナスL148のin vitro増殖は活性酸素の影響をほとんど受けない
活性酸素は反応性が高いため、細菌の成分を酸化させ、細胞に大きなダメージを与える。このことは、Xanthomonas L148がrbohD変異体には病原性を示すが、Col-0野生型植物には病原性を示さない理由を説明できるかもしれない。我々は、H2O2またはO2-1にin vitroで瞬間的に暴露することにより、活性酸素化合物に対するXanthomonas L148の感受性を調べた。驚いたことに、Xanthomonas L148は活性酸素による急性処理に耐性があるようで、H2O2およびO2-1濃度1 mMまで生存能力を維持した(補足図S5a, b)。同様の結果は、活性酸素発生化合物であるパラコート(PQ、補足図S5c)を用いても得られた。in vitroにおける活性酸素の悪影響は、継続的な活性酸素処理によってのみ観察されると言える。しかし、PQに慢性的に曝露しても、Xanthomonas L148の増殖速度に有意な影響は観察されなかった(補足図S5d)。このことから、rbohD植物におけるXanthomonas L148の増殖は、活性酸素の直接的な殺微生物作用によるものではなく、他のメカニズムによるものであることが示唆された。
Xanthomonas L148の病原性は、他の葉の微生物相の存在によって部分的に抑制される。
Xanthomonas L148は、自然の生息地で栽培された巨視的に健康なA. thaliana植物から分離され、A. thalianaの本来の葉の微生物叢の構成要素であることが示された。Xanthomonas L148は、単結合条件下ではrbohD変異体植物に有害であったが、微生物群集環境では、Xanthomonas L148は解除され、rbohD植物は無症状になると推測される。このことを検証するために、葉に強固に定着し、葉の常在細菌叢27,28,29の主要な門をカバーすることが判明した9つの葉由来の分離株からなる合成細菌群集を構築し、これをLeafSCと呼んだ(補足図S6a、株の詳細については補足データ1を参照)。また、LeafSC全体に対するXanthomonas L148の割合を変えて、発病の用量依存性を評価した。L148P1は合成群集の各メンバーと等しい用量(Xanthomonas L148/LeafSC, 1:9)、L148P9は合成群集の全菌量と等しい用量(Xanthomonas L148/LeafSC, 9:9)である。Col-0およびrbohD植物にLeafSCを洪水接種しても、観察可能な病徴は見られなかった(補足図S6bおよびc)。予想されたように、Xanthomonas L148を接種すると、rbohD株はCol-0野生型株と比 較してかなり枯死した。また、他の微生物株が存在する場合、Xanthomonas L148の殺傷活性はrbohD植物でやや低下したが、Xanthomonas L148を高用量用いるとこの逆効果は克服された(補足図S6bおよびc)。これらの結果は、機能的な葉の微生物叢が、おそらくニッチ占有、資源競合、あるいは抗生物質を通じて、rbohD植物におけるXanthomonas L148による病害症状の部分的軽減に寄与していることを示唆している。
Xanthomonas L148::Tn5変異体スクリーニングにより、その病原性の遺伝的決定因子が明らかになった。
Xanthomonas L148は条件付き病原体であり、その病原性は植物宿主にRBOHDが存在しない場合に発揮される。我々は、ゲノムワイドな変異体スクリーニングを通して、この形質の細菌遺伝的決定因子を同定することを目的とした。我々は、頑健なハイスループットスクリーニングプロトコルを開発・最適化し(図3a、補足図S7a)、Xanthomonas L148 Tn5変異体ライブラリーを作製・検証した(補足図S7b-d)。ハイスループット・プロトコルを用いて、このTn5変異体ライブラリーをrbohD欠損死亡率について表現型解析した。6,862株のトランスポゾン挿入変異株から、214株の候補株が一貫してrbohD変異株で病原性を発揮しなかった(図3b、候補変異株の全リストは補足データ2参照)。ほとんどの214株は、リッチTSB培地または最小XVM2培地でのin vitro増殖パラメーター(増殖速度、バイオフィルム形成、運動性)に大きな欠損を示さなかった(図3c)。214株のうち、機能的注釈のある遺伝子にトランスポゾンが挿入されていたのは124株だけであった。これらの菌株を正方形平板寒天培地で再試験したところ、18の細菌変異体が一貫してrbohD欠損による死亡を示した(図3b)。これらの18株のうち、3株は非常に強い表現型を示した。すなわち、gspE::Tn5、alaA::Tn5、rpfF::Tn5である(図3d-f)。候補遺伝子gspEはT2SSのコアATPアーゼをコードし、alaAはアミノ酸代謝に関与するアラニン合成トランスアミナーゼをコードし、rpfFは細菌のクオラムセンシング機構の構成要素である拡散性シグナル伝達因子(DSF)の合成酵素をコードする(図3e)。
図3:Xanthomonas L148::Tn5変異体のスクリーニングにより、その病原性の遺伝的決定因子が明らかになった。
図3
a Xanthomonas L148::Tn5変異体ライブラリーの最適化されたハイスループット遺伝子スクリーニングの模式図。b. 214株のXanthomonas L148::Tn5候補株で破壊された遺伝子のゲノム座標。合計6862株のXanthomonas L148::Tn5株を96穴ハイスループット形式でrbohD殺傷活性の喪失についてスクリーニングした(2回の独立実験)。その結果、機能的アノテーションを持つ124株が同定され、その後寒天平板法を用いてスクリーニングを行った結果、18株が強固な表現型を持つことが判明した。c 候補株214株のin vitro表現型:リッチTSB培地での増殖速度、バイオフィルム産生、運動性、最小XVM2培地での増殖速度とバイオフィルム産生。それぞれ2-3個の生物学的複製を含む2つの独立した実験から得られたデータを用いて、両側ANOVAとポストホック有意差最小(LSD)検定を行った。赤および青のバーは、それぞれ野生型 Xanthomonas L148 より有意に高い、または低いことを示す(P≦0.05)。 d-f col-0およびrbohD植物にXanthomonas L148::Tn5株(OD600 = 0.005)を単独接種したときの代表的な画像(d)、および植物の健全性パラメータとしての緑色組織面積の定量(f)。サンプルは5dpiで収穫した。少なくとも4つの独立した実験から得られたデータ(n = 114, 112, 115, 114, 75, 64, 55, 53, 44, 40、左から3-4生物学的複製)を用いて、Tukeyのポストホック検定による両側ANOVAを行った。e 候補遺伝子の機能をグラフ化したもの。(f)の結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)にまたがり、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。イラストの一部はBioRenderで作成されています。
フルサイズ画像
T2SS、アミノ酸代謝、クオラムセンシングがXanthomonas L148の条件付き病原性を支える
葉浸潤アッセイを用いて候補変異株を再評価した。その結果、熱で死滅させた菌では同様の反応が得られなかったことから、病害の進行には生きたXanthomonas L148が必要であることが示された(図4a)。これまでのシステム(ハイスループットおよび正方形プレートセットアップ)と同様、変異株は rbohD変異株で病徴を引き起こす能力を失った(図4a)。先に示したように、野生型Xanthomonas L148は、rbohD変異株の葉の全コロニーと内生コンパートメントの両方でコロニー形成の増加を示した。一方、gspE::Tn5変異体は、Col-0葉ではXanthomonas L148野生型と同程度の内生コロニーを示し、葉全体のコロニー形成能はわずかに低かったが、rbohDでは野生型L148とは対照的に、Col-0植物と比較してコロニー形成能の増加を示さなかった(図4b)。一方、alaA::Tn5変異株はCol-0植物でのコロニー形成能が低下したが、rpfF::Tn5変異株は野生型Xanthomonas L148と同程度にrbohD葉にコロニー形成した。それにもかかわらず、すべての変異株は葉内 層に定着しただけでなく、活発にコロニー形成することができた(図4b)。このことは、gspE::Tn5 変異株はその内生コロニー形成能力を保持する一方で、野生型 L148 と比較して rbohD 株に効率よくコロニー形成する能力は低下していることを示している。相関分析の結果、宿主のコロニー形成と植物の健全性の間に負の関係があることが明らかになり、観察された葉の症状は野生型株の積極的なコロニー形成によって説明できることが示された(図4d)。
図4:T2SS、アミノ酸代謝、およびクオラムセンシングが、rbohD植物におけるXanthomonas L148の条件付き病原性を支えている。
図4
a 5-6週齢のCol-0およびrbohDの葉にXanthomonas L148::Tn5変異株および野生型株を手で浸潤し、生細胞および熱死細胞を接種材として用いて緑色組織面積を定量した(OD600 = 0.2)。サンプルは3dpiで採取した(3-4生物学的複製で各2回の独立実験、加熱死菌については左からn=8, 15, 16, 17, 14, 12, 15, 16, 14、生細胞については左からn=15, 15, 16, 18, 18, 13, 19, 16, 18, 18)。b Xanthomonas L148::Tn5変異株および野生株(OD600 = 0.005)をaxenic Col-0およびrbohD植物に浸水接種した際の感染動態。サンプルは0~3dpiで全葉と内生葉を採取した(各2回の独立実験、3~4生物学的複製、n≧24)。異なる文字は、統計的に有意な差(P≦0.05)を示す。 b 遺伝子型、コンパートメント、dpi内の細菌株を比較するために実施されたポストホックTukey's検定付き両側ANOVA。異なる文字(Col-0は大文字、rbohDは小文字)は、遺伝子型、コンパートメント、dpi内での統計的に有意な差(P≦0.05)を示す。a,b)の結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。 c, 5~6週齢のCol-0およびrbohD植物の葉ディスクを、生きたままおよび熱で殺したXanthomonas L148野生株およびL148::Tn5変異株で処理したときの活性酸素バーストプロファイル(OD600 = 0. 5)(8 生物学的複製を用いた少なくとも 4 つの独立した実験、n = 24)。 d, e 全区画(d)および内生区画(e)における細菌のコロニー形成能力(R2、決定係数)に対する緑色組織面積として測定された植物の健康性能のピアソン相関分析。c、d、e)の結果は、局所推定散布図平滑化法(LOESS)を用いてプロットし、エラーバーと影は平均値の標準誤差を示した。
フルサイズ画像
つの変異株はいずれも、リッチTSB培地での増殖、バイオフィルム産生、運動性のいずれにも欠陥がなかった(図5a-c)。また、変異株はPQ処理にも感受性のないままであり、慢性的な活性酸素暴露に対する耐性が保持されていることが示された(図5a)。最小XVM2培地でのin vitro増殖表現型も、gspE::Tn5およびalaA::Tn5変異株でバイオフィルム産生が増加した以外は変化しなかった(図5d)。植物細胞壁に作用する細胞外酵素の分泌は、植物病原菌が宿主の物理的バリアを突破するために用いる典型的な戦略である20。細菌性病原体はしばしばT2SSを利用して、これらの酵素を植物宿主のアポプラストに送り込む30。我々は酵素分泌プレートアッセイを実施し、これらの菌株がさまざまな基質(炭水化物、タンパク質、脂質)を分解できるかどうかを調べた。野生型キサントモナスL148株は、ゼラチンや脱脂粉乳などのタンパク質、ペクチンやカルボキシメチルセルロースなどの炭水化物を分解する細胞外酵素を分泌することができた。注目すべきことに、gspE::Tn5変異株は、野生型や他の変異株とは対照的に、これらの基質を分解できなかったか、あるいはその程度が低かったことから、分泌活性が損なわれていることが示された(図5e, f)。このことから、gspE::Tn5変異株を用いたrbohD株で病害が進行しなかったのは、T2SSを介して宿主植物の細胞壁を分解する細胞外酵素を分泌できなかったためと考えられる。
図5:Xanthomonas L148のgspE::Tn5変異株は細胞外分泌活性が低下している。
図5
a, b Xanthomonas L148::Tn5候補変異株のTSBにおける増殖曲線(a)および増殖速度(b)。c TSB培地におけるXanthomonas L148::Tn5候補変異株のバイオフィルム産生および運動性(各2-3生物学的複製を用いた2つの独立した実験、n = 6) d XVM2培地におけるXanthomonas L148::Tn5候補変異株の増殖曲線、増殖速度およびバイオフィルム産生(各2-3生物学的複製を用いた2つの独立した実験、n = 6) e TSB培地におけるXanthomonas L148::Tn5候補変異株のバイオフィルム産生および運動性(各2-3生物学的複製を用いた2つの独立した実験、n = 6)。e 菌株の分泌活性のプレートアッセイの一例(L148 = 野生型Xanthomonas L148; gspE::Tn5; alaA::Tn5; rpfF::Tn5; Xcc = Xanthomonas campestris pv. campestris; Xoo = X. oryzae pv. oryzae; Pto = P. syringae pv. tomato DC3000; Eco = E. coli HB101; and E. coli HB101)。coli HB101;およびモック)。 f 0.1%の基質(タンパク質:ゼラチンおよび牛乳;炭水化物:ペクチン、カルボキシメチルセルロース、α-セルロース、キシラン、デンプン;脂質: 脂質:Tween20)を28℃で2日間インキュベートした(3生物学的反復)。酵素指標は、2~3日後の菌株による基質分解を示すクリアランスゾーンからコロニーの大きさを差し引いて算出した。 b-d 成長率μは、成長曲線に沿って5時間のウィンドウでローリング回帰を実行し、最大勾配を決定して算出した。 b-f 異なる文字は、統計的に有意な差を示す(両側ANOVAとポストホックTukey検定、P≦0.05)。(b-d)の結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)にまたがり、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。(a-d)の結果は、局所推定散布図スムージング(LOESS)を用いた折れ線グラフで示し、エラーバーと影は平均値の標準誤差を示す。
フルサイズ画像
Xanthomonas L148の病原性の進化を知るために、AtSPHERE25に含まれる病原性の近縁種Xanthomonas L13117とXanthomonas L70を含む他のXanthomonadales属のゲノムと、いくつかのXanthomonas属の植物病原体について、分泌系の出現とCAZymeカタログの可能性を調べた。一般的に、すべてのXanthomonadales株はT1SSとT2SS遺伝子の両方をコードしていた(補足図S8a)。病原性および病原性の可能性のあるXanthomonadales株は、植物細胞壁成分(α-、β-グルカン、α-マンナン、アラビナン、セルロース、ヘミセルロース、キシラン、アラビノキシラン、ペクチン)に対するCAZymeレパートリーを広げている(補足図S8b、c)。このことから、分泌系はキサントモナデス属の菌株に広く見られるが、CAZymeレパートリーの拡大は病原性株や潜在的病原性株の重要な特徴である可能性がある。
in planta、ex planta、in vitroの表現型から、我々はgspE::Tn5変異体に注目し、広範な特性解析を行った。gspEがrbohD依存性の病原性を決定することを立証するため、相同組換えにより2つの独立したgspE欠失変異株(ΔgspE_1およびΔgspE_2)を作製した。gspE欠失変異株とgspE::Tn5変異株はともに分泌活性の低下を示し、rbohD植物では発病しなかった(図6a, b)。以上のことから、T2SSの重要な構成要素であるgspEは、rbohD変異株におけるXanthomonas L148の病原性に必須であることが明らかとなった。
図6:T2SSの構成要素gspEは、Xanthomonas L148のrbohd依存的病原性の消失の遺伝的決定因子である。
図6
a 5dpiで野生型Xanthomonas L148、gspE::Tn5変異体および2つのΔgspE株をaxenic Col-0およびrbohD植物に浸水接種した(OD600 = 0.005)画像。b 5dpiで細菌株を接種したCol-0およびrbohD株について、植物の健全性パラメータとして緑色組織面積を測定した(それぞれ3-5生物学的複製を用いた2回の独立実験、模擬株および細菌株についてそれぞれn = 40および45)。異なる文字は統計的に有意な差を示す(両側ANOVAとTukeyのポストホックテスト、P≦0.05)。(b)の結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)にまたがり、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。
フルサイズ画像
植物の活性酸素は、Xanthomonas L148のgspEを含むT2SS遺伝子を抑制する。
Xanthomonas L148の病原性は、活性酸素の非存在下でRBOHDを介して発揮されるが、in vitroの結果は活性酸素の一般的な細胞毒性を示していない。従って、RBOHDを介した活性酸素産生がXanthomonas L148の病原性を抑制していると推測できる。このことを明らかにするために、我々はCol-0およびrbohD植物についてin plantaでXanthomonas L148細菌のトランスクリプトーム・プロファイリングを行った26。植物にXanthomonas L148を浸水接種し、2dpiの時点で新芽を採取した。この時点では、細菌力価はまだ区別できないが、その後、3dpiの時点でCol-0とrbohDの葉の間で有意差が生じた(図2f)。したがって、この時点で観察された細菌のトランスクリプトームから、発現の違いが細菌のトランスクリプトームに影響を与えることが知られている細菌の集団密度の違いによるものである可能性を除外することができる31。
主成分(PC)解析の結果、in plantaのXanthomonas L148トランスクリプトームはCol-0とrbohD植物で異なっていた(図7b)。統計解析の結果、Col-0とrbohDの葉のin planta細菌トランスクリプトームを比較すると、2946の差次的発現遺伝子(DEG)が見つかった(閾値:q値<0.05): Col-0ではrbohD植物と比較して563遺伝子が発現上昇し、2474遺伝子が発現低下しており、RBOHDの影響を受けて葉のコロニー形成時にグローバルな細菌のトランスクリプトームが再構成されることが示された(図7aおよびc、DEGの詳細については補足データ3を参照)。rbohDと比較してCol-0で差次的に発現した遺伝子は、Tn5変異体スクリーニングの候補遺伝子として捕捉された(候補214個のうち、73個が発現低下、29個が発現上昇)が、これらの候補遺伝子はむしろ発現が低かった(超幾何検定、***p-value = 1.00E-10)。gspEを含むほとんどのT2SS装置遺伝子は、col-0ではrbohDに比べて発現が低下していた(図7c-e)。6つのXanthomonas L148::Tn5変異体はCAZymesとしてアノテーションされた遺伝子に挿入があり、そのうちの5つはcol-0においてrbohD接種植物と比較して有意に発現が低下していた。Col-0植物で有意に発現低下したCAZymesは、植物細胞壁成分であるセルロース、ペクチン、α-グルカン、β-グルカン、β-マンナンを分解する可能性がある(図7c、補図S9)。パスウェイ濃縮解析の結果、クラスター3、9、14のような発現が増加した遺伝子クラスターは、走化性と付着に関連する生物学的機能に濃縮されている(K15125、K13924、K05874)。一方、クラスター8、10、12のようなCol-0で発現が減少した遺伝子クラスターは、輸送と解毒プロセスに関与するパスウェイに濃縮されている(K02014とK00799、図7f。)
図7:植物の活性酸素は、Xanthomonas L148のgspEを含むT2SS遺伝子を抑制する。
図7
a Col-0およびrbohD植物における野生型Xanthomonas L148のin planta細菌トランスクリプトームランドスケープのヒートマップ表示。2週齢の植物の葉にL148を洪水接種し、2dpiでサンプルを採取した。遺伝子クラスターは、正規化リードカウントのk-meansクラスタリングに基づいている。DEGはq-value < 0.05に基づいて定義された。c CAZymesとT2SS構成遺伝子をハイライトしたDEGのボルケーノプロット。g gspE、alaA、rpfFのRNA-Seq正規化カウント。 h gspE、alaA、rpfFのin planta発現プロファイリングのための独立したqRT-PCR実験。実験はRNA-seqと同様に、3-4生物学的複製でそれぞれ2回の独立実験を行った(左からn = 11, 10, 11, 11, 10, 10)。i TSB±10μM PQで24時間培養したXanthomonas L148野生株におけるgspE、alaA、rpfFのin vitro発現プロファイリング(各2回の独立実験、3-4生物学的複製、n=8, 8, 8, 8, 7, 8、左から)。(g-i)中の異なる文字は、統計的に有意な差を示す(両側ANOVAとTukeyのポストホックテスト、P≦0.05)。(g-i)の結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)にまたがり、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。一部のイラストはBioRenderで作成。
フルサイズ画像
さらに詳しく調べると、同定された候補遺伝子gspEとalaAの発現は、rbohDと比較してCol-0では強く抑制され、rpfFはわずかにダウンレギュレートされていた。このことは、これらの遺伝子が免疫不全野生型Col-0植物において病気の進行を防ぐために必要であり、その結果制御されているという仮説を支持している(図7g)。これらの知見は、qRT-PCRを用いた独立した実験でも再確認され、すべての候補遺伝子がrbohD植物と比較してCol-0では抑制されていた(図7h)。このことから、活性酸素がこれらの遺伝子の発現を直接制御していることが推測される。そこで、Xanthomonas L148細菌細胞をPQ存在下でin vitro培養し、遺伝子発現解析を行った。その結果、候補遺伝子gspE、alaA、rpfFの発現が、活性酸素に慢性的に曝露されると、Xanthomonas L148で抑制されることがわかった(図7i)。これらの知見を総合すると、Xanthomonas L148のコロニー形成がRBOHDを介した活性酸素産生を引き起こし、Col-0植物の病原性に関連する遺伝子、特にT2SSの構成遺伝子の発現を直接阻害していることが示唆される。一方、rbohD変異株では活性酸素の産生がないため、Xanthomonas L148の病原性のスイッチが入り、発病に至る。
RBOHDが介在する活性酸素がXanthomonas L148を防御細菌に変える
葉圏微生物叢は葉面病原体から保護することが知られており32、したがって、条件付きで病原性を持つ微生物叢のメンバーであっても、植物宿主に有益なサービスを提供する可能性がある。この疑問に答えるため、Col-0およびrbohD植物を野生型Xanthomonas L148またはgspE::Tn5変異株で5日間前コロニー形成させた後、細菌病原体Ptoと接触させた。Xanthomonas L148とPtoの菌力価は、0dpiと3dpiの葉内および葉全体について測定した。Xanthomonas L148はrbohD変異株を死滅させたため、この条件下でのPto力価を測定することはできなかった。野生型Xanthomonas L148またはgspE::Tn5変異体のいずれかをあらかじめコロニー形成したCol-0株は、Ptoに対する抵抗性が増加した(図8a-c)。興味深いことに、gspE::Tn5株で前培養したrbohD変異株は、Ptoに対する抵抗性が増加した(図8a, c)。さらに、gspE::Tn5株で前培養したCol-0およびrbohD株は、Ptoチャレンジ後、非接種株よりもわずかに良好な植物性能を示した(補足図S10a, b)。このことは、Xanthomonas L148の保護的な役割が、gspE依存的な病原性から遺伝的に切り離されていることも示している。Ptoによる侵入は、Xanthomonas L148およびgspE::Tn5の個体数の有意な減少をもたらさなかった(図8b)ことから、常在菌であるXanthomonas L148の病原体侵入に対する強いコロニー形成能力と抵抗性が示された。以上の結果から、RBOHDによって産生された活性酸素は、潜在的に有害なXanthomonas L148を、病原体の侵襲的なコロニー形成に対する防御菌に変えることが示唆された。
図8:RBOHDが介在する活性酸素は、Xanthomonas L148を有益な細菌に変える。
図8
a, b 寒天平板上で生育させた14日齢のCol-0およびrbohD植物に、野生型Xanthomonas L148およびgspE::Tn5(OD600 = 0.005)を5日間フラッド接種した後、Ptoを噴霧感染させた。細菌力価は0dpiと3dpiで測定した(a, Pto; b, L148)(2つの独立した実験、それぞれ6(a)または3-5(b)の生物学的複製、n≥12)。異なる文字は統計的に有意な差を示す(両側ANOVAとTukeyのポストホックテスト、P≦0.05)。a,b)の結果は箱ひげ図として描かれ、箱は四分位範囲(IQR、25~75パーセンタイル)にまたがり、中央線は中央値を示し、ひげはIQRの1.5倍を超えない最小値と最大値をカバーする。 c 潜在的に病原性のあるXanthomonas L148常在菌との共生による植物ROSライセンシングのメカニズムモデル。T2SSは宿主にCAZymesを供給し、細胞壁を分解してDAMPsを放出するか、あるいはCAZymesをMAMPとして作用させる。活性酸素はキサントモナスL148の病原性を抑制する分子ビーコンとして働き、特にT2SSの活性を低下させることによって、植物宿主による細菌の活性の負のフィードバック制御をもたらす。葉の微生物叢は、植物体内ではXanthomonas L148に弱い影響を与える(破線)。野生型Col-0植物では、活性酸素および微生物叢が介在するXanthomonas L148の抑制が、L148の宿主植物との協調的な挙動を促進し、ひいてはその後の葉面病原体による侵入に対する防御機能を付与していると考えられる。植物の活性酸素が存在しないrbohD変異株では、キサントモナスL148の病原性が解き放たれ、結果として病気が発生する。一部のイラストはBioRenderで作成。
フルサイズ画像
考察
植物がどのように微生物を認識し、植物体内でシグナルを伝達するかについては広範な研究がなされているが、免疫出力がどのように微生物の成長や行動を制御しているかについては、まだほとんど分かっていない。さらに、なぜ特定の微生物が特定の免疫応答に敏感なのか、そのメカニズム的な説明もほとんど欠けている。本研究では、健全なシロイヌナズナから単離した分類学的に多様な20種類の細菌に対して、初期免疫出力としてのRBOHDを介した活性酸素バーストが与える影響を調べ、RBOHDを介した活性酸素バーストと細菌のコロニー形成との関連性が低いことを示した(補足図S4)。これらの結果から、シロイヌナズナは常在細菌を認識し、活性酸素を産生するが、ほとんどの常在細菌のコロニー形成には検出できるほどの影響を与えないことが示唆された。このことは、微生物シグナルの認識、それに続く免疫シグナルのカスケード、そして微生物コロニー形成の制限につながる免疫の実行は、それぞれ異なる事象であるという考え方を浮き彫りにしている。このことは、常在細菌の植物応答とトランスクリプトーム応答は、感染の初期段階ではほとんど連関しないという、われわれの以前の発見を裏付けるものである26。MAMPに対する植物の反応は、必ずしも植物と微生物の相互作用の結果に影響を与えるわけではない。病原性細菌由来のMAMPsも、常在細菌由来のMAMPsも、同じPTI応答を誘導することができるからである33,34。また、異なるタイプのMAMPsやその変異体は、定量的に異なる免疫応答の強さを引き起こす可能性があり、これらの分子パターンを検出しても本質的に同じ免疫出力が得られるとは限らず、異なるMAMPsや特定の微生物が持つMAMPsのカタログによって、異なる免疫出力が活性化される35,36,37,38。したがって、微妙な刺激の組み合わせの認識、シグナルのカスケードの引き金、そして最終的に微生物に対する植物免疫応答の影響は、微生物株ごとに調整される。本研究では、RBOHDが介在する活性酸素が、葉の常在菌であるXanthomonas L148の成長と挙動を変化させるメカニズムを明らかにした。これは、植物の免疫応答が、潜在的に病原性を持つ微生物叢のメンバーの成長と挙動をどのように操作するかについての理解を大きく前進させるものである。
我々は、植物の活性酸素が、潜在的に病原性のある葉の微生物叢のメンバーであるXanthomonas L148の行動を調節することによって、その共生を可能にしていることを実証した。その結果、植物宿主は、ROSを分子メッセージとして、この微生物叢メンバーの増殖を抑制し、協力と共存を可能にしていることが明らかになった。生態学的および還元論的研究により、病原性を持つ可能性のある菌株が、病気を引き起こすことなく植物宿主に生息していることが明らかになっており、これらの菌株は植物微生物叢の正真正銘の構成要素であると考えられている29,33,39,40。これらの潜在的に有害な菌株の中には、単独で宿主に有害な作用を及ぼすものもある29,33,39,40,41,42。しかし、これらの潜在的病原微生物の悪影響は、宿主、環境、共存する微生物によって異なる17,39,40,41,42,43,44,45。高湿度下でのPTIと小胞子輸送経路の同時欠損が、植物体内の生物異常と植物病害を引き起こすことが示されている11,12。活性酸素が微生物叢の構造、組成、機能を調節するというのは、多細胞生物に共通するパターンのようだ。マウスでは、ミトコンドリア由来の活性酸素の減少は、腸内細菌叢の多様性の増加と関連している45。また、大腸でNOX1経路を介して産生される活性酸素は、Citrobacter rodentiumの嫌気性増殖を促進し、上皮環境をリモデリングする46。植物では、活性酸素は、植物由来の活性酸素の有害な影響から保護するために、有益な根粒菌Bacillus velezensisによる植物ホルモンオーキシンの分泌を誘導し、B. velezensisの効率的な根のコロニー形成を可能にする18。根での活性酸素産生は、シュードモナスの根圏での定着を制約する16。また、RBOHDを介した活性酸素産生が、潜在的に有害な細菌を寄せ付けないようにすることで、葉の微生物叢の恒常性を維持するために不可欠であることも、遺伝学的に示されている17。とはいえ、植物宿主が微生物叢の潜在的病原性細菌を選択的に抑制するメカニズムや、これらの菌株が宿主にとって機能的であるかどうかは、依然として不明である。ゲノムワイドなトランスポゾン変異体スクリーニングと植物体内トランスクリプトミクスにより、我々は、潜在的病原性常在菌であるXanthomonas L148のT2SSをダウンレギュレートすることで病原性を抑制する一方で、有益な機能を促進するために、植物の活性酸素がシグナル伝達の手がかりとして働くことを明らかにした。細菌のトランスクリプトーム・ランドスケープの大規模なリプログラミングは、細胞壁のリモデリング47,48、宿主のシグナル伝達49、気孔反応50,51など、RBOHD13の多様な役割に起因する可能性があるが、我々の試験管内実験は、RBOHDによって産生された活性酸素がXanthomonas L148の挙動を調節するという考えを支持するものであった。
葉圏微生物叢の他のメンバーも、キサントモナスL148の有害な影響の軽減に部分的に寄与している可能性がある。このことは、L148の近縁株であるXanthomonas L131がrbohD変異株に対して有害な影響を及ぼすという観察結果17と一致している。植物微生物群の近縁で無害な菌株は、病原性を持つ可能性のある菌株と競合したり拮抗したりするため、病害の進行は防げるが、自然界ではこれらの菌株の存続と共存が可能になる23,41。しかし、この常在菌が介在する保護機能は、植物の遺伝子型によっては失われ、特定の有害なシュードモナス菌株が微生物群集を支配するため、この現象は品種や菌株に特異的である41。このように、潜在的に病原性のある菌株を微生物叢の中に入れるには、宿主の免疫部門がその機能と行動を厳しく制御する必要があり、植物微生物叢の他のメンバーによって部分的に促進されている。
我々は、Xanthomonas L148の病原性がT2SSの構成要素gspEに依存していることを証明した(図3d-fおよび6a, b)。gspE::Tn5変異株のrbohD変異株に対する殺傷効果の消失は、その分泌活性の低下とrbohD葉へのコロニー形成の阻害によって説明できる(図4b、5e、f、6a、b、図7c、および補足図9a、b)。同じ遺伝子は最近、rbohD植物におけるXanthomonas L148の葉の分解と病原性の原因であることが判明しており、他の葉常在菌のために基質を放出し、結果的に葉圏微生物叢の組成を促進するよう機能している52。T2SSはしばしば植物病原菌によって利用され、植物細胞壁を分解するCAZymesを供給することで、宿主の侵入を可能にし、病害を促進する30。例えば、T2SSは、根の常在菌であるDyella japonica MF79が宿主に効率的に定着することを可能にし、病原性Dickeya dadantiiの病原性に必要である24,53。これらのことから、T2SSは微生物が宿主組織に定着する際に重要な役割を果たすことが示唆され、微生物の行動を操作するために宿主の標的となることが考えられる。また、分泌されたCAZymesは、その酵素作用により、CAZymeをMAMPとして直接認識したり、認識された植物由来の損傷関連分子パターン(DAMPs)を放出したりすることで、活性酸素バーストなどの免疫応答を引き起こす可能性もある54,55,56。実際、T2SSを欠損したgspE::Tn5 L148変異体は、野生型L148よりも活性酸素の放出が少なかったが、熱で殺した野生型L148とgspE::Tn5変異体では活性酸素バーストが区別できないことから、T2SSを介したCAZymeの分泌が活性酸素応答をさらに増強している可能性が示唆された(図4c)。植物の活性酸素は、T2SSの発現を抑制することで、CAZymesを介したL148の侵入に対する対抗防御として働くのかもしれない(図7c、補足図9a, b)。gspE::Tn5変異体は、野生型L148と比較して、野生型Col-0植物の葉内生育は同程度であったが、全植物コロニー形成はわずかに減少した。しかし、gspE::Tn5変異体は、野生型L148とは対照的にrbohDではコロニー形成の増加を示さなかった(図4b)。このことは、活性酸素が不完全ながらもT2SS活性を減弱させ、Xanthomonas L148を野生型Col-0植物の常在菌として機能させていることを示唆している。従って、我々は、Xanthomonas L148とCol-0植物との相互作用は、宿主の活性酸素レベルによって駆動される微妙なバランスに基づいており、その結果、潜在的に病原性のある常在菌を制御する負のフィードバックループが生じるというモデルを提案する(図8c)。我々の遺伝子スクリーニングとin planta細菌トランスクリプトーム解析(図3bと7a;補足データ2と3)からも、Xanthomonas L148の条件付き病原性は、アミノ酸代謝(alaA、DAO、speD、prnA)、クオラムセンシングと細菌シグナル伝達(rpfF、rsbu_P)、表面接着(sphB1、pilD)、抗酸化代謝(ubiB)を含む複数の経路に依存していることが示唆された。さらに、病原体Ptoに対するXanthomonas L148の植物保護機能は、gspE依存的な病原性とは遺伝的に連関していない。gspE::Tn5変異体は、Col-0およびrbohD変異体のいずれにおいても、Ptoに対して有意な抵抗性を付与することができるからである(図8a、補足図S10a, b)。gspE::Tn5変異体は、葉のコロニー形成が少ないにもかかわらず、野生型Xanthomonas L148よりもCol-0植物に対してより優れた病原体防御能を示した。このことは、効率的なコロニー形成が必ずしも病原体防御につながらないことを示唆している。この発見は、強固にコロニー形成する多くの微生物株が、病原菌の攻撃から植物を保護しなかったという最近の知見と一致している32。活性酸素を調整したXanthomonas L148が病原体を防御するメカニズムについては、さらなる研究が必要である。RBOHDを介した活性酸素がキサントモナスのT2SSを標的にするという我々の発見は、植物免疫が活性酸素を介してT2SSを抑制することにより、潜在的に有害な植物微生物叢のメンバーを監視するというメカニズムと概念を提供する。
我々は、植物微生物叢の個々のメンバーに対する反応において、免疫反応性の3つのクラスに分類できる異なる活性酸素バーストパターンを明らかにした:免疫活性株は無傷の細胞で活性酸素を誘発する;免疫侵襲株は熱で殺されたときのみ活性酸素を誘発する;免疫静止株は生死にかかわらず活性酸素を誘発しない(図1c、dおよび補足図S2)。免疫貪食性株は、MAMPの放出を阻止したり、自己由来のMAMPを分解・隔離するタンパク質を分泌したり、宿主の免疫成分を標的にして免疫の活性化を抑制したりすることで、自分の存在を隠している可能性がある57。
A.thalianaのほとんどの微生物叢メンバーは、表面に常在するPRR EFRを通して認識されることが観察された(補足図S2)。このことは、我々の実験セットアップでは、EF-Tuペプチドが防御プログラムを引き出す主要な細菌分子として機能していることを示している。これと一致して、efr変異株では野生型Col-0株に比べてコロニー形成が増加する株が多く、微生物認識とコロニー形成との基本的な関連性が強調された(補図S3)。私たちの観察はまた、A. thalianaの自然集団において、EFRが様々なMAMPエピトープに対する応答のもっともらしい遺伝的決定因子として見出されたGWAS研究と一致する58。EFRはアブラナ科の系統特異的な変異であるが7、他のEF-Tu断片はまだ知られていないレセプターによって認識され、イネの品種によっては免疫原性を示すようである59。また、A. thaliana EFRのソラマメ科植物への家族間移入は、病原体に対する広範な耐性を付与するのに十分であり、EFR認識の下流で働く構成要素は、少なくとも部分的には進化的に保存されていることを示している60。これらの知見は、EF-Tuペプチドが様々な植物種で宿主を検出するための一般的な微生物モチーフである可能性を示唆している。
新たな証拠によると、植物免疫は、タンパク質の翻訳を含む一般的な微生物代謝への影響に加えて、病原性に必要な微生物プロセスを調節する31,61。例えば、分泌型アスパラギン酸プロテアーゼSAP1は、A. thalianaの葉においてPtoタンパク質MucDを切断することにより、Ptoの増殖を阻害する62。植物はエフェクター・トリガー免疫の際、Ptoの鉄獲得システムを標的にしてPtoの成長を阻害する31。防御植物ホルモンであるサリチル酸と特殊な代謝産物であるスルフォラファンは、病原性PtoのIII型分泌系を阻害する61,63。これは、植物が機能的な微生物叢を維持する必要があり、潜在的に有害な微生物が宿主にサービスを提供する可能性さえあるため、微生物を排除するよりも優れた植物戦略となりうる。
方法
植物材料と生育条件
A. thaliana Col-0は野生型であり、本研究で用いたすべての変異体の遺伝的背景である。変異体fls26 (SAIL_691C4), efr7 (SALK_068675), cerk19 (GABI_096F09), fec11, bbc11, およびrbohD13 (atrbohD D3)については既報の通りである。寒天平板アッセイでは、種子をCl2ガスで2時間殺菌した64。その後、1%スクロースを加えた0.5×Murashige and Skoogs (MS)培地寒天培地上で、4℃で2-3日間層別化し、5日間発芽させた後、スクロースを含まない0.5×MSプレートに移植した。植物は、23℃/23℃(昼/夜)、10時間の光照射のチャンバー内で生育させた。その後、14日齢の苗に細菌株を接種し、指示された時点で収穫または表現型を決定した。ROSバーストおよび浸潤病態アッセイでは、植物を温室の土壌で5~6週間、23℃/23℃(昼夜)、10時間照明、相対湿度60%の条件下で生育させた(使用した植物の遺伝子型の詳細については補足データ5を参照)。
細菌株と生育条件
AtSPHERE 由来の細菌株はすべて既報25。Pseudomonas syringae pv. tomato DC3000 (Pto) および Pto lux については既報65,66。すべての細菌株は、0.5x Tryptic Soy Broth(TSB)で24時間培養した後、遠心分離で回収し、滅菌水で2回洗浄し、適切なOD600に希釈した(使用した細菌株のリストは補足データ1を参照)。
活性酸素バースト測定
ROSバーストはSmith and Heese, 2014に若干の修正を加えた方法で測定した67。簡単に説明すると、細菌株をTSB中、28℃で16~18時間、200rpmで振盪しながら培養した。細胞を回収し、滅菌水で2回洗浄した後、滅菌水でOD600 = 0.5に希釈した。アッセイ前日、23 °C/23°C(昼/夜)、10時間光照射のチャンバー内で生育させた5~6週齢の植物から、同じ生理状態と大きさの葉のディスク(4 mm)を収穫し、30分ごとに滅菌水で2回洗浄し、96ウェルプレート中の滅菌水に浸し、同じ生育チャンバー内で20時間インキュベートした。アッセイに先立ち、エリシテーション溶液は、2.5 mLの細菌懸濁液に5 µLの500倍ワサビペルオキシダーゼ(HRP、P6782-10MG、Sigma-Aldrich)と5 µLの500倍ルミノール(A8511-5G、Sigma-Aldrich)を加えて調製した。 5mLの細菌懸濁液、1μMのMAMP溶液(flg22 [ZBiolab inc.]、elf18 [Eurofins]、キチンDP7 [N-アセチルチトヘプタオース、GN7、Elicityl])、またはモックとして滅菌ナノ純水を添加した。アッセイ中、96ウェルプレートから水を注意深く取り除き、100μLのエリシテーション溶液を96ウェルプレートに加えた。ルミノメーター(TrisStar2 Multimode Reader、Berthold社製)を用いて、最小限の遅延で60分間の発光測定を行った。
常在細菌コロニー形成アッセイ
すべての菌株を0.5×TSBで24時間培養し、遠心分離で菌体を回収した後、滅菌水で2回洗浄し、滅菌水に懸濁した(最終OD600 = 0.005)。0.5×MS 培地寒天培地上で、23 °C/23°C(昼/夜)、10 時間照明のチャンバー内で生育させた 2 週齢の苗に、これらの細菌懸濁液を洪水接種し(1 プレートあたり 15 mL、1 分間インキュベート)、水切りし、5 分間風乾した後、同じ生育チャンバー内でインキュベートした。葉のサンプルは3~5dpiで無菌的に採取し、重量を測定し、2つのコンパートメントにプレーティングした。全コンパートメントでは、葉をホモジナイザー(TissueLyser III、Qiagen)を用いて10mM MgCl2で直接ホモジナイズし、10mM MgCl2で連続希釈し、0. 5×TSB寒天培地にプレーティングした。内生菌コンパートメントでは、葉を70%エタノールで1分間表面殺菌し、滅菌水で2回洗浄した後、ホモジナイズし、連続希釈し、全コンパートメントと同様にプレーティングした。コロニーを28℃で増殖させ、1~3日間写真を撮った。コロニー形成はcfu mg-1サンプルとして表した。
細菌変異体の作製
Xanthomonas L148::Tn5ライブラリーは、Xanthomonas L148とpuTn5TmKm268を保有するE. coli SM10λpirとのコンジュゲーションにより構築した。得られた交配プラークを希釈し、カナマイシンとニトロフラントインを添加したTSB培地にプレーティングし、それぞれL148形質転換体の選択と大腸菌に対するカウンターセレクションを行った。ライブラリー全体を構成するために、約7000個のコロニーを摘出し、0.5×TSBで再成長させ、グリセロールストックとして分注し、-80℃で保存した。このXanthomonas L148::Tn5ライブラリーから約20株をランダムに選択し、nested PCR(プライマーFDE117とFDE118を用いた1回目のPCR;プライマーFDE119とmTn5ACを用いた2回目のPCR)によりゲノムへのTn5挿入を確認し、最終アンプリコンをサンガー配列決定した(詳細は補足データ6を参照)。gspEの標的欠失変異体の作製には、pK18mobsacB自殺プラスミド69(GenBank accession: FJ437239)を、Phusion Taqポリメラーゼ(F-5305、Thermo Scientific)を用いてPCR直線化した(プライマーFDE234およびFDE235); 直鎖化したpK18mobsacBと末端配列が重なるgspEコード配列の上流(プライマーFDE278およびFDE279)および下流(プライマーFDE280およびFDE281)のフランキング領域750bpを、Phusion Taqポリメラーゼ(F-5305、サーモサイエンティフィック)を用いて増幅し、配列を確認した。プラスミド構築物は、Gibson cloning70 (E5510S, New England Biolabs)を用いて、製造者の指示に従って組み立てた。プラスミド構築物を大腸菌細胞(DH5α株)に形質転換し、ヘルパー株pRK60071との三親交配によりXanthomonas L148に導入した。形質転換体はカナマイシンとニトロフラントインを用いて選択し、2回目の相同組換えは0.5×TSB中でスクロースを用いて誘導した。欠失変異体は個々に摘出され、グリセロールストック中で-80℃で保存され、PCR(インサートを有するプラスミドの存在についてはプライマーFDE196およびFDE197を用い;ゲノム中のgspE遺伝子の存在についてはプライマーFDE125およびFDE126を用い;そしてゲノム中のgspE遺伝子の除去についてはプライマーFDE279およびFDE280を用いる)およびサンガー配列決定によって検証され、そして10μg/mLのカナマイシンを含む0.5×TSB上でプレーティングされた。真の欠失変異体はプラスミドを含まず、gspE遺伝子を失い、カナマイシンに感受性でなければならない(使用したプライマーとPCRプロファイルのリストは補足データ6を参照)。
L148::Tn5ライブラリー96ウェルスクリーニング
rbohDの苗を96ウェルプレートに500μLの0.5×MS寒天に1%スクロースを加えて各ウェルで生育させ、23℃/23℃(昼/夜)、10時間の光で14日間培養した。同時に、Tn5挿入変異体(~7000個のコロニー)をTSBを含む96ウェルプレートで28℃、200rpmの攪拌で飽和するまで3日間培養した。得られた細菌懸濁液を6倍に希釈し(その結果、1mL当たり~6×109個の細菌細胞が得られた)、20μLのアリコートを苗に接種した。植物は5日後の生存率について表現型を決定した。その結果、214株のXanthomonas L148:: 2回の独立した96ウェルプレートによるスクリーニングでrbohD殺傷活性の消失を示したTn5候補株214株について、ネステッドPCR(プライマーFDE117とFDE118を用いた1回目のPCR、プライマーFDE119とmTn5ACを用いた2回目のPCR)を行い、ゲノム中のTn5挿入遺伝子座を同定するために遺伝子型を決定し、最終アンプリコンをサンガー配列決定した(使用したプライマーとPCRプロファイルのリストはSupplement Data 6、Supplement Fig. S7). 機能的アノテーションを持つ遺伝子に挿入を持つ124のXanthomonas L148::Tn5候補変異体(リストは補足データ2を参照)を、寒天培地で生育させた植物を用いてさらにスクリーニングし、常在菌コロニー形成アッセイについて記述したように表現型を再評価した。
インビトロアッセイ
瞬時活性酸素処理では、Xanthomonas L148を24時間増殖させ、ペレット化し、OD600 = 0.02に希釈した。500μLの菌体懸濁液を最終濃度0~2000μMのH2O2(H10009-500ML、Sigma-Aldrich)と混合し、30分間インキュベートした後、コロニー数を測定するためにプレーティングした。同様に、500μLの細菌懸濁液を1mMのキサンチン(X7375-10G、Sigma-Aldrich)および10U/mLのウシ乳由来キサンチンオキシダーゼ(X4875-10UN、Sigma-Aldrich)と混合してO2-1を生成し、異なる時点でサンプルをプレーティングした(1mLのキサンチンは1Uのキサンチンオキシダーゼで1mLのO2-1に変換され、pH 7. 5、25℃、1分で1molのO2-1に変換されるため、0、2、4、10、20、40、60、80分の培養で、それぞれ0、50、100、250、500、1000、2000μMに相当するO2-1が生成されるはずである)のコロニー数を測定した。活性酸素への慢性的曝露は、活性酸素発生化合物であるパラコート(856177-1 G、Sigma-Aldrich)をTSB±10 µMで3日間培養し、分光光度計(Tecan Infinite Microplate reader M200 Pro)を用いてOD600を測定し、増殖曲線と増殖率を算出することで行った。候補の Xanthomonas L148::Tn5 変異体は、分光光度計(Tecan Infinite Microplate reader M200 Pro)を用いて OD600 での吸光度を測定しながら、140 µL の TSB または XVM2(Xanthomonas 菌株用に設計された最小培地72)を添加した 96 ウェルプレートで 3 日間、初期接種量 10 µL OD600 = 0.1 の細菌培養を行い、in vitro で表現型を決定した。得られた培養液を水で静かに短時間洗浄し、プレート上に付着した細胞を0.1%クリスタルバイオレット(27335.01、Serva社製)で15分間染色した。この染色を125μLの30%酢酸(A6283、Sigma-Aldrich)で可溶化し、分光光度計(Tecan Infinite Microplate reader M200 Pro)を用いてOD550でバイオフィルム形成を定量した。運動性は、0.8%寒天を含む0.5×TSB上の細菌培養物(OD600 = 0.1)に点接種して測定し、2~3日後にコロニーサイズを測定した。分泌活性のプロファイリングは、0.1%の目的の基質(炭水化物:ペクチン、カルボキシメチルセルロース、α-セルロース、キシラン、デンプン;タンパク質:牛乳およびゼラチン;脂質: 脂質:Tween 20)、28℃で2日間インキュベートした。ゼラチンについては、プレートを飽和過硫酸アンモニウム中で15分間インキュベートすることにより、分解のハローを可視化した。糖鎖については、0.1% Congo red (C-6767, SigmaAldrich)で15分間プレートを染色した後、6ppm NaCl溶液(0601.1, Roth)で洗浄することによりクリアランスゾーンを可視化した。すべてのプレートは、染色手順の前後に写真撮影した。酵素指標は、透明化ゾーンをコロニーサイズで割って算出した。
インプランタ細菌RNA-Seq
in planta Xanthomonas L148 RNA-SeqはNoboriら73.に従って行った。簡単には、寒天平板で生育した2週齢の植物にXanthomonas L148(10 mM MgCl2中、OD600 = 0.005)をフラッド接種し、Col-0とrbohD植物の間で細菌集団が同程度になった2dpiの時点で〜150株の新芽を収穫し、サンプルごとにプールした。サンプルは収穫し、液体窒素中でスナップ凍結し、RNA抽出まで-80℃で保存した。全実験を3回繰り返した。サンプルは金属ビーズで破砕し、単離バッファー73 と共に4℃で24時間インキュベートした。細菌細胞は6μmのフィルターメッシュを通して植物組織から分離し、1300 gで10秒間遠心分離した。TRIzol(15596026、Invitrogen)を用いて細菌ペレットからRNAを単離し、Turbo DNase(AM1907、Invitrogen)で処理した後、Max Planck-Genome-Centre Cologneに送り、Illumina HiSeq 3000システムを用いて、150 bp鎖特異的シングルエンドリードで、植物リボ欠失とcDNAライブラリー構築によるRNAシーケンス(Universal Prokaryotic RNA-Seq Library Preparation Kit、Tecan)を行った。得られたリードを、Rsubreadパッケージ74のデフォルトパラメーターでalign()関数を用いてXanthomonas L148ゲノム25にマッピングし、BAMファイルを作成した。マッピング率は20-46%で、期待値32の範囲内であった。マッピングされたリードは、BAMファイルからfeatureCounts()関数を用いてDESeq275を用いてカウントし、解析前にlimmaパッケージ76のvoom()関数を用いて正規化した。RNA-Seqのraw readsと処理されたデータは、NCBI GEOリポジトリにアクセッション番号GSE226583で寄託された。
品質チェック(PCAによるバッチ効果の評価、およびデータの分散に関するMAプロット)に合格した後、limma76のeBayes()関数を用いて線形モデル(遺伝子発現~0 + 遺伝子型 + rep; contrast = Col-0 - rbohD)およびEmpirical Bayes統計を用いて差次発現遺伝子を決定した。偽発見率はqvalue77を用いてp値で説明した。有意に発現差のある遺伝子の閾値はq-value < 0.05とした。prcomp関数を用いて主成分分析を行い78 、NbClustパッケージのNbClust()関数を用いて最適なクラスター数を決定し79 、k-meansアルゴリズムでクラスターのメンバシップを計算し80 、ComplexHeatmapパッケージのHeatmap()関数を用いてヒートマップを作成し81 、R82 のclusterProfilerパッケージのenricher()関数を用いて、同定された各遺伝子クラスターについてパスウェイの濃縮解析を行った。
合成群集実験
23℃/23℃(昼/夜)、10時間照明のチャンバー内で寒天培地に生育した2週齢の植物に、Xanthomonas L148を葉由来の合成群集(LeafSC、9葉の蔓延株および機能性葉単離株27,28,29)と一緒に、または葉由来の合成群集(LeafSC、9葉の蔓延株および機能性葉単離株27,28,29)を含まない2種類の用量で洪水接種した: 09)、L148P9 + リーフSCはリーフSCの全菌量に等しいキサントモナスL148の集団を含み(キサントモナスL148/リーフSC、9:9、L148とリーフSCのOD600 = 0.09)、同じ生育室で培養した。植物は14dpiでシュート新鮮重について表現型を決定した(菌株リストは補足データ1参照)。
保護機能実験
23 ℃/23 ℃(昼/夜)、10 時間の光照射のチャンバー内で寒天平板で生育させた 2 週齢の植物に、Xanthomonas L148 株(OD600 = 0.005)を洪水接種し、5 日間培養した。Pto lux66 (OD = 0.005)または水を無菌的にスプレー接種した(~200 µL/プレート)。0dpiと3dpiにサンプルを採取し、葉の区画ごとにL148とPtoのコロニーを数えた。全区画では、葉を直接ホモジナイズし、連続希釈し、プレーティングした。内生区画では、葉を70%エタノールで1分間表面殺菌し、滅菌水で2回洗浄し、ホモジナイズし、連続希釈し、プレーティングした。コロニーを28℃の0.5×TSB寒天培地で生育させ、1~3日間写真を撮った。Pto lux66のコロニーを色と発光でXanthomonas L148株と区別し、コロニー形成をcfu mg-1 leaf sampleで表した。
qPCR分析
TRIzol (15596026, Invitrogen)を用い、ターボDNase (AM1907, Invitrogen)で処理した後、Xanthomonas L148を2dpi植菌した植物サンプル、または10 µM PQ添加または無添加の0.5x TSBで増殖させたXanthomonas L148の細菌ペレットから細菌RNAを単離した。cDNAライブラリーは、SuperScript II逆転写酵素(18064-014、Invitrogen)およびプライマーとしてランダムヘキサマーを用いて、メーカーの指示に従って1μgのRNAインプットで合成した。細菌遺伝子のqPCR解析(CFX Connect Real-Time System、Biorad)には、50 ngのcDNAをインプットした(テストしたプライマーと遺伝子のリストは補足データ6を参照)。ΔCqは、Xanthomonas L148由来のgyrA遺伝子のCqから目的の遺伝子のCqを差し引くことで計算した。
統計解析
データ解析と可視化にはRプログラミング環境(Rバージョン4.2.2)を使用した78。サンプルサイズを事前に決定するための統計的検定は実施しなかった。実験は無作為に行われ、実験期間中、生育室内の植物は毎週シャッフルされた。キサントモナスL148に応答するrbohD植物の表現型が強いため、研究者は盲検化されなかった。データは線形モデルの仮定(ホモ分散性、独立性、正規性)について検査され、必要であれば、agricolae83パッケージを用いて、両側ANOVAとポストホックTukey's HSD検定、または多重比較のための最小有意差(LSD)検定を用いた統計解析の前に正規化された。解析から除外されたデータはなかった。
CAZyme機能のゲノム解析
AtSPHERE25 に含まれる Xanthomonas L148 株とその他の Xanthomonadales 株、および既知の Xanthomonas 病原体のゲノム(NCBI からダウンロード;Sayers, et al.)を、eggnog mapper(http://eggnog-mapper.embl.de/)85 を用いて CAZyme 機能(http://www.cazy.org/)84 のアノテーションを行い、菌株の CAZyme レパートリーと潜在的基質86 を決定した。
報告概要
研究デザインの詳細については、本論文にリンクされているNature Portfolio Reporting Summaryを参照されたい。
データの利用可能性
本論文で報告されたin planta細菌RNA-Seqデータは、Gene Expression Omnibus(GEO)データベースにアクセッション番号GSE226583で寄託されている。ソースデータは本論文とともに提供される。
参考文献
Müller, D. B., Vogel, C., Bai, Y. & Vorholt, J. A. The plant microbiota: systems-level insights and perspectives. Annu. Rev. Genet. 50, 211-234 (2016).
論文
PubMed
Google Scholar
微生物進化と寄生虫-相互作用の連続体に沿った遷移。Nat. Rev. Microbiol. 19, 623-638 (2021).
論文
論文
PubMed
パブメドセントラル
Google Scholar
ラベルか概念か-病原体とは何か?Trends Microbiol. 28, 789-792 (2020).
論文
論文
パブコメ
Google Scholar
Caballero, F. G., Pickard, J. M., & Nunez, G. 微生物を介したコロニー形成抵抗性:そのメカニズムと制御。Nat. Rev. Microbiol. 21, 347-360 (2023).
Dodds, P. N. & Rathjen, J. P. Plant immunity: towards an integrated view of plant-pathogen interactions. Nat. Rev. Genet. 11, 539-548 (2010).
論文
論文
パブコメ
Google Scholar
Zipfel, C. et al. シロイヌナズナにおけるフラジェリン知覚を介した細菌病抵抗性。Nature 428, 764-767 (2004).
論文
論文
PubMed
Google Scholar
Zipfel, C. et al. レセプターEFRによる細菌PAMP EF-Tuの認識はアグロバクテリウムを介した形質転換を制限する。細胞 125, 749-760 (2006).
論文
論文
PubMed
Google Scholar
Roux, M. et al. シロイヌナズナのロイシンリッチリピート受容体様キナーゼBAK1/SERK3およびBKK1/SERK4は、半 生物栄養性および生物栄養性の病原体に対する自然免疫に必要である。Plant Cell 23, 2440-2455 (2011).
論文
CAS
PubMed
PubMed中央
Google Scholar
Miya, A. et al. LysM受容体キナーゼであるCERK1はシロイヌナズナのキチンエリシターシグナル伝達に必須である。Proc. Natl Acad. Sci. USA 104, 19613-19618 (2007).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Boller, T. & Felix, G. エリシターのルネサンス:パターン認識受容体による微生物関連分子パターンと危険シグナルの認識。Annu. Rev. Plant Biol. 60, 379-406 (2009).
論文
論文
PubMed
Google Scholar
Xin, X. F. et al. 細菌は、病原性に重要な水性生活空間を植物内に確立する。Nature 539, 524-529 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Chen,T.ほか. フィルスフィアにおけるディスバイオシスを防ぐための植物遺伝学的ネットワーク. Nature 580, 653-657 (2020).
論文
論文
PubMed
パブメッドセントラル
Google Scholar
Torres、M. A., Dangl、J. L. & Jones、J. D. シロイヌナズナgp91phoxホモログAtrbohDとAtrbohFは植物防御反応における活性酸素中間体の蓄積に必要である。Proc. Natl Acad. Sci. USA 99, 517-522 (2002).
論文
CAS
PubMed
Google Scholar
ストレスによる活性酸素種のコンパートメント化、認識、シグナル伝達。Nat. Plants 7, 403-412 (2021).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
植物病原体相互作用における活性酸素種。In Reactive Oxygen Species in Plant Signaling and Communication in Plants 2nd edn, Vol.3 (eds Rio, L. & Puppo, A.) Ch. 452 (Springer, 2009).
FERONIAは活性酸素種の制御を介して根圏マイクロバイオームにおけるシュードモナスを制限する。Nat. Plants 7, 644-654 (2021).
論文
論文
PubMed
Google Scholar
Pfeilmeier, S. et al. 植物NADPHオキシダーゼRBOHDは葉の微生物恒常性に必要である。Nat. Microbiol. 6, 852-864 (2021).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
植物免疫系の活性化は、オーキシン分泌善玉菌による効率的な根のコロニー形成に必要である。Cell Host Microb. 29, 1507-1520.e4 (2021).
論文
CAS
Google Scholar
Kadota, Y. et al. 植物免疫におけるPRR関連キナーゼBIK1によるNADPHオキシダーゼRBOHDの直接制御。Mol. Cell 54, 43-55 (2014).
論文
CAS
PubMed
Google Scholar
植物病原細菌による細胞外病原因子の分泌.Annu. Rev. Phytopathol. 32, 181-200 (1994).
論文
CAS
Google Scholar
根粒菌と植物病原細菌のT3SSの共通点と相違点。Front. plant Sci. 5, 114 (2014).
論文
PubMed
PubMed Central
Google Scholar
根粒菌は共生時に病原体様エフェクタータンパク質を利用する。Mol. Microbiol. 71, 92-106 (2009).
論文
論文
パブコメ
Google Scholar
植物と動物の免疫系におけるNLRの機能:遠いようで近い。Nat. Immunol. 12, 817-826 (2011).
論文
論文
パブコメ
Google Scholar
Teixeira, P. J. P. L. et al. 常在細菌群集による根の免疫系の特異的調節。Proc. Natl Acad. Sci. USA 118, e2100678118 (2021).
論文
PubMed
パブメッドセントラル
Google Scholar
Bai, Y. et al. シロイヌナズナの葉と根の微生物叢の機能的重複。Nature 528, 364-369 (2015).
論文
論文
PubMed
Google Scholar
植物とその微生物叢のコトトランスクリプトーム・ランドスケープを解明する。EMBO Rep. 23, e55380 (2022).
論文
論文
PubMed
パブメドセントラル
Google Scholar
カールストレム、C. I.ら、シロイヌナズナ植物圏における合成微生物群の優先的効果と主要菌株を明らかにした。Nat. Ecol. Evol. 3, 1445-1454 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Thiergart, T. et al. ヨーロッパのシロイヌナズナ集団間の根微生物叢の集合と適応的分化。Nat. Ecol. Evol. 4, 122-131 (2020).
論文
PubMed
Google Scholar
Karasov, T. L. et al.シロイヌナズナとシュードモナス病原体は進化の時間スケールで安定した関係を示す。Cell Host Microb. 24, 168-179.e4 (2018).
論文
CAS
Google Scholar
Cianciotto, N. P. Type II secretion: a protein secretion system for all seasons. Trends Microbiol. 13, 581-588 (2005).
論文
論文
PubMed
Google Scholar
Nobori, T. et al. 植物免疫下における細菌性病原体のトランスクリプトーム・ランドスケープ. Proc. Natl Acad. Sci. USA 115, E3055-E3064 (2018).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Vogel, C. M., Potthoff, D. B., Schäfer, M., Barandun, N. & Vorholt, J. A. 細菌病原体に対するシロイヌナズナ葉の微生物叢の保護的役割。Nat. Microbiol. 6, 1537-1548 (2021).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
Veluchamy, S., Hind, S. R., Dunham, D. M., Martin, G. B. & Panthee, D. R. 平飼いトマトにおけるflg22、flgII-28、csp22とPseudomonas syringae pv. tomatoに対する応答性の自然変異。PloS One 9, e106119 (2014).
論文
PubMed
パブメッドセントラル
Google Scholar
Stringlis, I. A. et al. 有益な根粒菌と微生物免疫エリシターによって誘導される根の転写ダイナミクスから、相互依存者への適応のサインが明らかになった。Plant J. Cell Mol. Biol. 93, 166-180 (2018).
論文
CAS
Google Scholar
Parys, K. et al. 細菌フラジェリンエピトープにおける拮抗的多面性の特徴。Cell Host Microb. 29, 620-634.e9 (2021).
論文
CAS
Google Scholar
Colaianni,N.R.ら:常在菌群集におけるフラジェリンエピトープの変異に対する複雑な免疫応答。Cell Host Microb. 29, 635-649.e9 (2021).
論文
CAS
Google Scholar
Clasen, S. J. et al. Toll様受容体5によるヒト腸内常在菌由来フラジェリンのサイレント認識。Sci. Immunol. 8, eabq7001 (2023).
論文
論文
PubMed
Google Scholar
Spindler, M. P. et al.ヒトの腸内細菌叢は、門から株まで異なる定義された自然免疫応答を刺激する。Cell Host Microb. 30, 1481-1498.e5 (2022).
論文
CAS
Google Scholar
Durán, P. et al. 根における微生物間の相互作用はシロイヌナズナの生存を促進する。Cell 175, 973-983.e14 (2018).
論文
PubMed
PubMed Central
Google Scholar
Ma, K. W. et al. 植物自然免疫とのクロストークによる微生物-宿主ホメオスタシスの調整。Nat. Plants 7, 814-825 (2021).
論文
論文
PubMed
パブメドセントラル
Google Scholar
宿主植物における病原体に対する防御反応を促進する宿主シュードモナス株。Nat. Ecol. Evol. 6, 383-396 (2022).
論文
PubMed
パブメッドセントラル
Google Scholar
Wolinska, K. W. et al. シロイヌナズナの根におけるトリプトファン代謝と常在細菌は真菌の異常繁殖を防ぐ。Proc. Natl Acad. Sci. USA 118, e2111521118 (2021).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
Pseudomonas viridiflavaおよびP. syringaeはシロイヌナズナの天然病原菌である。Mol. Plant Microb. Interact. mpmi 15, 1195-1203 (2002).
論文
CAS
Google Scholar
Agler, M. T. et al. 微生物のハブ分類群は、宿主と生物多様性因子を植物マイクロバイオームの変動に結びつける。PLoS Biol.14, e1002352 (2016).
論文
PubMed
パブメドセントラル
Google Scholar
宿主ミトコンドリアは腸内細菌叢の多様性に影響を与える:活性酸素の役割。Sci. Signal. 12, eaaw3159 (2019).
論文
PubMed
グーグル・スカラー
Miller, B. M. et al. NOX1由来の過酸化水素の嫌気性呼吸は、大腸曲面での細菌増殖に影響を与える。Cell Host Microb. 28, 789-797.e5 (2020).
論文
CAS
Google Scholar
シロイヌナズナの細胞壁損傷によるリグニン生合成は、活性酸素種とジャスモン酸に依存したプロセスによって制御されている。植物生理学 156, 1364-1374 (2011).
論文
CAS
PubMed
パブコメ
Google Scholar
SCHENGEN receptor module drives localized ROS production and lignification in plant roots. EMBO J. 39, e103894 (2020).
論文
CAS
PubMed
PubMedセントラル
Google Scholar
植物NADPH酸化酵素RBOHDは、多様な刺激に応答して迅速な全身的シグナル伝達を媒介する。Sci. Signal. 2, ra45 (2009).
論文
PubMed
Google Scholar
Kwak, J. M. et al. NADPHオキシダーゼAtrbohDおよびAtrbohF遺伝子は、シロイヌナズナの活性酸素依存性ABAシグナル伝達に機能する。The. 22, 2623-2633 (2003).
論文
論文
PubMed
パブメドセントラル
Google Scholar
気孔運動制御における活性酸素種。Plant Physiol. 171, 1569-1580 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Pfeilmeier, S. et al. 葉のマイクロバイオームのディスバイオシスは日和見的なキサントモナス株の酵素分泌によって引き起こされる。 bioRvix https://doi.org/10.1101/2023.05.09.539948 (2023)
Dickeya dadantiiの病原性に必要なペクチン酵素は、シロイヌナズナの自然免疫系の活性化にも関与している。Mol. Plant Pathol. 19, 313-327 (2018).
論文
論文
PubMed
Google Scholar
Ma, Z. et al. フィトフトラ・ソジャエ(Phytophthora sojae)のグリコシドヒドロラーゼ12タンパク質は、ダイズ感染時の主要な病原因子であり、PAMPとして認識される。Plant Cell 27, 2057-2072 (2015).
論文
論文
PubMed
PubMed Central
Google Scholar
Wang, Y. et al. ロイシンリッチリピート受容体様遺伝子スクリーニングにより、ニコチアナRXEG1がグリコシド加水分解酵素12のMAMP検出を制御していることが明らかになった。Nat. Commun. 9, 594 (2018).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Verticillium dahliaeはグリコシド加水分解酵素12タンパク質と糖鎖結合モジュール1によって植物免疫を操作する。Environ. Microbiol. 19, 1914-1932 (2017).
論文
CAS
PubMed
Google Scholar
Teixeira, P. J. P., Colaianni, N. R., Fitzpatrick, C. R. & Dangl, J. L. Beyond Pathogens: Microbiota interactions with the plant immune system. Curr. Opin. Microbiol. 49, 7-17 (2019).
論文
CAS
パブコメ
Google Scholar
Vetter, M., Karasov, T. L. & Bergelson, J. Arabidopsis thalianaにおけるMAMPによる防御の分化。PLoS Genet. 12, e1006068 (2016).
論文
PubMed
PubMed Central
Google Scholar
イネとシロイヌナズナにおいて、2つの異なるEF-Tuエピトープが免疫応答を誘導する。Mol. Plant Microb. Interact. mpmi 27, 113-124 (2014).
論文
CAS
Google Scholar
Lacombe, S. et al. 植物パターン認識レセプターのファミリー間移動が、細菌に広域耐性を与える。Nat. Biotechnol. 28, 365-369 (2010).
論文
論文
パブコメ
Google Scholar
植物における細菌性病原体の多次元的遺伝子制御ランドスケープ。Nat. Plants 6, 883-896 (2020).
論文
CAS
パブコメ
Google Scholar
分泌型プロテアーゼによる細菌性MucDの部位特異的切断がシロイヌナズナの抗菌抵抗性を媒介する。Nat. Commun. 10, 2853 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Wang, W. et al. シロイヌナズナの二次代謝産物が細菌のIII型分泌系の発現を直接標的とし、細菌の病原性を阻害する。Cell Host Microb. 27, 601-613.e7 (2020).
論文
CAS
Google Scholar
Lindsey, B. E. 3rd, Rivero, L., Calhoun, C. S., Grotewold, E. & Brkljacic, J. シロイヌナズナ種子のハイスループット滅菌法の標準化。J. Visual. Exp. Jove 17, 56587 (2017).
グーグル・スカラー
Hinsch, M. & Staskawicz, B. 新しいシロイヌナズナ病害抵抗性遺伝子座RPs4の同定と、それに対応するPseudomonas syringae pv. pisi由来アビルレンス遺伝子avrRps4のクローニング。Mol. Plant Microb. Interact. 9, 55-61 (1996).
論文
CAS
Google Scholar
Tn7トランスポゾンを用いた生物発光タギングツールによる植物内細菌の定量的・空間的検出. Plant Commun. 3, 100227 (2022).
生きたシュードモナス・シリンゲに応答したシロイヌナズナ葉組織の初期活性酸素種産生を測定するための迅速バイオアッセイ。Plant Methods 10, 6 (2014).
論文
PubMed
PubMed Central
Google Scholar
Vibrio choleraeのコロニー形成と耐酸性に関与する新規因子の同定。Mol. Microbiol. 43, 1471-1491 (2002).
論文
論文
パブコメ
Google Scholar
Kvitko, B. H. & Collmer, A. Pseudomonas syringae pv. tomato DC3000変異株および多変異株の構築。方法 Mol. Biol. Clifton N. J. 712, 109-128 (2011).
論文
CAS
Google Scholar
数百キロ塩基までのDNA分子を酵素的に組み立てる。Nat. Methods 6, 343-345 (2011).
論文
Google Scholar
Kessler, B., de Lorenzo, V. & Timmis, K. N. Timmis. グラム陰性真正細菌の染色体にlacZ融合体を組み込む一般的なシステム:TolプラスミドのPmプロモーターの制御を、すべての制御要素をモノコピーにして研究。Mol. Gen. Genet. 233, 293-301 (1992).
論文
CAS
PubMed
Google Scholar
病原性と過敏反応の誘導に必須なXanthomonas campestris pv. vesicatoriaのタンパク質HrpA1の発現と局在。J. Bacteriol. 178, 1061-1069 (1996).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Pseudomonas syringaeのin plantaトランスクリプトーム解析。Bio. Protoc. 8, e2987 (2018).
論文
論文
PubMed
パブメドセントラル
Google Scholar
RNAシーケンスリードのアライメントと定量にRsubreadパッケージがより簡単、高速、安価で優れている。Nuc. Acids Res. 47, e47 (2019).
論文
CAS
Google Scholar
Love, M. I., Huber, W. & Anders, S. "Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2.". Genome Biol. 15, 550 (2014).
論文
PubMed
パブメドセントラル
Google Scholar
Ritchie, M. E. et al. "limma powers differential expression analyses for RNA-sequencing and microarray studies.". Nuc. Acids Res. 43, e47 (2015).
論文
Google Scholar
Storey, J. D., Bass, A. J., Dabney, A., Robinson, D. et al: Q-Value Estimation for False Discovery Rate Control http://github.com/jdstorey/qvalue (2022).
Core Team, R. A language and environment for statistical computing. R Foundation for Statistical Computing http://www.R-project.org/ (2013).
Charrad, M., Ghazzali, N., Boiteau, V. & Niknafs, A. NbClust: データセットのクラスタ数を決定するための R パッケージ。J. Stat. Softw. 61, 1-36 (2014).
記事
グーグル・スカラー
Struyf, A., Hubert, M. & Rousseeuw, P. "Clustering in an object-oriented environment.". J. Statist. Softw. https://doi.org/10.18637/jss.v001.i04 (1997).
Gu, Z. "Complex Heatmap Visualization" https://doi.org/10.1002/imt2.43 (2022).
Wu T. et al. "ClusterProfiler 4.0: オミックスデータを解釈するための万能エンリッチメントツール". Innovation 2, 100141 (2021).
Mendiburu, F. & Yaseen, M. Agricolae: Statistical Procedures for Agricultural Research https://myaseen208.github.io/agricolae/https://cran.r-project.org/package=agricolae (2020).
Drula, E. et al. 糖質活性酵素データベース:機能と文献。Nuc. Acids Res. 50, D571-D577 (2022).
論文
CAS
Google Scholar
Cantalapiedra, C. P., Hernandez-Plaza, A., Letunic, I., Bork, P. & Huerta-Cepas, J. eggNOG-mapper v2: メタゲノム規模での機能アノテーション、オルソロジーの割り当て、ドメイン予測。Mol. Biol. Evol. 38, 5825.5829 (2021).
論文
論文
パブメッドセントラル
Google Scholar
dbCAN-seq update:マイクロバイオームにおけるCAZyme遺伝子クラスターと基質。Nuc. Acids Res. 51, D557-D563 (2023).
論文
CAS
Google Scholar
参考文献のダウンロード
謝辞
原稿を編集してくださったNeysan Donnelly氏、有益なコメントを寄せてくださったWanqing Jiang氏に感謝する。本研究は、中国国家自然科学基金(K.T.に32250710139)、中国国家重点研究開発プログラム(K.T.に2022YFA1304403)、HZAU-AGIS協力基金(K.T.とX.H.にSZYJY2021007)、マックス・プランク協会(P.S.-LとK.T.に)、ドイツ研究財団(DFG)の助成金(SPP2125)(P.S.-LとK.T.に)の支援を受けて実施した。
資金提供
Projekt DEALによるオープンアクセス助成。
著者情報
著者および所属
華中農業大学植物科学技術学院農業微生物学国家重点実験室、湖北紅山実験室、植物病理学湖北重点実験室、武漢、中国430070
フレデリクソン・エンティラ、シャオウェイ・ハン、津田健一
マックス・プランク植物育種研究所・植物微生物相互作用研究部門、カール・フォン・リンネ通り10番地、ケルン、50829、ドイツ
フレデリクソン・エンティラ、ポール・シュルツ=ルフェルト、津田健一
華中農業大学深圳栄養健康研究所、武漢、中国、430070
シャオウェイ・ハン & 津田健一
中国農業科学院深圳農業ゲノム研究所嶺南現代農業広東研究室深圳分室 〒518120 中国広東省深圳市嶺南現代農業広東研究室
韓暁偉・津田健一
332-0012埼玉県川口市・JSTさきがけ
峰 明
京都大学大学院農学研究科 植物病理学研究室
峰 明
貢献
F.E.およびK.T.が研究を発案した。F.E.、X.H.、P.S.-L.、K.T.が研究をデザインした。A.M.はPto luxの設計と施工を行った。F.E.はすべての実験作業とデータの分析を行った。F.E.とK.T.は著者全員の意見を参考に原稿を執筆した。
責任著者
津田健一宛。
倫理申告
競合利益
著者らは競合する利益はないと宣言している。
査読
査読情報
Nature Communications誌は、本研究の査読に貢献いただいた匿名査読者に感謝する。査読ファイルはこちら。
追加情報
出版社からの注記 Springer Natureは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
補足情報
補足情報
査読ファイル
追加補足ファイルの説明
補足データ1
補足データ2
補足データ3
補足データ4
補足データ5
補足データ6
報告概要
ソースデータ
ソースデータ
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを付与し、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合はその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、または許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
アップデートの確認 CrossMarkで通貨と真正性を確認する
この記事の引用
Entila, F., Han, X., Mine, A. et al. シロイヌナズナのROSと細菌のT2SS間の負のフィードバックループによって制御される共生生活様式。Nat Commun 15, 456 (2024). https://doi.org/10.1038/s41467-024-44724-2
引用文献のダウンロード
受領
2023年05月09日
受理
2024年01月02日
掲載
2024年01月11日
DOI
https://doi.org/10.1038/s41467-024-44724-2
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
テーマ
細菌遺伝学
細菌の宿主応答
微生物
コメント
コメントを投稿することで、私たちの規約とコミュニティガイドラインに従うことに同意したことになります。誹謗中傷や規約・ガイドラインに反する投稿があった場合は、不適切な投稿としてフラグを立ててください。
ネイチャー・コミュニケーションズ(Nat Commun) ISSN 2041-1723(オンライン)
サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
プロフェッショナル育成
ネイチャー・キャリア
ネイチャーコンファレンス
地域ウェブサイト
ネイチャー・アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー・イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー クッキーの使用 お客様のプライバシーの選択/クッキーの管理 法的通知 アクセシビリティに関する声明 利用規約 お客様の米国におけるプライバシー権
シュプリンガー・ネイチャー
© 2024 シュプリンガー・ネイチャー
この記事が気に入ったらサポートをしてみませんか?
