COVID-19における微生物による共感染。関連する微生物相と病原性の基礎的なメカニズム
COVID-19における微生物による共感染。関連する微生物相と病原性の基礎的なメカニズム
https://pubmed.ncbi.nlm.nih.gov/33962007/
M. Nazmul Hoque, Salma Akter, [...], and M. Anwar Hossain
論文追加情報
関連データ
データの利用可能性
概要
重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)による新型コロナウイルス感染症(COVID-19)は、現在も続く壊滅的なパンデミックにより世界中にトラウマを与えている。SARS-CoV-2以外のウイルス、細菌、古細菌、真菌など多くの微生物ドメインが共に進化し、SARS-CoV-2とともに複雑な分子病態を相互に形成しています。しかし、COVID-19の重症患者における他の微生物共病原体の関与とその分子メカニズムについては、まだ広く検討されていない。SARS-CoV-2感染者における共感染の発生率は94.2%に達するが,宿主の防御免疫と免疫病理のバランスにより,共感染の運命が左右されることが多い.SARS-CoV-2の主な共存病原体は、肺炎球菌、黄色ブドウ球菌、肺炎桿菌、インフルエンザ菌、肺炎マイコプラズマ、アシネトバクター・バウマンニなどの細菌であることが確認されている。レジオネラ・ニューモフィラ、クラミジア・ニューモニエに続き、インフルエンザ、コロナウイルス、ライノウイルス・エンテロウイルス、パラインフルエンザ、メタニューモウイルス、B型インフルエンザウイルス、ヒト免疫不全ウイルスなどのウイルスが挙げられる。共同病原体(特に肺のマイクロバイオーム)、SARS-CoV-2、宿主間のクロストークは、最終的にCOVID-19の診断、治療、予後の難易度を高める重要な要因である。同時に、共感染の微生物群は、自然免疫反応と適応免疫反応の両方を変化させることによって、宿主の防御機構から逃れ、SARS-CoV-2の病原性をさらに悪化させる新たな戦略を用いる可能性がある。SARS-CoV-2の効果的な患者管理,治療,封じ込めには,COVID-19における共感染をよりよく理解することが重要である.したがって,本総説では,COVID-19で一般的に報告されている微生物共病原体,その感染パターン,共感染の可能性のあるメカニズムおよびその結果について包括的に検討することが必要である.このように、SARS-CoV-2の病原体として考えられる病原体とその分子メカニズムを明らかにすることは、現在流行しているSARS-CoV-2呼吸器感染症に対する診断法、適切な治療・予防的介入法を開発する上で、大きなヒントになると思われる。
キーワード COVID-19、SARS-CoV-2、共存する微生物、分子的病原体
1. はじめに
新型コロナウイルス感染症-2019(COVID-19)は、2019年12月に中国武漢で発生したSARS-CoV-2による急速に感染する肺炎様疾患であり、現在世界中で循環している[1,2]。ポジティブセンスエンベロープ型RNAウイルス(SARS-CoV-2)は、SARS-CoV-1や中東呼吸器症候群コロナウイルス(MERS-CoV)など、これまで知られていたコロナウイルスとは遺伝的に異なる[[1]、[2]、[3]]]。この恐ろしいウイルスは、中国での最初の発生直後から、1918-1920年のスペイン風邪に次いで、過去100年間で最も致命的なヒト病原体の1つとして出現した[4,5]。SARS-CoV-2感染は、世界中で公衆衛生上の課題となっているため、世界保健機関(WHO)は、この疾患を国際的に懸念される公衆衛生上の緊急事態と宣言しています[1,2]。2003年に発生したSARSと2012年に発生したMERSは、それぞれ9.6%と34.4%の致死率で、6ヶ月以内に収束することに成功しました。COVID-19は、2021年4月7日までに合計217の国と地域が感染し、世界で133,688,126人以上の患者が確認され、2,901,038人が死亡しています(https://www.worldometers.info/coronavirus/?utm_campaign=homeAdvegas1?)。したがって、この急速に広がるCOVID-19のパンデミックは、この憂慮すべき病原体による入院や死亡の数を減らすために、ワクチンや抗ウイルス治療の迅速な開発の必要性を浮き彫りにしています[6]。
多くの呼吸器系ウイルス感染症では、共感染や重複感染が一般的です[6,7]。細菌の共感染は、あらゆるウイルス感染症に感染した患者の死亡率を著しく増加させる可能性があります[6,8,9]。以前、集中治療を受けているMERS-CoV患者においても、細菌の併発が報告されました[10]。SARS-CoV-2と他の微生物との共感染は,COVID-19の正確な診断,治療,予後を複雑にし,死亡率さえも増加させるCOVID-19の病原体として非常に重要な要素である[11].臨床試験やメタゲノム調査により、COVID-19 患者には SARS-CoV-2 と共に他のウイルス、細菌、古細菌、真菌が共存していることが示された [[11], [12], [13]].COVID-19で死亡した患者の約50%は二次的な細菌感染症にかかっており[12,14],COVID-19の病態進行がさらに強まっている.SARS-CoV-2の効果的な患者管理、治療、封じ込めに、COVID-19の併発感染症に対する理解を深めることは非常に重要である。したがって,COVID-19患者における共感染の調査を強化することが必要である.また,COVID-19に関しては,感染拡大の防止策,適切な臨床検体の採取,感染経路,ウイルスの動態,有効な薬剤治療法など,まだ不明な点が多くある.しかし,細菌,古細菌,ウイルス(ベータコロナウイルス以外)および真菌を含む他の呼吸器系病原体との併発の可能性については,まだ明確に理解されていない。これらの二次病原体が共存感染を引き起こすかどうかは、COVID-19症例の管理において、臨床医にとって重要な関心事であるはずです。米国疾病対策予防センター(CDC)の新興感染症セクションは、他の呼吸器病原体の検査を推奨しており、SARS-CoV-2の迅速検査が広く利用できない場合、他の感染症の証拠がCOVID-19の可能性を持つ患者の評価を助けることができることを示唆している[15]。
先の2つのコロナウイルス(SARS-CoV-1とMERS-CoV)、インフルエンザウイルス、そしてSARS-CoV-2は、高熱、咳、頭痛、さらには肺炎など非常に似た呼吸器症状を示す[[16]、[17]、[18]、[19]]。最近の臨床およびin silico研究により,共存するウイルスは主に,エンテロ/ライノウイルス(hRV),ヒトメタニューモウイルス(hMPV),呼吸同期ウイルス(RSV),シホウイルス,アルファピロマウイルス,ミオウイルス,トンブスウイルス,ビクターウイルス,パルチウイルス,クリソウイルス,トチウイルス,およびその他のコロナウイルス(非SARS-CoV-2)等の呼吸器ウイルスが含まれると報告されています [11,20].COVID-19の同時併発感染は、呼吸器系マイクロバイオームのホメオスタシスを変化させ、その結果、感染を誘発し、免疫細胞を刺激してより重篤な炎症を生じさせることもあります[11,20]。COVID-19患者の腸内細菌の多様性も、日和見病原体の相対的存在量が増加し、有益な共生生物の相対的存在量が減少しています[21]。最近のメタゲノム研究では、COVID-19患者の鼻腔スワブにおいて、細菌、古細菌および非COVIDウイルスが同時に関連していることが明らかにされている[11]。SARS-CoV-1やMERS-CoVの初期の流行では、侵襲的人工呼吸を受けている患者は細菌を併発しやすく、死亡率も高かった[16,18]。したがって、細菌性合併症はCOVID-19の重症化と死亡率を促進する重要な要素である可能性がある[22]。死亡した患者を対象とした最近の研究では、敗血症(100%)が主な合併症の1つとして作用していたことから[23]、COIVD-19患者の予後とその後の治療には、共感染が非常に重要であることが示された。さらに、パンデミックおよび季節性インフルエンザでは、同時感染がより重篤な転帰となることが知られている[24]。インフルエンザ関連の細菌感染全体は、市中肺炎(CAP)症例の最大30%を占める可能性が示唆されている[25]。COVID-19の入院患者を対象としたいくつかの研究では、大多数の患者で経験的に抗生物質が使用されていることが指摘されています[24,26,27]。しかし,COVID-19患者では,細菌感染を伴わないプロカルシトニンやCRPなど細菌感染に関連する炎症性血清マーカーの増加が確認されている[24,28].一方、いくつかの記述的研究により、常在微生物叢の生態系は、侵入するウイルスを制御することも制御されることもでき、刺激的または抑制的な効果を促進することが示された[23,29,30]。さらに重要なことは、 共有している微生物がSARS-CoV-2感染症の新たな治療法開発のための戦略である可能性もあるということである。COVID-19の結果に対する重要性を示す証拠が増えているにもかかわらず、SARS-CoV-2負荷に対する共感染クリアランスの効果は、まだ体系的にレビューされておらず、批判的に議論されていない。この系統的レビューでは、SARS-CoV-2パンデミックに関連する微生物共感染に関する知識を更新し、COVID-19における共感染の可能な分子機構について、微生物共感染が重要であることを強調する。
2. 2.根拠とレビュー方法
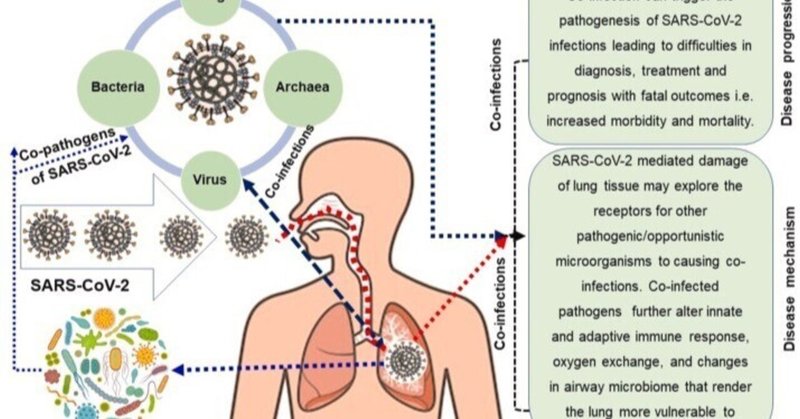
現在までに、SARS-CoV-2のゲノム、起源、ゲノム進化、分子診断、ワクチンおよび/または治療薬に関する数千の報告がなされている。しかし、COVID-19に関連する微生物(ウイルス、細菌、真菌、古細菌)の共感染とCOVID-19患者に対する共感染の影響、共起因子の特徴、およびCOVID-19患者におけるその基礎となる分子機構に関する包括的レビューが欠落しています。そこで,共感染に関する厳密な文献調査を行い,共感染微生物の同定とその病原性について検討した.序章では,COVID-19病と共存する感染症の概念とエビデンス,およびこの包括的レビューの理論的根拠を述べた。このレビューの後のセクションは、PubMed central、Google Scholar、ResearchGate、bioRxiv、medRxiv、Preprints archives、世界保健機関(WHO)COVID-19ブログ、国立衛生研究所(NIH)、疾病管理予防センター(CDC、米国)、臨床試験登録データベース、COVID-19 vaccine and therapeutics tracker (https://biorender.com/covid-vaccine-tracker) で入手できる文献を首尾よくアレンジしたものである。このレビューの内容については、COVID-19に有効な共感染のエビデンスと意義、共感染の検出と可能な分子メカニズムについて論じたオリジナルの研究論文を検討した。また、本文献調査では、2019年12月下旬に中国武漢市で発生したCOVID-19の発生当初から2021年4月7日までに発表された事例研究、ケースシリーズ、観察研究などを対象とした。文献検索は、タイトル、抄録、全論文のスクリーニングにより適格性を確認した。SARS-CoV-2感染症における同時併発感染の分子メカニズムの提案を図1に表した。

図1
図1
CoVID-19患者の同時感染につながるSARS-CoV-2と呼吸器系マイクロバイオームとの相互関係。COVID-19患者は、ウイルス(SARS-CoV-2以外)、細菌、古細菌、真菌を含む異なる微生物ドメインに重複感染している可能性がある ....
3. COVID-19入院患者における微生物による重複感染
共感染とは、2種類以上の病原体や菌株が細胞や宿主に同時に感染することを指し、スーパー感染とは、1つの病原体が2つ目の病原体に感染するしばらく前に宿主に感染するシナリオである[31]。いずれの場合も、感染した宿主の運命は、宿主の防御免疫と免疫病理のバランスに依存することが多い[32]。ヒトにおける共感染の普遍的な広まりや発生率は不明であるが、ありふれたものであり、時には単独感染よりも多いと考えられている[33]。例えば、Van der Hoekら(2004)は、呼吸器系の共感染では、ヒトコロナウイルス(hCoV)の負荷が単独感染の場合よりはるかに低いことを報告しているように、共感染の病原体は、一次病原体の集団を変化させることがあります[34]。共感染は、ウイルス、細菌、古細菌、真菌由来の複数の感染因子によって起こり(図1)、初発症状と同時に発生するようです[35]。共感染の罹患率は、以前から特定のコホート(年齢や性別など)内で研究されており、しばしば単独感染より悪いと報告されている[36]。最近、いくつかの観察研究およびコホート研究で、COVID-19患者の51-2%に肺合併症が発生し、そのうち82.6%が死亡を占め、死亡の独立した危険因子は男性性、65歳以上であると報告された[37]。しかし,COVID-19患者の年齢と性別のコホート間での死亡における共感染の発生については,まだ検討されていない.COVID-19における共感染は年齢層によって説明できない可能性があり、COVID-19の重症度における説明できない異質性は、研究間の重症度の違い、患者の併存疾患、治療の違い(コルチコステロイド投与など)、入院前および入院中の抗生物質の使用、またはその他の未同定の共変量による可能性がある。しかし、COVID-19の経過の後半に発症する二次的な細菌や真菌感染症は過小評価される可能性がある。
3.1. COVID-19の入院患者におけるウイルスの重複感染
呼吸器疾患のウイルス感染症では,他のウイルスとの重複感染が非常に多い。呼吸器系ウイルスの共感染の有病率は3.0%から68.0%まで様々である[20,38].いくつかの臨床研究で、SARS-CoV-2のウイルス共感染が、異なる国の他のウイルスと発生することが示された[23,26]。Linら(2020)は、深圳第三人民病院において、3.2%のSARS-CoV-2患者がウイルス性共感染を起こしたと報告している[20]。他のウイルス、細菌、真菌とSARS-CoV-2感染との関連も報告されている[13]。バクテリオファージは細菌を宿主とする自然発生ウイルスであり,比較的無害な細菌が病原体となる上で極めて重要な役割を担っている[19,39].バクテリオファージは、多くのヒトの病気の引き金と悪化の原因となる、見過ごされたヒトの病原体である[19]。COVID-19を引き起こすSARS-CoV-2株は、ヒトの古典的コロナウイルスであるSARSコロナウイルス分離株Tor2(SARS-CoV Tor2)と近縁であり、最近の知見を裏付けるものである[40]。最近のメタゲノム研究では、Hoqueら(2020)が、COVID-19サンプルは16のウイルス属(ベータコロナウイルス以外)と単独で関連しており、そのうち、Tombusvirus, Victorivirus, Partitivirus, Chrysovirus, TotivirusがSARS-CoV-2の共感染に最も多く関連している属であると報告した[11]。
3.1.1. SARS-CoV-2とインフルエンザ:その混乱 インフルエンザは急性かつ伝染力の強い呼吸器疾患であり、世界中で重大な罹患率と死亡率の原因となっています。毎年、インフルエンザは世界人口の約9%に影響を与え、最大で10億の感染、300万から500万の重症例、そして0.3から65万の死亡をもたらす可能性があります[41]。SARS-CoV-2による今回のCOVID-19のパンデミックは、発熱、頭痛、咽頭痛など、インフルエンザと同様の症状を示している。COVID-19パンデミックの初期には,SARS-CoV-2とインフルエンザの共感染はあまり注目されていなかったが,インフルエンザとSARS-CoV-2の共感染の最初の報告[42]では,2020年1月にインフルエンザ陽性患者がSARS-CoV-2に感染したのは0.4%であると示されている.COVID-19患者におけるインフルエンザウイルスによる共感染の発生率は、中国以外のさまざまな国から頻繁に報告されている[27]。日本における78歳女性の症例報告では,SARS-CoV-2へのA型インフルエンザの同時感染が認められ[43],渡航歴や患者の病状を考慮した,病因の特定と正確な検出の必要性が強くなった.別の研究では,入院中のCOVID-19陽性患者の4.35%にインフルエンザの併発が認められた[44].血液学的スクリーニングの異常は報告されていないが,侵襲的な人工呼吸器,集中治療室(ICU)ケア,体外式膜酸素療法を行うことなく,酸素吸入,オセルタミビル,抗菌薬による治療により,すべての共感染患者は臨床的に完治していた[44].中国の江蘇省における別のレトロスペクティブな研究では、実験室で確認されたCOVID-19患者の94.2%が共同感染しており、特にその31%がインフルエンザウイルスとのウイルス共同感染であることが実証された[45]。バルセロナの病院におけるCOVID-19患者に関する最近のレトロスペクティブ・コホート研究では、市中感染型A型インフルエンザウイルスに重複感染していた患者はわずか0.4%であり、市中感染型細菌感染症に感染した患者は3.1%、そのうち4.7%は院内スーパーインフェクション(院内感染)だったことが示されている[46]。しかし,冬季にインフルエンザとCOVID-19が同時に発生したことにより,複数の症例で同時感染の存在が確認され,SARS-CoV-2とインフルエンザウイルスの同時検査診断設備が必然的に重視されることになった.COVID-19と典型的なインフルエンザの両症状があることから,COVID陽性者,特にインフルエンザ流行地域に最近渡航した患者では,インフルエンザとの同時診断が必要である.
3.1.2. COVID-19患者におけるB型肝炎の同時感染 COVID-19に関連する肝合併は、既存の肝合併(例えば、肝硬変、肝不全、肝細胞癌)を伴うB型肝炎ウイルス(HBV)の同時感染者において特に問題となる[47,48]。呼吸器症候群を発症する前に肝炎の症状を持つCOVID-19患者の共感染は、いくつかの研究で記録されている[49,50]。SARS-CoV-2の病原体に関する理解は進みつつあるが、初期の研究では、ウイルスが主に肝細胞上のアンジオテンシン変換酵素2(ACE2)受容体に結合することによって、あるいはサイトカインストームの活性化を通じて免疫介在性の肝損傷を引き起こす可能性を示唆している [51].COVID-19が肝障害を引き起こし、アラニンアミノトランスフェラーゼ(ALT)、アスパラギン酸アミノトランスフェラーゼ(AST)および総ビリルビンを上昇させ、特にICUを必要とする重症COVID-19症例では、そのことが明らかになった[[52]、[53]、[54]]]。COVID-19患者の肝機能異常は、疾患の重症度や死亡リスクの増加とも関連している。興味深いことに,中国武漢市では,非呼吸器感染症によるウイルス感染が報告されており,急性COVID-19患者の12.2%でB型肝炎ウイルス感染の併発が記載されている[23].重症COVID-19患者の肝硬変率および肝機能異常上昇は,COVID-19患者のALT,AST,γ-グルタミルトランスフェラーゼ(GGT)値の上昇,中程度のプロトロンビン時間(PT)値,総ビリルビン(TB)の上昇などB型肝炎との同時感染所見と一致する[55, 56].重症のCOVID-19患者における肝障害の可能性は,肝組織へのウイルストロピズム,薬物毒性および全身性炎症によることが示唆されている[54].したがって,重症COVID-19患者におけるB型肝炎感染の広範なスクリーニングは,肝機能異常の顕著な診断的徴候を有する患者における疾患の進行分析,および効果的な治療計画の適用に,より有用であると考えられる.
3.1.3. SARS-CoV-2とデング熱:致命的なデュオ アルボウイルス性のデング熱が流行しているスイスやフランスなどの温帯諸国におけるSARS-CoV-2の広がりは、現代の旅行履歴とともに報告されています[57]。フランスでは、SARS-CoV-2 RT-PCRの最初の診断テストでは、患者のインフルエンザ様症候群で陰性となり、1週間後に発熱、疲労、食欲不振、下痢などのCOVID-19症状の激しい臨床的発症で陽性となりました[57]。びまん性斑状皮疹の出現により,レプトスピラ属,リフトバレー熱ウイルス,デングウイルスおよびチクングニアウイルス感染のスクリーニングを行ったところ,1型デングウイルスに対するRT-PCRが陽性であることが示された.シンガポールからの2人の患者の別の報告では、デング熱の迅速血清検査は、後にSARS-CoV-2が陽性となった患者の呼吸器合併症を加速する偽陽性結果を生み出す可能性があることが明らかになりました[58]。当初、発熱の悪化、血小板減少の増加、デング熱の血清陽性は、最近デング熱特異的免疫グロブリンがないことを発見した臨床医を欺いたが、鼻咽頭スワブの RT-PCR テストで SARS-CoV-2 が陽性であることが判明した。南米のいくつかの国では,COVID-19の漸増とともに,多数のデング熱患者が報告されている.ブラジルの研究では、COVID-19緊急対応に疫学的血清サーベイランス対応チームを大規模に動員したため、デング熱患者の報告が不十分となり、COVID-19発生時のデング熱の報告や治療に間接的に影響を与えた可能性が指摘されています[59]。この研究は、ブラジルにおけるデング熱とCOVID-19の管理のための監視、治療、予防計画を組み合わせた強固な統合国家戦略を促しています。コロンビアからの別の研究は、COVID-19パンデミックの最初の20週間におけるデング熱とSARS-CoV-2の二重の疫学的特徴を分析しました[60]。SARS-CoV-2感染時にデング熱の侵入と複製を阻止するウイルス干渉は、不顕性感染または軽度のCOVID-19感染者における臨床的デングの発症を減少させる要因になった可能性もあります[61]。エクアドルからの最新の報告では、広い沿岸地域でのデングの生態疫学的動態と高い流行性伝播は、診断、治療、予防措置のための公衆衛生施設への患者の大規模な負荷を通じて、緩和キャンペーンとCOVID-19封じ込め措置に劇的な影響を与える可能性があることが明らかになりました[62]。これらの報告は、温帯流行地域の居住者や旅行者におけるデングウイルス感染症の血清サーベイランスの緊急性を示した。また、COVID-19の中で、物理的な距離と公共交通機関の減少がデング熱感染の抑制に寄与する可能性があると述べられている[63]。
3.1.4. 慢性ウイルス性疾患を持つCOVID-19患者。HIVとHCV COVID-19,ヒト免疫不全ウイルス(HIV),C型肝炎ウイルス(HCV)の三重苦は,21世紀の主要かつ根強いグローバルな健康問題の一つである.HIV、HCV、そしてコロナウイルスのような新しく出現した感染症の流行は、HIVとHCBまたはHCVの高負担国で重なることが予想される[64]。COVID-19がHIV/HCVの共感染者にどのように現れるかはまだ不明である[64].HIVとHCVに感染している集団は、COVID-19に感染した場合、重篤な反応を起こすリスクが高くなる可能性がある。将来的には,COVID-19に関連する肺病変がHIVまたはHCVのリスクを高め,HIV-HCV-COVID-19共感染の真の悪循環を誘発する可能性がある[64,65].COVID-19が世界中に広がり続ける一方で,多くの地域がSARS-CoV-2の感染リスクに直面しており,高負荷HIV/HCV国においてHIVおよびHCV治療の連続性を維持するための障害と課題が増加している[64].実際、COVID-19の病原性は、免疫力が低下しているHIV感染者において加速される可能性があります[65]。最近の証拠では、コロナウイルス関連の下気道感染症(LRTI)と免疫不全者における死亡リスクの増加との間に実質的な関連性があることが示されている[64]。スペインで5人(男性3人、トランスジェンダー2人)のHIVとSARS-CoV-2の共感染が報告されている[32]。興味深いことに,HIV/SARS-CoV-2患者は,SARS-CoV-2に感染したHIV陰性患者と臨床的,実験的,放射線学的に類似した特徴を有していた.現在のSARS-CoV-2パンデミックの間,HIV感染者の多い国,特にHIV感染者の70%が住むサハラ以南のアフリカでは,この情報の欠如は懸念される[32].この患者は4年前にHIV-1とHCVの共感染の既往があったため,抗SARS-CoV-2免疫反応の追跡調査では,抗体反応の遅延が認められたが,SARS-CoV-2 RNAのRT-PCRテストでは繰り返し陰性であった[66].しかし、患者の免疫状態の悪化がSARS-CoV-2に対する体液性反応の発達の遅れを引き起こし、抗HIV治療薬と抗HIV薬による活性化IFN-γレベルの上昇がSARS-CoV-2の感染を抑制し、RT-PCR検査でRNAが持続的に検出されなくなると思われる[66]。したがって、免疫不全の状態や抗ウイルス剤治療によるウイルス感染の既往は、不明瞭なCOVID-19の診断とともに、抗体反応の遅れにつながる可能性がある。
3.1.5. SARS-CoV-2 と hCoV-HKU1 風土病のヒトコロナウイルス(hCoVs)は、互いに、あるいはインフルエンザ A/B、呼吸同期ウイルス(RSV)、メタニューモウイルス、エンテロウイルス、アデノウイルスなど、他の呼吸器ウイルスと共感染を起こし、連続感染することが知られている [67]. インドネシアで報告されたCOVID-19の患者におけるヒトコロナウイルスHKU1による共感染の重症例は、hCoV-HKU1とSARS-CoV-2の連続感染を示し、FilmArray Respiratory Panel(RP)検査で確認された[67]。したがって、臨床医はCOVID-19患者におけるhCoVの併発に注意する必要がある。この急速に進行するアウトブレイクでは、診断を下すために高度な疑いが必要であり、それによってCOVID-19の蔓延を抑制・制御することができる。
3.2. COVID-19の入院患者における細菌,古細菌および真菌の共存感染について
1918年のインフルエンザの大流行[4]や2009年のH1N1パンデミック[68]を含む他のよく研究された呼吸器ウイルス感染症と同様に,現在のSARS-CoV-2の大流行も二次的な微生物感染を伴うことが報告されている[11,12,69].SARS-CoV、MERS-CoV、集中治療を受けているインフルエンザ患者を含む呼吸器疾患について、細菌の共感染が以前に報告されている[10,70]。いくつかのレトロスペクティブな研究では、1918年のスペイン風邪のパンデミックの間、細菌性肺炎が罹患率と死亡率の主要な原因であったことが示されている[71]。以前の研究では、2009年から2012年にかけてのインフルエンザA(H1N1)のパンデミック時の細菌性重複感染の有病率は23.0%であった[68]。最近の研究では、実験室で確認されたインフルエンザ感染症例の約65%が、細菌性共同感染を合併していることが知られていると報告されています[72]。
細菌性複合感染症は、ある感染因子によって引き起こされた一次感染に続いて、あるいはその後に、患者に発症する。細菌性重複感染は、COVID-19の際にも重要な役割を果たし、疾患の重症度や症例致死率の上昇と関連しています[35]。それにもかかわらず、現在まで、SARS-CoV-2肺炎に伴う急性呼吸不全のためにICUに入院した患者における細菌性共同感染の発生率は、あまり研究されていない[73,74]。SARS-CoV-2は、主に鼻咽頭管から人体に侵入し、徐々に肺に移動して感染を開始する。COVID-19の病態生理は、ウイルスを除去する免疫反応の異常に起因していると考えられる[75,76]。ウイルスと細菌の同時感染と呼吸器疾患の重症度との間の明白な関連性を考えると、SARS-CoV-2と気道の宿主マイクロバイオームとの相互作用が、日和見感染を促進するウイルス感染とどのように相関しているかをより理解することが急務である[77]。しかし、COVID-19疾患発症の最終的な重症度に重要であると考えられている鼻腔内常在菌とSARS-CoV-2の相互作用の結果についてはほとんど知られていない。重症入院中のCOVID-19患者における細菌性共感染の有病率は、メタアナリシスにより約14%であることが明らかになった[78]。最近の北米の研究では、ICUに入院したCOVID-19患者17人の細菌性重複感染の有病率は41%であったと報告されている[79]。呼吸器ウイルスに感染していた患者における細菌性肺炎に関連する共同感染の発生率は、11%~35%であった[72]。最近、Fuら(2020)は、ICUに入院したCOVID-19患者のうち、13.9%が細菌性併発症に罹患していると報告した。COVID-19患者の細菌性併発率は様々であるにもかかわらず、非生存者では50%もの有病率になる可能性がある[80]。SARS-COV-2に関する一連のレトロスペクティブな症例研究では、重症患者と非重症患者が、それぞれ7.7%と3.2%の細菌と真菌の同時感染を有していることが確認された[54]。イタリアでは、SARS-CoV-2感染で死亡した重症患者16,654人を対象に行われた研究で、その11%が細菌と真菌の同時感染を伴っていることが描かれています[81]。
COVID-19の病態生理における肺炎球菌、黄色ブドウ球菌、または他の定着性細菌との共感染は、自然および適応的な抗菌性宿主防御を損ない、物理的および免疫的バリアを一時的に損ない、既存の併存疾患を持つ人々や以前に健康だった人々において重症で死に至る疾患を引き起こした[82]。COVID-19肺炎における細菌性重複感染に関するデータはまだ出てきていませんが、サンプル中の細菌性病原体の検出とCOVID-19患者の疾患の重症度との間に関連性が認められました。最もよく確認される共存細菌性病原体は、Acinetobacter baumannii、Klebsiella pneumoniae、Mycoplasma pneumoniae、Legionella pneumophila、Streptococcus pneumoniae、Clamydia pneumoniaeであり[11,70,83,84]、共存真菌として最もよく見られるのはAspergillus flavus、Candida glabrata、およびCandida albicansです[78]。さらに、黄色ブドウ球菌、インフルエンザ菌、肺炎桿菌、肺炎球菌、Neisseria meningitides [83,84] などの細菌性病原体や、Proteus、Enterobacter、Citrobacter 種のいくつかの属も入院中の COVD-19 患者で報告されている。最近のマイクロバイオーム研究では、Hoqueらがバングラデシュと中国のCOVID-19患者でそれぞれ527と306の細菌属を報告している[11]。さらに、緑膿菌と大腸菌は、院内スーパーインフェクションに関連する最も頻繁に分離される多剤耐性(MDR)病原体である[46]。驚くべきことに、SARS-CoV-2 RNAは、COVID-19患者の糞便サンプルからも検出されている。これは、SARS-CoV-2の消化管感染と糞便-経口感染経路の可能性の問題を提起している[85,86]。さらに、消化器系におけるACE2 mRNAの高い発現レベルは、高いマイクロバイオーム多様性と免疫抑制および細菌共感染の可能性がある消化器系とSARS-CoV-2の強い相互作用を明らかにした[85,86]。消化管におけるマイクロバイオームの多様性の調節におけるSARS-CoV-2の役割は、さらなる研究のための重要な問題である。SARS-CoV-2の腸管細胞への感染は、腸内細菌叢の変化を引き起こす可能性がある。Guらは,COVID-19患者の腸内細菌群集が健康なヒトと比較して有意に減少していることを報告した[87].このディスバイオーシス(有益な常在菌の消失)は、COVID-19患者のStreptococcus、Rothia、Veillonella、Actinomycesなどの日和見病原体の存在量が著しく高い一方で、Blautia、Romboutsia、Collinsella、Bifidobacteriumなどの有益な共生者の存在量が相対的にかなり低いままであることに反映されていた[87]。
口腔咽頭カンジダ症(OPC)のCOVID-19入院患者の研究では、C. albicansが70.7%と最も多く、C. glabrata(10.7%)、C. dubliniensis(9.2%)、C. tropicalis(3%)、C. krusei(1.5%)などの他の真菌が続くことが判明した [88](19).一方,Chen らは,中国の COVID-19 患者 99 例における真菌共感染の有病率は 5%であり,Aspergillus flavus 1 例,Candida glabrata 1 例,C. albicans 3 例が含まれていたと報告している[23]。Yang らは,重症 COVID-19 患者の 5.8%(3/52 例)が A. flavus,A. fumigatus,C. albicans の真菌共感染を有していることを明らかにした[89]。さらに、COVID-19患者の8〜15%の非特異的な共感染が中国の異なる研究で報告されているが、細菌感染か真菌感染かは明らかでない[52,90]。SARS-CoV-2感染者のかなりの割合が、典型的な院内病原体によるMDRに関連した同時感染症を発症している[91]。肺アスペルギルス症やカンジダ症などの真菌由来の感染症は、SARS-CoV-2感染に合併することが報告されている[46]。現在までにCOVID-19関連肺アスペルギルス症(CAPA)は30%以上の症例で報告されている[78].
現在までに報告されている呼吸器感染症の多くは、ウイルス、細菌、真菌の病原体に限られているが [5,78,90,92]、古細菌を含む他の多くの微生物が併存していることも確認されている [11,93]. 細菌とは異なり、これらの共存病原体の発生率、多様性、構成は、COVID-19の感染性物質と比較して常にはるかに低いままである。メタゲノム研究により、COVID-19患者のサンプルには、古細菌属としてMethanosarcina, Methanocaldococcus, Thermococcus, Methanothermobacter, Haloarcula, Staphylothermus, Natronomonas, Ferroglobus, Caldivirga, Halobacterium, Natrialba, MethanosphaerulaおよびPicrophilusの存在が確認された[11, 93](※3).
4. COVID-19における共感染の分子機構
呼吸器系ウイルス疾患の多くでは,共感染が病態,罹患率,死亡率を増大させることがある[35].表1は,COVID-19でよく報告される微生物共病原体,その伝播パターン,共感染の可能性のあるメカニズム,および転帰について述べたものである.COVID-19患者における共感染は、本疾患の臨床的転帰を複雑にする可能性もある。SARS-CoV-2は上下気道を裏打ちする細胞のACE2蛋白に結合してヒトの細胞内に侵入する。最近、Leeらは、ACE2受容体タンパク質が気道上皮細胞の運動性繊毛内に強固に局在することを報告し、これはおそらく、宿主呼吸器感染中のSARS-CoV-2ウイルス侵入の初期もしくは初期の細胞内部位を表していると考えられる[94]。しかし、上気道の繊毛ACE2の発現は、患者の人口統計学(年齢、性別、喫煙)、臨床特性、併存疾患/共同感染症または薬剤使用によって影響を受ける[94]。驚くべきことに、COVID-19患者におけるこれらの追加感染症の特異的な分子動態は、いくつかの研究が異なる国のCOVID-19患者における共同/重複感染症のいくつかのモデルを提案しているものの、まだ不明なままである[26]。そこで,文献に基づき,COVID-19患者における共感染のもっともらしい機序を提案する(図1,表1).
表1
表1
COVID-19でよく報告される微生物共病原体、その感染パターンと考えられる共感染のメカニズムおよび転帰。
呼吸器ウイルスは,日和見菌の発育に伴う二次的な細菌感染によって,しばしば共同感染する。COVID-19患者における共感染の具体的な分子メカニズムはまだ不明であるが,ウイルスによる気道障害,細胞消失,杯細胞過形成,粘液分泌の変化,繊毛運動頻度・機能・クリアランスの低下,酸素交換の低下,免疫系へのダメージなどが考えられる[27,45,95].共感染は、CRP(C-reactive protein)とPCT(procalcitonin)のレベルを上昇させる [5]。ウイルス感染は、組織的にも機能的にも呼吸器系気道にダメージを与える [69,96]。共感染のメカニズムには、ウイルスによる気道損傷、細胞損失、杯細胞の過形成、粘液分泌の変化、繊毛運動頻度の減少、粘膜繊毛クリアランスの減少、粘膜繊毛機能の非調整、酸素交換の減少、免疫系の損傷などがある [69,96,97].ウイルスの同時感染は、細菌の接着を促進し、タイトジャンクションと上皮バリアの完全性を破壊し、細菌の細胞外移動を促進し、自然免疫反応と適応免疫反応の両方を変化させ、肺をSARS-CoV-2感染に対してより脆弱にすることができる [20,38].多くのウイルスは、気道上皮を破壊し、他のウイルスの共感染を促進する[98]。HIVを併発したCOVID-19患者では、免疫系の崩壊により、病状の進行が長く、特異的抗体の産生が遅かった[99]。SARS-CoV-2感染は肝障害を引き起こす可能性があり[5]、したがって、薬剤性肝障害(DILI)はHCVやHIVを含む特定のウイルス感染症を既に持っている患者で発生しやすい[23]。したがって、SARS-CoV-2に関連した他のウイルスとの共感染の発生と結果は、特に高齢者では、宿主の免疫反応に大きく依存します[23]。ウイルスの共感染は、細菌の同時感染を促進する素因が気道に生じる、異なる分子メカニズムに関連しています。呼吸器上皮細胞は、ウイルス感染時に異なるメカニズムで細菌の付着を助ける一方、疾患の重症度は、ウイルス、細菌株、他の共存病原体、宿主の免疫によって変化します。呼吸器ウイルスは、宿主細胞膜タンパク質の発現をアップレギュレートして、その結合を促進することができる[69]。呼吸器合胞体ウイルス(RSV)は、インフルエンザ菌や肺炎球菌と直接結合するため、細菌が上皮単層に接近し、宿主細胞の受容体に付着するのを促進することが報告されている。さらに、感染中の宿主細胞膜上のRSV糖タンパク質の発現と局在は、肺炎球菌の結合のための細菌受容体としてさらに作用することができる[100]。以前の研究では、インフルエンザウイルスがマウスに黄色ブドウ球菌による肺炎を引き起こしやすくすることが示され、共存感染時にウイルスと細菌の両方の負荷が増加することが示された[100,101]。RSV,パラインフルエンザウイルス-3,インフルエンザウイルスなどの呼吸器系ウイルスは,初代上皮細胞および不死化上皮細胞において,感染時に細菌の接着を増加させることが報告されている[69].RSVやアデノウイルスの感染により,表面糖タンパク質接着分子-1(ICAM-1)の発現が上昇し,ヒト鼻咽頭細胞(HEp-2)やII型肺胞細胞(A549)において肺炎球菌の接着が促進されることが報告されている.上皮細胞における肺炎球菌の付着の増強は,細菌の蓄積をもたらし,他の細菌の共感染を促進する可能性がある[69,102].メタン生成古細菌は、嫌気性細菌と共存し、密接に相互作用しています[39]。メタン生成古細菌は、H2 + CO2、ギ酸、または酢酸などの低分子化合物を利用するため、これらの基質の生産者と共生関係を結んでいる。メタン生成古細菌の存在または増加によって、多細胞生物群集の構成が変化し、微生物叢の病原性が変化すると考えるのは妥当である[39]。また,古細菌の共感染は,ウイルスや細菌を宿主とする場合に多く見られるとする先行研究があるが[92,103],異なる分類群や環境におけるウイルス共感染の変動を説明する要因についての系統的な検証はまだなされていない.
最近の研究では、微生物共感染を有するCOVID-19患者は、リンパ球減少、および血漿中のインターロイキン-6(IL-6)およびIL-1β、ならびにMCP-1、IP-10および顆粒球コロニー刺激因子(G-CSF)を含む炎症性サイトカインのレベルの上昇によって特徴づけられることが示唆された。炎症性サイトカインの高値は、ショックだけでなく、呼吸不全や多臓器不全を引き起こす可能性があることが提唱されており、炎症性メディエーターを評価するいくつかの試験が進行中である[104]。サイトカインストームまたは高サイトカイン血症は、免疫系の過活性化を示すもので、感染症によって誘発されたり悪化したりすることがある。炎症性サイトカインが肺胞(ガス交換と酸素供給を担う肺の小さな袋)を損傷するため、これは肺組織の破壊的で修復不可能な破壊につながる可能性があります。SARS-CoV-2による肺組織の損傷は、二次感染を促進する他の病原性微生物や日和見菌の受容体を探索する可能性がある。ウイルスがこのような促進的な役割を果たす具体的な領域としては、クリプトレセプターのマスク解除と接着タンパク質のアップレギュレーションによる細菌接着の促進、細菌の細胞間移動と上皮バリアーの完全性の喪失を促すタイトジャンクションの完全性の破壊、ムチンや鉄などの栄養分の利用率の上昇、自然および適応免疫応答の変化、細菌に対する防御力の低下、そして最後に肺を病原菌に対してより脆弱化させる気道微生物相の変化[105]が挙げられます。さらに、SARS-CoV-2感染は、リンパ球、特にB細胞、T細胞、NK細胞を損傷し、病気の期間中、免疫系の障害をもたらすことになる[26]。リンパ球と宿主の免疫機能の低下は、さらなる超・二次感染の主因となる可能性がある[106]。死亡率は、非重症群に比べ重症群でより顕著である[107]。これは、重症患者における共感染率が高いためである[106,107]。インフルエンザウイルスが肺胞マクロファージの枯渇を引き起こし、より少ない菌量で生産的な感染を成立させることが、インフルエンザと肺炎球菌の併発のメカニズムとして示され[108]、結果として細菌併発の重症化は、肥満などの既存のホスト因子によって悪化することが明らかにされた[109]。重症の患者の場合、侵襲的なカテーテルによる治療を受ける可能性が高く、その結果、アシネトバクター・バウマンニ、大腸菌、緑膿菌、腸球菌などの多剤耐性病原体の共感染に対する感受性が高くなる [110]。さらに、COVID-19の病態の間、SARS-CoV-2ウイルスは多数の細胞タンパク質と相互作用し(ウイルス-宿主インタラクトーム)、無関係のウイルス、細菌、古細菌、真菌間のタンパク質-タンパク質相互作用も可能である [110]。共感染の結果,異種ウイルス間,あるいは異種病原体間の遺伝子交換が起こり[111],組換えあるいはキメラ病原体が生成され,この組換え効果は,ウイルスの進化,疾病動態,抗ウイルス療法に対する感受性,そして最終的には宿主の運命に影響を与える[110]未調査ではあるが,同様のメカニズム事象がSARS-CoV-2と関連共同感染で見られ,COVID-19の病態生理を悪化させると考えられている.さらに、宿主の生態、宿主の分類または系統、宿主の防御機構、およびSARS-CoV-2と共存する病原体の相互作用を含む4つの要因が、COVID-19疾患の病態生理と重症化に重要な役割を果たすと思われる。これらの病原体の分子事象の関連性と重要性は、交差感染性、培養共感染性、単細胞共感染性で異なると思われる[92]。全体として,肺の上皮障害,免疫系の調節障害,長期入院などのいくつかの危険因子により,重症のCOVID-19患者ではスーパーインフェクションの発症の可能性がある程度予想される[78].しかし、SARS-CoV-2感染者における微生物共同感染の有病率、発生率および特徴の実際のシナリオは、まだ解明され、分析されてはいない。このレビューでは、COVID-19の共存感染の免疫学的メカニズムと多様な臨床像の基礎を理解することが、合理的な治療戦略を設計する上で重要なステップであることを強調している。したがって、SARS-CoV-2の複製と自然免疫反応の誘導が、ヒトや動物の上気道(URT)マイクロバイオームの構成に及ぼす影響については、依然として解明されず、地域全体の規模での詳細な分析が必要とされている。SARS-CoV-2感染による重症患者の二次感染・重複感染の危険因子と疾患スペクトラムをより深く理解し評価するために、さらなる広範な調査が必要である。
5. 結論と展望
SARS-CoV-2感染症では,様々な微生物による共感染が一般的に認められ,COVID-19の重症度や死亡率に大きな影響を与えている。しかし,共存する微生物やそのクロストーク,宿主との最終的な相互作用に関する理解は乏しい.COVID-19の共感染は、ウイルス、細菌、真菌、古細菌など複数のドメインの微生物が関連している。SARS-CoV-2の病態生理における共感染の具体的な分子事象はまだ不明であるが、共感染病原体は呼吸気道の損傷、細胞損失、杯細胞の過形成、粘液分泌の変化、繊毛運動頻度・機能・クリアランスの低下、酸素交換の低下、免疫系の損傷に関与していると考えられる。さらに、ウイルスの共感染は細菌の接着を促進し、タイトジャンクションと上皮バリアの完全性を破壊して細菌の細胞外移動を促進し、自然および適応免疫応答を変化させて肺をSARS-CoV-2感染に対してより脆弱なものにしている。本総説は,COVID-19患者における共感染の包括的なシナリオを提供しているが,異なる地理的気候条件の多様なCOVID-19患者群における共感染病原体の疫学,臨床および臨床検査の特徴に焦点を当て,共感染微生物がCOVID-19患者の予後に及ぼす影響を評価するためのさらなる研究が必要である.
データの入手方法
本論文はLiterature Reviewであり、データおよびコードはない。
資金提供について
本総説の執筆にあたり、著者は資金提供を受けていない。
著者の貢献
MNH、SA、IDM、MRI、MSR、MA、II、MMHが本総説の構成を考え、設計し、原稿を執筆した。MMR、MS、TI、MAHは原稿を批判的に検討し、編集した。
利益相反の申告
著者らは、利害関係を宣言していない。
謝辞
ASM Rubayet-Ul-Alam氏には,本総説の執筆にあたり,建設的なご指摘とご支援をいただいた。
論文情報
Microb Pathog. 2021 Jul; 156: 104941.
2021年5月4日オンライン公開。doi: 10.1016/j.micpath.2021.104941
PMCID: PMC8095020
PMID: 33962007
M. この論文では、「医療費抑制のために必要なこと」として、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」、「医療費抑制のために必要なこと」を挙げています。Mizanur Rahaman, a Munawar Sultana, a Tofazzal Islam, e and M. Anwar Hossaina, f, ∗.
aDepartment of Microbiology, University of Dhaka, Dhaka, 1000, Bangladesh
bバンガバンドゥ・シェイク・ムジブル・ラーマン農業大学(BSMRAU)婦人科・産科・生殖衛生学科(バングラデシュ、1706年、ガジプール市
cバングラデシュ、ダッカ、サバール、ジャハンギルナガル大学、微生物学部門、1342
dバングラデシュ・ノアカリ科学技術大学水産海洋科学部(バングラデシュ・ノアカリ・3814
eバングラデシュ、1706、ガジプール、BSMRAU、バイオテクノロジー・遺伝子工学研究所(IBGE)
fバングラデシュ、7408、ジャショール科学技術大学
∗共著者 ダッカ大学微生物学部、ダッカ、1000、バングラデシュ。
1Equal contribution.
Received 2021年1月9日; Revised 2021年4月8日; Accepted 2021年4月8日.
Copyright © 2021 Published by Elsevier Ltd.(エルゼビア社)。
2020年1月より、エルゼビアは新型コロナウイルスCOVID-19に関する英語と北京語の無料情報を掲載したCOVID-19リソースセンターを作成しました。COVID-19リソースセンターは、同社の公開ニュースおよび情報サイトであるElsevier Connectでホストされています。エルゼビアはここに、COVID-19リソース・センターで公開されている同社のCOVID-19関連のすべての研究(この研究内容を含む)を、パブメド・セントラルおよびその他の公的資金によるリポジトリ(WHO COVIDデータベースなど)で直ちに公開する許可を、原典への謝辞を伴ういかなる形式または手段によっても無制限に研究再利用および分析する権利とともに付与するものである。これらの許可は、COVID-19リソースセンターが有効である限り、エルゼビア社から無償で付与されます。
参考文献
Hoque M.N., Chaudhury A., Akanda M.A.M., Hossain M.A., Islam M.T. Genomic diversity and evolution, diagnosis, prevention, and therapeutics of the pandemic COVID-19 disease(パンデミック COVID-19 疾患のゲノム多様性と進化、診断、予防、治療法)。PeerJ. 2020;8:e9689. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Rahman M.S., Hoque M.N., Islam M.R., Akter S., Rubayet-Ul-Alam A., Siddique M.A., et al. 世界的大流行COVID-19の病因SARS- CoV-2のS、M、E蛋白に対するエピトープベースのキメラペプチドワクチンデザイン:インシリコアプローチ. PeerJ. 2020;8 [PMCフリーアーティクル] [PubMed] [Google Scholar].
Zhu N., Zhang D., Wang W., Li X., Yang B., Song J., et al. A novel coronavirus from patients with pneumonia in China.中国の肺炎患者から検出された新規コロナウイルス。N. Engl. J. Med. 2019:2020. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Reid A.H., Fanning T.G., Hultin J.V., Taubenberger J.K. Origin and evolution of the 1918 "Spanish" influenza virus hemagglutinin gene(1918年「スペイン」インフルエンザウイルスヘマグルチニン遺伝子の起源と進化)。Proc. Natl. Acad. Sci. Unit. States Am. 1999;96:1651-1656. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Li R., Pei S., Chen B., Song Y., Zhang T., Yang W., et al. Substantial undocumented infection facilitates the rapid dissemination of novel coronavirus (SARS-CoV-2) 科学(Science).2020;368:489-493. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Mirzaei R., Goodarzi P., Asadi M., Soltani A., Aljanabi H.A.A., Jeda A.S., et al. Bacterial co-infections with SARS-CoV-2.(SARSとCoV-2の細菌感染). IUBMB Life. 2020;72:2097-2111. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Paget C., Trottein F. Mechanisms of bacterial superinfection post-influenza: a role for unconventional T cells. Front. Immunol. 2019;10:336. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Jia L., Xie J., Zhao J., Cao D., Liang Y., Hou X., et al. インフルエンザウイルス感染後の重症死亡率関連細菌共感染のメカニズム. Frontiers in cellular and infection microbiology. 2017;7:338. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Quah J., Jiang B., Tan P.C., Siau C., Tan T.Y. Impact of microbial Aetiology on mortality in severe community-acquired pneumonia. BMC Infect. Dis. 2018;18:451. [PMC無料記事] [PubMed] [Google Scholar].
Memish Z.A., Perlman S., Van Kerkhove M.D., Zumla A. Middle East respiratory syndrome. Lancet. 2020;395(10229):1063–1077. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hoque M.N., Rahman M.S., Ahmed R., Hossain M.S., Islam M.S., Crandall K.A., et al. 2020年. COVID-19および非COVID呼吸器疾患に関連するマイクロバイオームの多様性とゲノム決定要因.bioRxiv. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y., et al. 2019 new coronavirus pneumonia in Wuhan, China の 99 症例の疫学および臨床特性:記述的研究. Lancet. 2020;395:507-513. [PMC無料記事] [PubMed] [Google Scholar].
Shen Z., Xiao Y., Kang L., Ma W., Shi L., Zhang L., et al. コロナウイルス病2019年患者におけるSARS-CoV-2のゲノム多様性. Clin. Infect. Dis. 2020;71(15):713-720. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z., et al. 中国武漢の成人COVID-19入院患者の臨床経過と死亡の危険因子:レトロスペクティブ・コホート研究。Lancet. 2020 [PMC free article] [PubMed] [Google Scholar].
Martines R.B., Ritter J.M., Matkovic E., Gary J., Bollweg B.C., Bullock H., et al. 致死的コロナウイルス疾患に関連した SARS-CoV-2 の病理と病因、アメリカ. Emerg. Infect. Dis. 2020;26:2005. [PMC フリーアーティクル] [PubMed] [Google Scholar].
サウジアラビアの中東呼吸器症候群コロナウイルス感染症 47 例の疫学的、人口統計学的、臨床的特徴:記述的研究. Lancet Infect. Dis. 2013;13:752-761. [PMC フリーアーティクル] [PubMed] [Google Scholar].
このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」etc.etc.etc.it.at.it. N. Engl. J. Med. 2020;395(10229):1054–1062. [Google Scholar】。]
Zahariadis G., Gooley T.A., Ryall P., Hutchinson C., Latchford M.I., Fearon M.A., et al. 別の診断を除外することによる重症急性呼吸器症候群のリスク:診断分析に基づく非定型細菌の併発の変動率. Can. Respir. J. Can. Thorac. Soc. 2006;13 [PMC free article] [PubMed] [Google Scholar].
Zheng T., Li J., Ni Y., Kang K., Misiakou M.-A., Imamovic L., et al. Mining, analyzing, and integrating viral signals from metagenomic data(メタゲノムデータからのウイルスシグナルのマイニング、分析、統合). Microbiome. 2019;7:1-15. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Lin X., Gong Z., Xiao Z., Xiong J., Fan B., Liu J. Novel Coronavirus pneumonia outbreak in 2019: Computed Tomographic findings in two cases. Korean J. Radiol. 2020;21:365-368. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Guan W-j, Ni Z-y, Hu Y., Liang W-h, Ou C-q, He J-x, et al. Clinical characteristics of coronavirus disease 2019 in China.中国におけるコロナウイルス感染症の臨床的特徴。N. Engl. J. Med. 2020;382:1708-1720. [PMC無料記事] [PubMed] [Google Scholar].
McCullers J.A. The co-pathogenesis of influenza viruses with bacteria in the lung.インフルエンザウイルスの肺における細菌との共培養。Nat. Rev. Microbiol. 2014;12:252-262. [PubMed][Google Scholar].
Chen X., Liao B., Cheng L., Peng X., Xu X., Li Y., et al. COVID-19における微生物のコインフェクションについて。Appl. Microbiol. Biotechnol. 2020:1-9. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lansbury L., Lim B., Baskaran V., Lim W.S. Co-infections in people with COVID-19: a systematic review and meta-analysis. J. Infect. 2020;81(2):266-275. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Joseph C., Togawa Y., Shindo N. Bacterial and viral infections associated with influenza. Influenza and other Respiratory Viruses. 2013;7:105-113. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wang D., Hu B., Hu C., Zhu F., Liu X., Zhang J., et al. 中国武漢における2019年新型コロナウイルス感染肺炎の入院患者138名の臨床的特徴. J. Am. Med. Assoc.2020;323:1061-1069に掲載されました。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Wu X., Cai Y., Huang X., Yu X., Zhao L., Wang F., et al. 肺炎患者における SARS-CoV-2 と A 型インフルエンザウイルスの共感染、China.Emerg. Emerg. Infect. Dis. 2020;26:1324. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wan S., Xiang Y., Fang W., Zheng Y., Li B., Hu Y., et al. COVID-19 patients in northeast Chongqing の臨床的特徴と治療法。J. Med. Virol. 2020;92(7):797-806. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kalantar-Zadeh K., Ward S.A., Kalantar-Zadeh K., El-Omar E.M. SARS-CoV-2 感染におけるマイクロバイオームと食事の影響の考察:ナノテクノロジーの役割. ACS Nano. 2020;14(5):5179–5182. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Netea M.G., Giamarellos-Bourboulis E.J., Domínguez-Andrés J., Curtis N., van Crevel R., van de Veerdonk F.L., et al. 訓練免疫: SARS-CoV-2 感染に対する感受性と重症度を下げるための手段. Cell. 2020;181(5):969-977. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Salas-Benito J.S., Nova-Ocampo D. Viral interference and persistence in mosquito-borne flaviviruses(蚊が媒介するフラビウイルスにおけるウイルスの干渉と持続性). J. Immunol. Res. 2015;2015 [PMC free article] [PubMed] [Google Scholar].
Makoti P., Fielding B.C. HIV and human Coronavirus coinfections: a historical perspective(HIVとヒトコロナウィルスの重複感染:歴史的な視点). Viruses. 2020;12:937. [PMC フリーアーティクル] [PubMed] [Google Scholar] 32.
Griffiths E.C., Pedersen A.B., Fenton A., Petchey O.L. The nature and consequences of coinfection in humans(ヒトにおけるコイン感染の性質とその結果). J. Infect. 2011;63:200-206. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Van Der Hoek L., Pyrc K., Berkhout B. Human Coronavirus NL63, a new respiratory virus(ヒトコロナウイルスNL63、新しい呼吸器ウイルス). FEMS (Fed. Eur. Microbiol. Soc.) Microbiol. Rev. 2006;30:760-773. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bengoechea J.A., Bamford C.G. SARS-CoV-2, bacteria co-infections, and AMR: the Deadly trio in COVID-19? EMBO Mol. Med. 2020;12(7) [PMCフリー記事] [PubMed] [Google Scholar].
Griffiths E., Pedersen A., Fenton A., Petchey O. Reported co-infection deaths are more common in early adulthood and among similar infections.(報告された共同感染による死亡は、成人期初期および類似の感染症間でより一般的である)。BMC Infect. Dis. 2015;15:411. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nepogodiev D., Glasbey J.C., Li E., Omar O.M., Simoes J.F., Abbott T.E., et al. Perioperative SARS-CoV-2 infection の手術を受けた患者の死亡率と肺の合併症:国際コホート研究(Mortality and pulmonary complications in patients under surgery with perioperative SARS-CoV-2 infection: an international cohort study. Lancet. 2020;396(10243):27–38. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nickbakhsh S., Mair C., Matthews L., Reeve R., Johnson P.C., Thorburn F., et al. Virus-virus interactions impact the population dynamics of influenza and the common cold.ウイルスとウイルスの相互作用は、インフルエンザと風邪の集団動態に影響を与える。Proc. Natl. Acad. Sci. Unit. States Am. 2019;116:27142–27150. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Hoque M.N., Istiaq A., Clement R.A., Sultana M., Crandall K.A., Siddiki A.Z., et al. Metagenomic deep sequencing reveals association of microbiome signature with functional biases in bovine mastitis.メタゲノムディープシーケンスはウシ乳腺炎におけるマイクロバイオームシグネチャーと機能的偏りの関連性を明らかにした。Sci.Rep.2019;9:1-14。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Konno Y., Kimura I., Uriu K., Fukushi M., Irie T., Koyanagi Y., et al. SARS-CoV-2 ORF3b is a potent interferon antagonist whose activity is increased by a natural occurring elongation variant. Cell Rep.2020;32:108185。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Lambert L.C., Fauci A.S. Influenza Vaccines for the Future(ランバート・L.C., ファウチ・A.S. インフルエンザワクチンの将来). N. Engl. J. Med. 2010;363:2036-2044. [PubMed][Google Scholar].
Zheng X., Wang H., Su Z., Li W., Yang D., Deng F., et al. 中国武漢における COVID-19 流行の初期段階での SARS-CoV-2 とインフルエンザウイルスの共感染。J. Infect. 2020;81(2):128-129. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-CoV-2 と A 型インフルエンザウイルスの共感染.IDCases. 2020;20 [PMC free article] [PubMed] [Google Scholar].
Ding Q., Lu P., Fan Y., Xia Y., Liu M. The clinical characteristics of pneumonia patients cofected with 2019 novel coronavirus and influenza virus in Wuhan, China. J. Med. Virol. 2020;92(9):1549–1555. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhu X., Ge Y., Wu T., Zhao K., Chen Y., Wu B., et al. COVID-2019症例における呼吸器系病原体との共感染. Virus Res. 2020;285:198005. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Garcia-Vidal C., Sanjuan G., Moreno-García E., Puerta-Alcalde P., Garcia-Pouton N., Chumbita M., et al. COVID-19 入院患者における共感染およびスーパーインフェクションの発生率:レトロスペクティブ・コホートスタディ. Clin. Microbiol. Infect. 2020;27(1):83-88. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kunutsor S.K., Laukkanen J.A. COVID-19 の肝機能の発現と合併症:システマティックレビューとメタアナリシス. J. Infect. 2020;81:e72-e74. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zhang C., Shi L., Wang F.-S. COVID-19 における肝障害:管理と課題。The lancet Gastroenterology & Hepatology. 2020;5:428-430. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wander P., Epstein M., Bernstein D. COVID-19 Presenting as Acute Hepatitis(急性肝炎として現れるCOVID-19)。Am J Gastroenterol. 2020 doi: 10.14309/ajg.0000000000000660. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Alqahtani S.A., Schattenberg J.M. Liver injury in COVID-19: the current evidence. United European Gastroenterology Journal. 2020;8:509-519. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Mehta P., McAuley D.F., Brown M., Sanchez E., Tattersall R.S., Manson J.J., et al. COVID-19: Consider cytokine storm syndromes and immunosuppression.(サイトカインストーム症候群と免疫抑制を考慮せよ).COVID-19. Lancet (London, England) 2020;395:1033. [PMC無料記事] [PubMed] [Google Scholar].
Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., et al. 中国武漢における2019新型コロナウイルスに感染した患者の臨床的特徴. Lancet. 2020;395:497-506. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Khinda J., Janjua N.Z., Cheng S., van den Heuvel E.R., Bhatti P., Darvishian M. Association between markers of immune response at hospital admission and COVID-19 disease severity and mortality: a meta -analysis and meta -regression. J. Med. Virol. 2020;93(2):1078–1098. [PMC フリーアーティクル] [PubMed] [Google Scholar].
中国武漢市における COVID-19 患者 221 名の臨床的特徴と短期転帰.J. Clin. Virol. 2020:104364. [PMC フリーアーティクル] [PubMed] [Google Scholar].
COVID-19 感染と肝障害の関係:最近のデータのレビュー。Front. Med. 2020;7:458. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cai Q., Huang D., Yu H., Zhu Z., Xia Z., Su Y., et al. COVID-19: abnormal liver function tests. J. Hepatol. 2020;73(3):566-574. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Epelboin L., Blondé R., Nacher M., Combe P., Collet L. 帰国旅行者におけるCOVID-19とデング熱の同時感染. J. Trav. Med. 2020;27 taaa114. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yan G., Lee C.K., Lam L.T., Yan B., Chua Y.X., Lim A.Y., et al. Covert COVID-19 and false-positive dengue serology in Singapore(シンガポールにおけるCOVID-19とデング熱の血清診断の偽陽性). Lancet Infect. Dis. 2020;20:536. [PMC無料記事] [PubMed] [Google Scholar].
Lorenz C., Bocewicz A.C.D., de Azevedo Marques C.C., Santana L.M.R., Chiaravalloti-Neto F., Gomes A.H.A., et al. COVID-19 への対策はブラジルにおけるデングの患者数の減少に貢献したのか? Trav. Med. Infect. Dis. 2020 arXiv:2103.08669, Submitted for publication. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cardona-Ospina J.A., Arteaga-Livias K., Villamil-Gómez W.E., Pérez-Díaz C.E., Katterine Bonilla-Aldana D., Mondragon Cardona Á., et al. デングと COVID-19, overlapping epidemics ?(デングと COVID-19 は重複する疫病か?コロンビアの分析。J. Med. Virol. 2020;93(1):522-527. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ピンキー L., ドブロヴォルニー H.M. 呼吸器系の複合感染症:ウイルスの資源獲得競争. PLoS One. 2016;11 e0155589. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Navarro J.-C., Arrivillaga-Henríquez J., Salazar-Loor J., Rodriguez-Morales A.J. COVID-19 and dengue, co-epidemics in Ecuador and other countries in Latin America: pushing strained health care systems over the edge.エクアドルにおけるデング熱の共流行:緊張した医療システムを限界まで押し上げる。Trav. Med. Infect. Dis. 2020;37 [PMC無料記事] [PubMed] [Google Scholar].
ロレンツC.、アゼベドT.S.、キアラヴァロティ-ネトF. COVID-19とデング熱。ブラジルの医療制度にとって危険な組み合わせ。Trav. Med. Infect. Dis. 2020;35 [PMCフリーアーティクル] [PubMed] [Google Scholar].
Tamuzi J.L., Ayele B.T., Shumba C.S., Adetokunboh O.O., Uwimana-Nicol J., Haile Z.T., et al. HIV/TB に対する高負担国における COVID-19 の意義:エビデンスの系統的レビュー。BMC Infect. Dis. 2020;20:1-18. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Soriano V., Barreiro P. Impact of new coronavirus epidemics on HIV-infected patients(新しいコロナウイルスの流行がHIV感染者に与える影響). AIDS Rev. 2020;22 [PubMed] [Google Scholar].
HIV-1慢性感染症における持続的なIFN-I刺激によるIL-10誘導によるMAIT細胞の細菌に対する応答の障害.サイエンス・アドバンス。2020;6:eaaz0374. [PMC フリーアーティクル] [PubMed] [Google Scholar].
COVID-19 とコロナウイルス HKU1 の共感染-臨床的適応があれば再検査の重要な必要性-.J. Med. Virol. 2020;92(10):1785–1786. [PMC フリーアーティクル] [PubMed] [Google Scholar].
MacIntyre C.R., Chughtai A.A., Barnes M., Ridda I., Seale H., Toms R., et al. パンデミックインフルエンザa(H1N1)pdm09の致命的・重大な転帰における肺炎と二次的細菌感染症の役割について. BMC Infect. Dis. 2018;18:637. [PMC無料記事] [PubMed] [Google Scholar].
Manna S., Baindara P., Mandal S.M. Molecular pathogenesis of secondary bacterial infection associated to viral infections including SARS-CoV-2.(SARS-CoV-2を含むウイルス感染症に関連する二次的細菌感染の分子病態)。Journal of Infection and Public Health. 2020;13(10):1397–1404. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Langford B.J., So M., Raybardhan S., Leung V., Westwood D., MacFadden D.R., et al. COVID-19 患者における細菌の共感染と二次感染:生きた迅速レビューとメタアナリシス(British Rapid Review and Meta-analysis). Clin. Microbiol. Infect. 2020;26(12):1622–1629. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Morens D.M., Taubenberger J.K., Fauci A.S. Predominant role of bacterial pneumonia as a cause of death in pandemic influenza: implications for pandemic influenza preparedness(パンデミックインフルエンザにおける死因としての細菌性肺炎の優勢な役割:パンデミックインフルエンザ準備への示唆). J. Infect. Dis. 2008;198:962-970. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Klein E.Y., Monteforte B., Gupta A., Jiang W., May L., Hsieh Y.H., et al. The frequency of influenza and bacterial coinfection: a systematic review and meta-analysis. インフルエンザおよびその他の呼吸器系ウイルス. 2016;10:394-403. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Huttner B., Catho G., Pano-Pardo J.R., Pulcini C., Schouten J. COVID-19: Don't neglect antimicrobial stewardship principles ! Clin. Microbiol. Infect. 2020;26:808-810. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cox M.J., Loman N., Bogaert D., O'Grady J. Co-infections: potentially lethal and unexplored in COVID-19.(共感染:致死的で未解明の可能性がある)。The Lancet Microbe. 2020;1:e11. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yeoh Y.K., Zuo T., Lui G.C.-Y., Zhang F., Liu Q., Li A.Y., et al. Gut microbiota composition reflects disease severity and dysfunctional immune response in patients with COVID-19. Gut. 2021;70:698-706. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Mostafa H.H., Fissel J.A., Fanelli B., Bergman Y., Gniazdowski V., Dadlani M., et al. COVID-19確定患者と疑い患者から採取した鼻咽頭検体のメタゲノム次世代シーケンサー。mBio. 2020:11. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kaul D., Rathnasinghe R., Ferres M., Tan G.S., Barrera A., Pickett B.E., et al. Microbiome disturbance and resilience dynamics of the upper respiratory tract during influenza A virus infection.(A型インフルエンザウイルス感染時の上気道のマイクロバイオームの乱れと回復力のダイナミクス). Nat. Commun. 2020;11:1-12. [PMC フリーアーティクル] [PubMed] [Google Scholar].
バセッティM.、コレフM.H.、ティムジットJ.-F. COVID-19を用いた重症患者における細菌および真菌のスーパーインフェクション(Bacterial and Fungal Superinfections in Critical ill patients)。Intensive Care Med. 2020;46:2071-2074. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lehmann C.J., Pho M.T., Pitrak D., Ridgway J.P., Pettit N.N. Community acquired co-infection in COVID-19: a retrospective observational experience(COVID-19における市中感染症:レトロスペクティブ観察経験). Clin. Infect. Dis. 2020;72(8):1450–1452. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Fu Y., Yang Q., Xu M., Kong H., Chen H., Fu Y., et al. COVID-19の重症患者における二次的な細菌感染症。オープンフォーラム感染症. 2020;7(6) doi: 10.1093/ofid/ofaa220. [PMC フリーアーティクル] [PubMed] [CrossRef] [Google Scholar].
Lai C.-C.、Wang C.-Y.、Hsueh P.-R. COVID-19 患者の共感染:非抗 SARS-CoV-2 剤との併用療法の必要性は?J. Microbiol. Immunol. Infect. 2020;53(4):505-512. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ginsburg A.S., Klugman K.P. COVID-19肺炎と抗生物質の適切な使用. The Lancet Global Health. 2020;8:e1453-e1454. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Khatiwada S., Subedi A. Lung microbiome and coronavirus disease 2019 (COVID-19): possible link and implications. Human Microbiome J. 2020;17:100073. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Peddu V., Shean R.C., Xie H., Shrestha L., Perchetti G.A., Minot S.S., et al. Metagenomic analysis reveals clinical SARS-CoV-2 infection and bacterial or viral superinfection and colonization.メタゲノム解析による臨床SARS-CoV-2感染の発見と、細菌またはウイルスの重感染およびコロニー形成。Clin. Chem. 2020;66(7):966-972. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gao Q.Y., Chen Y.X., Fang J.Y. 2019 Novel Coronavirus infection and gastrointestinal tract. J. Digestive Diseases. 2020;21:125-126. [PMC無料論文] [PubMed] [Google Scholar].
Xiao F., Tang M., Zheng X., Liu Y., Li X., Shan H. Evidence for gastrointestinal infection of SARS-CoV-2. Gastroenterology. 2020;158:1831-1833. e3. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gu S., Chen Y., Wu Z., Chen Y., Gao H., Lv L., et al. コロナウイルス疾患2019またはH1N1インフルエンザ患者における腸内細菌叢の変化. Clin. Infect. Dis. 2020;71:2669-2678. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Salehi S., Abedi A., Balakrishnan S., Gholamrezanezhad A. Coronavirus disease 2019 (COVID-19): a systematic review of imaging findings in 919 patients.コロナウイルス病2019(COVID-19):919人の患者の画像所見の系統的レビュー。Am. J. Roentgenol. 2020:1-7. [PubMed][Google Scholar].
楊 X., 于 Y., 徐 J., 舒 H., 劉 H., 呉 Y., et al. 中国武漢における SARS-CoV-2 肺炎の重症患者の臨床経過と転帰:単施設、回顧的、観察的研究.Lancet Respiratory Medicine. The Lancet Respiratory Medicine. 2020;8(5):475-481. [PMC フリーアーティクル] [PubMed] [Google Scholar].
COVID-19の世界的流行に関連する真菌共感染:中国からの臨床・診断の視点. Mycopathologia. 2020:1-8. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Clancy C.J., Buehrle D.J., Nguyen M.H. PRO: the COVID-19 pandemic will result in increased antimicrobial resistance rates. JAC-Antimicrobial Resistance. 2020;2:dlaa049. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Díaz-Muñoz S.L. Viral coinfection is shaped by host ecology and virus-virus interactions across diverse microbial taxa and environments. Virus Evolution. 2017;3 [PMCフリー記事] [PubMed] [Google Scholar].
Contou D., Claudinon A., Pajot O., Micaëlo M., Flandre P.L., Dubert M., et al. フランスのICUに入院した重症SARS-CoV-2肺炎患者における細菌およびウイルスの共感染. Ann. Intensive Care. 2020;10:1-9. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ACE2 は呼吸繊毛に局在し、ACE 阻害薬や ARB によって増加することはない。Nat. Commun. 2020;11:1-14. [PMCフリーアーティクル] [PubMed] [Google Scholar].
You H.-L.、Chang S.-J.、Yu H.-R.、Li C.-C.、Chen C.-H.、Liao W.-T. 呼吸器症状を有する患者における1段階多重リアルタイムRT-PCRによる呼吸器シンシチアルウイルスおよびヒトメタニューモウイルスの同時検出。BMC Pediatr. 2017;17:89. [PMC無料記事] [PubMed] [Google Scholar].
Avadhanula V., Rodriguez C.A., DeVincenzo J.P., Wang Y., Webby R.J., Ulett G.C., et al. Respiratory viruses augment of bacterial pathogens to respiratory epithelium in a viral species-and cell type-dependent manner.呼吸器ウイルスの細菌性病原体付着は、ウイルス種および細胞型に依存する。J. Virol. 2006;80:1629-1636. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Vareille M., Kieninger E., Edwards M.R., Regamey N. The airway epithelium: soldier in the fight against respiratory viruses(気道上皮:呼吸器系ウイルスとの戦いの兵士). Clin. Microbiol. Rev. 2011;24:210-229。[PMC フリーアーティクル] [PubMed] [Google Scholar].
デニー・L.・ホー・L.-P. インフルエンザウイルス感染に対する宿主防御における呼吸器上皮の役割. Biomed. J. 2018;41:218-233. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wang M., Luo L., Bu H., Xia H. Case report: One case of coronavirus disease 2019 (COVID-19) in patient Co-infected by HIV with a low CD4+ T cell count. Int. J. Infect. Dis. 2020 [PMC free article] [PubMed] [Google Scholar].
Iverson A.R., Boyd K.L., McAuley J.L., Plano L.R., Hart M.E., McCullers J.A. Influenza virus primes mice for pneumonia from Staphylococcus aureus. JID (J. Infect. Dis.) 2011;203:880-888. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Smith A.M., Adler F.R., Ribeiro R.M., Gutenkunst R.N., McAuley J.L., McCullers J.A., et al. Kinetics of coinfection with influenza A virus and Streptococcus pneumoniae.インフルエンザウイルスと肺炎球菌のコイネーショ ン。PLoS Pathog. 2013;9 [PMCフリーアーティクル] [PubMed] [Google Scholar].
Nguyen D.T., Louwen R., Elberse K., van Amerongen G., Yüksel S., Luijendijk A., et al. Streptococcus pneumoniae enhances human respiratory syncytial virus infection in vitro and in vivo(肺炎球菌は、in vitro および in vivo で、ヒト呼吸器合胞体ウイルス感染を促進する。PLoS One. 2015;10 [PMCフリー記事] [PubMed] [Google Scholar].
Roux S., Hawley A.K., Beltran M.T., Scofield M., Schwientek P., Stepanauskas R., et al. Single-cell-and meta-genomics as revealed by uncultivated SUP05 bacteria infected virus of Ecology and Evolution.(シングルセルメタゲノミクスで明らかになった未培養SUP05細菌に感染するウィルスの生態と進化). Elife. 2014;3 [PMCフリーアーティクル] [PubMed] [Google Scholar].
Arunachalam P.S., Wimmers F., Mok C.K.P., Perera R.A., Scott M., Hagan T., et al. Systems biological assessment of immunity to mild versus severe COVID-19 infection in human.(ヒトにおけるCOVID-19感染の軽症と重症に対する免疫のシステム生物学的評価). Science. 2020;369:1210-1220. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ロッシ G.A., ファナス H., コリン A.A. 呼吸器系細菌スーパーインフェクションの素因となるウイルス戦略. Pediatr. Pulmonol. 2020;55:1061-1073. [PubMed][Google Scholar].
Luo Y., Xie Y., Zhang W., Lin Q., Tang G., Wu S., et al. 宿主免疫の評価におけるリンパ球の数と機能の組合せ. Aging (Albany NY) 2019;11:12685. [PMC無料論文] [PubMed] [Google Scholar].
Qin C., Zhou L., Hu Z., Zhang S., Yang S., Tao Y., et al. 中国武漢のCOVID-19患者における免疫反応の調節障害. Clin. Infect. Dis. 2020 covidwho-7937. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Smith A.M., Smith A.P. A critical, nonlinear threshold dictates bacterial invasion and initial kinetics during influenza.(臨界的な非線形閾値がインフルエンザ時の細菌侵入と初期動態を規定する)。Sci. Rep. 2016;6:1-11. [PMC フリーアーティクル] [PubMed] [Google Scholar].
McArdle A.J., Turkova A., Cunnington A.J. When do co-infections matter? Curr. Opin. Infect. Dis. 2018;31:209. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Kumar N., Sharma S., Barua S., Tripathi B.N., Rouse B.T. Virrological and immunological outcomes of coinfections.(クマールN.、シャルマS.、バルアS.、トリパティB.N.、ラウスB.T. Clin. Microbiol. Rev. 2018;31 [PMCフリー記事] [PubMed] [Google Scholar].
Roux S., Enault F., Bronner G., Vaulot D., Forterre P., Krupovic M. Chimeric viruses blur the borders between the major groups of eukaryotic single-stranded DNA viruses(キメラウイルスは真核生物の一本鎖DNAウイルスの主要なグループの境界を曖昧にする。Nat. Commun. 2013;4:1-10. [PubMed] [Google Scholar].
Suwanwongse K., Shabarek N. インフルエンザとの併発はCOVID-19の転帰を悪化させうるか?Journal of Investigative Medicine High Impact Case Reports. 2020;8 2324709620953282. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ma S., Lai X., Chen Z., Tu S., Qin K. 中国武漢市における SARS-CoV-2 とインフルエンザウイルスに重複感染した重症患者の臨床的特徴. Int. J. Infect. Dis. 2020 [PMC free article] [PubMed] [Google Scholar].
COVID-19 における肝疾患:病因,治療,予後.World J. Gastroenterol. 2020;26:2286. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lozano-Sepulveda S.A., Galan-Huerta K., Martínez-Acuña N., Arellanos-Soto D., Rivas-Estilla A.M. SARS-CoV-2 another kind of liver aggressor, how does it do that? Ann. Hepatol. 2020;19:592-596. [PMC無料記事] [PubMed] [Google Scholar].
Zou X., Fang M., Li S., Wu L., Gao B., Gao H., et al. SARS-CoV-2 および慢性 HBV コインフェクション患者における肝機能の特徴. Clin. Gastroenterol. Hepatol. 2020;19(3):597-603. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lin Y., Yuan J., Long Q., Hu J., Deng H., Zhao Z., et al. SARS-CoV-2とHBVの同時感染者は、より大きな肝損傷を受ける危険性がある。Genes & Diseases. 2020 doi: 10.1016/j.gendis.2020.11.005. In press. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Verduyn M., Allou N., Gazaille V., Andre M., Desroche T., Jaffar M.-C., et al. Public Library of Science; San Francisco, CA USA: 2020. デング熱とCOVID-19の共感染。症例報告。[PMC free article] [PubMed] [Google Scholar].
Saddique A., Rana M.S., Alam M.M., Ikram A., Usman M., Salman M., et al. COVID-19とデングの同時感染の出現:深刻な公衆衛生の脅威。J. Infect. 2020;81(6):e16-e18. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Xu B., Fan C-y, Wang A-l, Zou Y-l, Yu Y-h, He C., et al.2020年。COVID-19患者におけるT細胞介在性免疫の抑制:中国武漢市における臨床的レトロスペクティブスタディ。中国. (3/16/2020) [PMCフリー記事] [PubMed] [Google Scholar].
Hu Y., Ma J., Huang H., Vermund S.H. Coinfection with HIV and SARS-CoV-2 in Wuhan, China: a 12-person case series. J. Acquir. Immune Defic. Syndr. 2020;85(1):1-5. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yang R., Gui X., Zhang Y., Xiong Y., Gao S., Ke H. Clinical characteristics of COVID-19 patients with HIV coinfection in Wuhan, China(中国武漢におけるHIV重複感染患者の臨床特性). Expet Rev. Respir. Med. 2020:1-7. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Alothaid H., Aldughaim M.S., El Bakkouri K., AlMashhadi S., Al-Qahtani A.A. SARS-CoV-2 と HCV の細胞レベルでの影響の類似性、および COVID19 進行におけるイオンチャネルの考えられる役割:診断および治療のための潜在的ターゲットの検討。Channels. 2020;14:403-412. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Reddy K.R. SARS-CoV-2 and the liver: Considerations in hepatitis B and hepatitis C infections.(SARS-CoV-2と肝臓:B型肝炎とC型肝炎の感染に関する考察).臨床肝疾患。2020;15:191. [PMC無料記事] [PubMed] [Google Scholar].
Murphy R.C., Lai Y., Barrow K.A., Hamerman J.A., Lacy-Hulbert A., Piliponsky A.M., et al. Effects of asthma and human rhinovirus A16 on the expression of SARS-CoV-2 entry factors in human airway epithelium.喘息およびヒトライノウイルスA16がヒト気道上皮に及ぼす影響. Am. J. Respir. Cell Mol. Biol. 2020;63:859-863. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Orozco-Hernández J.P., Montoya-Martínez J.J., Pacheco-Gallego M.C., Céspedes-Roncancio M., Porras-Hurtado G.L. SARS-CoV-2 and rhinovirus/enterovirus co-infection in a critically ill young adult patient in colombia. Biomedica. 2020;40:34-43. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Motta J.C., Gómez C.C. Adenovirus and novel coronavirus (SARS-Cov2) coinfection: a case report. IDCases. 2020;22 e00936. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Nieto-Moro M., Ecclesia F.G., Tomé-Masa I., Caro-Patón G.D.L., Leoz-Gordillo I., Cabrero-Hernández M., et al. SARS-CoV-2 and Streptococcus pneumoniae coinfection as a cause of severe pneumonia in an infant.(乳児の重症肺炎原因としてのSARS-CoV-2と肺炎球菌の重複感染).All Rights Reserved. Pediatr. Pulmonol. 2020;55(9):2198–2200. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Rodriguez-Nava G., Yanez-Bello M.A., Trelles-Garcia D.P., Chung C.W., Egoryan G., Friedman H.J. A retrospective study of coinfection of SARS-CoV-2 and Streptococcus pneumoniae in 11 hospitalized patients with severe COVID-19 pneumonia at an single center. Med. Sci. Mon. Int. Med. J. Exp. Clin. Res. 2020;26 [PMCフリーアーティクル] [PubMed] [Google Scholar].
Duployez C., Le Guern R., Tinez C., Lejeune A.-L., Robriquet L., Six S., et al. Panton-valentine leukocidin-sereting staphylococcus aureus pneumonia complicating COVID-19(パントンバレンタインロイコシジン分泌黄色ブドウ球菌肺炎). エマージェンシー・インフェクト(Emergency. Dis. 2020;26:1939. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cusumano J.A., Dupper A.C., Malik Y., Gavioli E.M., Banga J., Berbel Caban A., et al. Oxford University Press US; 2020. COVID-19に感染した患者における黄色ブドウ球菌の菌血症。ケースシリーズ。オープンフォーラム 感染症; p. ofaa518. [PMC フリーアーティクル] [PubMed] [Google Scholar].
細田 崇、原田 晋、岡本 恭平、石野 晋、金子 正、鈴木 正、他 COVID-19とHypervirulent Klebsiella pneumoniaeによる致死性敗血症、日本、2020年. Emerg. Infect. Dis. 2020:27. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Oliva A., Siccardi G., Migliarini A., Cancelli F., Carnevalini M., D'Andria M., et al. SARS-CoV-2 とクラミジアあるいは肺炎マイコプラズマの共感染:ケースシリーズと文献のレビュー。Infection. 2020;48:871-877. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Amin D., McKitish K., Shah P.S. COVID-19患者における死亡率と最近の肺炎マイコプラズマ感染との関連性. J. Med. Virol. 2020;93(2):1180–1183. [PMC フリーアーティクル] [PubMed] [Google Scholar].
新城 崇、中村 聡、浅見 崇、三國 陽夫、藤原 瑛、坂本 聡、他 ナイルクルーズ帰国者における SARS-CoV-2 とレジオネラ菌の共感染.J. Trav. J. Trav. Med. 2020;27 taaa053. [PMC フリーアーティクル] [PubMed] [Google Scholar].
SARS-Coronavirus-2に関連した髄膜炎・脳炎の1例. Int. J. Infect. Dis. 2020;94:55-58. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gallacher S.D., Seaton A. Meningococcal meningitis and COVID-19 co-infection. BMJ Case Reports CP. 2020;13 e237366. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Crisan-Dabija R., Grigorescu C., Pavel C.A., Artene B., Popa I.V., Cernomaz A., et al. medRxiv; 2020.に掲載されました。2020年の結核とCOVID-19。2020年の結核とCOVID-19:過去のウイルス発生からの教訓と将来起こりうる結果. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Liu Y., Bi L., Chen Y., Wang Y., Fleming J., Yu Y., et al. medRxiv; 2020. 活動性または潜伏性結核は、COVID-19に対する感受性と疾患の重症度を増加させる。[Google Scholar]
Sy K.T.L., Haw N.J.L., Uy J. Previous and active tuberculosis increases of death and prolongs recovery in patients with COVID-19 (結核の罹患歴があると、死亡リスクが高まり、回復が遅れる). Infectious Diseases. 2020;52:902-907. [PubMed] [Google Scholar].
Lai C.-C., Yu W.-L. COVID-19 associated with pulmonary aspergillosis: a literature review.(肺アスペルギルス症に関連するCOVID-19:文献レビュー). J. Microbiol. Immunol. Infect. 2020;54(1):46-53. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Al-Hatmi A.M., Mohsin J., Al-Huraizi A., Khamis F. COVID-19 associated invasive candidiasis(COVID-19関連侵襲性カンジダ症)。J. Infect. 2020;82(2):e45-e46. [PMC free article] [PubMed] [Google Scholar].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
