経口マグネシウムは微生物代謝の調節によりアセトアミノフェン誘発急性肝障害を予防する
メインコンテンツへスキップ
細胞宿主微生物
ログイン
検索...
論文|第32巻第1号、p48-62.e9、2024年1月10日
全文ダウンロード
経口マグネシウムは微生物代謝の調節によりアセトアミノフェン誘発急性肝障害を予防する
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(23)00456-0
李東平 12
ユー・チェン 12
王美娟 12
姜永
Qiang Ma
ペン・チェン 13
すべての著者を表示する
脚注を表示する発行:2023年12月05日DOI:https://doi.org/10.1016/j.chom.2023.11.006
PlumXメトリクス
ハイライト
経口マグネシウムはアセトアミノフェンによる急性肝不全を緩和する
マグネシウムはビフィズス菌によるI3C産生を促進する
ビフィズス菌のギ酸C-アセチルトランスフェラーゼはI3C生成に寄与する
I3CはCYP2E1を不活性化し、有害な反応性中間体の生成を抑制する。
まとめ
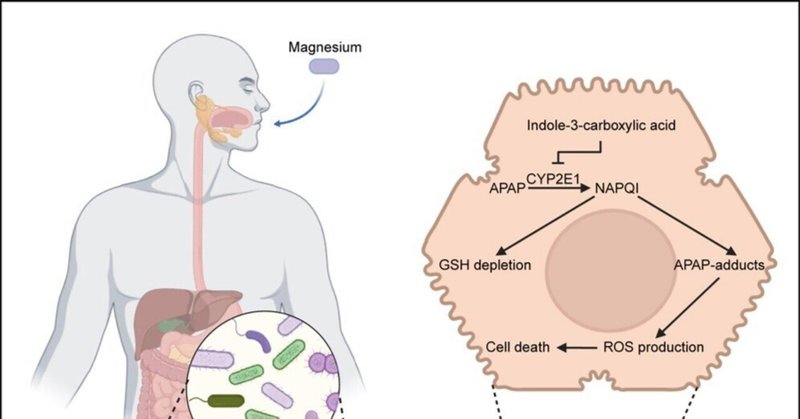
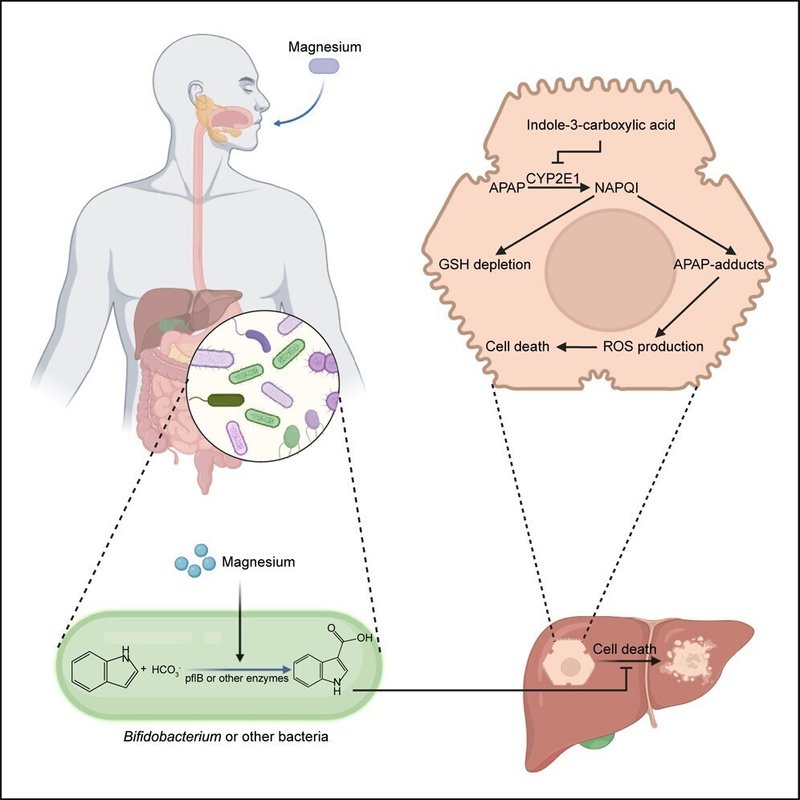
アセトアミノフェンの過剰使用は急性肝不全(ALF)の一般的な原因である。ALF中、毒素はCYP2E1などの酵素によって代謝され、反応性種に変化し、酸化的障害と肝不全を引き起こす。ここで我々は、マグネシウム(Mg)の経口投与が、CYP2E1を阻害する腸内細菌叢の代謝変化を通じて、アセトアミノフェン誘発性ALFを緩和することを見出した。Mgを補充したヒトの腸内細菌叢は、マウスにおけるアセトアミノフェン誘発性ALFを予防した。Mg曝露はビフィズス菌の代謝を調節し、インドール-3-カルボン酸(I3C)濃度を濃縮した。ギ酸C-アセチルトランスフェラーゼ(pflB)は、I3C生成に関与するビフィズス菌の重要な酵素として同定された。したがって、ビフィズス菌のpflBノックアウトはI3C生成の減少を示し、Mgの有益な効果を減少させた。逆に、I3Cまたはビフィズス菌pflBを過剰発現させた人工細菌で処理すると、ALFから保護された。メカニズム的には、I3CはCYP2E1と結合して不活性化することで、有害な反応性中間体の形成を抑制し、肝細胞の酸化的損傷を減少させた。これらの知見は、Mgと腸内細菌叢の相互作用がALFとの闘いに役立つ可能性を強調するものである。
図抄録
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
マグネシウム
腸内細菌叢
急性肝不全
インドール-3-カルボン酸
ビフィズス菌
はじめに
アセトアミノフェン(APAP)の乱用は、先進国においてALFの最も一般的な誘因である4,5。ALF中、毒素は通常、チトクロームp450 2E1(CYP2E1)などの第1相酵素によって代謝され、細胞の酸化的損傷や肝不全を引き起こす活性種に変化する6,7。具体的には、APAPはN-アセチル-p-ベンゾキノンイミン(NAPQI)に変化し、このNAPQIはさらに機能性タンパク質を攻撃し、最終的に細胞死を引き起こす。
現在のところ、APAPによるALFの治療法は限られており、肝障害の後期には肝移植が考慮されることもある。マグネシウム(Mg)などのミネラル物質は、ヒトの健康に有益な栄養素として認識されている。Mgはほとんどの生理学的プロセスの恒常性維持に必要であり、低マグネシウム血症は病原体感染、メタボリックシンドローム、さらには腫瘍を含む様々な疾患の発症と密接に関連している。例えば、Mgは細胞の増殖と代謝を制御するラパマイシン複合体1プロテインキナーゼの主要な補酵素として機能する可能性がある21。しかし、最近の研究では、Mgが真核細胞の機能をどのように調節するかに主に焦点が当てられており、Mgが常在細菌叢に影響を与えるかどうか、もしそうなら、そのような相互作用が宿主の病態生理学的進行にどのように寄与するかについてはほとんど知られていない。本研究ではまず、ヒトとマウスの両方において、Mgの経口摂取が腸内細菌組成を変化させることを示した。重要なことは、糞便を介してMgに曝露することにより、APAP誘発性ALFが予防されることである。次に我々は、Mgがビフィズス菌の代謝プロファイルを変化させ、インドール-3-カルボン酸(I3C)の生成を促進することを明らかにした。具体的には、ギ酸C-アセチルトランスフェラーゼ(pflB)がビフィズス菌のI3C生成に関わる重要な酵素のひとつである可能性を明らかにした。I3CはCYP2E1の天然阻害剤として作用し、ALFに対する保護効果を発揮することが証明された。我々の研究により、宿主の病態生理学的進行における腸内常在菌のMgの重要性が明らかになり、Mg/ビフィズス菌/I3C/CYP2E1軸が、CYP2E1が介在するALFに対抗する調節機構であることが明らかになった。
結果
ALFに対するMg経口摂取の有益な効果は、腸内細菌叢と関連していた
MgがALFにどのような影響を与えるかを評価するため、マウスにMgCl2を投与し、APAP誘発ALF前臨床モデルを確立した。MgCl2の腹腔内注射を受けたマウスは、NaClで処理した対照マウスと同等の肝障害を示した(図1A-1D)。しかし、MgCl2の経口投与は、APAP誘発血漿トランスアミナーゼ上昇、肝細胞壊死、肝炎細胞浸潤およびサイトカイン過剰発現を顕著に改善した(図1E-1HおよびS1A)。この観察をさらに確認するため、次にMgを経口投与したマウスから糞便を採取し、レシピエントマウスに移植した。ドナーの糞便中のMg濃度はNaCl投与群とMgCl2投与群で同程度であり(図S1B)、糞便中の残留Mgの寄与の可能性は否定された。図1I-1LおよびS1Cが示すように、糞便からMg曝露を受けたマウスは、糞便からNa曝露を受けたマウスに比べて肝障害が顕著に緩和された。さらに、抗生物質(ABX)前処置マウスおよび無菌(GF)マウスのいずれにおいても、Mgの経口補充は肝障害をさらに軽減することはできなかった(図1M-1OおよびS1D-S1G)。したがって、これらの所見は、現在の実験環境において、APAP誘発ALFの文脈におけるMgの保護効果に腸内細菌叢が関連していることを明確に示した。
図サムネイルgr1
図1APAP誘発ALFに対するマグネシウム経口投与の有益な効果は腸内細菌叢と関連していた
キャプション
大きな画像を見るダウンロード 高解像度画像
ヒトにおけるMg経口摂取後の腸内細菌叢は、APAP誘発肝障害に対して有益な効果を発揮した
肝臓病態生理と腸内細菌叢に対するMgの機能的影響をさらに検証するために、41人のボランティアを募集し、説明書の推奨用量に従ってクエン酸Mg(最も一般的な市販のMgサプリメントの1つ)を3週間経口摂取させた(図2A)。Mg摂取の0日後(Mg摂取前)と3週間後(Mg摂取後)の糞便と血液を採取した。図2Bが示すように、クエン酸Mgの3週間投与は確かに血漿Mg濃度を上昇させたが、高マグネシウム血症(1.2mmol/L以上)を発症した者はいなかったことから、本治療の安全性が示唆された。興味深いことに、クエン酸Mgの3週間の摂取は、総ビリルビン(TBIL)、直接ビリルビン(DBIL)および間接ビリルビン(IBIL)値を有意に低下させた(図2C~2E)。一方、Mg投与は血漿尿酸(UA)レベルを低下させ、総トリグリセリドおよび総タンパク質レベルをわずかに上昇させたが(図S2AおよびS2B)、2つの重要な肝臓指標であるアスパラギン酸トランスアミナーゼ(AST)、アラニントランスアミナーゼ(ALT)(図S2C)および他の主要生化学パラメータ(図S2D)は有意に変化しなかった。
図サムネイルgr2
図2マグネシウム経口摂取によるヒト腸内細菌叢の適応的変化は、急性肝不全に対する保護効果を発揮する
キャプション
大きな画像を見るダウンロード 高解像度画像
マグネシウム処理糞便がALFに対して機能的効果を示すかどうかをさらに調べるために、処理前の糞便と処理後の糞便をマウスに移植してヒト化マウスを樹立した。マウスの糞便微生物叢移植(FMT)の結果と一致して、従来のマウス(特異的病原体フリー、SPF)およびGFマウスのいずれにおいても、処理後の糞便は処理前の糞便と比較してALFを有意に軽減することが見いだされた(図2F-2M、S2E、S2F)。我々はボランティアから採取した便中のMg含量を検出した。興味深いことに、マウスの研究とは異なり、"post-Mg "群のドナー糞便中のMg濃度は "pre-Mg "群のそれよりもわずかに高かった(図S2G)。我々は、Mgの違いが肝障害の表現型に影響するのではないかと考えた。以下の実験を行った:まず、「pre-Mg」群の糞便サンプルにMgを添加し、糞便中のMg濃度が「pre-Mg」群と「post-Mg」群で同じになるようにした(図S2H)後、これらの糞便をマウスに移植した。図S2JおよびS2Lは、Mgを補充した前Mgの糞便をマウスに移植した場合としなかった場合とで、肝障害が同程度であることを示しており、後Mgの糞便を移植した場合には、前Mgの両群に比べて肝障害が確かに保護されたことから、後Mg群の余分なMgが有益な効果に重要な役割を果たしていないことが示された。第二に、検出可能なすべてのMgをキレート化するために、Mg前およびMg後の糞便サンプルにエチレンジアミン四酢酸(EDTA)を添加した(図S2I)。我々は、Mg前の糞便と比較して、Mg後の糞便が依然としてAPAP誘発性肝障害からマウスを保護することを見いだし(図S2KおよびS2M)、Mg後の糞便の保護効果がMgに関連するのではなく、糞便中の他の物質であることをさらに証明した。
経口Mg摂取による腸内ビフィズス菌の濃縮
Mgが腸内細菌叢にどのような影響を及ぼすかを調べるために、我々は、糞便を介してMgに曝露したマウスおよびヒトと、それに対応する対照群について16S rDNA配列決定を行った。腸内細菌叢のシャノン多様性は、マウスおよびヒトの糞便において、Mg曝露群の腸内細菌群集が対照群と異なることを示した(図S3AおよびS3B)。図3Aおよび3Bは、マウスおよびヒトの糞便試料において、Mg曝露が腸内細菌叢の全体的な組成を対照群と比べてある程度シフトさせたことを示している。門レベルでの腸内細菌叢の組成は、Mg曝露群で明らかな変化を示した(図3Cおよび3D)。さらに、ヒトとマウスの両方で、線形判別分析(LDA)の効果量(LEfSe)とヒートマップ分析により、ビフィズス菌の相対量がMg曝露群で増加する傾向が示された(図3E、3F、およびS3C-S3F)。Akkermansia属の相対量はMg投与マウスで増加傾向を示したが(図S3G)、qPCRの結果はヒトのMg投与後群でAkkermansia属が濃縮されていることを支持しなかった(図S3H)、 一方、ビフィドバクテリウムの存在量は、ヒトおよびマウスの両方で、Mg処理糞便中の腸内に濃縮されていた(図3Gおよび3H)。このことは、腸内のビフィドバクテリウムがMg摂取後の重要な応答菌である可能性を示唆している。ビフィドバクテリウムの生理機能をさらに検証するために、ビフィドバクテリウムに属するビフィドバクテリウム・ロンガム(Bifidobacterium longum)、ビフィドバクテリウム・ビフィダム(Bifidobacterium bifidum)、ビフィドバクテリウム・ブレーベ(Bifidobacterium breve)、ビフィドバクテリウム・アニマリス(Bifidobacterium animalis)の4つの優勢株を選び、マウスに投与して、これらの細菌がALFに影響を及ぼすかどうかを調べた。図3I-3Mが示すように、生きた菌株はすべてALFを顕著に緩和した。特に、加熱死菌は肝臓を保護しなかったことから、生きたビフィズス菌がALF予防に重要である可能性が示唆された。
図サムネイルgr3
図3ヒトおよびマウスにマグネシウムを経口投与したところ、ビフィズス菌は濃縮された。
キャプション
大きな画像を見るダウンロード 高解像度画像
MgはI3C生成を促進することでビフィズス菌の代謝プロファイルをリモデリングした
ビフィズス菌は生きた菌株のみが有益な効果を発揮することから、我々はビフィズス菌が生理活性産物を生成し、ALFから宿主を保護するのではないかと推測している。この仮説を検証するために、ビフィズス菌の培養上清をマウスに投与したところ、図4A-4D、S4A、S4Bに示すように、4株すべての培養上清がブランク培地と比較してALFを緩和することができた。
図4マグネシウムの調節
図4マグネシウムはI3Cの生成を促進することでビフィズス菌の代謝を調節した
キャプション
大きな画像を見るダウンロード 高解像度画像
次に、ビフィズス菌培養上清の非標的メタボローム解析を行った。その結果、ビフィズス菌は様々な化合物を生成・分泌することが確認され、Mgがビフィズス菌の代謝プロファイルを変化させることが明らかになった(図S4C)。さらに、マウスの糞便を介したMg曝露についても、アンターゲットのメタボローム解析を行った。同様に、Mgはin vivoで腸内細菌叢の代謝プロファイルを変化させることができた(図S4D)。具体的には、I3Cは各Bifidobacterium培養上清で濃縮された最も重要な代謝物ではなかったが、Mgを添加したすべての異なるBifidobacterium培養上清および糞便を介したMg曝露で有意な変化を示した唯一の代謝物であり(図4E〜4G)、I3Cが重要な応答性生理活性代謝物である可能性が示唆された。次に、標的メタボローム解析を用いて、上記の知見をさらに検証した。図4Hは、I3Cレベルが生きたビフィズス菌培養上清で検出可能であることを示した。さらに、生きたビフィズス菌を接種するとマウスのI3Cレベルが上昇することから(図4I)、ビフィズス菌はそれ自体でI3Cを生成できることが示唆された。重要なことに、Mgはビフィズス菌培養上清中のI3Cを有意に濃縮した(図4H)。生体内におけるMgとI3Cの関連をさらに検証するために、Mg投与群のI3Cレベルをモニターした。図4J~4Mから、経口Mg摂取およびMg曝露糞便処理により、マウスとヒトの両方でI3Cレベルが実際に上昇することが明らかになった。次に、in vivoでの機能的検討により、血漿トランスアミナーゼ上昇の低下、肝壊死の低下、炎症反応の改善から明らかなように、I3CはマウスにおいてALFを顕著に防御しうることが示された(図4N-4Q、S4E、S4F)。I3Cの保護効果は、in vitroのデータによっても確認された。図S4GおよびS4Hは、I3Cの前処理が、APAPを負荷した初代肝細胞において、細胞生存率を有意に増加させ、乳酸デヒドロゲナーゼ(LDH)放出を減少させたことを示している。
細菌では、I3Cは主にインドールとHCO3-からカルボキシル化により生成される27,28。ビフィズス菌のI3C生成に対するMgの影響を詳細に調べるため、13C標識NaHCO3を用いた代謝フロー実験を行った。その結果、ビフィズス菌4株すべての培養液中に13C標識I3Cが陽性に検出されたことから、ビフィズス菌においてインドールとHCO3-が反応してI3Cが形成されることが確認された。注目すべきは、Mg処理によって培地中の13C標識I3Cがさらに濃縮されたことであり(図4RおよびS5A)、MgがインドールとHCO3-のカルボキシル化反応を促進する可能性が示唆された。
次に、ビフィズス菌のどの代謝酵素がI3C形成を媒介するかを調べた。インドール誘導体とHCO3-の間のカルボキシル化反応を触媒する細菌酵素として、インドール-3-カルボン酸脱炭酸酵素(I3CD)、インドール-3-インドール酢酸脱炭酸酵素(I3AD)、インドールピルビン酸脱炭酸酵素が同定された。このうち、I3CDとI3ADは基質が類似していることから、I3C生成の可能性がある酵素であった。ビフィズス菌にはI3CDとI3ADのアノテーションがないため、I3CDやI3ADと比較して構造類似性のあるビフィズス菌がコードするタンパク質をスクリーニングした。B.longumのAlphaFold2によって生成されたタンパク質構造モデルは、European Bioinformatics InstituteのAlphaFoldデータベースのFTPサーバから取得した。よく知られたテンプレートモデリング(TM)-整列法29を用いることにより、B. longumのWP_013582507.1(ギ酸C-アセチルトランスフェラーゼ、pflB)を、TMスコア(2つの構造の類似性を測定するための長さに依存しないスコアリング関数)が0.75以上の、I3ADに最も近い構造ホモログとして同定した。その結果、I3ADとWP_013582507.1の構造比較は非常に正確であった(図4S)。重要なことに、本研究で用いた4種類のビフィズス菌はすべて、WP_013582507.1をコードする類似の遺伝子を含んでいた(図S5B)。続いて、B. longumにおけるpflBの機能を検証した。まず、pflBノックアウト(KO)B. longumを構築した(図4Tおよび4U)。KO菌と野生型(WT)菌のin vitroでの増殖は同等であった(図S5C)。代謝フローデータから、KO株は培地中の13C標識I3Cの生成量が著しく低いことが明らかになり(図4V)、pflBがインドールとHCO3-の間のカルボキシル化反応に実際に関与していることが示された。さらに、KO菌ではMg曝露によりI3C生成促進効果が消失したことから(図4W)、B. longumにおけるI3C生成の際にpflBがMgの必須標的である可能性がさらに強まった。また、重要な点として、KO株はAPAP誘発ALFに対する有益な効果を失い、Mg処理ではKO菌投与マウスの肝障害を救済できなかった(図4Xおよび4Y)。次に、大腸菌BL21(DE3)(OE、図S5E)にpflB OEを導入した人工細菌株を構築した。In vitro代謝物フロー実験では、pflB OE細菌が培地中で13C標識I3Cの生成を促進し、Mg曝露が13C標識I3Cのレベルをさらに高めることが明らかになった(図S5F)。さらに、人工細菌処理はマウスにおいてI3Cの形成を実際に促進し、Mgの共処理はI3Cレベルをさらに高めることができた(図S5G)。同時に、人工細菌処理は対照細菌処理と比較してALFを有意に改善し、Mgの経口摂取は人工細菌処理マウスのALFをさらに改善した(図S5HおよびS5I)。これらのデータを総合すると、pflBはビフィズス菌のI3C生成に関与する重要な遺伝子であり、MgはpflBに影響を及ぼし、マウスのI3CレベルおよびAPAPによるALFを調節する可能性があることが明らかになった。
MgとI3CはALFの初期段階における反応性中間体の形成を抑制した
次に、ALF発症時に宿主がMgの経口投与とI3Cにどのように反応するかを検討した。APAP誘発ALFの病態は、APAPの吸収、NAPQIの形成、および肝再生を含むいくつかの重要な段階から構成される30。我々はまず、経口Mg投与がAPAPの薬物動態に影響を及ぼすかどうかを調べた。図S5JおよびS5Kから、経口MgはAPAP吸収を有意に変化させないことが明らかになった。また、経口Mgによる肝再生調節の可能性は、APAP投与後のMg投与群と対照投与群との間の増殖細胞核抗原(PCNA)発現量が同等であることから除外した(図S5L)。次に、経口MgがNAPQI形成にどのような影響を及ぼすかを評価した。その結果、経口Mg投与群ではAPAPチャレンジ後のAPAP付加体が対照群と比較して有意に減少しており(図5A)、これは経口Mg投与によりNAPQI形成が減少することを示していた。さらに、経口Mg糞便移植レシピエントマウスにおいても、対照の糞便移植マウスと比較してAPAP付加体レベルの低下が観察された(図5B)。重要なことは、I3C投与と同様にヒト糞便移植でも同様の結果が得られたことである(図5Cおよび5D)。
図5
図5I3CはCYP2E1活性の不活性化によって反応性中間体の形成を阻止した
キャプション
大きな画像を見るダウンロード 高解像度画像
GSHはNAPQIを中和して肝臓を酸化的損傷から守るため、APAP付加体の生成はALFの初期段階において肝グルタチオン(GSH)レベルと負の相関を示した31,32。APAP付加体のデータと一致して、肝GSHレベルは、対照群と比較して、Mg経口投与群、ヒトおよびマウスの糞便移植群、およびI3C投与群で著明に上昇していた(図5E-5H)。このことは、Mg経口投与によるNAPQI形成抑制効果、および糞便を介したMg曝露効果をさらに裏付けるものであった。GSHの回復に対するI3Cの影響は、in vitro実験によっても検証された(図5I)。その結果、肝臓における活性酸素種(ROS)の蓄積は、ALFの初期段階において、すべての有益な処置において顕著に緩和された(図5J-5M)。APAP付加物はJNKシグナル伝達経路を活性化し、細胞死の進行を促進するが33、すべての有益な治療法は肝障害の初期段階でも肝JNK活性化を抑制した(図S5M-S5P)。これらの所見はすべて、経口Mg摂取、糞便を介したMg曝露、およびI3C処置の有益な効果が、肝臓における反応性中間体形成の減少と関連していることを明確に示していた。しかしながら、APAPチャレンジの6時間後にI3CとMgを処理したところ、有意な保護効果は認められなかった(図S5Q-S5T)。このことは、ALFの初期段階の重要性をさらに強調し、MgとI3CはALFを予防することはできても、ALFを逆転させることはできないことを示唆している。
I3CはCYP2E1酵素活性に直接結合して阻害する
第I相酵素はAPAPからNAPQIへの変換を担っていた。この反応を触媒する主なサブタイプはCYP2E1である。そこで我々は、I3CによるCYP2E1の調節機構の可能性を探った。I3C および経口 Mg 投与は CYP2E1 タンパク質発現に影響を与えなかった(図 S5U および S5V)ことから、I3C は CYP2E1 酵素活性に影響を与える可能性があることが示された。この可能性を検討するため、ヒトおよびマウスの両ミクロソームにおいて、CYP2E1の基質としてクロルゾキサゾンをインキュベートしたところ、クロルゾキサゾンから6-ヒドロキシクロルゾキサゾンへの変換率は、I3C存在下で対照と比較して有意に低下し(図5N)、I3Cが実際にCYP2E1活性を低下させたことが示された。また、APAP後にチャレンジしたマウスの肝臓において、CYP2E1に対するI3Cの阻害効果を検証した(図5O)。さらに、マウスのCYP2E1をノックダウンしたところ(図S5W)、CYP2E1ノックダウン動物ではAPAP後にI3Cの保護作用が消失したことから(図5P)、I3Cの有益な作用の少なくとも一部はCYP2E1に依存していることが示唆された。
次に、分子ドッキング解析を行い、I3CがCYP2E1に結合できるかどうかを検討した。分子ドッキング解析の結果、I3Cはこのタンパク質と直接相互作用する可能性が示唆された(図5Q)。さらに、表面プラズモン共鳴(SPR)解析、薬物親和性標的安定性(DARTS)および細胞熱シフトアッセイ(CETSA)実験により、I3CとCYP2E1の結合活性が確認された(図5R-5U)。これらの結果から、I3CはCYP2E1と直接結合することにより、CYP2E1の内因性阻害剤として機能することが示唆された。また、CYP2E1は、CCl4誘発急性肝障害におけるCCl4の危険な変換を媒介する可能性がある。次に、マウスをI3Cで前処理し、CCl4誘発急性肝障害マウスモデルを樹立した。予想通り、I3CもCCl4誘発肝障害を軽減した(図S6AおよびS6B)。同様に、Mgの経口摂取もCCl4誘発急性肝障害を顕著に緩和した(図S6CおよびS6D)。慢性肝障害は急性肝障害の蓄積効果である。I3Cの投与は、血漿ALT、AST、肝壊死および線維形成の減少によって証明されるように、慢性肝障害も緩和しうることがわかった(図S6E-S6G)。
また、アルコールはミクロソームエタノール酸化系(MEOS)のCYP2E1によって代謝され、アセトアルデヒドを生成し、肝臓に多くの有害な産物を蓄積することが注目される。我々は、MgおよびI3Cの経口投与が、アルコール誘発性急性肝障害を有意に軽減することを見出した(図S6H-S6K)。これらの所見を総合すると、MgとI3Cの有益な作用を媒介するCYP2E1の重要性が高まった。
Mgの経口投与は、ブタにおけるAPAP誘発ALFを予防した
最後に、今回の知見のトランスレーショナルな意義をさらに検証するために、ブタモデルでAPAP誘発ALFを確立した(図6A)。Mgの経口前処置は腸内のビフィズス菌を濃縮し(図6B)、血中のI3C濃度を高めた(図6C)。重要なことに、Mgを経口投与したブタは対照群と比較して、血漿トランスアミナーゼ値の低下、肝壊死および肝炎反応の低下など、肝障害が顕著に緩和された(図6D~6G)ことから、ALFに対するMg経口摂取の有益な効果がさらに強化された。これらの結果から、Mgはビフィズス菌におけるI3C生成の重要な調節因子であることが明らかになった。I3CはCYP2E1活性阻害剤として作用し、毒素チャレンジ中の危険な活性種の形成を抑制し、最終的にALFから保護する(図6H)。今回の発見は、ALF予防に関与する制御軸を明らかにしただけでなく、マウスおよびブタモデルにおける保護効果も確認した。
図のサムネイルgr6
図6マグネシウム経口投与はブタにおけるAPAP誘発ALFを予防した
キャプション
大きな画像を見るダウンロード 高解像度画像
考察
Mgはほとんどの細胞および生理学的プロセスの恒常性維持に必要である。Mgの欠乏は細胞機能を障害し、全身的な異常を引き起こす可能性がある。例えば、Mgは脂肪細胞におけるプロテインキナーゼB(AKT)の活性化に関与している可能性があり、Mg欠乏はインスリン依存性のグルコース取り込みを減少させ、最終的にインスリン抵抗性の一因となる。実際、宿主細胞と同様に、常在細菌も生存するためにMgを必要とする。多くの酵素の調節にはMgを含む主要ミネラル元素の存在が必要だからである35,36,37。本研究では、宿主と微生物叢の両方に影響を及ぼす可能性があるため、低マグネシウム血症状態を誘導するために食事からMgを欠乏させることはしなかった。その代わりに、経口投与によってMgを補充し、常在菌をMgに曝露させ、その影響を調べた。吸収されたMgがALF中に肝細胞を標的にして保護に寄与する可能性はまだ完全には否定できない。さらに、腹腔内投与と胃内投与の投与期間、濃度、代謝の違いなど、他の多くの要因も関与している可能性がある。しかしながら、in vitroの解析では、Mgの補充は肝細胞の損傷を有意には改善しないことが明らかになった(図S6LおよびS6M)。したがって、Mgのi.p.投与がALFを著明に改善しなかったことを示した図1A-1Dの結果と合わせて、今回の実験設定では、経口Mg投与で観察された有益な効果は、Mgと常在菌との相互作用に起因する可能性が高いことが示された。特筆すべきことに、ヒトにおける今回の治療では高マグネシウム血症が引き起こされなかったことから(図2B)、Mgが著しく蓄積されることはなく、治療アプローチ(クエン酸Mgの3週間摂取)が安全であることが示され、今回の知見のトランスレーショナルな可能性が拡大した。さらに、図S2Cは、Mg摂取前と摂取後とでALTおよびAST値に有意差がないことを示しており、これは、重度のチャレンジを伴わないヒトでは、Mgが血漿ALTおよびASTを著明に変化させないこと、すなわち、正常範囲内にあるALT/AST値に対するMgの影響は限定的であることを示している。しかしながら、図2C-2Eは、Mgの経口摂取が血漿ビリルビン値を低下させることを示した。本研究で観察された血漿ビリルビンに対するMgの低下作用の理由は複雑であり、ビリルビン代謝調節を含む多くの可能性が関与している可能性がある。詳細なメカニズムについては今後明らかにされるべきであろう。
ビフィズス菌は古典的なプロバイオティクスとして知られている。本研究では、ビフィドバクテリウム属の主要4種の影響を全身的に評価し、すべての菌株がALFに対する保護作用を示したことから、ビフィドバクテリウム属は肝保護プロバイオティクスである可能性が示された。さらに、Mg曝露後にビフィドバクテリウムが特異的に濃縮されたことから、Mgがビフィドバクテリウムを標的とし、その増殖を促進する可能性が示唆された。しかしながら、Mgがビフィズス菌の増殖をどのように調節するかはまだ分かっていない。すなわち、ビフィズス菌の多くの増殖および代謝調節タンパク質がMg刺激に応答し、下流の経路が活性化されて代謝が活性化され、菌の増殖が促進されるのかもしれない。しかし、その詳細なメカニズムについてはさらなる研究が必要である。また、他の細菌においてもALF時の代謝にMgが影響している可能性は完全には否定できず、今後、より多くのMg応答性微生物が同定される必要がある。
前述したように、インドール誘導体のカルボキシル化を触媒する酵素は、現在微生物において広く同定されており、I3ADまたはI3CDは、本研究で観察されたカルボキシル化反応を満たす潜在的な候補である可能性がある。我々は当初、全ゲノム配列に基づいてB. longumがコードする全てのタンパク質を予測し、既知のI3CDまたはI3ADタンパク質との配列アラインメントを行った。しかし、類似性が低い(30%以下)ため、候補となるタンパク質は見つからなかった(表S2)。タンパク質の構造が生化学反応において支配的な役割を果たすことを考慮し42、B. longumがコードする全てのタンパク質の構造を予測したところ、幸いにもI3ADと比較して最も類似したタンパク質としてpflBが見つかった。この酵素はグルコースとエネルギー代謝に関与しており、細菌の増殖に影響を与える可能性がある。微生物のpflB KOまたはOEにおける増殖の違いがI3C生成に寄与している可能性を排除するため、まずKO対WTの増殖速度を調べたところ、有意差はなかった。さらに、I3C生成量を細胞数で正規化したところ(図4H)、pflBが確かにI3C生成に関与していることが明らかになった。通常の脱炭酸酵素とは異なり、pflBの基質にはC-Sの「活性」結合が含まれている可能性がある。我々は、B. longumにおいてpflBがインドールのカルボキシル化を果たすには、いくつかの可能性があると推測している。第一に、インドールが補酵素Aと結合して活性型C-S結合を生成する可能性。一方、pflBがインドールをカルボキシル化する酵素複合体のモジュレーターとして働くなどの間接的なメカニズムも否定できない。したがって、ビフィズス菌においてI3Cを産生する酵素はpflBだけではない可能性があり、今後さらに多くの機能性タンパク質が開示される可能性がある。また、KOとOEの両方のアプローチから、MgがpflBのモジュレーターとして働く可能性が示された。したがって、一定レベルのMgがインドールのカルボキシル化を促進する可能性がある。しかしながら、Mgがビフィズス菌のインドールのカルボキシル化を促進するために、他のタンパク質も標的にしている可能性は否定できず、今後より多くのMg応答性タンパク質を調査する必要がある。
このように、I3Cの生成にはMgと常在菌との直接的な相互作用が必要であり、ALF予防のための経口摂取の重要性がさらに強調されている。I3Cはアリール炭化水素受容体(AhR)の天然リガンドとして認識されている。しかし、最近の研究では、肝臓におけるAhRの活性化が、おそらくCYP1A2の発現を促進することによって、APAP誘発ALFを感作する可能性さえあることが明確に指摘されている44。この逆説的な結論の可能性から、我々は、APAPチャレンジ中のI3CとAhRとの関連を明らかにすることにした。その結果、I3Cは依然として、AhRノックダウン肝細胞においてGSHレベルを有意に上昇させ、APAP誘発細胞障害を改善した(図S6NおよびS6O)。さらに、肝細胞AhRノックダウンマウスにおいても、I3Cはやはり肝障害を軽減することがわかった(図S6PおよびS6R)。これらのデータから、I3Cの保護作用はAhRとは無関係であり、I3CによるCYP2E1の阻害が、I3CによるAhRの活性化による副作用の可能性を克服できることが示された。CYP2E1を介した毒素変換は、複数のチャレンジによって誘発されるALFのユニークなメカニズムとして機能する。I3CはCYP2E1に対する有効な阻害剤として明らかにされているので、APAP誘発ALFを予防するだけでなく、他のタイプのALF、例えばCCl4やアルコール誘発肝毒性も改善する可能性がある。これらを総合すると、本研究で得られた知見は、ALFを誘発する化学物質の全領域に及ぶ可能性がある。
本研究の限界は、ヒトを対象とした研究の一般化可能性である。我々が募集したボランティアはすべて20~30歳の若者であり、全員が中国(アジア人)出身であった。異なる年齢および/または異なる人種の人々が、Mg投与後に同様の反応を示すかどうかはまだ不明である。今後、より広範なヒトを対象としたさらなる実験が必要である。
結論として、われわれの研究は、経口摂取によるMgの潜在的標的としてビフィズス菌とその代謝物I3Cを同定し、I3CはAPAP投与後にCYP2E1に直接結合することによって有害な反応性中間体の形成を阻害し、最終的に肝細胞の損傷を抑制し、ALFから保護する可能性があることを明らかにした。我々は、CYP2E1が介在するALFを予防するための安全かつ効果的な戦略として、Mgの経口摂取という貴重なアプローチを提供する。
STAR★方法
主要リソース表
試薬またはリソースのソース IDENTIFIER
抗体
SAPK/JNK 抗体 Cell Signaling Technology Cat# 9252; RRID:AB_2250373
リン酸化 SAPK/JNK (Thr183/Tyr185) 抗体 Cell Signaling Technology Cat# 9255;
RRID:AB_2307321
抗ウサギ F4/80 Abcam Cat# ab111101;
RID:AB_10859466
抗ウサギ Ly6G Abcam Cat# ab238132;
RID:AB_2923218
PCNA 抗体 Cell Signaling Technology Cat# 13110;
RID:AB_2636979
CYP2E1 特異的ポリクローナル抗体 Proteintech Cat# 19937-1-AP;
RID:AB_10646444
β-アクチン抗体 Proteintech Cat#81115-1-RR; RRID:AB_2923704
抗マウス IgG-HRP Cell Signaling Technology Cat# 7076
RRID:AB_330924
抗ウサギ IgG-HRP Cell Signaling Technology Cat# 7074
RRID:AB_2099233
細菌およびウイルス株
ビフィドバクテリウム・ロンガム ATCC ATCC 15707
ビフィドバクテリウム・ビフィダム ATCC ATCC 29521
ビフィドバクテリウム・ブレーベ ATCC ATCC 15700
ビフィドバクテリウム・アニマリス ATCC ATCC 700541
pflB- ノックアウト ビフィドバクテリウム・ロンガム この試験 該当なし
生物学的サンプル
血液 ボランティアから採取 N/A
ボランティアから採取した便
マウス血液
マウス便
マウス肝臓
化学物質、ペプチド、組換えタンパク質
NaCl アラジン Cat# C111535
MgCl2 Aladdin Cat# M140788
インドール-3-カルボン酸 Aladdin Cat# I107990
アセトアミノフェン Sigma-Aldrich Cat# A7085
PBS ギブコ Cat# C10010500BT
CCl4 マックリン Cat# C805329
コーン油 Aladdin Cat# C116025
アンピシリンナトリウム塩 Macklin Cat# A800429
メトロニダゾール Macklin Cat# M813526
硫酸ネオマイシン Macklin Cat# N814740
バンコマイシン Aladdin Cat# V105495
RPMI1640 培地 Gibco Cat# 11875093V
ウシ胎児血清 Gibco Cat# 10099141C
ペニシリン-ストレプトマイシン Gibco Cat# 15140122
BBLブロス培地 Shandong Tuopu Bio-engineering Cat# M1409
LBブロスSigma-Aldrich Cat# L3022
イソプロピル b-D-チオガラクトシド(IPTG) Solarbio Cat# I8070
クロラムフェニコール Macklin Cat# C804169
ジアミノベンジジン四塩酸塩 Maixin Biotech Co., Ltd. Cat# DAB-4033
パラホルムアルデヒド Aladdin Cat# C104190
絶対エタノール Guangdong Guanghua Sci-Tech Co., Ltd Cat# 1.17113.023
RIPA 溶解バッファー Beyotime Cat# P0013B
PVDF 膜 Merck Millipore Cat# IPVH00010
強化化学発光 Biosharp Cat# BL520B
最適切断温度コンパウンド SAKURA Cat# 4583
DCFH-DA プローブ Beyotime Cat# S0033S
酢酸ナトリウム Aladdin Cat# S431683
P 型コラゲナーゼ Worthington Biochemical Cat# 11213857001
4 型コラゲナーゼ Worthington Biochemical Cat# LS004188
ヒト肝ミクロソーム BeiJing HuiZhi HeYuan Biotechnology Co.
マウス肝ミクロソーム BeiJing HuiZhi HeYuan Biotechnology Co.
クロルゾキサゾン Aladdin Cat# C129514
NADPH Beyotime Cat# ST360
6-hydroxychlorzoxazone 上海英信実験設備有限公司 Cat# YXE04977
デュアルカラータンパク質ローディングバッファー Fdbio science Cat# FD006
炭酸水素ナトリウム(13C)同位体 Cat# cil-1172
プロナーゼ Sigma-Aldrich Cat# P8811
AhR 阻害剤(CH-223191) Selleck Cat# S7711
APAP 付加体(3-システイニルアセトアミノフェン(トリフルオロ酢酸塩) Glpbio Cat# GC42258
I 型コラーゲン Corning Cat# 354236
グリセロール Guangdong Guanghua Sci-Tech Co., Ltd Cat# 1.1706.020
CYP2E1 (ヒト) リコンビナントタンパク質 Abnova Cat# H00001571-P01
重要な市販アッセイ
BCA 測定キット Thermo Fisher Cat# 23227
DNA Stool Mini Kit TIANGEN Cat# DP328-02
LDH Glpbio Cat# GK10003
セルカウンティングキット 8 Glpbio Cat# GK10001
クマシーブルー高速染色液 Beyotime Cat# P0017B
脱染液 Beyotime Cat# P0017C
シトクロム P450 2E1 (CYP2E1) 活性測定キット GENMEDSCIENTIFICSINC Cat# GMS18021.1
ALT 測定キット 南京建成生物工学研究所 Cat# C009-3-1
AST 測定キット 南京江城生物工学研究所 Cat# C010-3-1
T-GSH 測定キット 南京江城生物工学研究所 Cat# A061-1-2
SYBR® Green リアルタイム PCR マスターミックス 東洋紡績株式会社 Cat# QPK-201
ReverTra Ace® qPCR RT マスターミックス 東洋紡 Cat# FSQ-201
Total RNA 単離キット Vazyme Cat# RC112-01
エンドフリーミニプラスミドキット II TIANGEN Cat# DP118
改変シリウスレッド染色キット Solarbio Cat# G1472
in vivo DNA RNA Advanced Transfection Reagent Zeta life Cat# AV500075
寄託データ
マウスの 16S rRNA データ GSA CRA012910
ヒト用 16S rRNA データ ヒト用 GSA HRA005658
実験モデル 細胞株
マウス初代肝細胞 この論文 該当なし
実験モデル 生物/株
特定病原体フリー C57BL/6J SiPeiFu Biotechnology Co.
ジャームフリー C57BL/6J Cyagen Bioscience Inc. 該当なし
チベット産ミニブタ 広東明珠生物技術有限公司 該当なし
オリゴヌクレオチド
qPCR 用プライマー 本論文 表 S1 参照
マウスCyp2e1-siRNA:5'-GCTCATGAGTTTGTTCAAT-3'本論文 N/A
マウスコントロールsiRNA: 5'-UUCUCCGAACGUGUCACUG-3' 本論文 N/A
shRNA-AhR 5'-ACCGCTAGCTAACTGGAG
GCTGCTGAAGGCTGTATGCTGTATGTC
TGCAGCATGATGAAGTTTTGCCACTG
actgacttcatccactgcagacatacaアクトガクトカトカクトカクトカガカカ
GGGACACAAGCCTGTTAGCACTCA
CATGGAACAAAT-3' 本論文 N/A
組み換えDNA
pUC57 この論文 N/A
pET-28a (+)-6xHis/Chain Aプラスミド 本論文 N/A
ソフトウェアとアルゴリズム
ImageJ ソフトウェア NIH https://imagej.nih.gov/ij/
Adobe illustrator 2021 Adobe https://www.adobe.com/
Graphpad Prism 9 ソフトウェア GraphPad https://www.graphpad.com/scientific-software/prism/
R studio ソフトウェア RStudio https://www.rstudio.com/
QIIME2 Bolyen et al.45 N/A
Schrödinger Suite(バージョン 2017-1) Schrödinger, LLC https://www.schrodinger.com
BIA 評価ソフトウェア バージョン 4.1 Biacore AB https://biaevaluation.software.informer.com/4.1/
新しいタブで表を開く
リソースの有無
リード連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるPeng Chen (perchen@smu.edu.cn)までご連絡ください。
材料の入手
材料は、要求に応じて主担当者から入手可能である。
データおよびコードの利用可能性
16sデータはBIG Data Center (http://bigd.big.ac.cn/gsa)のGenome Sequence Archive (GSA)データベースに寄託されており、マウスデータはCRA012910、ヒトデータはHRA005658である。
本論文ではオリジナルコードは報告しない。
本論文で報告されたデータを再解析するために必要な追加情報は、要求があれば主担当者から入手可能である。
実験モデルと被験者の詳細
ヒト試験
ヒトを対象とした研究は、https://www.clinicaltrials.gov(NCT05597150)に登録され、世界医師会のヘルシンキ宣言のガイドラインと原則に従い、南医科大学第七付属病院の倫理委員会の承認を得た。参加者全員から募集前に書面によるインフォームド・コンセントを得た。主な組み入れ基準:健康な成人(20~30歳、すべて中国(アジア)出身)、同時に他の実験プロジェクトに参加していないこと、本研究者への自発的参加。主な除外基準:参加前3ヵ月以内に抗生物質、プロバイオティクス、ホルモン剤の服用歴があること、急性または慢性の疾患があること、脂質および糖代謝を阻害する可能性のある薬剤を使用していること、喫煙者および飲酒者であること、神経疾患または精神疾患の既往歴があること、妊娠中および授乳中の女性であること、重度の器質的疾患があること。プロトコールによれば、60名のボランティアを募集する予定であったが、研究資金の制限により、最終的に41名(男性14名、女性27名)のボランティアを募集することに成功した。
マウス
従来型の野生型C57BL/6Jマウス(SPF、雄、6-8週齢)はSPF Biotechnology Co.Ltd(中国、北京)から購入し、無菌C57BL/6JマウスはCyagen Bioscience Inc.(中国、江蘇省)から購入した。実験用マウスはすべて、12時間明期/12時間暗期サイクルで飼育し、餌と水を自由に摂取できるようにした。
豚
チベット産ミニブタをGuangdong Mingzhu Biotechnology Co. 本実験では8頭のブタ(オス、体重約25kg、12~14週齢)を使用した。すべてのブタは、ステンレス製フィーダーとニップルドリンカーを備えたステンレス製クレートに個別に収容された。すべての動物実験(ブタとマウス)は、南方医科大学(中国広州市)の動物飼育使用委員会の承認を得た。
細胞培養
マウス初代肝細胞は野生型C57BL/6Jマウスから単離した。初代肝細胞の培養には、RPMI1640培地(Gibco, Cat# 11875093, USA)に10%ウシ胎児血清(Gibco, Cat# 10099141C, USA)、100 U/mL Penicillin- streptomycin(Gibco, Cat# 15140122, USA)を添加した。細胞をコラーゲンタイプI(Corning, Cat# 354236, USA)と接着させるため、37℃、5% CO2のインキュベーター内で一晩培養した。
細菌培養
ビフィドバクテリウム・ロンガム(B. longum, ATCC15707)、ビフィドバクテリウム・ビフィダム(B. bifidum, ATCC 29521)、ビフィドバクテリウム・ブレーベ(B. breve, ATCC 15700)、ビフィドバクテリウム・アニマリス(B. animalis, ATCC 700541)の4種のビフィドバクテリウムをBBLブロス培地(Shandong Tuopu Bio-engineering Co、 Ltd.、Cat# M1409、中国)にて37℃、嫌気条件下で培養した。
方法の詳細
動物モデル
MgCl2の腹腔内注射実験。マウスを確率的に4群に分けた:(1)i.p NaCl群、(2)i.p MgCl2群、(3)APAP-i.p NaCl群、(4)APAP-i.p MgCl2群。マウスには、20mM NaCl(Aladdin、Cat# C111535、中国)または20mM MgCl2(Aladdin、Cat# M140788、中国)(いずれもddH2Oで希釈)を1日1回、200μLずつ7日間連続で腹腔内注射した。アセトアミノフェン(APAP)誘発急性肝障害には、300mg/kg APAP(Sigma-Aldrich、Cat# A7085、米国)をマウスに経口投与した。
MgCl2の経口投与実験。マウスを無作為に4群に分けた:(1) NaCl経口投与群;(2) MgCl2経口投与群;(3) APAP-NaCl経口投与群;(4) APAP-MgCl2経口投与群。20mMのNaClまたは20mMのMgCl2を200μLずつ1日1回7日間経口投与した。APAPモデルマウスには、300mg/kgのAPAPまたはPBS(リン酸緩衝液、Gibco、Cat# C10010500BT、米国)を24時間経口投与した。CCl4誘発急性肝障害については、コーン油(Aladdin、Cat# C116025、中国)に溶解した1mL/kgのCCl4(Macklin、Cat# C805329、中国)をマウスに腹腔内注射した。マウスは注射の24時間後に犠牲にした。
抗生物質で前処理したマウスおよび無菌マウスへの経口Mg補充実験。従来のマウスは7日間連続でNaClまたはMgCl2を経口投与し、最後の3日間は抗生物質のカクテル(ABX)処理(アンピシリンナトリウム塩(200mg/kg、Macklin、 A800429、中国)、メトロニダゾール(200mg/kg、Macklin、Cat# M813526、中国)、硫酸ネオマイシン(200mg/kg、Macklin、Cat# N814740、中国)、およびバンコマイシン(200mg/kg、Cat# V105495、Aladdin、中国)を投与した。) 無菌マウスには、20mM NaClまたは20mM MgCl2を200μLずつ1日1回7日間連続経口投与した後、APAP(300mg/kg)またはPBSを経口投与した。
腸内細菌叢の減少および移植(FMT)の実験。NaClマウスまたはMgCl2マウスの糞便を0.125g/mLの濃度でPBSに懸濁し、マウスにABXを5日間経口投与して腸内細菌叢を枯渇させた後、NaClおよびMgCl2ドナーの糞便を5日間経口投与した。その後、レシピエントマウスに300mg/kgのAPAPを投与した。
ヒト化マウスの実験。Mg前処理ドナーまたは後処理ドナーの糞便を0.125g/mLの濃度でPBSに懸濁し、次に無菌マウスには前処理糞便または後処理糞便を1日1回7日間移植し、ABXを5日間投与した従来型マウスには前処理糞便または後処理糞便を1日1回5日間投与した。最後に、APAP経口投与24時間後に血液と肝臓を採取した。
インドール-3-カルボン酸(I3C)介入実験。(1)PBS、(2)I3C-100mg/kg、(3)APAP、(4)APAP-I3C-100mg/kg。I3C(Aladdin, Cat# I107990、中国)をPBSに超音波溶解した。マウスは、APAPまたはPBS投与の1時間前にI3Cを経口投与された。最後に、APAP投与24時間後に血液と肝臓のサンプルを採取した。
アルコール誘発急性肝障害については、モデルマウスは既報の通りである46。簡単に言えば、マウスに30%(vol/vol)エタノール(Cat# 1.17113.023、Guangdong Guanghua Sci-Tech Co.
CCl4誘発慢性肝障害モデルマウスには、隔週1mL/kgのCCl4腹腔内注射の1時間前にI3C(100mg/kg)を6週間経口投与した。
ブタを用いたALFモデルの実験 ブタを2群に分けた:(1)NaCl-APAP群、(2)MgCl2-APAP群。ブタには9.4mg/kgのNaClまたは15mg/kgのMgCl2(両群とも同等の数の陽イオンが投与されるように)を1日2回、連続7日間投与した(いずれもddH2Oで希釈)。ブタALFモデルは、以前に記載されたとおりに実施した47。簡単に説明すると、麻酔をかけたブタに、最初に経鼻胃管から250mg/kgのAPAPを投与し、6時間まで維持用量のAPAPを4g/時間投与した。最後に、APAP投与後に血液と肝臓のサンプルを採取した。
ビフィズス菌と培養上清の介入
ビフィズス菌-動物試験では、マウスにB. longum、B. bifidum、B. breve、B. animalisのいずれかを1日1回3日間経口投与し(マウス1匹あたり2*108 CFU)、その後APAPを投与した。ビフィズス菌上清動物モデルでは、4種のビフィズス菌をBBLブロス培地で48時間嫌気培養し、菌体上清を回収し、マウスに200μLの上清を3日間経口投与した。加熱死菌したビフィドバクテリウムについては、100℃下で10分間培養し、菌体を完全に失活させた。
微生物遺伝子編集戦略
pET-28a (+)-6xHis/Chain Aプラスミド(全長ギ酸C-アセチルトランスフェラーゼ(Gene ID:69577907)をコードするDNA断片をpET28aベクターにクローニングした)をVectorBuilder社(広州、中国)により構築した。プラスミドを導入した大腸菌BL21(DE3)をLBブロス(Sigma-Aldrich, Cat# L3022, USA)で37℃、OD600約0.6まで培養し、0.2mMイソプロピルb-D-チオガラクトシド(IPTG, Solarbio, Cat# I8070, 中国)で16℃、一晩誘導し、ギ酸C-アセチルトランスフェラーゼ過剰発現株(OE)を作製した。細菌経口投与では、細菌培養液を4000g、4℃で10分間遠心し、ペレットをPBSに懸濁した。細菌コロニー形成のため、マウスを3群に分けた:(1) WT-APAP; (2) OE+APAP; (3) OE+MgCl2+APAP. WT-大腸菌およびギ酸C-アセチルトランスフェラーゼ過剰発現-大腸菌を、200μLの滅菌PBS中で、MgCl2添加または無添加で2 * 108 CFUを3日間連続経口投与した後、300mg/kgのAPAPを投与した。
ギ酸C-アセチルトランスフェラーゼ(pflB, 遺伝子ID:69577907)ノックアウトB. longumは相同組換え法を用いて行った。簡単に説明すると、500bpの上流側フランキング領域 "upstream-pflB"、クロラムフェニコール耐性(Cmr)遺伝子、および500bpの下流側フランキング領域 "down-pflB "を含むコンストラクトを増幅し、シームレスクローニングによりプラスミドpUC57を構築した。プラスミドはTIANGEN Biotech社のキット(Cat# DP118、中国)で精製した。コンピテントセル調製のため、B. longumを培地でOD600吸光度が0.4-0.6になるまで培養した。その後、細胞を回収し、10%グリセロール(Guangdong Guanghua Sci-Tech Co., Ltd, Cat# 1.1706.020、中国)に1∗ 1011 CFU/mlの濃度で再懸濁した。次に、pflB遺伝子ノックアウトプラスミドをエレクトロトランスフェクション(2.5kV、200Ω、25μF)によりB. longumのコンピテントセルに形質転換した。電気穿孔したB. longumを回収培地に添加し、クロラムフェニコール(50μg/mL、Macklin、Cat# C804169、中国)を含むBBLブロス寒天培地プレートで24〜48時間培養した。pflB遺伝子ノックアウト株は、上流および下流のフランキング領域にプライマー(pflB-up:TGGTAGCGTTCACAGAAACAATGTG、pflB-down:CATCAAAGTCTGCGAGGCATAGGTC)を用いたPCRにより確認した。
pflB-KO B.longumの動物実験では、マウスにpflB-KO B.longum(2*108 CFU/マウス)をMgCl2添加または無添加で1日1回3日間経口投与し、その後APAPを投与した。
血漿生化学分析
血液サンプルを採取し、遠心分離(12000rpm、10分、4℃)して血漿を得た。アラニンアミノトランスフェラーゼ(ALT、南京江城生物工学研究所、Cat# C009-3-1、中国)およびアスパラギン酸アミノトランスフェラーゼ(AST、南京江城生物工学研究所、Cat# C010-3-1、中国)の血漿濃度は、製造元の紹介に従って測定した。
ボランティアのその他の生化学的指標は、AU5800全自動生化学分析装置(Beckman Coulter、米国)で分析した。
組織学、免疫組織化学、顕微鏡検査
肝組織は新鮮な状態で採取し、4%パラホルムアルデヒド(PFA、Aladdin、Cat# C104190、中国)に浸漬して24時間固定した。肝病理学的変化、Ly6G陽性細胞およびF4/80陽性細胞は、それぞれHE染色またはIHC染色により定量した。病理組織学的評価のために、肝臓切片(4μm)を通常のヘマトキシリン/エオジン染色で処理した。シリウスレッド染色は、Modified Sirius Red Stain Kit(Solarbio, Cat# G1472、中国)を用い、製造者の指示に従って行った。肝壊死および肝線維化領域は、面積率分析(Image Jソフトウェア)により定量化した。Ly6GおよびF4/80の免疫組織化学的染色には、抗原回収用にクエン酸ナトリウム緩衝液(10mMクエン酸ナトリウム、0.05%Tween20、pH6.0)を調製し、切片を10分間煮沸し、10分間中和した後、水道水で10分間洗浄した。切片中の内因性ペルオキシダーゼ活性は、切片を3 % H2O2中で30分間インキュベートすることにより抑制することができた。非特異的部位は10%ヤギ血清でブロックした。各スライドを抗ウサギF4/80抗体(Abcam, Cat# ab111101, UK)または抗ウサギLy6G抗体(Abcam, Cat# ab238132, UK)と一晩インキュベートした後、HRP標識ヤギ抗ウサギIgGと室温で45分間インキュベートした。ジアミノベンジジン四塩酸塩(Maixin Biotech Co., Ltd, Cat# DAB-4033, China)を用いて免疫反応性を可視化した。ヘマトキシリン染色後、スライドを脱水し、中性樹脂で密封した。画像は、肝臓スライドごとに無作為に選んだ6フィールドから200倍の倍率で撮影した。
定量的リアルタイムPCR
組織または細胞から total RNA を total RNA isolation kit(Vazyme Biotech Co.Ltd、Cat# RC112-01、中国)を用いて製造者の指示に従って抽出し、ReverTra Ace® qPCR RT Master Mix(東洋紡、Cat# FSQ-201、日本)を用いて cDNA 合成に用いた。すべてのqPCRは、SYBR® Green Real-time PCR Master Mix(東洋紡、Cat# QPK-201、日本)を用いて、ABI 7500 Real-Time PCR System(Applied Biosystems、米国)で行った。閾値サイクル数は18SまたはGAPDH値に対して正規化し、比較CT(ΔΔCt)法に従って相対的な倍数変化を解析した。プライマーは表S1に示した。
GSH測定
肝組織または肝細胞を氷上でホモジナイズし、遠心分離(3500rpm、10分、4℃)して上清を回収し、タンパク質を含むサンプルを以下の測定のために配給した。メーカーのプロトコールに従い、グルタチオン(GSH)は市販のアッセイキット(Nanjing jiancheng Bioengineering Institute, Cat# A061-1-2, China)を用いて測定した。
タンパク質抽出とウェスタンブロッティング
肝細胞および肝組織をRIPA溶解バッファー(Beyotime、Cat# P0013B、中国)でホモジナイズした。BCA assay kit (Thermo Fisher, Cat# 23227, USA)を用いてタンパク質濃度を測定し、混合物をDualColor Protein Loading Buffer (Fdbio science, Cat # FD006, China)で98℃、5分間煮沸した。等量のタンパク質を12% SDS-PAGEで分離し、PVDF膜(Merck Millipore, Cat# IPVH00010, USA)に転写した後、膜を一次抗体および二次抗体とインキュベートした。一次抗体には、JNK(Cell Signaling Technology, Cat# 9252, USA)、P-JNK(Cell Signaling Technology, Cat# 9255, USA)、PCNA(Cell Signaling Technology, Cat# 13110, USA)、β-アクチン(Proteintech, Cat# 81115-1-RR, USA)、CYP2E1(Proteintech, Cat# 19937-1-AP, USA)を用いた。二次抗体には、Cell Signaling Technology 社の抗マウス IgG-HRP(Cat#7076)、抗ウサギ IgG-HRP(Cat#7074)を用いた。一次抗体を4℃で一晩インキュベートした後、二次抗体を室温で1時間インキュベートした。タンパク質のバンドを可視化するために、増強化学発光(ECL)(Biosharp, Cat# BL520B、中国)を行った。最後に、定量的解析のためにImageJを適用し、標的タンパク質の発現レベルをβ-アクチンで正規化した。
活性酸素ストレス(ROS)アッセイ
肝臓を-20℃の至適切断温度化合物(O.C.T, SAKURA, Cat# 4583, Japan)に浸漬した。メーカーのプロトコールに従い、肝臓凍結切片をDCFH-DAプローブ(Beyotime、Cat# S0033S、中国)と30分間インキュベートした。活性酸素の含量は直ちにLeica顕微鏡で検出し、ImageJソフトで解析した。
高速液体クロマトグラフィー(HPLC)分析
肝臓中の APAP 付加体(3-システイニルアセトアミノフェン(トリフルオロアセテート塩)、Cat# GC42258, Glpbio, USA)は、Agilent 1200 infinity HPLC(Agilent Technologies, USA)を用いて、既報の方法に従って調べた48。簡単に説明すると、100mgの肝組織を1mLの10mM酢酸ナトリウム(pH=6.5、Aladdin、Cat# S431683、中国)でホモジナイズし、16000gで10分間遠心分離した。上清を回収し、タンパク質濃度を測定した。HPLCの移動相はアセトニトリル-水(20:80)であった。カラムは20℃、流速1.0 mL/分で沈降させた。APAP付加物は254 nmのUV検出により定量した。
メタボローム解析
細菌培養上清アンターゲットメタボロミクスでは、実験のデータ取得と解析はYujing Technology (Shanghai) Co., Ltd.で行い、以前のNature Protocolsのメソッドに従って若干の修正を加えた49。メタボロミクス解析用の全サンプルのアリコートをプールして品質管理(QC)サンプルを調製した。QCサンプルはデータ取得中、5サンプルごとに注入した。50μLのBifidobacterium上清を回収し、150μLのアセトニトリルを加え、十分にボルテックスした。4680rpm、15分間、4℃で遠心後、上清を回収した。その後、各サンプル100μLを、エレクトロスプレーイオン化四重極飛行時間型質量分析計(ESI-QTOF MS)(SYNAPT G2-S HDMS、Waters)に連結したUHPLCシステム(ACQUITY UPLC-I-Class、Waters)で分析した。流速は0.4 mL/min、サンプル注入量は5μLであった。ポジティブモードでは、移動相Aは水中0.1%ギ酸(FA)、移動相Bはアセトニトリル(ACN)中0.1%FAであった。ネガティブモードでは、移動相Aは水中の10mMギ酸アンモニウム、移動相BはACNであった。リニアグラジエントは以下のように設定した: 初期~0.2分:2%B、0.2~4.0分:2%B~60%B、4.0~5.0分:60%B~60%B、5.0~9.0分:60%B~95%B、9.0~10.5分:95%B、10.6~13.0分:2%B。
生データは、ピークピッキング、ピークアライメント、m/z、保持時間、強度などの化合物関連情報の取得を含むデータ処理のために、市販のソフトウェアProgenesis QI (Version 2.4, Waters, USA)にインポートされました。
マウス便の非標的メタボロミクスでは、20mgの便を内部標準物質を含む400μLのメタノール-水(7:3、V/V)で3分間ボルテックスした。氷冷超音波槽で、混合物を30分間ボルテックスソニケーションした。その後、混合物を12000rpmで10分間(4℃)遠心し、上清を回収した後、上清を12000rpmで3分間(4℃)遠心した。200μLの上清をLC-MS分析用のバイアルに移した。注入量は2μL、流速は0.4mL/min、カラム温度は40℃とした。カラム(Waters ACQUITY UPLC HSS T3 C18, (1.8μm, 2.1mm∗100 mm) Waters Corp., Milford, USA)は、5%移動相B(アセトニトリル中0.1%ギ酸)から90%移動相Bで11分で溶出し、1分間保持した後、0.1分で5%移動相Bに戻し、1.9分間保持した。
APAPのLC-MS分析については、既報の通り行った50。
I3CのLC-MS/MS分析では、100μLの血漿または菌体上清サンプルを400μLのアセトニトリルで抽出し、10秒間ボルテックスした後、12,000rpmで15分間遠心した(4℃)。上清10μLをXB-C18カラム(Phenomenex, Cat# 00D-4496-AN, USA)に注入し、島津HPLCシステム(Shimadzu Nexera LC-30A, Japan)とAPI 4000トリプル四重極質量分析計(Applied Biosystems Sciex, Ontario, Canada)を用いてLC-MS/MSシステムで分析した。移動相Aは水、移動相Bはアセトニトリルであった。サンプルは以下のグラジエントで溶出した: 10%B、1分;95%B、3.6分;95%B、4.5分;10%B、6分。MS分析は、ネガティブエレクトロスプレーイオン源を用いて行った。最適化された装置パラメータは、イオン源温度(500℃)、イオンスプレー電圧(5000V)、カーテンガス(15psi)、イオン源ガス1(55psi)、イオン源ガス2(55psi)、ドエルタイム(100ms)であった。定量は多重反応モニタリングモードで、I3Cのm/z、159.9/115.9で行った。データ処理には、MultiQuant 1.2 software (AB SCIEX)を使用し、ピーク面積を積分した。
13C代謝フラックス分析のために、ビフィズス菌をNaH13CO3(同位体、Cat# cil-1172、中国)と共にMgCl2の存在下または非存在下で初期OD600が約0.4となるように12時間インキュベートし、上清を回収して13C標識I3Cを検出した。定量は多重反応モニタリングモードで行い、13C標識I3Cのm/zは160.9/115.9であった。
16S rDNA配列決定および特異的細菌分析
糞便DNAは、TIANGEN DNA Stool Mini Kit(TIANGEN、Cat# DP328-02、中国)を用い、キットの説明書に従って抽出した。PCR増幅には、細菌16S rDNA遺伝子のV3V4領域のユニバーサルアンプリコンプライマー、特異的バーコード、蛍光色素を用いた。産物は、イルミナのハイスループットシーケンスプラットフォームNovaSeq 6000で解析した。データ抽出にはQIIME2プラットフォーム(Version2022.8)を用いた。品質管理後、平均シーケンス深度はマウス研究でサンプルあたり128456リード(104573-166086の範囲)、ヒト研究でサンプルあたり64697リード(46078-75897の範囲)であった。Divisive Amplicon Denoising Algorithm 2 (DADA2)パイプラインを使用して、ヒトとマウスの16S rDNAシーケンスデータを処理した。各特定細菌群の相対量は、δ-Ct法に従ってqPCRで解析した。プライマーは表S1に示した。
分子ドッキング
CYP2E1 (UniProt ID: P05181)の構造はRSCB PDB Protein Data Bank (http://www.rcsb.org)から取得した。また、I3C (Compound CID: 69867)の構造はPubChemデータベース(https://pubchem.ncbi.nlm.nih.gov/)からダウンロードした。構造に基づくモデリングは、前述のようにSchrödinger Suite(バージョン2017-1)で行い51、続いてDiscovery Studio Visualizer(Accelrys、米国)で可視化した。
表面プラズモン共鳴(SPR)解析
rhCYP2E1に対するインドール-3-カルボキシルの結合親和性は、3Dデキストランセンサーチップ(Plexera Bioscience、Cat# PX201、米国)を用いたPlexArray® HTシステム(PlexArray、米国)を用いて測定した。簡単に説明すると、CYP2E1(ヒト)リコンビナントタンパク質(Abnova, Cat# H00001571-P01, China)を3Dデキストランチップにロードし、0.49 M 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride (EDC)と0.1 M N-hydroxysuccinimide(NHS)を等量加えて活性化した。I3C(0.1%DMSOに溶解)は濃度を上げながら流した(5μM、10μM、20μM、50μM、100μM)。流速は2mL/sとした。反応シグナルデータはPlexera Data Explorerで収集し、BIA評価ソフトウェアバージョン4.1で解析した。
初代肝細胞の単離、培養および処理
C57BL/6Jの初代肝細胞は、in situ肝灌流とコラゲナーゼ消化を含む2つのステップによって単離された。肝臓と下大静脈を露出させた後、門脈を24ゲージの針でカニュレーションし、直ちにCa2+とMg2+を含まないハンク緩衝食塩水(buffer-I)を2mL/分の流速で37℃にて灌流した。一方、門脈を切開し、肝臓に血液が流れるようにした。肝臓をブランチングした後、灌流を0.033mg/mLコラゲナーゼType P(Worthington Biochemical, Cat# 11213857001, USA)と0.33mg/mLコラゲナーゼType 4(Worthington Biochemical, Cat# LS004188, USA)を添加したbuffer-IIに切り替えた。肝臓は完全に消化されたので、RPMI1640培地(Gibco、Cat# C11875500CP、USA)で除去し、70μmメッシュフィルター(Biologix、Cat# 15-1070、China)で濾過した。800rpmで3分間遠心した後、肝細胞を10%ウシ胎児血清(Gibco, Cat# 10099141C,USA)および1%ペニシリン/ストレプトマイシン(Gibco, Cat# 15140122,USA)を添加したRPMI1640培地で6-8時間培養し、5%CO2、37℃インキュベーター内でプレートに接着させた。初代肝細胞に対するI3Cの保護作用を調べるため、I3C(1μM)を1時間処理した後、または処理せずに、細胞を10mM APAPで刺激した。AhRがI3Cの保護作用を介するか否かを決定するために、初代肝細胞を5μM AhR阻害剤(CH-223191、Cat# S771、Selleck、中国)で2時間処理した後、10mM APAPでチャレンジし、その後I3Cを1時間投与した。in vitroにおけるMgの影響を検出するために、細胞をNaCl(1μM、10μM、100μM)またはMgCl2(1μM、10μM、100μM)で12時間インキュベートし、その後APAP(10mM)で12時間刺激した。
乳酸脱水素酵素(LDH)の測定とCCK8アッセイ
細胞障害を判定するために、培養液中のLDHを測定した。LDHの吸光度データは、製造元(Glpbio, Cat# GK10003、USA)から承認されたプロトコールに従い、490nmで得られた。Cell counting kit 8 (CCK8)によるin vitroアッセイ実験は、CCK8 Kit (Glpbio, Cat# GK10001, USA)を用い、製造元の指示に従って行った。
In vivoにおけるCyp2e1の沈黙
In vivo。Cyp2e1 siRNA(マウスCyp2e1-siRNA:5'-GCTCATGAGTTTGTTCAAT-3')またはコントロールsiRNA(マウスControl-siRNA-5'-UUCUCCGAACGUGUCACUG-3')をin vivo DNA RNA Advanced Transfection Reagent(ZETA life, Cat# AV500075, USA)と1:1の比率に従って10〜15分間混合した。初日と4日目にCyp2e1 siRNA(20nmol)を尾静脈注射した。6日目にマウスを犠牲にし、Cyp2e1のサイレンス効率を測定した。
マウスにおけるAhRサイレンス
マウスの肝臓のAhR mRNAをサイレンスするために、6週齢の雄C57BL/6Jマウスにアデノ随伴ウイルス血清型8(AAV8)-AhR-shRNA(中国Genechem社製)を、マウス1匹あたり1*1011ゲノムコピー(GC)で肝動脈内注射した。マウス初代肝細胞を単離し、2週間後のAhRのサイレンス効率を測定した。
細胞熱シフトアッセイ
初代肝細胞をRIPA緩衝液(Beyotime、Cat# P0013B、中国)で溶解した後、懸濁液を液体窒素中で3サイクル凍結融解した。溶解液を15000rpm、15分間、4℃で遠心した。I3C(1μM)を添加または無添加で1時間インキュベートした後、細胞懸濁液を6本のPCRチューブ(各群3本のPCRチューブ)に分け、PCRチューブ内で37℃、42℃、47℃、52℃、57℃、62℃で3分間個別に加熱する。最後に、タンパク質の安定性を測定するために、続くウェスタンブロッティングのステップでサンプルを処理した。
薬剤親和性標的安定性(DARTS)アッセイ
タンパク質サンプルは5μg/μLとして定量した。各チューブにI3C(1μM)を添加または無添加で加え、室温で1時間インキュベートした。TNCバッファー(0.05M Tris, 0.5M NaCl, 5mM CaCl2, 0.02% NaN3、5℃、HClでpH7.50に調整)で調製したStreptomyces griseus由来のプロナーゼ(Sigma-Aldrich, Cat# P8811, USA)を、タンパク質サンプルに1:333(w/w)になるように30分間添加した。その後、ローディングバッファーを加えて反応を終了させた。次に、タンパク質の安定性を測定するために、サンプルをウェスタンブロッティングで処理した。メーカーのプロトコールに従い、ゲルをクマシーブルー高速染色液(Beyotime, Cat# P0017B, China)と脱染液(Beyotime, Cat# P0017C, China)にゲル上の縞が見えるまで浸した。
In vivo および In vitro での CYP2E1 酵素活性の測定
in vitro
ヒト(Cat# 0121A1.01、中国)およびマウス(Cat# 0121E2.01、中国)肝ミクロソームは、BeiJing HuiZhi HeYuan Biotechnology Co. 肝ミクロソームをI3Cの有無にかかわらず1時間プレインキュベートした後、代謝基質としてクロルゾキサゾン(Aladdin, Cat# C129514, 中国)を各群に5分間37℃で添加し、NADPH(10mM, Beyotime, Cat# ST360, 中国)を用いて酵素反応を20分間プライミングした。次に、氷アセトニトリルでタンパク質を沈殿させ、懸濁液を12,000rpm、4℃で15分間遠心した。最後に、上清を回収し、代謝産物である 6-ヒドロキシクロルゾキサゾン(Cat#YXE04977、Shanghai Yingxin laboratory equipment Co., Ltd, China)を、従来の方法に従って LC-MS で測定した52。
In vivo
マウスをI3Cで1時間前処理した後、APAP(300mg/kg)を1時間投与し、肝臓サンプルを採取して超音波ホモジナイズし、タンパク質を定量した。製造業者のプロトコールに従い、活性測定キット(Fluorometric)(GENMEDSCIENTIFICSINC、Cat#GMS18021.1、中国)を用いて肝臓ホモジネート中のチトクロームP450 2E1(CYP2E1)活性を測定した。
定量および統計解析
データは平均値±平均値の標準誤差(SEM)で示した。2群間の比較は、両側無対または対(ヒトデータの対解析のみ)のStudent's t-testsを用いて行い、複数群間の比較はone-way ANOVAを用いて評価した。シーケンシングデータの統計的手法は、図中の凡例に記載した。サンプル数(n)は図中の凡例に示した。統計解析にはGraphpad Prism 9を用いた。p < 0.05は統計的に有意な差を示した。グラフィカルアブストラクトはBioRenderを用いて作成し、承認を得た。
その他のリソース
本研究の臨床登録番号および関連リンクはhttps://www.clinicaltrials.gov(NCT05597150)である。
謝辞
本研究は、中国国家重点研究開発計画(2022YFA0806400)および中国国家自然科学基金(81873926、32071124、32271230)からP.C.に、中国国家自然科学基金(82072100)からQ.M.に、中国国家自然科学基金(82130063)および広東省優秀人材特別支援計画(2019JC05Y340)からY.J.に、広東省基礎応用基礎研究基金(2022B1515130004)からY.C.に支援された。
著者貢献
D.L.、Y.C.、M.W.、F.M.、F.W.、P.G.、Rongjuan Wei、H.Z.、B.C.、Q.X.、T.X.、Riqing Weiが実験を行い、データを解析した。X.Z.、Y.T.、H.L.、L.D.、Y.Q.はバイオインフォマティクス解析に参加した。Y.C.、Y.Z.、T.G.、Z.L.、H.Y.、L.Y.は臨床データを解析した。Y.Y.とP.W.は細菌培養実験に参加した。S.W.とT.A.T.は付加体解析に参加し、原稿を修正した。J.G.とL.-Y.Z.はメタボロミクス解析に参加した。B.S.、N.K.、Y.J.、Q.M.およびP.C.は、研究の計画、データの解釈、原稿の起草および編集、ならびに研究の監督を行った。
利害関係
著者らは、競合する利益はないと宣言している。
インクルージョンと多様性
我々は、包括的で多様性があり、公平な研究実施を支持する。
補足情報
pdfをダウンロード (2.09 MB)
pdfファイルのヘルプ
資料S1. 図S1〜S6、表S1、S2
参考文献
ベルナル W.
ウェンドンJ.
急性肝不全。
N. Engl. J. Med. 2013; 369: 2525-2534
記事で見る
スコープス (844)
PubMed
クロス
グーグル奨学生
ジェルマーニ G.
テオチャリドゥE.
アダムR.
カラムV.
ウェンドンJ.
オグレディ J.
ブラ P.
センゾロ M.
ミルザ D.
キャステイングD.
他。
ヨーロッパにおける急性肝不全に対する肝移植:ELTRデータベースによる20年間の治療成績。
J. Hepatol. 2012; 57: 288-296
論文で見る
スコープス(195)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ストラビッツ R.T.
クレイマーD.J.
急性肝不全の管理
Nat. Rev. Gastroenterol. Hepatol. 2009; 6: 542-553
論文で見る
スコープス (143)
PubMed
クロス
グーグル奨学生
ベルナル W.
Wendon J.
急性肝不全:臨床的特徴と管理。
Eur. J. Gastroenterol. Hepatol. 1999; 11: 977-984
論文で見る
スコープス (47)
PubMed
クロス
グーグル奨学生
クレイグ D.G.
リー A.
ヘイズ P.C.
シンプソン K.J.
総説:急性肝不全の現在の管理。
Aiment。薬理学。Ther. 2010; 31: 345-358
論文で見る
スコープス (79)
PubMed
クロス
グーグル奨学生
リー S.S.
ブターズJ.T.
ピノーT.
フェルナンデス-サルゲーロP.
ゴンザレス F.J.
アセトアミノフェンの肝毒性におけるCYP2E1の役割。
J. Biol. Chem. 1996; 271: 12063-12067
論文で見る
(546件)
PubMed
概要
全文
全文PDF
グーグル奨学生
Ge W.
Wang T.
Zhao Y.
ヤン Y.
Sun Q.
ヤン X.
Gao Y.
Xu X.
Zhang J.
Period1はCYP2E1と相互作用することにより、毒素の律動的代謝を媒介する。
Cell Death Dis. 2021; 1276
論文で見る
スコパス (10)
クロスリファレンス
グーグル奨学生
ヘルース D.P.
ショートK.
チャン N.
リーD.Y.
Zhang L.Q.
Qing Ye S.
一塩基多型とアセトアミノフェン誘発性肝毒性との遺伝的関連。
J. Pharmacol. Exp. Ther. 2018; 367: 95-100
論文で見る
スコープス (10)
PubMed
クロス
グーグル奨学生
ダーリン D.C.
三輪 G.T.
Lu A.Y.
ネルソン S.D.
N-アセチル-p-ベンゾキノンイミン:アセトアミノフェンのチトクロームP-450介在酸化生成物。
Proc. Natl. Acad. Sci. USA. 1984; 81: 1327-1331
論文で見る
PubMed
クロス
グーグル奨学生
パク J.-H.
ソ K.-S.
タディ S.
アン B.-H.
イ J.-U.
ホ J.-Y.
ハン J.
ソン M.-S.
Kim S.-H.
Yim Y.-H.
他。
インドール誘導体は、マウスにおいてN-アセチル-p-ベンゾキノンイミンに直接結合することにより、アセトアミノフェン誘発肝障害から保護する。
Antioxid. Redox Signal. 2013; 18: 1713-1722
論文で見る
スコープス (28)
PubMed
クロス
グーグル奨学生
リー・W.M.
ハイナン L.S.
ロッサロL.
フォンタナ R.J.
ストラビッツ R.T.
ラーソン A.M.
ダバーン2世 T.J.
マレー N.G.
マッカシュランド T.
ライシュ J.S.
他
N-アセチルシステイン静注は、早期非アセトアミノフェン性急性肝不全における無移植生存率を改善する。
Gastroenterology. 2009; 137: 856-864.e851
論文で見る
スコープス (495)
PubMed
要旨
全文
全文PDF
グーグル奨学生
カーベラス C.J.
レヴェンタール T.M.
ラケラ J.L.
チャン J.
Durkalski V.
レディ K.R.
フォンタナ R.J.
ストラビッツ R.T.
レイク J.R.
リー W.M.
パレックJ.R.
肝移植の適応となった急性肝不全患者の転帰: 多施設前向きコホート解析。
肝移植 2023; 29: 318-330
論文で見る
スコープス (10)
PubMed
クロス
グーグル奨学生
戸内 謙一
片山 聡
小山和彦
佐多直人
富岡義明
今馳浩
布宮慎一郎
敗血症における低マグネシウム血症と凝固障害との関連:後方視的観察研究。
BMC Anesthesiol.
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
Wang D.
Zheng J.
Hu Q.
Zhao C.
Chen Q.
Shi P.
Chen Q.
Zou Y.
Zou D.
Liu Q.
et al.
Magnesium protects against sepsis by blocking gasdermin D N-terminal-induced pyroptosis.
Cell Death Differ. 2020; 27: 466-481
論文で見る
スコープス (58)
PubMed
クロス
グーグル奨学生
ソリマンH.M.
メルカンD.
ロボ S.S.
メロ C.
Vincent J.L.
イオン化低マグネシウム血症の発症は死亡率の上昇と関連する。
Crit. Care Med. 2003; 31: 1082-1087
論文で見る
スコープス (139)
PubMed
クロス
グーグル奨学生
アルカゼミ D.
アルスーリ N.
ザファルT.
クボウ S.
見かけ上健康なクウェート人成人における低マグネシウム血症とメタボリックシンドローム: 横断的研究。
栄養素。2022; 145257
論文で見る
スコープス (3)
PubMed
クロス
グーグル奨学生
黄 J.W.
ファミュールO.
Li Y.
キム・S.J.
腎移植後の低マグネシウム血症と新規糖尿病発症リスク。
J. Am. Soc. Nephrol. 2016; 27: 1793-1800
論文で見る
PubMed
クロスフィルム
グーグル奨学生
ロッチャー J.
マルティI.L.A.A.
キルヒハマーN.
クリビオーリ E.
ジョルダーノ・アティアネーゼG.M.P.
トレフニー M.P.
レンツ M.
ロスチャイルド S.I.
ストラティ P.
クンツリM.
他
LFA-1を介したマグネシウム感知がCD8(+)T細胞のエフェクター機能を制御している。
Cell. 2022; 185: 585-602.e29
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
ヤン N.
ゴン F.
リウ・B.
ハオ Y.
Chao Y.
Lei H.
Yang X.
Gong Y.
Wang X.
Liu Z.
Cheng L.
マグネシウムガルバニック細胞は水素を産生し、腫瘍微小環境を調節して癌の増殖を抑制する。
Nat. Commun. 2022; 132336
論文で見る
Google Scholar
ラーション S.C.
ベルクヴィスト L.
Wolk A.
女性の大腸がんリスクとマグネシウム摂取量。
JAMA. 2005; 293: 86-89
論文で見る
スコープス (101)
PubMed
クロス
グーグル奨学生
ニカストロ R.
ガイヤールH.
ザルスエラL.
ペリ-ガリM.P.
フェルナンデス-ガルシアE.
トメ M.
ガルシア・ロドリゲス N.
ドゥラン R.V.
デ・ヴィルジリオ C.
ウェリンガー R.E.
マンガンは、酵母および哺乳類において生理的に重要なTORC1活性化因子である。
eLife. 2022; 11e80497
論文で見る
クロスフィルム
グーグル奨学生
Li R.
Xie L.
Li L.
Chen X.
Yao T.
Tian Y.
Li Q.
Wang K.
Huang C.
Li C.
et al.
腸内細菌の代謝産物である3,4-ジヒドロキシフェニルプロピオン酸は、マウスのマクロファージ炎症活性の緩和を介して肝虚血/再灌流障害を緩和する。
Acta Pharm. Sin. B. 2022; 12: 182-196
論文で見る
(15件)
PubMed
クロス
グーグル奨学生
He Y.
Fu L.
Li Y.
Wang W.
Gong M.
Zhang J.
Dong X.
黄 J.
王 Q.
マッケイ C.R.
他。
腸内微生物の代謝産物は、細胞傷害性CD8(+)T細胞免疫を調節することにより、抗がん治療の効果を促進する。
Cell Metab. 2021; 33: 988-1000.e7
論文で見る
スコープス (209)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ラヴェルA.
Sokol H.
炎症性腸疾患のキーアクターとしての腸内細菌叢由来代謝産物。
Nat. Rev. Gastroenterol. Hepatol. 2020; 17: 223-237
論文で見る
スコープス (781)
PubMed
クロス
グーグル奨学生
アグス A.
クレマンK.
ソコルH.
代謝異常における中心的調節因子としての腸内細菌叢由来代謝産物。
Gut. 2021; 70: 1174-1182
論文で見る
スコープス (410)
PubMed
クロス
グーグル奨学生
Zeng Y.
Wu R.
Wang F.
Li S.
Li L.
Li Y.
Qin P.
Wei M.
Yang J.
Wu J.
et al.
腸内微生物のβ-ガラクトシダーゼによるダイゼインの遊離は、マウスにおけるアセトアミノフェン誘発肝毒性を抑制する。
Cell Host Microbe. 2023; 31: 766-780.e7
論文で見る
PubMed
要旨
全文
全文PDF
グーグル奨学生
吉田敏明
藤田和彦
長澤 毅
非酸化的脱炭酸反応を触媒する新規可逆的インドール-3-カルボン酸脱炭酸酵素.
Biosci. Biotechnol. Biochem. 2002; 66: 2388-2394
論文で見る
スコープス (43)
PubMed
クロス
グーグル奨学生
ガロスD.
フィッシャーK.
ペインK.A.P.
クリフ M.
レヴィ C.
レイズ D.
プレニル化フラビンモノヌクレオチド依存性インドール-3-カルボン酸脱炭酸酵素の構造と生化学的性質
J. Biol. Chem. 2022; 298101771
論文で見る
スコープス (5)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
Zhang Y.
Skolnick J.
TM-align:TMスコアに基づくタンパク質構造アライメントアルゴリズム。
核酸研究 2005; 33: 2302-2309
論文で見る
筑波大学
PubMed
クロスフィルム
グーグル奨学生
ゴン S.
ラン T.
Zeng L.
Luo H.
Yang X.
Li N.
チェン X.
Liu Z.
Li R.
Win S.
et al.
腸内細菌叢はアセトアミノフェンによるマウス急性肝障害の日内変動を媒介する。
J. Hepatol. 2018; 69: 51-59
論文で見る
スコープス (164)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ウィジャジャ A.A.
ドン J.
アダミ E.
ヴィスワナサン S.
ン B.
パクキリ L.S.
チョタニ S.P.
シン B.K.
リム・W.W.
Zhou J.
他
アセトアミノフェン誘発肝障害における再生制限性肝毒素および治療標的としてのIL11の再定義。
Sci. Transl. Med. 2021; 13eaba8146
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
ジェームス L.P.
メイユーP.R.
ヒンソンJ.A.
アセトアミノフェン誘発性肝毒性。
Drug Metab. Dispos. 2003; 31: 1499-1506
論文で見る
スコープス (856)
PubMed
クロス
グーグル奨学生
グナワンB.K.
リウ Z.X.
ハン D.
Hanawa N.
ガアルデ・W.A.
Kaplowitz N.
C-Jun N末端キナーゼはマウスアセトアミノフェン肝毒性に主要な役割を果たしている。
Gastroenterology. 2006; 131: 165-178
論文で見る
スコパス (379)
PubMed
要旨
全文
全文PDF
グーグル奨学生
オーストL.J.
クルシェンス S.
マー C.
ホーエンデロップJ.G.J.
タック C.J.
デ・バアイJ.H.F.
マグネシウムは脂肪細胞におけるインスリン依存性グルコース取り込みを増加させる。
Front. Endocrinol. 2022; 13986616
論文で見る
スコープス (4)
PubMed
クロス
グーグル奨学生
ウェイクマンC.A.
グッドソンJ.R.
ザッカリアV.M.
ウィンクラー W.C.
枯草菌におけるマグネシウムトランスポーターの必要性の評価。
J. Bacteriol. 2014; 196: 1206-1214
論文で見る
スコープス (31)
PubMed
クロス
グーグル奨学生
リウ・Y.
Han R.
Wang J.
ヤン P.
Wang F.
ヤン B.
マグネシウムセンシングが腸管出血性大腸菌O157:H7の腸内コロニー形成を制御する。
mBio. 2020; 11 (e02470-e02420)
論文で見る
スコープス (24)
クロスフィルム
グーグル奨学生
モラレス M.S.
デホリティB.A.
主要なルーメンセルロース分解菌のマグネシウム要求性。
Animal. 2014; 8: 1427-1432
論文で見る
スコパス (8)
PubMed
クロス
グーグル奨学生
シバン A.
コラレスL.
ユベールN.
ウィリアムズJ.B.
アキーノ=マイケルズK.
アーリー Z.M.
ベニヤミン F.W.
レイ Y.M.
ジャブリ B.
アレグレ M.L.
他
ビフィズス菌は抗腫瘍免疫を促進し、抗PD-L1効果を促進する。
Science. 2015; 350: 1084-1089
論文で見る
スコープス (2521)
PubMed
クロス
グーグル奨学生
ラウセン M.F.
坂中 貢
フォン・ブルグ N.
メルベ U.
アンデルセン D.
モル J.M.
ペクメズ C.T.
リヴォリエ A.
ミケルセン K.F.
モルゴーC.
他
母乳育児に関連するビフィズス菌種は、乳児の腸内で芳香族乳酸を産生する。
Nat. Microbiol. 2021; 6: 1367-1382
論文で見る
スコープス (132)
パブコメ
クロス
グーグル奨学生
バラット M.J.
ヌジャットS.
アーサンK.
フレセ S.A.
アルザマソフ A.A.
サルカー S.A.
イスラム M.M.
パリット P.
イスラム M.R.
ヒバードM.C.
他
ビフィドバクテリウム・インファンティスの投与は、バングラデシュの重症急性栄養失調児の体重増加を促進する。
Sci. Transl. Med. 2022; 14eabk1107
論文で見る
スコープス (40)
PubMed
クロス
グーグル奨学生
福田慎一郎
トウ・エイチ
長谷和彦
大島和彦
中西康之
吉村和彦
戸部 徹
クラーク J.M.
トッピング D.L.
鈴木 T.
他
ビフィズス菌は酢酸産生により腸管病原体感染から身を守る。
Nature. 2011; 469: 543-547
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
チェン・ビー
Sun L.
Zeng G.
シェン Z.
Wang K.
Yin L.
Xu F.
Wang P.
Ding Y.
Nie Q.
et al.
腸内細菌は、腸内ニコチンを分解することによって喫煙に関連するNASHを緩和する。
Nature. 2022; 610: 562-568
論文で見る
スコープス (26)
PubMed
クロス
グーグル奨学生
アグス A.
プランセJ.
ソコルH.
健康と疾患におけるトリプトファン代謝の腸内細菌叢制御。
細胞宿主微生物。2018; 23: 716-724
論文で見る
スコパス (1215)
PubMed
要旨
全文
全文PDF
グーグル奨学生
シューランF.A.
ロンメッツC.
シュテッターA.
ガーラブA.
ヴィーシェンドルフ B.
シュヴィンジ D.
ズエルケ S.
ラインダース J.
ヘーレン J.
ローゼA.W.
他
肝細胞におけるアリール炭化水素受容体活性は、マウスにおける超急性アセトアミノフェン誘導性肝毒性を感作する。
Cell. Mol. Gastroenterol. Hepatol. 2021; 11: 371-388
論文で見る
スコープス (8)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ボリエン E.
ライドアウト J.R.
ディロン M.R.
ボクリッチ N.A.
アブネットC.C.
アル・ガリス G.A.
アレクサンダー H.
アルム E.J.
アルムガム M.
アスニカーF.
他
QIIME 2を用いた再現性、対話性、拡張性のあるマイクロバイオームデータサイエンス。
Nat. Biotechnol. 2019; 37: 852-857
論文で見る
スコープス (8706)
PubMed
クロス
グーグル奨学生
陳 鵬
宮本雄一
マザゴワ M.
リー・K.C.
Eckmann L.
シュナーブルB.
微生物叢は急性アルコール誘発肝障害からマウスを保護する。
アルコール。Clin. Exp. Res. 2015; 39: 2313-2323
論文で見る
スコープス (86)
PubMed
クロス
グーグル奨学生
ダルグ R.
ジアR.
ラウ C.
ニコルズ A.W.
デア T.O.
リー K.
ジャラン R.
コーエン M.
ウィルソン I.D.
ブタの肝不全モデルにおけるパラセタモール(アセトアミノフェン)の代謝と内因性代謝への影響。
Toxicol. Sci. 2020; 175: 87-97
論文で見る
スコープス (13)
パブコメ
クロス
グーグル奨学生
Wen Y.
Wang C.
Gu J.
Yu C.
Wang K.
スン X.
Sun Y.
Wu H.
Tong Y.
Xia Q.
Kong X.
オステオポンチンによるアセトアミノフェン誘発肝毒性の代謝調節。
Cell. Mol. Immunol. 2019; 16: 483-494
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
ダン W.B.
ブロードハーストD.
ベグリーP.
ゼレーナ E.
フランシス・マッキンタイア S.
アンダーソン N.
ブラウン M.
ノウルズ J.D.
ハルソール A.
ハセルデン J.N.
他
ガスクロマトグラフおよび液体クロマトグラフ質量分析計を用いた血清および血漿の大規模代謝プロファイリング手順。
Nat. Protoc. 2011; 6: 1060-1083
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
マクギル M.R.
ジェームス L.P.
マッカロー S.S.
モラン J.H.
マシューズ S.E.
ピーターソン E.C.
フレミング D.P.
トライポッド M.E.
バスケス J.H.
ケノン-マクギルS.
他
代償性肝硬変患者におけるアセトアミノフェンの反復使用の短期的安全性。
Hepatol. Commun. 2022; 6: 361-373
論文で見る
スコパス (4)
PubMed
クロス
グーグル奨学生
チェン B.
Ren Y.
ニウ X.
Wang W.
Wang S.
Tu Y.
Liu S.
Wang J.
Yang D.
Liao G.
Chen J.
プログラム細胞死-1/プログラム細胞死-リガンド1相互作用を標的とした新規レゾルシノールジベンジルエーテルの抗がん剤としての可能性の発見。
J. Med. Chem. 2020; 63: 8338-8358
論文で見る
スコープス (46)
PubMed
クロス
グーグル奨学生
He F.
Bi H.C.
Xie Z.Y.
Zuo Z.
Li J.K.
Li X.
Zhao L.Z.
Chen X.
Huang M.
液体クロマトグラフィー/質量分析法によるヒト肝ミクロソーム中の複数のチトクロームP450プローブ基質から6種類の代謝物の迅速測定:テルペノイドのハイスループット阻害スクリーニングへの応用。
Rapid Commun. Mass Spectrom. 2007; 21: 635-643
論文で見る
スコープス (93)
PubMed
クロス
グーグル奨学生
論文情報
出版履歴
出版 2023年12月5日
受理 受理:2023年11月8日
改訂版受理 2023年10月10日
受理:2023年10月10日 受理:2023年7月20日
識別
DOI: https://doi.org/10.1016/j.chom.2023.11.006
著作権
© 2023 Elsevier Inc.
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
図サムネイルgr1
図1APAP誘発ALFに対するマグネシウム経口投与の有益な効果は腸内細菌叢と関連していた。
図2マグネシウムの経口摂取
図2マグネシウム経口摂取によるヒト腸内細菌叢の適応的変化は急性肝不全に対する保護効果を発揮する
図サムネイルgr3
図3ヒトおよびマウスにおけるマグネシウム経口投与後のビフィズス菌の濃縮
図サムネイルgr4
図4マグネシウムはI3Cの生成を促進することでビフィズス菌の代謝を調節した
図サムネイルgr5
図5I3CはCYP2E1活性の不活性化により反応性中間体の生成を抑制した
図サムネイルgr6
図6マグネシウムの経口投与はブタのAPAP誘発ALFを予防した
関連記事
広告
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
セルレポーツ・メソッド
セルレポート 物理科学
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
ヘリオン
免疫
アイサイエンス
ジュール
物質
医学
分子細胞
ニューロン
一つの地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理ジャーナル
生物物理学レポート
EBioMedicine
HGGアドバンス
分子植物
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
著者
論文投稿
複数ジャーナルへの投稿
STARメソッド
プレビュー - プレプリント
査読者
査読者向け情報
ニュース&イベント
ニュースルーム
細胞シンポジウム
コンソーシアムハブ
ウェビナー
ラボリンク
マルチメディア
セルプレスポッドキャスト
セルプレスビデオ
カラーリングとコミック
フィギュア360
セル画ショー
研究篇
セルプレスについて
セルプレスについて
オープンアクセス
COVIDハブ
持続可能性
インクルージョンと多様性
コンタクト
お問い合わせ
ヘルプ&サポート
採用情報
セルプレス採用情報
サイエンティフィックジョブボード
アクセス
登録する
請求
今すぐ読む
司書に推薦する
出版アラート
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
Nucleusコレクション
スナップショット・アーカイブ
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
プライバシーポリシー
ご利用条件
アクセシビリティ
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ Copyright © 2024 Elsevier Inc.、そのライセンサー、および寄稿者。
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
