
がんと妊娠におけるマクロファージの可塑性と機能
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
20
総閲覧数
7
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは2
レビュー記事
Front. 免疫学、2024年1月11日
Sec.免疫寛容とその制御
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1333549
この論文は次の研究テーマの一部です
子宮微小環境とその免疫細胞の生物学と病理学
全4記事を見る
がんと妊娠におけるマクロファージの可塑性と機能
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1333549/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit
Tingxuan Yin1 Xinyi Li1 Yanhong Li1 Xingxing Zang2 Lu Liu1* Meirong Du1*
1復旦大学上海医科大学産婦人科病院女性生殖内分泌関連疾患上海重点実験室生殖免疫学研究室(中国、上海市
2アルバート・アインシュタイン医科大学微生物学・免疫学教室、ブロンクス、ニューヨーク州、アメリカ合衆国
生命の土壌である子宮の免疫微小環境の構成と形成過程は、探求する価値がある。マクロファージは自然免疫系の不可欠な構成要素であり、炎症と組織リモデリングの重要なメディエーターでもある。マクロファージ亜集団の不均一性についての最近の洞察は、生理的および病理学的環境におけるマクロファージの機能的多様性への関心を新たにした。マクロファージは顕著な可塑性を示し、ある表現型から別の表現型へと切り替わる。本質的な可塑性により、組織マクロファージは、がんや妊娠など、変化する組織の状況に応じて様々な機能を発揮することができる。マクロファージは、免疫調節と新生血管形成によって機能的に特徴づけられる腫瘍や半同種の胎児を攻撃したり保護したりするという二律背反的な役割を果たすことから、その驚くべき多様性と可塑性は、特に興味深い細胞である。ここでは、悪性腫瘍や妊娠合併症に対する新たな治療戦略の可能性をもたらすかもしれないマクロファージのアイデンティティと機能の不均一性、およびそのメカニズムに関する最近の研究から得られた情報をもとに、起源、表現型、分化、対応する微小環境における重要な役割など、これら2つの環境におけるマクロファージの生物学的性質に関する新たな視点について概説し、比較した。
1 はじめに
マクロファージは自然免疫系の単核食細胞のサブセットである。多機能な免疫集団として、炎症や宿主防御において中心的な役割を果たすだけでなく、広範な末梢組織において恒常性維持機能を発揮する。驚くべきことに、マクロファージはヒトの造血細胞の中で最も可塑的で多様な細胞のひとつであり、ヒトのほぼすべての疾患に関与している。局所の組織では、微小環境の手がかりが、周囲の恒常的な必要性に応じてマクロファージを形態的・機能的に形成し、マクロファージの組織特異的な機能に深い刻印を残す。
胚が着床し発育する場所として、母体-胎児界面は非常にダイナミックで多機能であり、半同質の胎児に対する免疫寛容、病原体に対する防御、組織のリモデリングの両方を必要とする恒常的な環境を維持する。母体と胎児の境界面では、マクロファージは妊娠の全期間にわたって存在し、そこで様々な生物学的プロセスにダイナミックに関与しており、その中には脱子葉、絨毛浸潤、血管新生、分娩、分娩後の子宮収縮などが含まれる(1)。同様に、がんにおいても、腫瘍の発生、進行、転移に伴って、マクロファージの表現型の変化や機能の偏りが起こる(2)。元来、慢性炎症過程の中心的存在である活性化マクロファージは、老化した上皮細胞の排除と腫瘍組織の破壊を媒介し、その後の発癌を促進する(3)。その後、腫瘍が形成されると、がん細胞産物は近隣のマクロファージを、古典的な活性化状態から、栄養、免疫調節、血管新生を促進する表現型へと変化させ、腫瘍の脱出を促進する(4)。
今から30年前にさかのぼるが、一部の研究者は、血色胎盤の貫通性が、浸潤性の高い腫瘍で観察される現象を模倣しており、両者とも低酸素環境と豊富な免疫細胞を伴っていることに気づいた(5, 6)。実際、一種の万能な免疫成分であるマクロファージは、その極めて高い可塑性と多様性によって、免疫寛容と新生血管の形成に大きく貢献している(7)。しかし、両者の類似性を明らかにする研究はまだ少ない(5, 7, 8)。系統追跡、シングルセル・マルチオミクス、形態学的・分子生物学的解析を組み合わせた最近の研究では、腫瘍発生のような病的過程と妊娠のような生理的状態の両方の様々な側面を媒介する多様なマクロファージ集団の本質的な役割とメカニズムが明らかにされている(9-11)。この総説では、がんと妊娠の両方におけるマクロファージの表現型の多様性と分化を制御する因子について述べ、マクロファージが免疫調節能と血管新生能を発揮する具体的なメカニズムを比較した。
2 腫瘍と子宮頸部の微小環境
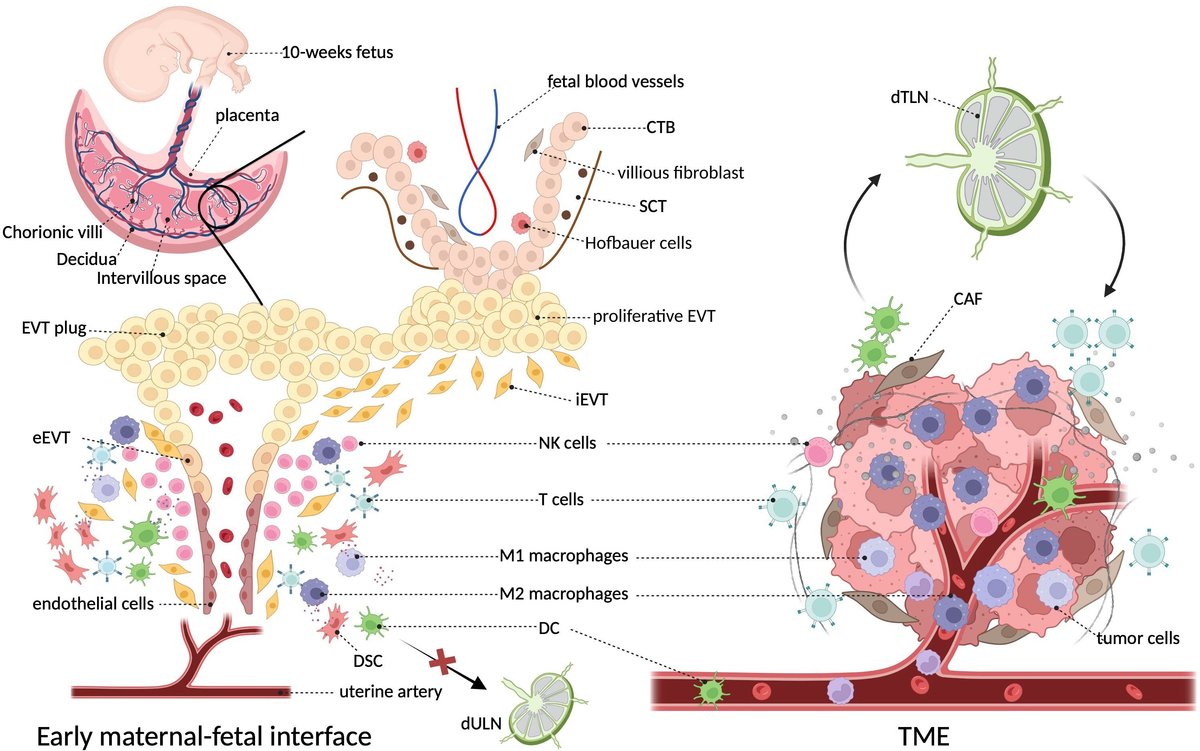
母体と胎児の境界面は、胎児由来の胎盤と母体由来の絨毛で構成されており、その適切な定着が妊娠の成功を保証している。胚の着床によりよく適応するために、母体側では子宮内膜間質細胞(ESCs)が増殖を始め、大きく丸く、細胞質に富み、多核を持つ十二指腸間質細胞(DSCs)に分化する。胚が着床すると、胎児側では胚盤胞の最外層が細胞栄養芽細胞(CTB)に変化し、その後、一連の絨毛分化を経て、多核化した合胞体栄養芽細胞(SCT)と浸潤性絨毛外細胞栄養芽細胞(EVT)を生成する。SCTは絨毛絨毛の外側を覆う細胞であり、母体の腺分泌物や母体末梢血で満たされた絨毛間隙に流入する母体血液と直接接触する。一方、EVTは脱落絨毛と接触し、局所のリンパ管、静脈、腺に浸潤し、胎盤の構築と胎児の発育に関与する(14, 15)。アンカリング絨毛(十二指腸に接している絨毛の遠位先端)に由来する増殖性EVTは、十二指腸に移動し、相反する方向に向かって2つの分化経路を経験する: 間質性EVTは十二指腸間質を横切って、子宮壁の筋層まで母体のらせん動脈に向かって侵入し、一方、血管内性EVTは動脈を逆行性に移動して栓を形成し、血液が絨毛間腔に入るのを防ぎ、内皮細胞に取って代わる(16)。胎盤が組織栄養から血液栄養に切り替わる妊娠10週目には、EVTの栓は溶解し、胎児に豊富な血液を供給する(17)。
妊娠初期には、十二指腸免疫細胞は胎児由来細胞の侵入を容認し、抗炎症ネットワークを形成して血管新生促進性サイトカインを放出することにより、胎盤の初期発育と血管新生の過程に協力する(18)。この時期、十二指腸細胞の40%までは白血球であり、ナチュラルキラー(NK)細胞が約70%と最も多く、次いで十二指腸マクロファージ(dMφ、20〜25%)、T細胞(3〜10%)、樹状細胞(DC)、B細胞が続く(18)。これらのうちdMφは、らせん動脈のリモデリング、絨毛芽細胞の浸潤促進、アポトーシス細胞の除去、正規の抗菌機能、免疫寛容微小環境の構築の補助など、重要な機能を果たしている(19)。
腫瘍微小環境(TME)は、栄養不足と酸素不足を特徴とする独特の環境で、腫瘍細胞、細胞外マトリックス、間質細胞(線維芽細胞、間葉系間質細胞、周皮細胞、脂肪細胞、血液、リンパ管など)、免疫細胞(Tリンパ球、Bリンパ球、DC、NK細胞、単球、マクロファージなど)を含んでいる(20)。デシデュアと同様に、腫瘍に関連したサイトカインやケモカイン、成長因子、代謝産物のダイナミックなネットワークが、腫瘍の抑制と促進のバランスをとっている(5)。TME内で最も豊富な免疫集団である腫瘍関連マクロファージ(TAM)は、一部の固形新生物の最大50%を占め、予後不良と関連する可塑的で不均一な細胞集団を構成している(21)。TAMは、腫瘍の発生と促進、転移とコロニー形成、免疫回避、血管新生、細胞外マトリックスのリモデリングなど、様々な原腫瘍活性を発揮することが証明されている(22)。重要なことは、TAMはその本質的な可塑性により、腫瘍の進行や治療上の挑戦の過程で起こる周囲の擾乱に迅速に対応できることである。さらに、TAMは血液供給が乏しい低酸素状態のTME環境下で濃縮されることを好み、血管新生作用を持つ分子や酵素を産生することによって腫瘍血管系の形成に寄与する(23)
初期の母体-胎児境界面は、腫瘍細胞と絨毛芽細胞を中心として、細胞外マトリックス(ECM)、間質細胞、および免疫成分が取り囲む構造構成という点で、TMEと顕著に類似しており、両者とも異常な脈管性を有していることが認識できる。しかし、腫瘍の免疫環境ではTAMが支配的であるのに対し、母体と胎児の境界面では十二指腸NK細胞が主導的であるため、様々な免疫細胞の割合は2つの環境間で一貫していない。腫瘍と腫瘍排出リンパ節(TdLN)の密接な関係とは異なり、ESCの脱分化はリンパ管の喪失をもたらし(24, 25)、子宮排出リンパ節(UdLN)へのDCの移動とホーミングを制限し、胎児を攻撃する圧倒的な免疫反応を起こしやすくする。図1は、両環境におけるこれらの微小環境の特徴を示している。
図1
www.frontiersin.org
図1 腫瘍と乳腺における免疫微小環境の構造とその周辺。斜めの枠は、マクロファージが両方の免疫微小環境の主要な構成要素であることを示している。この2つの微小環境は、腫瘍細胞/栄養芽細胞、線維芽細胞/間質細胞、内皮細胞、上皮細胞、および様々な免疫細胞を含む複数の細胞型から構成されており、マクロファージが主要な免疫構成要素を構成している(5)。子宮頸管面では、成長中の浸潤性胎児細胞が子宮頸管と直接接触し、また妊娠後期の初めにEVTプラグが侵食された後は、豊富な母体血液と接触する(16)。子宮頸管におけるNK細胞の主な役割とは異なり、がんのTMEにはマクロファージが主に浸潤する(26)。特に、腫瘍から流出した樹状細胞はリンパ節に入った後、T細胞にがん関連抗原を提示することができるが、一方、十二指腸樹状細胞はリンパ管の変性により排出リンパ節に移動することができない(25)。CTB、細胞栄養芽細胞;CAF、癌関連線維芽細胞;DSC、十二指腸間質細胞;EVT、絨毛外栄養芽細胞;SCT、滑膜栄養芽細胞;TdLN、腫瘍排出リンパ節;UdLN、子宮排出リンパ節。
3 マクロファージの起源と表現型の多様性
マクロファージは、胚発生の過程で最初に出現する免疫系であり、その正確な発生過程は広く研究されている。成体では、マクロファージは身体の様々な組織や臓器に偏在し、拡散している。長い間、マクロファージは骨髄由来の前駆細胞や血液中の単球中間体のみに由来すると考えられてきた(27, 28)。これまでのところ、マクロファージは発生段階や組織特異的な方法で、さらに別の起源を持つことが証明されている(11)。マウスのフェイトマッピング研究と単細胞解析から、組織常在マクロファージ(TRM)は、マクロファージの胚卵黄嚢前駆細胞か、胎児肝臓由来の赤血球骨髄系前駆細胞(EMP)から発生することが示されている(11)。ヒトの場合、胚は卵黄嚢由来の原始マクロファージか、卵黄嚢由来の骨髄性前駆細胞(YSMP)由来の胚性肝単球のどちらかから2波のTRMを持つが、これはマウスのEMPに相当する(29)。多様なマクロファージの発生過程の詳細を図2に示す。
図2
www.frontiersin.org
図2 マクロファージの発生と表現型分化。グラフの上半分はマウス胎児のマクロファージ発生を描いている。原始造血として知られる第一の波は、E7.5に胚外卵黄嚢の血島で直接起こり、卵黄嚢はミクログリアに分化する(11)。第二の波は、まずE8.25頃に卵黄嚢の増殖性EMPから生成され、その後胎児肝臓に到達し、そこで前駆細胞が胎児肝臓単球由来のマクロファージを産生し、多様な組織に播種し、再生能力を持つ組織常在マクロファージに分化する(11)。最後の波は造血幹細胞に依存しており、胎生期中胚葉の約E9.5から胎児造血幹細胞および前駆細胞の産生を開始し、さらに成熟するために胎児肝臓に移行する(30)。その後、造血幹細胞はE16.5までに発育中の胎児骨髄に移動してコロニーを形成し、成体になってもそこに留まり、末梢血に単球を供給する(31)。異なる色はマクロファージのそれぞれの起源を表している。下半分は伝統的なM1とM2の命名法を示しており、異なる転写因子、表現型、分泌プロファイルが関与し、複雑な外的状況に応じて異なる機能をもたらす(32)。M1マクロファージはIFN-γやLPSによって急性に刺激され、炎症因子や外敵に対する殺傷分子を分泌する(26)。活性化刺激に応じて、M2マクロファージはさらにM2a、M2b、M2c、M2dからなる4つの異なるサブセットに分けられる(33)。特に、M2a(IL-4とIL-13によって誘導される)とM2b(TLRまたはIL-1Rアゴニストによって誘導される)は免疫調節機能を発揮し、Th2応答を促進する。一方、M2cマクロファージ(IL-10によって誘導される)はアポトーシス細胞に対する抗炎症活性に関連し、M2dマクロファージ(TLRアンタゴニストによって誘導される)は腫瘍の進行を誘導する傾向がある(33, 34)。ACs、アポトーシス細胞;BM、骨髄;CXCL、ケモカイン(C-X-C)リガンド;CCL、ケモカイン(C-Cモチーフ)リガンド;EMPs、赤血球骨髄系前駆細胞;GC、グルココルチコイド;GM-CSF、顆粒球マクロファージコロニー刺激因子;造血幹細胞;HIF、低酸素誘導性転写因子;IFNg、インターフェロン-γ; iNOS、誘導性一酸化窒素合成酵素、MHC、主要組織適合性複合体、MPs、骨髄前駆細胞、M-CSF、マクロファージ刺激因子、PPARγ、ペルオキシソーム増殖因子活性化受容体γ、TLR、Toll様受容体、TNF-α、腫瘍壊死因子α、TGF-β、トランスフォーミング増殖因子β、Ym1/2、Ym1およびYm2。
腫瘍では、TAMは基本的に2つの起源からなる:既存のTRMと循環している骨髄由来マクロファージ(BMDM)である(35)。単球関連MDSCs(M-MDSCs)は現在、TAMsの主な循環前駆体として知られており、広範な炎症性シグナルによって誘導されて腫瘍体に浸潤し、低酸素症のような極度の生存条件に影響される(36)。TAMsのリクルートと集積を媒介するリガンド/レセプター軸には、主にマクロファージコロニー刺激因子/コロニー刺激因子1レセプター(M-CSF/CSF-1R)、CCL2/CCR2、CX3CL1/CX3CR1、CCL3/CCR1、CCL3/CCR5、CCL5/CCR5、血管内皮増殖因子-A/血管内皮増殖因子レセプター1(VEGF-A/VEGFR1)などがある(37)。生理的状態と比較して、腫瘍は肺癌、神経膠芽腫、肝細胞癌のようにTRMの有意に高い増殖を特徴とする(35)。異なる起源のTAMが腫瘍内に共存し、異なる起源のTAMが特定のTME内で異なる機能を示すことを示唆する証拠がある(35)。しかし、最近の研究では、異なるニッチが、がん種、組織、および病期特異的な方法でTAMの活性化プロファイリングを指示することが示唆されており、TAM集団の教育における起源よりもむしろ特定のTMEの決定的な役割が強調されている(38)。
TAMと比べると、dMφの起源に関する証拠は乏しい(30)。月経中、古典的な単球に由来するマクロファージが分泌子宮内膜に流入し、マクロファージ由来のサイトカインやプロテアーゼが増加する(31)。受精後18日目に、胎児由来のマクロファージ群が絨毛板に出現し、後に胎盤の絨毛に移動する。これはホフバウアー細胞(ヒトではCD14+HLA-DR-FOLR2+、マウスではCD11bloF4/80hiCX3CR1hi)と呼ばれる(39)。母体由来の十二指腸マクロファージ(ヒト、CD14+HLA-DRhi;マウス、CD11bhiF4/80lo)は、造血幹細胞由来細胞によって母体循環から補充され、妊娠期間中、基礎十分に存在する(39)。これら2つの集団は、それぞれ母体と胎児の界面に存在するマクロファージの70%と30%を占めている(40)。CSF-1とCX3CR1は、血管から子宮への単球の血管外遊出を制御することが報告されている(31, 41)。自己複製能を持つdMφの特異的なクラスターは、母体の胎生期から存在し、その後の循環単球よりも、妊娠中のデシドゥアで恒常的な役割を果たす可能性が高い(41)。
ダイナミックなTAMの表現型は、癌の転帰に影響しうる様々な機能を駆動する。長い間、マクロファージは2つの異なるサブセットM1とM2に分類され、前者は宿主を守るために病原体と闘うのに優れ、後者は免疫調節や腫瘍促進活性に関連すると考えられてきた(26, 32)。図2は、現在のM1/M2の命名法を示したもので、異なる転写因子、表現型、分泌プロファイルが関与し、複雑な外的状況に応じて異なる機能をもたらす。しかしながら、M2様マクロファージは、がん特異的なマクロファージとみなされるべきではなく、ましてやTAMとみなされるべきではなく(26)、むしろ表現型の高い異種性(現在のところ4つのサブセットと考えられている)を示し、免疫、組織恒常性、代謝の接点で機能を制御する、別の活性化状態を示すことに注意すべきである(33, 34, 42)。実際、M2様マクロファージは、健康な生体ではどのような免疫応答の後にも発生し、組織のリモデリングを開始し、炎症を解消する。癌では、M2状態に移行したマクロファージが腫瘍の進行のために乗っ取られる(43)。従って、この二極化モデルでは、TMEにおける環境シグナルによって引き起こされる適応が、静的なものではなく柔軟なものであることを無視しており、TAMの複雑な活性化と異質性を読み解くことはできない(44)。いくつかの大規模なトランスクリプトーム研究に支えられ、「多機能ナイフ」というモデルが広く受け入れられ始め、TAMsは過渡的な中間状態に存在し、並外れた可塑性と幅広い活性化・機能状態と一致していることが示された(10)。最近、特定の機能を持つTAMsサブセット(45-48)がいくつか同定され、表1にリストアップされている。
表1
www.frontiersin.org
表1 TAMsとdMφの最近の分類の要約。
dMφは機能的、量的可塑性を持ち、環境の変化に著しく適応する(55)。最初に、精漿が着床周囲の子宮でM1骨格を持つマクロファージの増加を含む本質的な炎症環境を引き起こす(56)。EVTが子宮内膜に付着し、脱落膜に浸潤すると、M1/M2マクロファージの混合プロファイルに移行する(14)。M2が主体の表現型は、子宮血管のリモデリングとともに徐々に形成され、第2期の初めには胎盤の発育が完了する(57)。これらのM2様dMφは、半奇胎に対する免疫寛容を促進し、分娩まで胎児の成長を守る。最後に、分娩時のM1 dMφの急増は、炎症性サイトカインの流出とともに、分娩の引き金となる重要な役割を示唆している(58)。DMφは優れた可塑性を示し、栄養状態、喫煙習慣、炎症状態、生理的ストレスなど、微小環境の小さな変化に敏感である。マクロファージの不適切な可塑性は、それが起こるたびに妊娠転帰に悪影響を及ぼし、不妊症、反復性妊娠喪失症(RPL;2回以上の連続妊娠喪失と定義)、子癇前症[PE;高血圧(≧140/90mmHg)および/または蛋白尿(≧0. 3g/L)]、胎児発育制限(FGR;胎児が生物学的に期待される発育に達しないことと定義される)、早産などがある(59)。過去数十年の間に、科学者たちはdMφのサブグループを同定し、健康な妊娠の維持に関連するdMφの表現型を確認する努力をしてきた(49-54, 60)。
4 マクロファージの表現型と機能を制御する因子
4.1 代謝リプログラミング
4.1.1 低酸素症
酸素の利用可能性が制限されると、腫瘍細胞は代謝的適応を受け、好気的解糖を高速で開始する能力を獲得し、栄養不足のTMEを生成する(61)。このような状況において、TAMの状態や表現型は腫瘍組織の酸素化の格差によって調整され、腫瘍細胞は栄養欠乏を克服し、TMEをよりホスピタリティの高い部位に変えることができる(2)。より具体的には、M2細胞は低酸素、壊死、血管周囲の腫瘍部位に存在する傾向があり、抗腫瘍性炎症を抑制するのに対し、M1細胞は正常酸素領域に集中する(62)。低酸素状態では、腫瘍壊死因子α(TNF-α)、IL-1β、誘導性一酸化窒素合成酵素(iNOS)などの炎症性マーカーと、IL-10やアルギナーゼ1(ARG1)などの抗炎症性マーカーの両方が産生されるが、TAMは主にM2様表現型に移行する(63)。低酸素が誘導する化学誘引物質の放出によってTAMの腫瘍部位へのホーミングが促進されるだけでなく、低酸素はTAM上の主要組織適合性複合体II(MHC-II)の発現レベルを微調整し、腫瘍特異的抗原の「免疫的不可視化」を誘導する。
固形腫瘍の低酸素ニッチ(0.1%~5%O2)に位置するTME(64)と比較すると、胎盤全体の低酸素レベルはより緩やかである。胎盤の灌流が完全に確立される第1期(2%-3%)および第2期(8%-10%)の間、絨毛領域のO2レベルは劇的に変化するが、デシドゥアのO2レベル(5%-6%)は妊娠初期に比較的一定に保たれ、これは妊娠していない子宮と同程度である(39, 65)。子宮動脈の近くに位置する部位は、豊富な酸素供給(最大10%~14%O2)を浴びてさえいる(39)。このように、低酸素はTAMに比べてdMφの表現型変換にあまり影響を与えないようである。それでもなお、胎盤の繁栄には適切な程度の低酸素が不可欠である(5)。初期段階では、低酸素は末梢NK細胞の子宮へのホーミングを助け、ホフバウアー細胞前駆細胞の正常な膨張と発達を促進する(66)。PEやRPLのようにdMφの機能不全が見られる妊娠合併症では、子宮螺旋動脈のリモデリング不全や子宮卵管虚血が極度の低酸素症を引き起こすことから(67)、dMφの分化と機能には酸素濃度の絶妙なバランスが重要であることが示唆される。
4.1.2 乳酸
乳酸(LA)は、酸素欠乏条件下で、解糖と乳酸脱水素酵素(LDH)によるピルビン酸の変換によってグルコースから産生される代謝産物である(68)。極度の低酸素状態のTMEでは、腫瘍由来のLAが介在するグルコース制限と低pHが、高レベルのVEGFとARG1、脂肪酸酸化(FAO)のアップレギュレーション、および抗原提示能の弱さとともに、解糖能の乏しいM2様プロファイルを誘導する(69)。LAレベルを調節することで、M2-TAMサブセットを再分布し、PD-L1をアップレギュレートして、T細胞のアポトーシスを誘導することで腫瘍の免疫逃避を助けることも報告されている(70)。
母体と胎児の界面では、栄養芽細胞とDSCsが、特に着床周辺期と脱子葉期に、LAの主要な供給源となる(68)。腫瘍とは異なり、絨毛由来のLAは、酸素とLAの濃度に応じてマクロファージの分極を制御するという二重の役割を果たす(71)。正常酸素下では、軽い絨毛由来のLAは、低酸素誘導性転写因子-1α(HIF-1α)とは無関係に、ミトコンドリアの酸化的リン酸化(OXPHOS)とVEGF発現をアップレギュレートすることによって、マクロファージのM2表現型への極性化を促進する。一方、低酸素下では、膨大な絨毛由来のLAは、HIF-1α/SRC/LDHA経路を介する解糖とiNOSのアップレギュレートによって、M1表現型の極性化を促進する(71)。臨床的には、RPL患者の母体-胎児微小環境は、LA蓄積の亢進と低酸素の亢進によって特徴づけられることから、dMφの表現型と機能を抑制することにより、グルコース代謝が治療標的となりうることが示唆される(72)。
4.1.3 アミノ酸代謝
ヒトおよびマウスのTMEのマクロファージは、非必須アミノ酸の獲得に必死であるため、免疫細胞の最適なエフェクター機能に必要なアミノ酸の局所環境を枯渇させ、免疫サーベイランスを阻害する(73)。中でもアルギニン代謝は重要な調節因子である(73)。腫瘍が低酸素状態になると、iNOSよりもArg1の異化が優先され、その結果、M2様分極が進み、TMEへの腫瘍支持因子が上昇する(74)。
さらに、局所微小環境中のトリプトファン(Trp)とその副産物であるキヌレニン(Kyn)の濃度もマクロファージの極性化に寄与する(75)。Trpを消費する酵素インドールアミン2,3-ジオキシゲナーゼ(IDO)はTAMやdMφに高発現し、NK細胞やT細胞の機能低下を引き起こす(43, 44)。Trpの欠乏に加えて、免疫抑制性Kynはリガンド活性化転写因子であるアリール炭化水素受容体(AHR)と相互作用し、Tregや寛容原性骨髄系細胞の生成を促し、CD8+T細胞ではAnti-programmed cell death 1(PD-1)をアップレギュレートし、M2様マクロファージ活性を調節する(76)。IDOの遮断は、マクロファージのリクルートと貪食を減少させ、マクロファージをM1様表現型に切り替えることができる(76)。一方、IDO阻害剤である1-メチル-D-トリプトファンを妊娠初期に投与すると、明らかな子宮の炎症が起こり、胎児が死亡する(77)。
4.1.4 その他の代謝産物
最近報告されたように、子宮上皮が産生する脂質代謝の重要な中間体であるリゾホスファチジン酸(LPA)は、dMφ内の核内受容体ペルオキシソーム増殖剤活性化受容体γ(PPARγ)と結合し、M2分化遺伝子の転写を誘導し、絨毛芽細胞の浸潤と胎盤の発達を促進するデシデュア常在マクロファージの蓄積を促進する(65)。これと同様に、絨毛十二指腸におけるLPAレセプターの低発現は、早期RPLのリスクと関連することが臨床観察から判明した。これに加えて、卵巣癌においても、TAMの形成と分極に対するLPAの作用が報告されている(78)。
さらに、絨毛細胞やDSC、妊娠関連ホルモンのような母体-胎児界面特有の構成要素があるため、TMEが関与しない、dMφを寛容な表現型に向かわせる明確なメカニズムが存在する可能性がある。例えば、子宮脱落時の重要なグルコース代謝産物であるフルクトース-1,6-ビスリン酸(FBP)は、DSCからのIL-27の分泌を増加させ、M2様dMφの分化を誘導し、炎症分子の産生を抑制することが分かっている(79)。RPL患者のデシドゥアと血漿で観察されるFBPのレベルが低いことから(79)、FBPの補充は、IL-27をトリガーとするM2様マクロファージを標的とすることで、胎児死亡を予防する有望な戦略となりうる。
4.2 エピジェネティック制御
エピジェネティック制御は、マクロファージの分化と機能的プログラミングを修飾することによって、TMEにおける多様な刺激に応答したマクロファージにおける転写の活性化と不活性化のための非常に柔軟なメカニズムを提供し、可塑性の基礎として作用する。まず、DNAメチル化である。DNAメチル化酵素(DNMT)がマクロファージの表現型形成に特異的な影響を及ぼすという証拠がいくつかある。植物ホメオドメイン(PHD)とリングフィンガードメイン1を含むユビキチン様タンパク質(UHRF1)は、DNMT1をリクルートすることによってDNAのメチル化状態を維持する(80)。最近の研究で、絨毛細胞でUHRF1が減少すると、炎症性IL-1βの発現が促進され、単球をデシドアに集め、M1表現型に移行させ、RPLをさらに悪化させることがわかった(80)。癌では、DNAメチル化は癌抑制遺伝子の発現抑制に重要であり、一方、メチル基の除去によるDNAメチル化の消失は癌遺伝子の過剰発現につながる。例えば、脱メチル化酵素ten-eleven転座2(TET2)の発現は、IL-1R-MyD88経路依存的にメラノーマのTAMで増加する(81)。
第二に、ヒストンのメチル化とアセチル化もマクロファージのエピジェネティック制御に関与している。腫瘍では、ヒストン脱アセチル化酵素(HDAC)クラスI(HDAC3)がM2活性化の中心であるのに対し、HDACクラスII(HDAC4、5、6、7)は主にM1サブグループを標的としている(44)。Enhancer of zeste homolog 2 (EZH2)は、ポリコンブ抑制複合体2 (PRC2)の酵素サブユニットであり、ヒストンH3のリジン27をトリメチル化(H3K27me3)し、遺伝子の転写抑制とクロマチンコンパクションを仲介する(82)。大腸癌(CRC)のような様々な悪性腫瘍におけるEZH2の抑制は、STAT3のプロモーター上のH3K27me3レベルを減少させることにより、TAMをM1表現型にシフトさせることが報告されており(83)、これは腫瘍治療にとって有益である一方、EZH2の有意な発現低下は、RPLのような不利な妊娠転帰と関連することが見出されている(84)。予想通り、絨毛細胞におけるEZH2の阻害は、トランスフォーミング増殖因子β(TGF-β)、IL-10、IL-6、IL-4、CXCL-16、PD-L1の産生を減少させることにより、マクロファージの表現型分化を阻害し、M2様をM1様dMφに変化させた(84)。さらに、HDAC8の発現低下は、dMφにおけるCD163のようなM2マーカー遺伝子のレベルをダウンレギュレートし、これは免疫寛容を乱し、母体-胎児界面での炎症反応を誘導し、RPLに関連すると考えられる(85)。
さらに、ノンコーディングRNAはマクロファージに対するもう一つの修飾である。100を超えるマイクロRNA(miRNA)がマクロファージの分極と機能に影響を与え、複雑な転写後制御ネットワークを形成していることを示す証拠は多い(86)。例えば腫瘍では、miRNAはmiR-155、miR-181、miR-451を介してM1表現型に、あるいはmiR-99a、miR-146a、miR-125a、miR-145-5pを介してM2表現型にTAMの極性を制御する(73)。dMφに関しては、miR-19a-3pとmiR-130b-3p、miR-10a-5pとmiR-150-5pがM1マーカー遺伝子の発現を抑制し、M2表現型マーカーの産生を増加させることが報告されている。TAMsと同様に、dMφ由来のmiR-155もまた、M1の極性化を促進する一方で、M2の状態を損ない(4)、その変化は流産やPEなどの妊娠合併症と関連している。
4.3 環境成長因子、サイトカイン、ケモカイン
癌の進行やTAMの表現型の変化における分泌分子や表面分子の役割については、まだ不十分であるが、これは特定の分子の供給源、腫瘍のタイプ、病期、宿主の全身免疫の不均一性によって形成されるTAMの可塑性によって説明できる。デクチン1(87、88)やCCL2/MCP-1軸(89)のように、ある分子が特定の微小環境やマクロファージのサブグループに応じて、マクロファージの分極を制御する多様な機能を発揮する可能性がある。腫瘍や妊娠におけるマクロファージ分極に関与する様々な重要な調節因子を考慮すると、ターゲティングはマクロファージ分極の切り替えや調節に役立ち、おそらく免疫療法を促進する可能性がある。表2は、現在報告されている環境因子が腫瘍および子宮頸管からのマクロファージの分極に及ぼす影響をまとめたものである(90-94, 96-106)。
表2
www.frontiersin.org
表2 マクロファージの極性化と表現型に影響を及ぼす様々な環境因子。
5 免疫寛容におけるマクロファージの機能
5.1 腫瘍免疫逃避におけるTAM
5.1.1 TAMと間質細胞との相互作用
TMEに最も多く存在する間質細胞として、がん関連線維芽細胞(CAF)は、IL-6、M-CSF、単球走化性タンパク質-1(MCP-1、またはCCL2)、間質細胞由来因子1(SDF-1、またはCXCL12)などの複数の制御分子を分泌することにより、単球のリクルートとM2表現型への転換を促進する(107)。さらに重要なことは、CAFはPD-1の高発現など、TAMの免疫抑制特性を動機づけることができるということである(45)。相互に、M2様TAMはCAFの活性化と進行を制御し、EMTプロセスを促進する。その結果、CAFとTAMの間に正のループが形成され、共に腫瘍の回避と生存を促進する(107)。
5.1.2 TAMは他の免疫細胞の機能を制御する
TAMは細胞傷害性免疫細胞の反応を直接阻害することができる。第一に、TAMは、TGF-βやIL-10などの抑制性サイトカインに依存した形で、抗腫瘍性細胞傷害性Tリンパ球(CTL)やCD4+ Th1細胞を寛容なTh2細胞、Th17細胞、Tregs細胞へと逆転させることにより、T細胞の表現型や機能分化に影響を与える(36)。TAMはまた、PD-L1/L2やCD80/86などの免疫チェックポイントを発現し、T細胞上に構成的に発現する受容体(PD-1/細胞傷害性Tリンパ球関連タンパク質4(CTLA-4))に結合して、活性化された抗腫瘍T細胞の機能を直接抑制することによって、腫瘍免疫微小環境(TIME)の形成にも関与している(36)。その後、Th2細胞がIL-4、IL-5、IL-10を分泌してM2マクロファージを誘導することにより、Th細胞はマクロファージの分極方向を変化させることによって、腫瘍TMEをリモデリングする(44)。加えて、TAMは可溶性メディエーターのクロストークと細胞間コンタクトの両方を通じて、腫瘍に関連したNK細胞の働きを弱める重要な仲介的役割を担っている。ヒト白血球抗原-G(HLA-G)およびヒト白血球抗原-E(HLA-E)のような抑制分子を保有するTAMは、それぞれILT2およびNKG2のような共抑制シグナル分子を介してNK/T細胞と相互作用する(108)。直接的な接触に加えて、TAMによるIL-10とTGF-βの分泌もまた、NK細胞を免疫抑制状態へと教育する(109)。先に述べたように、代謝産物(L-アルギニンやTrpなど)の枯渇など、TAMが介在する代謝活動もまた、Treg活性を促進し、CTL増殖とインターフェロン-γ(IFN-γ)産生の両方を障害するため、免疫抑制的TMEに関与する(61)。さらに、TAMが放出するIL-10は、腫瘍内の従来型DCによるIL-12の発現を抑制し、その結果CTL応答が低下する(36)。
TAMはまた、免疫抑制性集団をリクルートし、正のフィードバックループを構築して互いの拡大を促進し、抑制性TIMEを強化する。TAMは、Treg細胞上のCCR8とCCR4のそれぞれのリガンドであるCCL22とCCL1を介して、ヒトがんへのTreg細胞のリクルートを促進することが示されている(23)。腫瘍が進行する段階では、TAMはIDO1とCXCL10を大量に分泌し、周囲のTreg細胞を惹きつける(36)。その結果、TMEからのTreg細胞は、TAMによるIL-10、TGF-β、CD73の産生を刺激し、PD-L1のような負の共抑制分子の発現をオートクライン的に増加させ、後にエフェクターT細胞に結合して抗腫瘍活性を抑制する(110)。
TAMは腫瘍免疫において非従来型T細胞とも相互作用するが、すべてが免疫抑制につながるわけではない。非通常型ナチュラルキラーT細胞(iNKT)は、CD40/Fas依存的にM2様TAMを直接抑制し、M1様マクロファージの生存を促進することで、トランスジェニックマウスモデルにおいて前立腺がんを弱らせることがわかった(111)。さらに、TCRαβ+CD4-CD8-NK1.1-自然型αβT細胞(iαβT)は、抗原提示とT細胞の化学誘引を高めながら、CCR5依存的にマクロファージのM1様炎症性リプログラミングを促進し、腫瘍に対するCD4+およびCD8+細胞傷害性T細胞を改善する(112)。上述したように、γδ-T細胞はCCR2+TAMに刺激されてIL-17を分泌し、転移促進反応を組織化することができる(113)。
5.1.3 TAMと腫瘍細胞との相互作用
悪性腫瘍細胞は免疫監視を回避し、免疫反応を「冷やす」ように誘導されることが一般的である(114)。この場合、腫瘍が免疫監視を回避するもう一つの重要な基本メカニズムは、腫瘍細胞に乗っ取られ操作されているTAMが、寛容なTMEを確立することを好むことである。初めに、腫瘍細胞はCD47、β2M、CD24のような自己標識を高発現し、ITIMをリン酸化してマクロファージの貪食機能をダウンレギュレートすることができる(63)。さらに、腫瘍細胞は多くのサイトカインやケモカインを産生し、TAM表面のレセプターに結合して、関連する免疫抑制遺伝子の発現を制御する。こうして操作されたTAMは、IL-2、IL-12、TNF-α、IFN-γのような細胞傷害性因子の放出を阻害する一方で、CCL18、IL-10、TGF-βを含む様々な腫瘍促進因子の分泌を増加させ、他の免疫成分の抗腫瘍能力を阻害し、腫瘍の生存期間を延長させる(115)。
5.1.4 TAMに関与する免疫チェックポイント分子
TAMはTMEにおける免疫チェックポイント分子の主要な供給源である。PD-1/PD-L1およびCTLA-4/CD86に加えて、TAMはIDO/AHR、T細胞免疫グロブリンおよびムチンドメインタンパク質3(Tim-3)/ガレクチン-9、Fas/Fas-Lなどの他の免疫チェックポイントとともに免疫逃避を誘導することができる(44)。最近の研究で、PTEN(Phosphatase and tensin homolog)欠損の膠芽腫(GBM)細胞は、AKT-GSK3β-IRF1経路を介してガレクチン-9を大量に分泌し、これがTim-3を活性化することによってM2偏極を促進することが見いだされた(116)。Suらは、PD-L1とIDOを過剰発現することで抗体依存性細胞貪食を受けるマクロファージが、NK細胞とT細胞を介する細胞傷害性の両方を阻害することで、予想外の免疫抑制効果を示すことを明らかにした(117)。臨床的には、ヒト癌のTAM上のPD-1発現は、病期が進むにつれて上昇し、TAMの増殖と活性化をダウンレギュレートし、腫瘍細胞の逃避を加速する(118)。
5.2 母体と胎児の境界における免疫寛容のDMφ
5.2.1 dMφとデシデュア間質のクロストーク
デシデュアで最大の集団であるDSCsは、プロラクチンなどのホルモンを産生するだけでなく、サイトカインやケモカインを介して局所の免疫学的微小環境を形成することによっても、妊娠の成功維持に重要である(30)。最初に、DSCsはCD14+血液由来単球の生存を促進し、それらをCD14brightCD163+CD209+CD86dim表現型に誘導し、主にM-CSFとTGF-βシグナルを介してdMφの拡大と表現型転換を引き起こす(119)。その後、DSCから分泌されるCCL2などのケモカインは、M1/M2混合免疫の状態を維持するための重要な調節因子となる(120)。DSCsが産生する成長停止特異的因子6(GAS6)もまた、dMφをM2様表現型に偏向させ、細胞増殖を誘導する(94)。正常妊娠と比較して、初期流産ではDSCsによるGAS6分泌が少ないことから、健全な妊娠の維持にはDSCsとdMφの対話が重要な役割を果たすことが示唆される(94)。同様に、アポトーシス細胞上のGAS6の同族レセプターであるTAMレセプター(Tyro3、Axl、MerTK)もTAM上に発現しており、免疫の恒常性と腫瘍の進行に関与しながら、M2様表現型に偏向している(95)。
5.2.2 dMφと栄養細胞間のクロストーク
腫瘍細胞と同様に、絨毛細胞は免疫細胞をリクルートして教育し、母体と胎児の境界において寛容な環境を確立するために、多量のシグナル伝達分子を分泌する(121)。一般に、IDO、TGF-β、IL-10、M-CSF、IL-34、IL-6、CXCL16、PD-L1などの絨毛細胞由来因子は、dMφを胎児に優しい免疫集団に形成する上で重要な役割を果たしている(122、123)。PD-1/PD-L1軸は、母体-胎児寛容を調節する表現型サブセットへのdMφの分極を調節し、この分極の阻害は胎児死亡の増加と関連することが証明されている(124)。絨毛細胞は、非クラシカルなHLAクラスIb分子であるHLA-E、HLA-F、HLA-Gをアップレギュレートする傾向があり、表面抑制レセプターCD94/NKG2A、KIR3DL1、免疫グロブリン様転写産物2および4(ILT-2/4)、KIR2DL4を介して、NK細胞、T細胞、骨髄系細胞などの免疫細胞に抑制シグナルを与える(125)。Leeらは、sHLA-G5がマクロファージをM2表現型に偏向させ、貪食活性が高く、IDO、IL-6、CXCL1の発現が増加し、T細胞の増殖と細胞傷害機能を障害し、絨毛浸潤を促進することを見出した(126)。正常妊娠中、sHLA-G5の血漿レベルは妊娠初期に上昇し、妊娠が進むにつれて徐々に低下する。妊娠初期のsHLA-Gレベルの低さは、しばしばRPL、PE、FGRなどの妊娠合併症に関係する(127)。
さらに、絨毛芽細胞の破片はマクロファージ中のサイトカインの発現を調節し、PD-L1、IDO、IL-1Ra、IL-6、IL-10のような抑制性分子の発現をアップレギュレートする一方、MHC-II分子や細胞間接着分子1(ICAM-1)のようなコスティミュレイトリー分子、IL-8やIL-1βを含む炎症性サイトカインの発現を低下させることが報告されている(14)。さらに、Mφ由来のサイトカインIL-33は、妊娠初期の胎盤の成長に重要な因子として働き、栄養芽細胞の増殖を誘導する(59)。
5.2.3 dMφと他の免疫細胞とのクロストーク
妊娠初期において、dMφは母体-胎児間の免疫寛容の制御に強い影響を及ぼす(18)。支配的なAPCとして、dMφはT細胞の活性化を制御する役割を担っている(127)。20年前、有効なT細胞の増殖に対するdMφの抑制効果は、妊娠初期に初めて報告された(128)。DMφはまた、母体の免疫エフェクター機能を制御し、胎児の拒絶反応を防ぐTreg細胞を引き寄せ、増殖を促進する(30)。
様々な免疫チェックポイントが、妊娠中の胎児抗原に対する母体の過剰な炎症反応を防いでいる。末梢血単球と比較して、十二指腸マクロファージはPD-L1/PD-1相互作用を介して、十二指腸T細胞によるTh1型サイトカインIFN-γの産生を抑制する(59)。Tim-3+のdMφサブセットは、細胞傷害性Tリンパ球の消耗やアポトーシスを誘導し、子宮頸部CD4+T細胞のTh2やTregの偏りを好む(129)。前臨床がん研究では、PD-1/Tim-3経路の同時遮断が腫瘍増殖の抑制に成功していることから、Tim-3とPD-1の共同作用が胎児にも最適な保護をもたらすかどうかは魅力的である。実際、PD-L1とGal-9の融合タンパク質の併用は、単独で介入した場合と比較して、流産、絨毛細胞浸潤、胎児血管発達のリスクを低下させるという明らかな利点を示すことが証明されており、共阻害経路の相乗効果によって妊娠転帰が改善することが示されている(130)。
妊娠中に最も多く存在する白血球として、dNK細胞は十二指腸CD14+骨髄単球系細胞と密接に接触しており、両者間のクロストークの可能性を示している。実際、dMφから分泌されるTGF-βは、胎児細胞に対するdNKの殺傷を抑制する(131)。さらに、栄養細胞からのCXCL16は、dMφにおけるIL-15の分泌を減少させる(99)。NK細胞の分化、成熟、生存を制御する重要なサイトカインとして、IL-15の減少は免疫寛容を確立するためのNK細胞傷害性を損なう(99)。dNK細胞との相互作用後、dMφはIDOを発現し、そのIDOがTGF-β産生やCTLA-4を介した相互作用を通じてTregの拡大を誘導する(132)。
5.2.4 dMφの本質的な貪食作用は炎症予防に役立つ
いずれにせよ、プロフェッショナルなAPCの一種として、マクロファージが本来持っている能力が貪食であることは無視できない。母体-胎児界面に蓄積した外来病原体や脱落した絨毛残屑は、炎症を引き起こし、細胞傷害性免疫細胞を凝集させる重要な原因となり、胎児を守るホメオスタシスを乱す可能性が高い(127)。この場合、病原体の病原体関連分子パターンか、アポトーシス細胞の損傷関連分子パターンのいずれかが、有害な炎症ストレスを防ぐために、炎症部位に十二指腸マクロファージをリクルートするのに役立つ可能性がある(133)。一方、表面のパターン認識レセプターは、これらのマクロファージを一時的にM1様表現型に逆転させることから、マクロファージが正統的な抗菌剤の役割を保持していることが示唆される(127)。興味深いことに、外来病原体によって操作されたdMφが、pro-M1あるいはpro-M2という妊娠転帰にどのような影響を及ぼすかは、子宮内病原体の異なる病原性株と特異的に関連しており、外部刺激に対するdMφの複雑な可塑性を示唆している(134)。
とりわけ、腫瘍や妊娠の場面では、免疫抑制細胞やサイトカインネットワークの中核をなすマクロファージが、腫瘍細胞や栄養芽細胞によって教育され、細胞、サイトカイン、抑制性免疫チェックポイントを含む複数の免疫成分をリクルートする能力を通じて、腫瘍の免疫回避や胎児の保護を助けている。一方、dMφはまた、正常な妊娠を妨げる可能性のある炎症性ストレスを抑制するように働き、潜在的な子宮内感染に対する防御にも貢献している。TAMとdMφがどのようにして免疫抑制環境を作り出すのか、その共通点と相違点を図3に示す。
図3
www.frontiersin.org
図3 腫瘍免疫微小環境または母体と胎児の境界面におけるマクロファージと他の免疫成分とのクロストーク。腫瘍免疫微小環境であれ、絨毛免疫微小環境であれ、マクロファージは他の細胞成分と緊密な結合を確立し、共同で免疫寛容の環境を作り出しており、この環境はそれぞれ、急速に拡大する腫瘍細胞や絨毛細胞の生存に寄与している(5, 8)。これらのマクロファージは、CTLの細胞傷害性を抑制し、Tregの生成を促進し、Th1型からTh2型への転換を促進する共抑制分子を高レベルで発現しているか、NK細胞やエフェクターT細胞の殺傷能力を阻害するために、様々な免疫制御因子を産生するかのいずれかである(36, 67)。腫瘍微小環境では、マクロファージは腫瘍細胞やCAFとより緊密なホルモン伝達を維持し、ポジティブフィードバックを形成しており、これはDSCと十二指腸マクロファージのクロストーク間にも存在する(107, 119)。胎児とその付属物の急速な発達の間、十二指腸マクロファージによる絨毛芽細胞の破片の迅速な除去は、潜在的な炎症反応をも防ぐ。CAFsはがん関連線維芽細胞、DSCsは絨毛間質細胞、trosは絨毛芽細胞、CTLは細胞傷害性T細胞、GAS6は成長停止特異的因子6。
6 血管新生におけるマクロファージ
6.1 TAMは腫瘍の新生血管形成に重要な影響を及ぼす
胎盤のように、発育中の臓器としての腫瘍は、酸素と栄養を運搬する血管を必要とし、これが腫瘍の成長を飛躍的に加速する。新生血管の形成は様々なメカニズムによって組織化されるが、その中でもTAMは内皮細胞の増殖、遊走、生存を促進し、ECMのリモデリングを促進することによって血管新生に主導的な役割を果たしている(135)。この過程において、低酸素とLAは、TAMの活性化を細かく調整し、VEGFA、TIE2、ニューロピリン-1(NRP1)などのHIF-α依存的な方法で血管新生促進遺伝子の転写を刺激することにより、腫瘍関連血管に対するTAMの作用を調節する(62, 136, 137)。内皮細胞はまた、代謝的に血管新生を促進する表現型を維持するために、TAMに影響を及ぼすことができる。中でもPPAR-γは、マクロファージの分極化と腫瘍血管新生との相互作用に関与していることが示唆されており(138)、内皮細胞はTAMの代替的活性化を促進し(139)、HIF-2αの転写集積を誘導する(140)。
さらに、寛容なTIMEによって誘導されたM2様TAMは、VEGFA、FGF、CXCL8、CXCL12、WNT7B、BV8などの血管新生促進因子、IL-1β、IL-6、TNFなどの炎症性サイトカイン、マトリックスメタロプロテアーゼ(MMP)やカテプシンなどの血管新生促進プロテアーゼの分泌を通して、腫瘍の血管新生を促進する(141)。これらのうち、VEGFAは血管新生スイッチと血管透過性を特徴とする異常な血管系の両方を保証し、それによって腫瘍の浸潤と遠隔転移を促進する(142)。MMPはECMに結合したVEGFAを動員し、内皮細胞に発現しているVEGFレセプター2との結合を可能にし、血管新生を誘発する(143)。
アンジオポエチン(Ang-1からAng-4)は、主に血管新生後期の血管安定化に関与する血管新生成長因子のファミリーで、膜結合型チロシンキナーゼレセプター(Tie-1とTie-2)を介してシグナルを伝達する。Ang-2は最もよく知られたAngファミリーの1つであり、TAMのリクルートと教育に関与することが示されている(144)。低酸素性TMEはCXCL12とAng-2の発現を誘導し、CXCR4+TIE2+ TAMのリクルートと血管周囲への集積を刺激する(145)。その後、TAMとAng-2を分泌する内皮細胞との間のパラクリン相互作用により、腫瘍の血管新生が促進され(136)、萌芽血管や吻合血管に密接な血管新生促進作用と組織再構築作用がもたらされる。
6.2 DMφはらせん動脈のリモデリングに必須である
妊娠が成功した場合、胎盤と胎児に必要な血流と栄養を保証するために、血管新生と十二指腸のらせん動脈リモデリングが必要であり、これにはdNK細胞、EVT、dMφ、血管平滑筋細胞(VSMCs)の共同調整が必要である。これまでの研究から、ヒトの妊娠におけるらせん動脈のリモデリングは2つの相で起こることが示されている(146)。第一段階は絨毛細胞非依存性で、子宮内膜のらせん動脈内で起こる。この段階では、血管周囲のVSMCは破壊され、内皮は膨潤してその連続性を失い、VSMCと内皮細胞は部分的にアポトーシスに誘導され、これはdMφの局所的蓄積と関連していることが証明される(145)。ここで、リモデリング血管に浸潤したdMφはアポトーシス細胞の除去を助け、MMP-7とMMP-9を産生し、血管周囲のECM分解と血管リモデリングプロセスを促進する(146)。第二段階、すなわち栄養細胞依存性とは、EVTがらせん動脈に移動し、ほとんどのVSMCsと内皮細胞を失って擬似内皮を形成することを指す。ここで、栄養芽細胞によって産生される血管作動性腸管ペプチドと妊娠特異的糖タンパク質は、内皮細胞ネットワークを破壊し、マクロファージへの影響を介して新生血管の成長を促進する(147)。いずれの段階においても、十二指腸螺旋動脈内皮細胞はCCL14を発現・分泌し、dNKとdMφの走化性を誘導する(148)。腫瘍の血管新生と同様に、Ang-1、Ang-2、およびTie-2は、発育中の胎盤、EVT、子宮渦状動脈の内皮細胞およびVSMCsに存在することが同定されており、その結果、血管系の組織的な破壊とリモデリングが起こる(144)。しかしながら、dMφのリクルートメントや表現型の誘導におけるAngの正確な役割については、まだ解明されていない。
臨床的には、異常な血管新生はPEを引き起こす重要な因子であり、機能不全に陥ったdMφは疾患の進行を促進する可能性がある(149)。TAMと同様に、dMφはVEGFA(57)、胎盤成長因子(PlGF)、およびそれらの受容体であるFMS様チロシンキナーゼ(Flt-1)(150)などの豊富な血管新生制御因子を分泌することにより、血管リモデリングを制御することができる。妊娠中のマウスでは、着床期における子宮マクロファージのiNOSとVEGFの発現レベルが、非妊娠時のそれに比べて高い(151)。
このことから、TAMとdMφの血管新生調節は、VEGFに大きく依存していることがわかる。TAMに関する研究に比べ、dMφに関する研究はマウスモデルに限られており(152, 153)、ヒトの妊娠に伴うdMφのダイナミックな変化を正確に表現することができない。しかし、オルガノイド、マイクロ流体工学、オルガン・オンチップなどの新しく有望な技術が、胎盤の発生や腫瘍形成に関与する血管新生をより深く研究する道を開きつつある(154, 155)。血管系のリモデリングに対するTAMとdMφの効果を図4に示す。
図4
www.frontiersin.org
図4 TAMとdMφを介した妊娠初期の腫瘍新生血管とらせん動脈のリモデリング。低酸素、アシドーシス、高乳酸などの明確なシグナルに応答して、TAMは腫瘍の低酸素領域に集積する傾向があり、HIFのアップレギュレーションを介して、一連の血管新生促進因子および血管新生調節因子の分泌を増加させる(61, 145)。同様に、十二指腸マクロファージは血管新生因子、特にVEGFとMMPを産生することにより、らせん動脈のリモデリングをサポートする。さらに、例えばアポトーシス細胞や残骸を貪食することにより、恒常的な組織環境を維持する(39)。ANGPT2, angiopoietin 2; HIF, hypoxia-inducible transcription factors; MMPs, matrix metalloproteinase; TME, tumor microenvironment; VSMC, vascular smooth muscle cells; VEGFA, vascular endothelial growth factor-A.
7 結論と展望
固形腫瘍の形成は複雑な多段階プロセスであり、生存を促進するためには、様々な細胞タイプと周囲のTMEとの相互作用が必要である。加えて、妊娠の成立は、以下のように、半同種の胎児の着床と成長を包含する類似の戦略を採用している(5, 8)。第一に、免疫調節に関しては、古典的なMHC-Iの発現の欠如によって免疫寛容が促進され、共抑制シグナルが提示され、免疫抑制性サイトカインと調節代謝産物が両方の環境で産生される(156)。第二に、代謝とエネルギー摂取に関して、腫瘍も絨毛芽細胞も低酸素レベルで増殖し、より高い酸素レベルに向かって浸潤を続け、その間にエネルギー源とシグナル伝達分子として乳酸を放出する(5)。第三に、前述したように、腫瘍と妊娠成立の間には、血管新生と細胞浸潤の点でいくつかの相関関係がある。増大する酸素と栄養素の需要を維持するために、腫瘍も絨毛芽細胞も、血管新生促進因子を放出し、マクロファージやNK細胞を含む様々な白血球を引き寄せることによって、宿主の血液供給に努める(5)。以上、この総説が先に説明したように、両者の文脈におけるマクロファージの表現型と機能の類似性を説明した。
しかし、腫瘍細胞とは対照的に、絨毛芽細胞の代謝、増殖、遊走、浸潤の状態は、厳密かつ細かく管理されていることを示す証拠は十分にある(6, 157)。例えば、整然としたらせん動脈のリモデリングと混乱した脈管形成模倣、また整然とした浸潤終点と遠隔転移が、それぞれデシドゥアと腫瘍部位に存在する(158)。孤発性の腫瘍とは異なり、胚の着床と絨毛の提示に先立ち、ヒトの子宮は胎児に備え、様々な性ホルモンによって組織化された脱子葉を終え、DSCsとして不可欠な栄養支持集団を生成している(159)。DSCは、絨毛膜で絨毛芽細胞と対向し、白血病抑制因子、IL-6、IL-11、IL-15、CXCL-10、顆粒球マクロファージコロニー刺激因子(GM-CSF)など、様々なサイトカインや成長因子を分泌し、絨毛芽細胞の侵入を受け身で受けるのではなく、適度な侵入を誘導する積極的な役割を果たす(110)。また、妊娠中の十二指腸におけるホルモンレベル、特にエストロゲンとプロゲステロンの変動は、マクロファージの表現型と反応性に影響を与える(160)。加えて、前述したように、EVTプラグや消失したリンパ管のような微細な構造のおかげで、胎盤の確立と免疫応答は母親によって適時調節することができるが、腫瘍の成長中にはこのイニシアチブが奪われることもある(25)。さらに、無視されやすいのは、妊娠と腫瘍における胎児/腫瘍特異的抗原認識の違いである。妊娠では、絨毛細胞も父方のMHC分子を発現しているため、母体のT細胞は専ら「間接的」な抗原提示を通じて胎児の同種移植片を認識する一方、腫瘍部位には「間接的」と「直接的」の両方の抗原提示を通じて腫瘍特異的抗原を認識するT細胞が浸潤していることが報告されている(161, 162)。言い換えれば、十二指腸マクロファージは胎児とは異なるMHC分子を提示するのに対し、TAMと腫瘍は同じMHC分子を提示する。このことは、これら2つの環境における抗原特異的提示と応答という点で、マクロファージの機能が微妙に異なることを示唆している。
この総説では、TAMとdMφの異質性と可塑性を説明し、母体-胎児免疫寛容と腫瘍免疫逃避、胎盤血管リモデリングと腫瘍新生血管形成を比較する。著しく高い可塑性と多様性は、局所的な微小環境環境に支配された表現型により、多くの機能を発揮することを可能にし、このことはTAMsとdMφの両者から裏付けられる。一般に、腫瘍部位と母体-胎児境界の両方に存在するマクロファージは、恒常的なM2様表現型をとる傾向があり、その結果、それぞれネガティブな結果(腫瘍の進行と転移)とポジティブな結果(胎児の発育と妊娠の維持)をもたらす。がんを抑制するためには、抗炎症性TAMを減少させ、炎症性TAMを活性化することによって、疲弊した免疫状態を逆転させ、攻撃を強化することに努める。妊娠中、dMφは子宮内に宿る半同種の胎児に免疫寛容な環境を提供する。したがって、マクロファージの極性の切り替えは、がん治療で予測されるように、妊娠合併症を治療するための潜在的な治療標的となりうる。先に述べたシグナル伝達経路とケモカイン/サイトカインから、同じ制御因子がマクロファージの生物学的性質に影響を与え、生理的過程と病的過程の両方を助ける可能性があると推測される。研究者たちは、マクロファージを標的とした治療薬を開発するために重要な、マクロファージの機能に関与する分子機構を、動物モデルや臨床データに基づいてより正確に理解することが求められている。
さらに、単純な腫瘍や妊娠だけでなく、いくつかの特殊なケースも考慮すべきである。十二指腸マクロファージは、炎症性サイトカインと抗炎症性サイトカインの両方を分泌し、微生物のチャレンジに対応しながら胎児の耐性を維持しようとする役割を果たす。例えば、リステリア・モノサイトゲネス(Listeria monocytogenes)である。グラム陽性細菌は最初に胎盤組織に浸潤し、子宮内感染を引き起こし、流産や早産の原因となる(163)。妊娠中にリステリア菌に感染すると、dMφではサイトカイン産生だけでなく、炎症性経路のシグネチャーが強くアップレギュレートされる(163)。このことは、危険な刺激がM1/M2ミックスのバランスを乱し、支配的な恒常性dMφを逆転させ、有害な転帰をもたらす可能性があることを示している。さらに、妊娠を伴うがん患者に関しては、ほとんどの研究が疫学と個々の管理に焦点を当てており、子宮頸管と同時に発生する腫瘍部位における免疫細胞の動的な表現型と機能についてはほとんど論じられていない(164)。今後、局所のマクロファージの可塑性と極性化が、2つの異常な免疫状態によって相互に影響を受けうるかどうかについては、さらなる研究が必要であり、これは妊娠を希望する、あるいは妊娠している癌患者にとって極めて有意義なことである。
著者貢献
TY:可視化、執筆-原案、執筆-校閲・編集。XL:調査、原案執筆。YL:構想、監修、執筆-校閲・編集。XZ:構想、監修、執筆-校閲・編集。LL: 構想、監督、執筆 - レビューと編集。MD: 構想立案、監修、検証、執筆 - 査読および編集。
資金提供
著者は、本論文の研究、執筆、および/または出版のために金銭的支援を受けたことを表明する。本研究は、中国国家自然科学基金[82271713, 31970859, 81630036]、中国国家重点研究開発プログラム[2021YFE0206500]、マカオ・上海国際協力プロジェクト(20410760300)、上海市高級地方大学革新研究チーム助成金および上海市教育委員会重点研究室プログラム(ZDSYS14005)、上海市保健家族計画委員会20204Y0403、上海セーリングプログラム(1YF1403700)の支援を受けた。
謝辞
本総説の図1、3、4はBioRender.comで作成した。
利益相反
著者らは、潜在的な利益相反と解釈され得る商業的または金銭的関係がない中で研究が行われたことを宣言する。
発行者注
本論文で表明されたすべての主張は、あくまでも著者らのものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
略号
ARG1、アルギナーゼ1;ANG-2、アンジオポエチン2;CTL、細胞傷害性T細胞;CAFs、がん関連線維芽細胞;CSF-1、マクロファージ刺激因子1;CCL、ケモカイン(C-Cモチーフ)リガンド;CXCL、ケモカイン(C-X-C)リガンド;DC、樹状細胞; dMφ、十二指腸マクロファージ;EVT、絨毛外絨毛;FBP、フルクトース-1,6-ビスリン酸;FGR、胎児発育制限;iNOS、一酸化窒素合成酵素;IDO、インドールアミン2,3-ジオキシゲナーゼ;IFN-γ、インターフェロン-γ;ICAM1、細胞間接着分子1; IL、インターロイキン;Kyn、キヌレニン;LPA、リゾホスファチジン酸;MDSCs、骨髄由来抑制細胞;mIHC、多重免疫化学染色;PE、子癇前症;RPL、再発性妊娠損失;scRNA-seq、単一細胞RNAシーケンス; TGF-β、トランスフォーミング増殖因子-β;TAM、腫瘍関連マクロファージ;TME、腫瘍微小環境;TRM、組織常在マクロファージ;TNF-α、腫瘍壊死因子-α;VEGFA、血管内皮増殖因子-A。
参考文献
Houser BL. 母体と胎児の境界面における十二指腸マクロファージとその役割。Yale J Biol Med (2012) 85(1):105-18.
PubMed Abstract|Google Scholar
腫瘍転移における腫瘍関連マクロファージ: 生物学的役割と臨床治療への応用。J Hematol Oncol (2019) 12(1):1-16. doi: 10.1186/s13045-019-0760-3.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Qian BZ, Pollard JW. マクロファージの多様性は腫瘍の進行と転移を促進する。Cell (2010) 141(1):39-51. doi: 10.1016/j.cell.2010.03.014.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HDAC8の発現低下によりCD163レベルが低下し、再発性自然流産におけるERKシグナル伝達経路を活性化することでマクロファージのアポトーシスを促進する。このような背景のもと、HDAC8の発現がCD163レベルを低下させ、マクロファージのアポトーシスを促進することが示唆された。
PubMedアブストラクト|全文|Google Scholar
Krstic J, Deutsch A, Fuchs J, Gauster M, Sparovec TG, Hiden U, et al. (Dis)similarities between the decidual and tumor microenvironment. バイオメディシン (2022) 10(5):1-35.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
妊娠と腫瘍:制御性T細胞における類似点と相違点。論文タイトル:Front Immunol (2022) 13:866937.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Soeters PB, Grimble RF. 妊娠とがんにおける炎症の条件付き役割。臨床栄養(2013)32(3):460-5.DOI:10.1016/J.CLNU.2012.07.010
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mor G, Aldo P, Alvero AB. 妊娠のユニークな免疫学的および微生物学的側面。Nat Rev Immunol [Internet] (2017) 17(8):469-82. doi: 10.1038/nri.2017.64.
PubMed Abstract|クロスリファレンス全文|Google Scholar
再発性妊娠喪失患者におけるヒト十二指腸免疫微小環境のシングルセルプロファイリング。論文・報告等:川口 有美子 2007/03/31 「"膀胱 "と "膀胱 "の関係」『膀胱 "膀胱 "と膀胱 "膀胱 "の関係
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腫瘍関連マクロファージサブ集団の再定義と腫瘍微小環境における機能。論文タイトル:Front Immunol (2020) 11:1731.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hoeffel G, Chen J, Lavin Y, Low D, Almeida FF, See P, et al. C-myb+赤血球骨髄系前駆細胞由来の胎児単球は、成体組織常在マクロファージを生じる。Immunity (2015) 42(4):665-78. doi: 10.1016/j.immuni.2015.03.011.
クロス・リーフ・フルテキスト|Google Scholar
ヒト絨毛芽細胞の発生をナイーブ多能性幹細胞を用いてin vitroで捉える。細胞幹細胞 (2021) 28(6):1023-39.e13. doi: 10.1016/j.stem.2021.03.013
CrossRef 全文|Google Scholar
Haider S, Meinhardt G, Saleh L, Kunihs V, Gamperl M, Kaindl U, et al. 自己複製絨毛細胞オルガノイドは発生プログラムを再現する。Stem Cell Rep (2018) 11:1-15. doi: 10.1016/j.stemcr.2018.07.004
クロス・リーフ・フルテキスト|Google Scholar
Ding J, Zhang Y, Cai X, Diao L, Yang C, Yang J. Crosstalk between trophoblast and macrophage at the maternal-fetal interface: current status and future perspectives. 論文タイトル:Front Immunol (2021) 12:1-10.
CrossRef フルテキスト|Google Scholar
ヒト絨毛芽細胞の試験管内浸潤の検討。論文タイトル:Hum Reprod Update (2020) 26(4):501-13.
CrossRef 全文|Google Scholar
ヒト胎盤の発生。(2019) 146(22):dev163428.
クロスレフ・フルテキスト|Google Scholar
Pollheimer J, Vondra S, Baltayeva J, Beristain AG, Knöfler M. Regulation of placental extravillous trophoblasts by the maternal uterine environment. Front Immunol (2018) 9:1-18s. doi: 10.3389/fimmu.2018.02597.
クロス・リーフ・フルテキスト|Google Scholar
Li X, Zhou J, Fang M, Yu B. Pregnancy immune tolerance at the maternal-fetal interface. Doi: 10.1080/08830185.2020.1777292.
クロスレフ・フルテキスト|Google Scholar
ヒト十二指腸の免疫寛容。J Clin Med (2021) 10(2):1-16.
CrossRef 全文|Google Scholar
Rodríguez-Cerdeira C, Gregorio MC, López-Barcenas A, Sánchez-Blanco E, Sánchez-Blanco B, Fabbrocini G, et al. Advances in immunotherapy for melanoma: A comprehensive review. Mediators Inflamm (2017) 3264217.
クロスレフ・フルテキスト|Google Scholar
Wagner J, Rapsomaniki MA, Chevrier S, Anzeneder T, Langwieder C, Dykgers A, et al. A single-cell atlas of the tumor and immune ecosystem of human breast cancer. Cell (2019) 177(5):1330-45.e18. doi: 10.1016/j.cell.2019.03.005.
クロス・リーフ・フルテキスト|Google Scholar
Ma RY, Black A, Qian BZ. シングルセルオミクスの時代に再考されるがんにおけるマクロファージの多様性。トレンド免疫学(2022)43(7):546-63.
CrossRef 全文|Google Scholar
腫瘍免疫における腫瘍関連マクロファージ。Doi: 10.3389/fimmu.2020.583084.
CrossRef 全文|Google Scholar
妊娠子宮内への樹状細胞の封入は、マウスにおける母体と胎児の境界面の免疫監視を阻害する。J Clin Invest (2009) 119(7):2062-73.
CrossRef 全文|Google Scholar
ヒト子宮内膜のリンパ管は、子宮脱分化の過程で消失する。論文番号:Hum Reprod (2010) 25(10):2455-64.
CrossRef 全文|Google Scholar
M1とM2マクロファージよりもはるかに多く、CD169+とTCR+マクロファージも存在する。Doi: 10.3389/fimmu.2015.00263
CrossRef フルテキスト|Google Scholar
Wu Y, Hirschi KK. 組織常在マクロファージの発生と機能。論文タイトル:Front Cell Dev Biol (2021) 8:1-7.
CrossRef 全文|Google Scholar
Locati M, Curtale G, Mantovani A. マクロファージ可塑性の多様性、メカニズム、および意義。Annu Rev Pathol Mech Dis (2020) 15:123-47. doi: 10.1146/annurev-pathmechdis-012418-012718.
クロスレフ・フルテキスト|Google Scholar
Bian Z, Gong Y, Huang T, Lee CZW, Bian L, Bai Z, et al. ヒトマクロファージの発生を単一細胞分解能で解読。Nature (2020) 582(7813):571-6.
CrossRef 全文|Google Scholar
妊娠中の十二指腸マクロファージの機能制御。J Reprod Immunol (2021) 143:103264.
CrossRef 全文|Google Scholar
子宮内膜症関連マクロファージ:起源、表現型、および機能。Doi: 10.3389/fendo.2020.00007.
CrossRef 全文|Google Scholar
Tugal D, Liao X, Jain MK. マクロファージ極性化の転写制御。Arterioscler Thromb Vasc Biol (2013) 33(6):1135-44. doi: 10.1161/ATVBAHA.113.301453.
クロスレフフルテキスト|Google Scholar
Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol (2018) 233(9):6425-40. doi: 10.1002/jcp.26429.
CrossRef フルテキスト|Google Scholar
Boutilier AJ, Elsawa SF. 腫瘍微小環境におけるマクロファージの分極状態。Int J Mol Sci (2021) 22(13):6995.
CrossRef 全文|Google Scholar
Hourani T, Holden JA, Li W, Lenzo JC, Hadjigol S, O'Brien-Simpson NM. 腫瘍関連マクロファージ:起源、動員、表現型の多様性、標的化。Doi: 10.3389/fonc.2021.788365.
CrossRef 全文|Google Scholar
Qiu Y, Chen T, Hu R, Zhu R, Li C, Ruan Y, et al. 腫瘍免疫療法における次のフロンティア:マクロファージを介した免疫回避。
CrossRef 全文|Google Scholar
Kielbassa K, Vegna S, Ramirez C, Akkari L. Understanding the origin and diversity of macrophage to tailor their targeting in solid cancers. doi: 10.3389/fimmu.2019.02215.
クロス・リーフ・フルテキスト|Google Scholar
Laviron M, Boissonnas A. Ontogeny of tumor-associated macrophages. Front Immunol (2019) 10:1799.
クロス・リーフ・フルテキスト|Google Scholar
Zhao H, Wong RJ, Stevenson DK. 妊娠初期の低酸素が胎盤細胞に与える影響。Doi: 10.3390/ijms22189675.
CrossRef 全文|Google Scholar
Mezouar S, Katsogiannou M, Ben Amara A, Bretelle F, Mege JL. 胎盤マクロファージ: 起源、不均一性、機能、妊娠関連における役割。(doi:10.1016/j.placenta.2020.10.017。
CrossRef 全文|Google Scholar
CSF-1による組織マクロファージと樹状細胞の集団動態の協調的制御。J Exp Med (2011) 208(9):1901-16。
CrossRef 全文|Google Scholar
Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M. 多様なマクロファージの活性化と極性化におけるケモカイン系。Trends Immunol (2004) 25(12):677-86.
クロスレフ・フルテキスト|Google Scholar
Wang S, Liu G, Li Y, Pan Y. Metabolic reprogramming induces macrophage polarization in the tumor microenvironment. Doi: 10.3389/fimmu.2022.840029.
クロス・リーフ・フルテキスト|Google Scholar
Chamseddine AN, Assi T, Mir O, Chouaib S. 腫瘍関連マクロファージを調節して免疫チェックポイント阻害剤の有効性を高める: TAM-ptingアプローチ。薬物療法 (2022) 231:107986. doi: 10.1016/j.pharmthera.2021.107986.
クロス・リーフ・フルテキスト|Google Scholar
Single-cell transcriptome analysis reveals of tumor immune microenvironment in oral squamous cell carcinoma after chemotherapy. 論文タイトル:Front Cell Dev Biol (2022) 10(6月):1-14.
CrossRef 全文|Google Scholar
シングルセル解析は、大腸がんにおける骨髄系標的治療のメカニズムを明らかにする。論文名:Cell (2020) 181(2):442-59.e29.
CrossRef 全文|Google Scholar
Zhang Q, He Y, Luo N, Patel SJ, Han Y, Gao R, et al. Landscape and dynamics of single immune cells in hepatocellular carcinoma. Cell [Internet] (2019) 179(4):829-845.e20. doi: 10.1016/j.cell.2019.10.003.
クロス・リーフ・フルテキスト|Google Scholar
Lavin Y, Kobayashi S, Leader A, Amir E ad D, Elefant N, Bigenwald C, et al. ペアシングルセル解析による早期肺腺がんにおける自然免疫ランドスケープ。Cell (2017) 169(4):750-65.e17. doi: 10.1016/j.cell.2017.04.014.
CrossRef フルテキスト|Google Scholar
Houser BL, Tilburgs T, Hill J, Nicotra ML, Strominger JL. 2つのユニークなヒト十二指腸マクロファージ集団。J Immunol (2011) 186(4):2633-42. doi: 10.4049/jimmunol.1003153.
クロスレフ・フルテキスト|Google Scholar
Svensson J, Jenmalm MC, Matussek A, Geffers R, Berg G, Ernerudh J. 胎児-母体界面のマクロファージは、代替活性化マーカーを発現し、M-CSFおよびIL-10によって誘導される。J Immunol (2011) 187(7):3671-82.
クロスレフ・フルテキスト|Google Scholar
Vento-tormo R, Efremova M, Botting RA, Turco MY, Vento-tormo M, Meyer KB, et al. ヒトにおける初期母体-胎児界面の単一細胞再構築。ネイチャー (2018) 563(7731):347-53.
クロス・リーフ・フルテキスト|Google Scholar
Jiang X, Du MR, Li M, Wang H. Three macrophage subsets are identified in the uterus during early human pregnancy. Cell Mol Immunol (2018) 15(12):1027-37. doi: 10.1038/s41423-018-0008-0.
クロス・リーフ・フルテキスト|Google Scholar
陳P、周L、陳J、呂Y、曹C、呂S、他:原因不明の再発性妊娠損失を伴うヒトデキドゥアの免疫アトラス。論文タイトル: Front Immunol (2021) 12(June):1-16.
CrossRef 全文|Google Scholar
Wang F, Jia W, Fan M, Shao X, Li Z, Liu Y, et al. ヒト再発流産の単一細胞免疫ランドスケープ。Genomics Proteomics Bioinforma (2021) 19(2):208-22. doi: 10.1016/j.gpb.2020.11.002.
CrossRef 全文|Google Scholar
妊娠中の免疫系: ユニークな複雑性。Am J Reprod Immunol (2010) 63(6):425-33. doi: 10.1111/j.1600-0897.2010.00836.x.
クロスレフ・フルテキスト|Google Scholar
Jaiswal MK, Mallers TM, Larsen B, Kwak-Kim J, Chaouat G, Gilman-Sachs A, et al. 妊娠初期におけるV-ATPアーゼのアップレギュレーション: 着床前妊娠期間における炎症反応の確立との関連性の可能性。リプロダクション (2012) 143(5):713-25.
CrossRef 全文|Google Scholar
Yao Y, Xu XH, Jin L. Macrophage polarization in physiological and pathological pregnancy. 論文名:Front Immunol (2019) 10:1-13.
クロス・リーフ・フルテキスト|Google Scholar
Zha Y, Liu H, Lin X, Yu L, Gao P, Li Y, et al. 期産・早産時の十二指腸における免疫逸脱。Doi: 10.3389/fimmu.2022.877314.
CrossRef 全文|Google Scholar
Lemon SM, Walker CM. 妊娠および関連合併症におけるマクロファージの役割。Arch Immunol Ther Exp(2019)67(5):295-309。
クロス・リーフ・フルテキスト|Google Scholar
Jiang X, Wang H. Macrophage subsets at the maternal-fetal interface. 細胞分子免疫学(2020)17(8):889-91.
CrossRef 全文|Google Scholar
Vitale I, Manic G, Coussens LM, Kroemer G, Galluzzi L. Macrophage and metabolism in the tumor microenvironment. Cell Metab (2019) 30(1):36-50. doi: 10.1016/j.cmet.2019.06.001.
クロス・リーフ・フルテキスト|Google Scholar
Casazza A, Laoui D, Wenes M, Rizzolio S, Bassani N, Mambretti M, et al. sema3A/nrp1シグナル遮断による低酸素腫瘍領域へのマクロファージ進入阻害は、血管新生を阻害し、抗腫瘍免疫を回復させる。Cancer Cell (2013) 24(6):695-709.
CrossRef 全文|Google Scholar
腫瘍微小環境と腫瘍関連マクロファージ間の代謝制御クロストーク。Theranostics (2020) 11(3):1016-30. doi: 10.7150/thno.51777.
CrossRef 全文|Google Scholar
腫瘍関連マクロファージに対する低酸素の影響。J Clin Invest (2016) 126(10):3672-9. doi: 10.1172/JCI84427.
CrossRef Full Text|Google Scholar
リゾホスファチジン酸-オートファジー軸の欠損は、十二指腸マクロファージの滞留を制限することで流産リスクを高める。オートファジー (2022) 00(00):1-22.
CrossRef 全文|Google Scholar
低酸素下のNK細胞:腫瘍と妊娠における脈管形成の2つの顔。論文番号:Front Immunol (2022) 13:1-13.
クロスレフ・フルテキスト|Google Scholar
Jena MK, Nayak N, Chen K, Nayak NR. 妊娠および関連合併症におけるマクロファージの役割。Arch Immunol Ther Exp (Warsz) (2019) 67(5):295-309.
CrossRef 全文|Google Scholar
Ma LN, Huang XB, Muyayalo KP, Mor G, Liao AH. 乳酸: 妊娠初期の新規シグナル伝達分子?2020年2月号)11:1-10. doi: 10.3389/fimmu.2020.00279.
CrossRef 全文|Google Scholar
Colegio OR, Chu NQ, Szabo AL, Chu T, Rhebergen AM, Jairam V, et al. 腫瘍由来乳酸による腫瘍関連マクロファージの機能的分極化。Nature (2014) 513(7519):559-63.
クロス・リーフ・フルテキスト|Google Scholar
乳酸によって変化したM2-TAMサブセットは、PD-L1/PD-1経路を介してT細胞のアポトーシスを促進する。Oncol Rep (2020) 44(5):1885-94. doi: 10.3892/or.2020.7767.
CrossRef 全文|Google Scholar
絨毛細胞由来の乳酸は、妊娠初期にSRC/LDHAシグナルを介して十二指腸マクロファージの分化を制御する。Int J Biol Sci (2022) 18(2):599-616.
CrossRef 全文|Google Scholar
Zhang T, Shen HH, Qin XY, Li MQ. 妊娠喪失*における十二指腸免疫細胞の代謝特性とその特異的性質。Immunol Rev (2022) 308(1):168-86.
クロスレフ・フルテキスト|Google Scholar
腫瘍関連マクロファージイリナの転写、エピジェネティックおよび代謝プログラミング。Doi: 10.3390/cancers12061411.
CrossRef 全文|Google Scholar
マクロファージは腫瘍微小環境内で代謝的に不均一である。セルレップ(2021)37(13):110171.
CrossRef 全文|Google Scholar
がんにおける免疫抑制性IDO:作用機序、動物モデル、標的化戦略。論文タイトル:Front Immunol (2020) 11:1-15.
CrossRef 全文|Google Scholar
AHRの遮断は、L-キヌレニンによって誘導されるTreg-マクロファージ抑制軸を抑制する。Nat Commun (2020) 11(1):1-11. doi: 10.1038/s41467-020-17750-z
CrossRef 全文|Google Scholar
Huang HL, Yang HL, Lai ZZ, Yang SL, Li MQ, Li DJ. 絨毛芽細胞の増殖を促進し、アポトーシスを抑制する。J Reprod Immunol (2021) 148:103364.
クロスレフ・フルテキスト|Google Scholar
Feng Y, Xiao M, Zhang Z, Cui R, Jiang X, Wang S, et al. 卵巣癌におけるリゾホスファチジン酸と腫瘍関連マクロファージとの潜在的相互作用。J Inflammation (United Kingdom) (2020) 17(1):1-5. doi: 10.1186/s12950-020-00254-4
CrossRef 全文|Google Scholar
フルクトース-1 , 6-ビスリン酸は、十二指腸COX-2+マクロファージ分化を誘導することにより、妊娠損失を予防する。Sci Adv (2022) 8(8):eabj2488. doi: 10.1126/sciadv.abj2488.
CrossRef 全文|Google Scholar
UHRF1は、妊娠初期の絨毛浸潤と十二指腸マクロファージ分化の両方を形成する。FASEB J (2022) 36(4):1-17. doi: 10.1096/fj.202101647RR
クロスレフ・フルテキスト|Google Scholar
腫瘍関連マクロファージの転写、エピジェネティックおよび代謝プログラミング。Doi: 10.3390/cancers12061411.
CrossRef 全文|Google Scholar
Nancy P, Siewiera J, Rizzuto G, Tagliani E, Osokine I, Manandhar P, et al. H3K27me3 dynamics dictate evolving uterine states in pregnancy and parturition. J Clin Invest (2018) 128(1):233-47. doi: 10.1172/JCI95937.
クロス・リーフ・フルテキスト|Google Scholar
EZH2阻害剤は、腫瘍微小環境におけるマクロファージ分極を制御することにより、大腸がんを抑制する。論文タイトル:Front Immunol (2022) 13:1-15.
CrossRef 全文|Google Scholar
絨毛細胞におけるEZH2のダウンレギュレーションは、十二指腸M1マクロファージの極性化を誘導する:再発性自然流産の潜在的原因。論文タイトル:「絨毛膜細胞におけるEZH2のダウンレギュレーションは絨毛膜細胞のM1マクロファージ分極を誘導する:自然流産の再発を引き起こす可能性がある。
CrossRef 全文|Google Scholar
Wang LL, Li ZH, Wang H, Kwak-Kim J, Liao AH. 最先端:妊娠中のマクロファージ極性化と機能の制御機構。J Reprod Immunol (2022) 151:103627. doi: 10.1016/j.jri.2022.103627.
クロスレフ・フルテキスト|Google Scholar
Wang(王)L, Deng(鄧)Z, Yang(楊)J, Zhao(趙)Y, Zhou(周)L, Diao(貂)L, et al.統合マルチオミクスアプローチによる反復流産患者の母体-胎児界面のエピジェネティックおよびトランスクリプトーム特性化。J Reprod Immunol (2022) 154:103754. doi: 10.1016/j.jri.2022.103754.
クロスレフ・フルテキスト|Google Scholar
Daley D, Mani VR, Mohan N, Akkad N, Ochi A, Heindel DW, et al. Dectin 1 activation on macrophage by galectin 9 promotes pancreatic carcinoma and peritumoral immune tolerance. Nat Med (2017) 23(5):556-67.
クロス・リーフ・フルテキスト|Google Scholar
Tiwari RK, Singh S, Gupta CL, Pandey P, Singh VK, Sayyed U, et al. TLR-9アゴニストをカプセル化した非拮抗性Dectin-1リガンドを用いた膠芽腫マクロファージ細胞の再分極:脳腫瘍に対する再生医療におけるもっともらしい役割。Int J Neurosci (2021) 131(6):591-8. doi: 10.1080/00207454.2020.1750393.
CrossRef 全文|Google Scholar
CCR2とCX3CR1を介したマクロファージとがん細胞のクロストークは、肺がんを促進する基本的なメカニズムである。Am J Respir Crit Care Med (2014) 191(4):437-47. doi: 10.1164/rccm.201406-1137OC
クロス・リーフ・フルテキスト|Google Scholar
Zhang YH, He M, Wang Y, Liao AH. 妊娠中のM1マクロファージとM2マクロファージのバランスの調節因子。Front Immunol (2017) 8:1-12. doi: 10.3389/fimmu.2017.00120.
クロス・リーフ・フルテキスト|Google Scholar
Wheeler KC, Jena MK, Pradhan BS, Nayak N, Das S, Hsu C, et al. VEGFは、デシドゥアにおけるマクロファージのリクルートとM2極性化に寄与する可能性がある。PLoS One (2018) 13(1):e0191040. doi: 10.1371/journal.pone.0191040.
クロス・リーフ・フルテキスト|Google Scholar
Lin Z, Shi JL, Chen M, Zheng ZM, Li MQ, Shao J. CCL2: 正常妊娠および病的妊娠における重要なサイトカイン: 総説。Doi:10.3389/fimmu.2022.1053457。
クロス・リーフ・フルテキスト|Google Scholar
Cascio S, Chandler C, Zhang L, Sinno S, Gao B, Onkar S, et al. がん関連MSCは腫瘍の免疫排除と免疫療法への抵抗性を促進するが、これはヘッジホッグ阻害によって克服できる。Sci Adv (2021) 7(46):eabi5790.
クロス・リーフ・フルテキスト|Google Scholar
GAS6を介した十二指腸間質細胞とマクロファージとの対話は、十二指腸マクロファージのM2様極性化と細胞増殖を誘導することにより、妊娠初期の維持に必須である。論文タイトル:Mol Hum Reprod (2022) 28(3):1-14.
CrossRef 全文|Google Scholar
Myers KV, Amend SR, Pienta KJ. Tyro3、AxlおよびMerTK(TAM受容体)を標的とする: 腫瘍微小環境におけるマクロファージへの示唆。Mol Cancer (2019) 18(1):1-14. doi: 10.1186/s12943-019-1022-2.
クロス・リーフ・フルテキスト|Google Scholar
Vijayan M, Lee CL, Wong VHH, Wang X, Bai K, Wu J, et al. 十二指腸グリコデリン-Aは、siglec-7を介してヒト単球を十二指腸マクロファージ様表現型に偏極させる。J Cell Sci (2020) 133(14):jcs244400.
CrossRef 全文|Google Scholar
IL-33/ST2 axis affects the polarization and efferocytosis of decidual macrophages in early pregnancy. Am J Reprod Immunol (2018) 79(6):1-10. doi: 10.1111/aji.12836.
CrossRef Full Text|Google Scholar
Lindau R, Mehta RB, Lash GE, Papapavlou G, Boij R, Berg G, et al. Interleukin-34は胎児と母体の界面に存在し、in vitroで十二指腸表現型の免疫制御性マクロファージを誘導する。Hum Reprod (2018) 33(4):588-99. doi: 10.1093/humrep/dey037.
CrossRef フルテキスト|Google Scholar
Wang XQ, Zhou WJ, Hou XX, Fu Q, Li DJ. 絨毛芽細胞由来のCXCL16は、M2マクロファージの分極化を誘導し、その結果、母体と胎児の界面でNK細胞を不活性化する。Cell Mol Immunol (2018) 15(12):1038-46. doi: 10.1038/s41423-018-0019-x
クロス・リーフ・フルテキスト|Google Scholar
Ding J, Yang C, Cheng Y, Wang J, Zhang S, Yan S, et al. トロフォブラスト由来のIL-6は、Stat3を介したM2マクロファージの極性化を活性化することにより、正常妊娠に重要な因子として機能する。doi: 10.1016/j.intimp.2020.106788.
クロスレフ・フルテキスト|Google Scholar
Weng YS, Tseng HY, Chen YA, Shen PC, Al Haq AT, Chen LM, et al. MCT-1/miR-34a/IL-6/IL-6Rシグナル軸は、トリプルネガティブ乳がんにおけるEMT進行、がん幹細胞化、M2マクロファージ分極を促進する。Mol Cancer (2019) 18(1):1-15. doi: 10.1186/s12943-019-0988-0
クロス・リーフ・フルテキスト|Google Scholar
絨毛細胞由来のヒアルロン酸は、十二指腸マクロファージの制御表現型を促進する。Reproduction (2019) 157(2):189-98.
CrossRef 全文|Google Scholar
Meng YH, Zhou WJ, Jin LP, Liu LB, Chang KK, Mei J, et al. RANKLを介した胎児と母親の調和的な対話は、十二指腸M2マクロファージの分極化を誘導することで円滑な妊娠を保証する。Cell Death Dis [Internet] (2017) 8(10):1-13. doi: 10.1038/cddis.2017.505
クロス・リーフ・フルテキスト|Google Scholar
Tsai YC, Tseng JT, Wang CY, Su MT, Huang JY, Kuo PL. Medroxyprogesterone acetate drives M2 macrophage differentiation towards a phenotype of decidual macrophage. Mol Cell Endocrinol (2017) 452:74-83. doi: 10.1016/j.mce.2017.05.015.
CrossRef フルテキスト|Google Scholar
ヒト絨毛性ゴナドトロピンは、母体と胎児の界面において抗炎症作用を有し、エンドトキシン誘発早産を予防するが、マウスでは難産と胎児危殆化を引き起こす。Biol Reprod (2016) 94(6):25-8. doi: 10.1095/biolreprod.116.139345
CrossRef 全文|Google Scholar
Ye Y, Peng L, Chelariu-Raicu A, Kuhn C, Dong X, Jeschke U, et al. Prostaglandin E2 receptor 3 promotes M1 macrophages polarization in unexplained recurrent pregnancy loss. 生物学 Reprod (2022) 106(5):910-8. doi: 10.1093/biolre/ioac030
CrossRef 全文|Google Scholar
腫瘍微小環境におけるがん関連線維芽細胞と免疫細胞のクロストーク:新たな知見と今後の展望。Doi: 10.1186/s12943-021-01428-1.
CrossRef 全文|Google Scholar
Marchesi M, Andersson E, Villabona L, Seliger B, Lundqvist A, Kiessling R, et al. HLA依存性の腫瘍発生: 腫瘍関連マクロファージの役割?J Transl Med (2013) 11(1):1-15.
クロスレフ・フルテキスト|Google Scholar
腫瘍微小環境におけるマクロファージとナチュラルキラー細胞のクロストーク。doi: 10.1016/j.intimp.2021.108374.
クロス・リーフ・フルテキスト|Google Scholar
腫瘍微小環境における制御性T細胞: 腫瘍微小環境における制御性T細胞:新たなメカニズム、潜在的治療戦略、および将来展望。Doi: 10.1186/s12943-020-01234-1.
CrossRef 全文|Google Scholar
Cortesi F, Delfanti G, Grilli A, Calcinotto A, Gorini F, Pucci F, et al. iNKT細胞と腫瘍関連マクロファージ間の二峰性CD40/fas依存性クロストークは、前立腺がんの進行を障害する。Cell Rep (2018) 22(11):3006-20. doi: 10.1016/j.celrep.2018.02.058.
CrossRef フルテキスト|Google Scholar
膵臓腫瘍微小環境における非通常型T細胞: Thinking outside the box. Cancer Discov (2019) 9(9):1164-6. doi: 10.1158/2159-8290.CD-19-0722.
クロス・リーフ・フルテキスト|Google Scholar
Kersten K, Coffelt SB, Hoogstraat M, Verstegen NJM, Vrijland K, Ciampricotti M, et al. 乳腺腫瘍由来のCCL2は、腫瘍関連マクロファージにおけるIL1βのアップレギュレーションを通じて、転移性全身性炎症を促進する。Oncoimmunology (2017) 6(8):1-14. doi: 10.1080/2162402X.2017.1334744
CrossRef フルテキスト|Google Scholar
Fabian KP, Padget MR, Fujii R, Schlom J, Hodge JW. 炎症性腫瘍(温性腫瘍)とT細胞排除腫瘍(冷性腫瘍)に対する併用免疫療法の必要性の違い: 関与し、拡大し、可能にし、進化させる。J Immunother Cancer (2021) 9(2):e001691. doi: 10.1136/jitc-2020-001691.
CrossRef 全文|Google Scholar
Bai R, Li Y, Jian L, Yang Y, Zhao L, Wei M. The hypoxia-driven crosstalk between tumor and tumor-associated macrophages: mechanism and clinical treatment strategies. Doi: 10.1186/s12943-022-01645-2.
CrossRef 全文|Google Scholar
膠腫-M2マクロファージ相互作用の解明により、PTEN欠損膠芽腫に対する有効な標的としてGal-9/Tim-3が同定された。Sci Adv (2022) 8(27):eabl5165.
クロス・リーフ・フルテキスト|Google Scholar
Su S, Zhao J, Xing Y, Zhang X, Liu J, Ouyang Q, et al. 免疫チェックポイント阻害は、マクロファージによるADCP誘発免疫抑制を克服する。Cell (2018) 175(2):442-57.e23. doi: 10.1016/j.cell.2018.09.007.
クロス・リーフ・フルテキスト|Google Scholar
Gordon SR, Maute RL, Dulken BW, Hutter G, George BM, McCracken MN, et al. 腫瘍関連マクロファージによるPD-1発現は、貪食と腫瘍免疫を阻害する。Nature (2017) 545(7655):495-9. doi: 10.1038/nature22396.
クロス・リーフ・フルテキスト|Google Scholar
デシデュアル間質細胞は、制御性M2マクロファージと制御性T細胞を誘導することで、ヒト胎児と母体の境界における寛容を支えている。J Reprod Immunol (2021) 146:103330.
クロスレフ・フルテキスト|Google Scholar
Wei CY, Li MQ, Zhu XY, Li DJ. 妊娠初期の十二指腸マクロファージの免疫状態は、CCL2/CCR2/JAK2経路に依存している。Am J Reprod Immunol (2021) 86(5):1-11. doi: 10.1111/aji.13480.
クロスレフフルテキスト|Google Scholar
CCR2とCX3CR1を介したマクロファージとがん細胞のクロストークは、肺がんを促進する基本的なメカニズムである。Am J Respir Crit Care Med (2015) 191(4):437-47. doi: 10.1164/rccm.201406-1137OC
クロス・リーフ・フルテキスト|Google Scholar
Fang XH, Li ZJ, Liu CY, Mor G, Liao AH. マクロファージメモリー: マクロファージメモリー:マクロファージメモリーの種類、メカニズム、健康と疾患における役割。免疫学(2023)171(1):18-30.
クロスレフ・フルテキスト|Google Scholar
デシデュアル由来RANKLは、ヒト妊娠初期における母体-胎児界面でのマクロファージの集積と滞留を促進する。Am J Reprod Immunol (2021) 86(2):1-9. doi: 10.1111/aji.13406.
クロスレフ・フルテキスト|Google Scholar
妊娠中のマクロファージの分化と機能におけるPD-1/PD-L1軸の役割。Hum Reprod (2019) 34(1):25-36. doi: 10.1093/humrep/dey347.
クロス・リーフ・フルテキスト|Google Scholar
Drukker M, Katz G, Urbach A, Schuldiner M, Markel G, Itskovitz-Eldor J, et al. ヒト胚性幹細胞におけるMHCタンパク質の発現の特性化。Proc Natl Acad Sci USA (2002) 99(15):9864-9. doi: 10.1073/pnas.142298299.
CrossRef 全文|Google Scholar
可溶性ヒト白血球抗原G5は、十二指腸マクロファージ様表現型へのマクロファージの分化を極性化する。Hum Reprod (2015) 30(10):2263-74. doi: 10.1093/humrep/dev196
CrossRef フルテキスト|Google Scholar
Parasar P, Guru N, Nayak NR. 母体免疫寛容に対するマクロファージの寄与。doi: 10.1016/j.humimm.2021.02.013.
CrossRef 全文|Google Scholar
ヒト妊娠初期の十二指腸における、DC-SIGN(CD209)を発現する増殖性抗原提示細胞の特異的な出現。Am J Pathol (2003) 162(3):887-96. doi: 10.1016/S0002-9440(10)63884-9
CrossRef 全文|Google Scholar
Tim-3+ decidual Mφs induced Th2 and Treg bias in decidual CD4+T cells and promoted pregnancy maintenance via CD132. doi: 10.1038/s41419-022-04899-2.
CrossRef 全文|Google Scholar
Hu XH, Li ZH, Muyayalo KP, Wang LL, Liu CY, Mor G, et al. 子癇前症における新たな介入戦略:PD-1/Tim-3シグナル経路を標的とし、子宮頸部マクロファージの極性化を調節する。FASEB J (2022) 36(1):1-18. doi: 10.1096/fj.202101306R
CrossRef 全文|Google Scholar
Co EC, Gormley M, Kapidzic M, Rosen DB, Scott MA, Stolp HAR, et al. 母体の十二指腸マクロファージは、ヒト妊娠中の浸潤性細胞絨毛芽細胞のNK細胞による殺傷を阻害する。doi: 10.1095/biolreprod.112.099465
CrossRef 全文|Google Scholar
Vacca、Cantoni、Vitale、Prato、Canegallo、F、Fenoglio、Dら:十二指腸NK細胞とCD14+骨髄単球細胞間のクロストークは、Tregの誘導と免疫抑制をもたらす。Proc Natl Acad Sci USA (2010) 107(26):11918-23. doi: 10.1073/pnas.1001749107.
CrossRef 全文|Google Scholar
Kapellos TS, Iqbal AJ. 炎症時のマクロファージ極性化と可溶性メディエーター遺伝子発現のエピジェネティック制御。Mediators Inflamm (2016) 2016:6591703.
CrossRef フルテキスト|Google Scholar
Brown MB, von Chamier M, Allam AB, Reyes L. M1/M2 macrophage polarity in normal and complicated pregnancy. Doi: 10.3389/fimmu.2014.00606.
CrossRef Full Text|Google Scholar
Murdoch C, Muthana M, Coffelt SB, Lewis CE. 腫瘍血管新生促進における骨髄系細胞の役割。Nat Rev Cancer (2008) 8(8):618-31。
CrossRef 全文|Google Scholar
Mazzieri R, Pucci F, Moi D, Zonari E, Ranghetti A, Berti A, et al. ANG2/TIE2軸を標的とすると、血管新生が阻害され、血管新生を促進する骨髄系細胞のリバウンドが無効になるため、腫瘍の増殖と転移が阻害される。DOI: 10.1016/j.ccr.2011.02.005
CrossRef 全文|Google Scholar
Duran CL, Borriello L, Karagiannis GS, Entenberg D, Oktay MH, Condeelis JS. 腫瘍微小環境におけるtie2の標的化: 血管新生から播種まで。キャンサーズ(バーゼル)(2021)13(22):5730.
CrossRef 全文|Google Scholar
Du S, Wagner N, Wagner KD. 腫瘍血管新生におけるPPARβ/δの新たな役割。PPAR Res (2020) 2020:3608315.
クロスレフ・フルテキスト|Google Scholar
Wang Q, He Z, Huang M, Liu T, Wang Y, Xu H, et al. Vascular niche IL-6 induces alternative macrophage activation in glioblastoma through HIF-2α. Nat Commun (2018) 9(1):559. doi: 10.1038/s41467-018-03050-0
CrossRef フルテキスト|Google Scholar
マクロファージにおけるHIF-αアイソフォームの異なる活性化と拮抗機能は、NOホメオスタシスに必須である。Genes Dev (2010) 24(5):491-501.
CrossRef 全文|Google Scholar
De Palma M, Biziato D, Petrova TV. 腫瘍血管新生の微小環境制御。Nat Rev Cancer [Internet] (2017) 17(8):457-74. doi: 10.1038/nrc.2017.51.
クロスリーフフルテキスト|Google Scholar
VEGFAと腫瘍血管新生。J Intern Med (2013) 273(2):114-27. doi: 10.1111/joim.12019.
クロスレフ・フルテキスト|Google Scholar
Schatz F, Guzeloglu-Kayisli O, Arlier S, Kayisli UA, Lockwood CJ. 子宮止血、月経、炎症、不利な妊娠転帰、異常子宮出血における十二指腸細胞の役割。Hum Reprod Update (2016) 22(4):497-515. doi: 10.1093/humupd/dmw004
CrossRef 全文|Google Scholar
Wang Q, Lash GE. 胎盤形成と腫瘍生物学におけるアンジオポエチン2: 血管生物学の陰と陽。Placenta (2017) 56:73-8. doi: 10.1016/j.placenta.2017.03.021.
CrossRef フルテキスト|Google Scholar
Hughes R, Qian BZ, Rowan C, Muthana M, Keklikoglou I, Olson OC, et al. 血管周囲M2マクロファージは化学療法後の腫瘍再発を刺激する。Cancer Res (2015) 75(17):3479-91. doi: 10.1158/0008-5472.CAN-14-3587.
クロスレフ・フルテキスト|Google Scholar
Smith SD, Dunk CE, Aplin JD, Harris LK, Jones RL. ヒト妊娠初期の十二指腸螺旋動脈リモデリングにおける免疫細胞の関与の証拠。Am J Pathol (2009) 174(5):1959-71. doi: 10.2353/ajpath.2009.080995.
CrossRef 全文|Google Scholar
Paparini DE, Choudhury RH, Vota DM, Karolczak-Bayatti M, Finn-Sell S, Grasso EN, et al. Vasoactive intestinal peptide shapes first-trimester placenta trophoblast, vascular, and immune cell cooperation. Br J Pharmacol (2019) 176(7):964-80. doi: 10.1111/bph.14609.
クロス・リーフ・フルテキスト|Google Scholar
Choudhury RH, Dunk CE, Lye SJ, Aplin JD, Harris LK, Jones RL. 絨毛外絨毛芽細胞と内皮細胞のクロストークは、初期リモデリングの十二指腸螺旋動脈壁への白血球浸潤を媒介する。J Immunol (2017) 198(10):4115-28. doi: 10.4049/jimmunol.1601175.
クロスレフフルテキスト|Google Scholar
Rong M, Yan X, Zhang H, Zhou C, Zhang C. Dysfunction of decidual macrophages is a potential risk factor in the occurrence preeclampsia. Doi:10.3389/fimmu.2021.655655。
クロス・リーフ・フルテキスト|Google Scholar
ヒト胎盤における血管内皮増殖因子、胎盤増殖因子、およびそれらの受容体Flt-1、KDRの病態下での発現。Hum Pathol (2002) 33(11):1069-77.
CrossRef 全文|Google Scholar
Tan W, Chen L, Guo L, Ou X, Xie D, Quan S. Relationship between macrophages in mouse uteri and angiogenesis in endometrium during the peri-implantation period. Theriogenology (2014) 82(7):1021-7. doi: 10.1016/j.theriogenology.2014.07.025.
クロス・リーフ・フルテキスト|Google Scholar
マウスとヒトにおける胎盤早期発生のメカニズム。Nat Rev Genet (2020) 21(1):27-43. doi: 10.1038/s41576-019-0169-4.
CrossRef 全文|Google Scholar
ブラウンEAB、To drive or be driven SA. 再発性妊娠喪失モデルマウスの軌跡。リプロダクション(2014)2147(5):R153-67。
CrossRef 全文|Google Scholar
ヒト細胞絨毛芽細胞の分化・浸潤のグローバルプロテオーム解析。DEV (2021) 148(13):1-11。
クロスレフ・フルテキスト|Google Scholar
Sun W, Luo Z, Lee J, Kim HJ, Lee KJ, Tebon P, et al. Organ-on-a-chip for cancer and immune organs modeling. Adv Healthc Mater (2019) 8(4):1-12. doi: 10.1002/adhm.201801363.
クロスリーフフルテキスト|Google Scholar
Reeves E, James E. 腫瘍と胎盤の確立: 抗原処理と提示の重要性。プラセンタ(2017)56:34-9. doi: 10.1016/j.placenta.2017.02.025
CrossRef フルテキスト|Google Scholar
Costanzo V, Bardelli A, Siena S, Abrignani S. Exploring the links between cancer and placenta development. Open Biol (2018) 8(6):180081.
クロス・リーフ・フルテキスト|Google Scholar
Tutar R, Çelebi-Saltik B. 人工3Dヒト胎盤のモデリング。Cells Tissues Organs (2022) 211(4):527-36.
CrossRef 全文|Google Scholar
妊娠初期のヒト十二指腸間質細胞は、G-CSFとIL-1βのクロストークを介して単球由来樹状細胞の機能的リプログラミングを誘導する。論文名:Front Immunol (2020) 11:1-11.
CrossRef 全文|Google Scholar
Hoffmann JP, Liu JA, Seddu K, Klein SL. 性ホルモンのシグナル伝達と免疫機能の調節。免疫 (2023) 56(11):2472-91. doi: 10.1016/j.immuni.2023.10.008.
CrossRef 全文|Google Scholar
Erlebacher A, Vencato D, Price KA, Zhang D, Glimcher LH. 抗原提示における制約が、同種胎児のT細胞認識を著しく制限する。J Clin Invest. (2007) 117(5):1399-411.
クロスレフ・フルテキスト|Google Scholar
DhatChinamoorthy K, Colbert JD, Rock KL. MHCクラスI抗原提示の喪失による癌免疫回避。DhatChinamoorthy、Colbert、JD、Rock、KL. Doi: 10.3389/fimmu.2021.636568.
クロスレフ・フルテキスト|Google Scholar
妊娠中の単球とマクロファージ: 良いこと、悪いこと、そして醜いこと*。Immunol Rev (2022) 308(1):77-92.
クロスレフ・フルテキスト|Google Scholar
Albright CM、Wenstrom KD。妊娠中の悪性腫瘍。Doi: 10.1016/j.bpobgyn.2015.10.004.
クロス・リーフ・フルテキスト|Google Scholar
キーワード:マクロファージ、可塑性、母体-胎児界面、腫瘍関連マクロファージ(TAM)、免疫抑制、免疫微小環境
引用 Yin T, Li X, Li Y, Zang X, Liu L and Du M (2024) Macrophage plasticity and function in cancer and pregnancy. Front. Immunol. 14:1333549.
受理された: 2023年11月05日;受理された: 2023年12月18日;
発行:2024年1月11日
編集者
リピン・フェン(デューク大学、米国
査読者
ギル・モル, ウェイン州立大学, アメリカ合衆国
Carla Guenther, 大阪大学, 日本
Copyright © 2024 Yin, Li, Li, Zang, Liu and Du. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*Correspondence: Meirong Du, mrdu@fudan.edu.cn; Lu Liu, liulu11n@163.com
免責事項:本論文で表明されたすべての主張は、あくまで著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
こんな人たちも見ています
胚中心は優性抗体応答に対して寛容である
フィリップ・A・ロベール,テインモジ・アルルラージ,ミヒャエル・マイヤー=ヘルマン
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
