加齢に伴う白髪の遺伝学的研究
エイジング・リサーチ・レビュー
2023年6月3日オンライン公開、101977号
In Press, Journal Pre-proofこれは何ですか?
レビュー
加齢に伴う白髪の遺伝学的研究
https://www.sciencedirect.com/science/article/pii/S1568163723001368

著者リンク オーバーレイパネルを開くSifan Wang a, Yuanbo Kang b, Fei Qi a, Hongzhong Jin a
もっと見る
概要
シェア
引用元
https://doi.org/10.1016/j.arr.2023.101977Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
ハイライト
加齢に伴う白髪の遺伝学的研究により、白髪のメカニズムが解明された。
加齢に伴う白髪の遺伝については、濃縮理論、ゲノムワイド関連研究、全エクソームシークエンス、遺伝子発現研究、白髪の遺伝学モデルなど、いくつかの側面がある。
これらの側面は、加齢に伴う白髪のメカニズム、治療、あるいは予防の可能性に関連するものである。
概要
白髪は、ヒトの加齢に伴う表現型および生理的特徴として、早期に明らかに現れる。分子生物学と遺伝学の最近のいくつかの進歩により、白髪のメカニズムについての理解が深まり、毛包におけるメラニンの合成、輸送、分布に関連する遺伝子、およびこれらのプロセスを制御する遺伝子が解明された。そこで、これらの進歩を概観し、エンリッチメント理論、Genome-Wide association study、全エクソームシーケンス、遺伝子発現研究、加齢による白髪の動物モデルなどから白髪の遺伝的側面の動向を検討し、白髪の変化を遺伝子レベルで概観し、今後の研究の基礎を確立することを目的とするものです。また、遺伝学的にまとめることで、加齢に伴う白髪のメカニズムや治療、予防の可能性を探ることも大きな意義があります。
キーワード
遺伝学
白髪
老化
メラノサイト
メラノサイト幹細胞
毛包
はじめに
白髪は、カニティとも呼ばれ、人種や性別に関係なく、ヒトの早期かつ共通の表現型老化関連現象であり、ヘアサイクル依存性の変化、遺伝、酸化、代謝、ストレス、老化関連因子、(神経)内分泌、栄養によって調節される(Battistellaら、2020、Inomataら、2009、O'Sullivanら、2021、Papacioら、2022、Changら、2020)。髪の色はメラノサイトで生成されるメラニンによって提供され、白髪の発生は毛軸内のメラニン生成と沈着の減少に依存しています(Liao et al., 2017, Tobin and Paus, 2001)。毛幹の異なる色素レベルからの光の反射の変化により、これらの色素不足または未色素の毛は、灰色または白色に見える(McMullen and Jachowicz, 2004)。活性酸素種を介する損傷の増加、および抗酸化および抗アポトーシスシステムの機能不全に伴い(Denat et al., 2014, Lee et al., 2021)、白髪は、マトリックス通過増幅細胞の特定の枯渇に関連している(Wu et al、 2022)、外根鞘と球根の両方に影響を及ぼす毛包メラノサイト、ならびにメラノサイト幹細胞(MeSCs)の自己維持、分化、および移動の欠陥に関連している(Arckら、2006、Comoら、2004、Nishimuraら、2005、Tobin and Paus, 2001, Zhangら、2020)。
メラニンの合成、輸送、分布に関連する遺伝子や、上記のこれらのプロセスを制御する遺伝子を調べる研究がいくつか行われている(Liu et al., 2013, Matama et al.、2015)。顕著な早期白髪を有する親族の観察によると、遺伝的素因が大きく(Christoffersen and Tybjaerg-Hansen, 2016)、白髪の変動の90%までが双子対照研究によって示された遺伝要因によって説明できる(Gunn et al., 2009)。その上、民族差や性差から、白髪の発症年齢には遺伝的背景があることが示唆されています(Panhard et al.、2012)。白髪の遺伝的要素を示す手がかりは多いが、毛周期における遺伝子発現の差、異なる細胞種やタンパク質間の複雑な相互作用、変動する毛包微小環境、酸化ストレス、毛髪の複数の刺激など、複雑な内外の要因が重なるため、その遺伝はほとんど不明または散逸したままだ(Sikkink et al., 2020, Wood et al., 2009)。
したがって、加齢に伴う白髪の基礎となる遺伝学についての理解をさらに深めるため、本総説では2つの目標を掲げています。まず、エンリッチメント理論、ゲノムワイド関連研究、全エクソームシークエンス、遺伝子発現研究、加齢に伴う白髪の動物モデルなど、さまざまな側面から加齢に伴う白髪の遺伝子の変化に関する現在の進展に焦点を当てる。私たちは、加齢に伴う白髪の遺伝的構造と変化に視点を置き、この現象に関連するいくつかの同定された遺伝子座についてもレビューします。次に、遺伝学的にまとめることで、加齢に伴う白髪のメカニズム、治療、あるいは予防の可能性を探ることを期待しています。白髪に関係する遺伝子
メラノサイトの「老化」プロセスは、まず遺伝子発現レベルで毛髪の「老化」プロセスを支配している可能性がある(Yu et al.) 2022年12月8日までに、色素沈着または色素脱失に関連する68のヒト遺伝子が国際色素細胞学会連盟のデータベースに記載されていた(http://www.espcr.org/micemut/)。白髪は、マウスの自然変異体や遺伝子操作マウスが大量に寄与しており、ヒトの黒髪と白髪の関連遺伝子の発現の違いが表1で証明されました、 加齢に伴うメラノサイトの発達やメラニン形成に必須の遺伝子として、TYR、TYRP1、TYRP2、MITF、Pax3、Sox10、チロシンキナーゼ受容体c-Kit、Plexin C1、Melan-A、Pmel17、肝細胞成長因子受容体(MET)などが確認されています(Choi et al. , 2008、Peters et al.、2013)。また、これらの遺伝子座内の多型は、毛色形質の正常な変動に関連している(Sturm, 2009)。特筆すべきは、MC1Rシグナル伝達経路の遺伝的変異が髪色を決定する重要な要因であり、髪の表現型は異なる色素形成遺伝子間の多数の相互作用に依存していることである(Pavan and Sturm, 2019)。さらに、最初の10ヘアサイクルの間、すなわち約40歳までにのみ、無傷のヒト毛包色素ユニットのヘアサイクル再構築がすべての頭皮毛包で最適に起こる(Van Neste and Tobin, 2004)。また、加齢に伴う白髪の発生は、個人の遺伝関連要因に依存し、血縁関係や民族性とも関連し、平均して白人では30代半ば、アジア人では30代後半、アフリカ人では40代半ばに発生します(Franbourg et al., 2003, Keogh and Walsh, 1965, Panhard et al., 2012)。
表1. 加齢に伴う白髪に関連する重要な選択遺伝子、生物学的過程におけるそのカテゴリー、および非色素化毛包と色素化毛鞘毛包におけるその発現の違いをGO用語の適用で示した(http://www.geneontology.org)。
カテゴリー遺伝子記号発現変化アミノ酸代謝過程TYR, TYRP1/2DSCLYUcell adhesionPCDHAC2Dcell differentiationSTK18Uchromatin organizationRBBP5Ucytoskeleton organizationKRT25, KRT33B, KRT83, KRTAP4Dintracellular protein transportDSCR3UMelanin biosynthesisPmel17、 Melan-AD膜組織LSCR2DMDS032Umitotic細胞周期PKMYT1DCETN1DNAテンプレート転写の制御MITF、Pax3、Sox10、SOX18、チロシンキナーゼ受容体c-Kit、 IRF4Dシグナル伝達プレキシンC1、MET、KIAA1493、MDS010、PRO1600、FGF5DKIAA0390、KIAA1317タンパク質、KIAA1735、IL22RA2、KIAA0467、FGF7、NFAT2U膜外輸送SLC2A1DSLC26A9UトランスポートKIAA1821U
略称: D:ダウン、U:アップエンリッチメント理論
機能性遺伝子を異なる生物学的プロセスにクラスター化するエンリッチメント理論に関しては、Gene Ontology (GO; http://www.geneontology.org) termsとKyoto Encyclopedia of Genes and Genomes (KEGG; http://www.kegg.jp/) pathwaysが、ゲノム配列だけでなく他のハイスループット・データの生物学的解釈における2大統合データベースツールです(Gene Ontology, 2015, 金久ら、2016、金久ら, 2017)。GO解析を適用することで、白毛と黒毛の球根間で2289個の遺伝子が、白毛と黒毛の鞘間で388個の遺伝子が異なる発現を示すことが世界的に研究されています(Yu et al.、2012)。その結果、ほとんどの遺伝子が有意に発現低下しており、主に「細胞死の制御」(113遺伝子)、「細胞死のポジティブ制御」(60遺伝子)、「代謝プロセス」(14遺伝子)など、いくつかの支配的な機能カテゴリーに濃縮されていることがわかった。最近のGOエンリッチメント解析により、白毛根と黒毛根の免疫細胞の発現量の異なる遺伝子は、「抗原処理と提示」、「好中球の脱顆粒」、「免疫応答の正の調節」、「外部刺激に対する応答の正の調節」といったカテゴリーに属していることが確認されています(Wu et al., 2022)。
KEGGパスウェイ解析によると、ヌクレオチド切除修復(NER)シグナル伝達経路などの「放射線に対する反応」経路が、白髪と黒髪の有意差を表していました。さらに詳細な解析の結果、ゲノム安定性、DNA修復、遺伝子転写、さらに損傷耐性の調整において中心的な役割を果たすヌクレオチドエクシジョン修復(NER)シグナル経路(Fousteri and Mullenders, 2008)に関与するエクシジョン修復相互補完遺伝子などのいくつかの変化遺伝子(Marteijn et al, 2014)から、加齢による白髪のメカニズムの1つとしてMeSCにおけるDNA損傷修復不全が考えられると指摘されています。また、同時期に行われた別のKEGG解析では、白髪と白髪の毛包の加齢に伴う選択された制御経路が異なっており、前者は軸索誘導、アクチン骨格の制御、ADP-リボシレーション因子、糖化、グルコネシスに着目している、 血管内皮増殖因子、グルタミン酸代謝、インテグリンシグナル、細胞間接着シグナル経路に着目し、後者はメラニン生成、FASシグナル経路、前骨髄球性白血病タンパク質による転写活性制御、アルツハイマー病と結論付けた(Peters et al. , 2013). これらのシグナル伝達経路の違いは、遺伝子の発現レベルの違いを反映している可能性があり、より詳細な比較が必要である。また、これらの毛髪の構造タンパク質において、ケラチン関連タンパク質4遺伝子のファミリーは、加齢に伴う変化が最も激しいようである(Giesen et al.、2011)。加齢による白髪のサンプルを用いて、毛包組織を付着させた毛軸根のリピドーム解析を行ったところ、スフィンゴ脂質代謝に関わるグルコシルセラミド経路が加齢による白髪のバイオマーカー候補となる可能性が明らかになった(Ma and He、2022)。将来的には、白髪/白髪と黒髪の間の差次発現遺伝子の利用は、DESeq2、edgeR、limma-voom、NOISeq、dearseq、ウィルコクソン順位和検定の適用による重要なステップであり、サンプルサイズの大きい集団レベルのRNA-seq研究ではウィルコクソン順位和検定が推奨されます (Li et al., 2022).ゲノムワイド関連研究およびホールエクソームシーケンス
関心のある表現型と統計的に関連する遺伝的変異を同定することを目的とした、ゲノムワイド関連研究とホールエクソームシーケンスは、多数の症例被験者と対照被験者からのサンプルにより、白髪に関する研究を別の段階に引き上げることができます(Cho et al., 2018, International HapMap et al., 2007, Koboldt et al.) 疾患遺伝子探索に広く応用されているにもかかわらず(Evangelou and Ioannidis, 2013)、加齢に伴う白髪におけるこれらの研究の数は驚くほど限られており、これまでに報告された研究はわずか2件(Adhikari et al, 2016, Pospiech et al, 2020)です。6,000人以上の混血ラテンアメリカ人を対象とした頭髪の特徴に関するゲノムワイド関連スキャンから、白髪の遺伝率はわずか27%で、これまでの双子対照研究を大きく下回っています(Gunn et al.、2009)。調査された一塩基多型(SNP)のうち、IRF4のイントロン内のrs12203592のみがGWA-significanceを達成し、白髪と有意に関連しています(Adhikari et al., 2016, Han et al., 2008)。IRF4はインターフェロン制御因子をコードし、そしてTYRの発現を活性化できるMITFと協力する(Praetorius et al.、2013)。興味深いことに、IRF4 rs12203592 T対立遺伝子は白髪の増加にも関連していますが、そのメカニズムを探る実験的証拠はまだ見つかっていません。したがって、MeSCsの維持・生存や分化後のメラノサイトの消失に影響を与えるかどうかを探ることは大きな価値がある(Adhikari et al., 2016, O'Sullivan et al., 2021)。
その後、ポーランドからの849サンプルのコホートにおけるフォローアップの独立したエクソームワイドSNP関連試験は、IRF4 rs12203592とMROH2A rs2361506(Adhikariらの別の追加遺伝子座)の効果を重複して検証し、KIF1Aのrs59733750とNSMCE1のrs1127228という二つの新規DNA変異が、表2に示す白髪と相関することが確認されました(Pospiech et al.、2020).すべてのSNPの中で、KIF1Aのrs59733750は、最も高い最小冗長度最大関連性スコアを獲得している。KIF1Aは、シナプス小胞の軸索輸送体であるキネシンファミリー蛋白質のメンバーをコードし(Riviere et al., 2011)、NSMCE1は、ゲノムの完全性の維持、DNA損傷応答、DNA修復に関わるNSMCE1蛋白質をコードする(藤岡 et al., 2002)。
表2. Genome-Wide Association StudiesとWhole Exome Sequencingから得られた白髪に関連するSNPsのリスト。
SNP_IDChr positionGene/LocusProteinAssociation with hair grayingrs12203592chr6:396321IRF4interferon regulatory factor 4MITFを介してTYR発現を活性化するため (Praetorius et al., 2013)rs2361506chr2:23383064MROH2Amaestro heat like repeat family member 2AT 高ビリルビン濃度と関連性がある (Bielinski et al、 2011)rs59733750chr2:240780193KIF1アキネシンファミリーメンバー1AT色素異常と関連していること(Blumen et al., 2003)rs1127228chr16:27226789NSMCE1NSE1ホモログ、SMC5-SMC6複合成分既知の制御領域に位置していること(Hunt et al., 2018)
しかし、白髪の遺伝率については論争が残っています。IRF4 rs12203592とMROH2A rs2361506の重複は、白髪で観察された変動の1.6%を完全に説明しただけで、異なる遺伝率の測定を行った先行研究よりも低く、後者の研究集団では、遺伝子成分が白髪の変動のわずか<10%を説明するという驚きの結果が確認された(Adhikari et al., 2016, Shin et al., 2015).一方で、遺伝子-環境相互作用、表現型、または遺伝的不均一性はすべて、白髪遺伝子の同定に複雑さをもたらす(Zhou et al.、2018年)。一方で、同様の精度を得るためには、関連研究において統一された遺伝率測定法を適用すべきことが明らかにされている(Weissbrod et al.,2018)。したがって、今後の加齢に伴う白髪に関する遺伝学的研究では、同じ遺伝率の基準で病態に直接寄与する機能的バリアントを特定することができるはずです。遺伝子発現研究
メラニン生成は、チロシナーゼ活性の制御ではなく、メラニン生成酵素の発現、例えばTYRとTYRP-1の制御の結果として、アナゲン毛包に限定される(Tobin et al., 1998)(Como and Bernard, 2000)。黒髪と白髪を比較するためのポリメラーゼ連鎖反応(PCR)や免疫組織化学的研究の応用により、白髪の候補遺伝子や経路(図1)を特定することは極めて重要であり(Kubistaら、2006、Petersら、2013)、先行研究は主に細胞マーカーとメラニン生成の主要酵素に焦点を当てていた。メラノサイト系譜の初期マーカーであるpMel17(Commo and Bernard, 2000)は、メラノサイトに見られる中間フィラメントタンパク質であるビメンチンと組み合わせて、加齢とともに減少することが標識され、加齢による白髪が個々の毛包のメラノサイトの総数の特異かつ段階的減少を行うことを証明しました。凍結切片免疫標識の適用により、白髪に残存するメラノサイトは、TYRおよびTYRP1の発現により依然として活性化されており、メラニン顆粒の存在によりメラニン生成および皮質ケラチノサイトへの移行過程が達成された(Commo et al., 2004)。
ダウンロード: 高解像度画像ダウンロード(468KB)
ダウンロード フルサイズ画像のダウンロード
図1. 発現研究(D'Mello et al., 2016, Hushcha et al., 2021, Pillaiyar et al., 2015, Zhou et al., 2021)から得られたメラニン生成に関わる主要遺伝子および分子シグナル伝達経路。メラニン生成は、一連の反応によってメラノソーム内でメラニンが生合成されることである。そのプロセスは、非義務的なステップであるフェニルアラニンヒドロキシラーゼ(PAH)によるL-フェニルアラニンのL-チロシンへの水酸化、またはL-チロシンから直接のいずれかのステップから開始される。そして、L-チロシンはチロシナーゼ(Suszynska-Zajczykら)を触媒としてL-ジヒドロキシフェニルアラニン(L-DOPA)に水酸化されるが、これはメラニン生合成の重要な律速段階である(35)。次に、L-DOPAがドーパキノンに酸化され、ドーパキノンはチオールが存在する場合はフェオメラニンに、チオールが存在しない場合はユーメラニンに加工される(36)。その後、メラニンを含むメラノソームがメラノサイトから順次移動してケラチノサイトに取り込まれ、毛髪色素が生成される(27)。線維芽細胞やケラチノサイトから分泌されるα-MSH、ACTH、ASP、SCF、ET-1、WNTなどのパラクリン因子は、それぞれの受容体に結合し、複数のシグナル伝達経路を活性化する。その後、MITFの転写が促進され、TYR、TYRP1、DCT、Rab27a、MLPH、MYO5Aといったメラニン生成に関わる主要遺伝子の発現促進に寄与する。したがって、メラニンは重要な酵素の上昇によって合成され、TYRの触媒によってチロシンからL-DOPAへの変換が開始される。次に、L-DOPAが酸化されてドーパキノンになり、ドーパキノンはフェオメラニンやユーメラニンに加工されます。Rab27a、MLPH、MYO5Aなどの輸送タンパク質の助けを借りて、豊富なメラニンを含むメラノソームがメラノサイトからケラチノサイトに輸送される。α-MSH:α-メラノサイト刺激ホルモン、ACTH:副腎皮質刺激ホルモン、ASP:アゴニスト刺激タンパク質、MC1R:メラノサイト特異的メラノコルチン-1受容体、AC:アデニル酸シクラーゼ、cAMP:環状アデノシン一リン酸、PKA:タンパク質キナーゼA、CREB:cAMP応答要素結合タンパク質、MITF:小眼筋関連転写因子、Wnt.ウィングレス関連統合部位;GSK3β:グリコーゲン合成酵素キナーゼ3β;SCF:幹細胞因子;PKC:プロテインキナーゼC;cAMP:サイクリックAMP;MEK:MAPK/ERCキナーゼ;ERK:細胞外制御型MAPキナーゼ;ET-1:エンドセリン1;ETRB:エンドセリン受容体タイプB;PAH:フェニルアラニンヒドロキシラーゼ;L-DOPA.L-ジヒドロキシフェニルアラニン、TYP:チロシナーゼ、TYRP1:チロシナーゼ関連プロテイナーゼ1、DCT:ドーパクロムタウトメラーゼ(TYRP2とも)、DHICA:5,6-ジヒドロキシインドール2-カルボン酸、DHI:5,6-ジヒドロキシインドール、Pmel17:プレメラノソーム蛋白17、MLPH:メラノフィリン、MYO5A:ミオシンVAの4種が挙げられる。
その後、白髪の毛球部では、MITF-M、Sox10、Pax3、TYR、TYRP1、TYRP2遺伝子の発現が黒髪に比べて著しく減少するか、ほとんど消失することが調査された(Choi et al., 2008)。より多くのサンプルを用いた別の実験では、これらの遺伝子に加え、Pmel17、Melan-A、MET、PLXC1、Kitの発現が黒髪、白髪、白髪で順次減少し(Peters et al.、2013)、老化によるメラノサイトの枯渇が確認された。統計的には、毛包メラノサイトにおいて、TYRの発現は約77%減少し、ドーパクロムトートメラーゼの発現は加齢により約67%増加した。これは、細胞の酸化還元状態を維持する非顔料的役割のためと考えられる(Kauser et al.、2011)。しかし、これらの割合は、年齢や個人の限界、また、生体外で摘出した際に球根の活性メラノサイトが生存不可能であることを考慮する必要があります。また、毛包からtotal RNAを分離し、ある遺伝子の発現量を平均化した結果、機能的なメラノサイトが減少したのか、それともメラノサイトのみが機能不全に陥ったのかを組織学的根拠なしに誤認させたことは注目に値する。一方、白髪ではメラノサイトが減少しているため、白髪の毛包からのバルクRNA配列データは、メラノサイトの遺伝子発現を評価するための超情報にはなり得ないと思われた。これらの遺伝子の発現が減少しているにもかかわらず、ヒトの毛包の白髪化において、なぜ、どのようにしてメラノサイトが減少し始めるのかということは、まだ未解決の問題である。
色素沈着していない毛髪は色素沈着している毛髪よりも成長速度が速いことが正確に検証されているため(Nagl, 1995, Van Neste, 2004)、cDNAマイクロアレイ解析により、色素沈着していない毛球のケラチンおよびケラチン関連タンパク質(KRTAP)遺伝子の発現が色素沈着した毛球に比べて少なくとも2倍に大きく上昇していることが判明した。この現象を確認するために、毛包特異的ケラチン(KRT25)、ヘアケラチン(KRT33B、KRT83)、KRTAP4アイソフォーム(Gong et al., 2012)を選択してRT-PCRと免疫組織化学分析を行ったところ、後者は前者と一致した(Choi et al., 2011)。実際、これらの結果は、MeSCsの枯渇だけでなく、毛髪の成長速度やそのパターン、あるいはヘアサイクル中のアナゲン延長が白髪の主要なメカニズムである可能性を示唆している(Choi et al., 2011, Kaplan et al.) とはいえ、色素沈着していない毛が厚く存在するほど、多くの構造成分で構成されており、活発な毛髪成長、毛髪の力学的特性、加齢による白髪との関係を明らかにするには、さらなる検討が必要です。
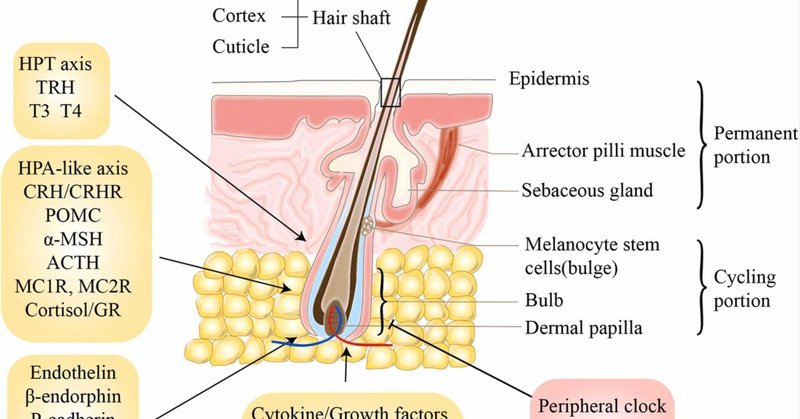
また、ヒトの毛包は神経内分泌器官として、いくつかのホルモンの受容体を遺伝子やタンパク質のレベルで発現しており、それらが協調して図2に示す複雑な制御ネットワークを形成しており、多くの研究がこれらのプロセスに集中している(伊藤ら、2004、伊藤ら、2005、パウスら、2014、ラモートら、2021、van Beekら、2008)。免疫組織化学研究では、灰色/白色毛包の毛球において、副腎皮質刺激ホルモン、コルチコトロピン放出ホルモン、αメラノサイト刺激ホルモンなどの視床下部-下垂体-副腎(HPA)軸ホルモンの減少が示されている(Ito et al., 2004)。また、色素沈着していない毛髪では、色素沈着している毛髪と比較して、線維芽細胞増殖因子5(FGF5)(毛髪成長の阻害因子)の発現が低下し、FGF7(毛髪成長の促進因子)の発現が上昇していました(Choi et al.、2011)。従って、白髪における制御因子の役割を検討する際には、毛周期における制御因子のカテゴリーとその最適な効率化のタイミングを区別する必要がある。さらに、活性化T細胞核因子(NFAT2)は、cDNAマイクロアレイにおいて、黒毛球と比較して白毛球で有意に発現が上昇し、NFAT2の阻害によりTYRとMITFの発現が促進される(Lee et al.、2010)。ただし、著者らが材料として選んだのはB16メラノーマ細胞であり、メラノサイトを直接使ったわけではなく、前者の結論のメカニズムについては実験による証明が必要であることを指摘しておく必要がある。結論として、生体毛包年齢の完全な指標となるのはメラノサイトの生体関連マーカーの発現変化であり、その制御シグナル経路の評価はその老化プロセスにおいて重要な役割を果たす(Peters et al.、2013)。特に、ヒトの毛包はホルモン感受性が高く、周期的にリモデリングを繰り返す小器官であるため(Paus et al.、2014)、老化に伴うこれらの調節因子やホルモンの変化全体について、毛包レベルだけでなく全身レベルでより詳しく調べる必要があります。
ダウンロード 高解像度画像ダウンロード(317KB)
ダウンロード フルサイズ画像のダウンロード
図2. 毛髪とヒト毛包色素形成の制御因子の概略構造(O'Sullivan et al., 2021, Shimomura and Christiano, 2010)。ヒト毛包の色素形成を制御する複数の陽性(矢印で示す)および陰性(阻害線で示す)因子が存在する。HPT:視床下部-下垂体-甲状腺;TRH:チロトロピン放出ホルモン;T3:トリヨードサイロニン;T4:テトラヨードサイロニン;HPA:視床下部-下垂体-副腎軸;CRH.コルチコトロピン放出ホルモン;POMC:プロオピオメラノコルチン;α-MSH:αメラノサイト刺激ホルモン;ACTH:副腎皮質刺激ホルモン;MC1R:メラノコルチン受容体;GR:グルココルチコイド受容体;TSC.結節性硬化症複合体;MITF:小眼球症関連転写因子;NGF:神経成長因子;TrkA:チロシン受容体キナーゼA;SCF:幹細胞因子;c-KIT:チロシン蛋白キナーゼキット;FGF.線維芽細胞増殖因子、c-Met:チロシンプロテインキナーゼMet、HGF:肝細胞増殖因子、BMAL1:脳・筋肉ARNT様1、PER1:期間概日制御因子1、TGF-β:トランスフォーミング増殖因子β。
メラノサイトマーカーとは別に、最近の包括的なシングルセルRNA-seq解析により、毛母細胞の通過増幅細胞(TAC)マーカーであるKi67とLFF1が、白毛根の毛母細胞において、黒毛根と比較して顕著に減少し、白毛根では著しい毛母細胞のTAC枯渇が見られることが判明した(Wu et al, 2022)。TAC枯渇とともに、白髪の毛包は、遺伝毒性ストレスと成長因子の欠乏、さらに他の未解明な因子の組み合わせによって引き起こされるP53経路の活性化を伴っています。注目すべきは、ヒトの白髪の毛包とその隣の黒髪の毛包の間には、比較的若い人と老人の両方で違いがあることが観察されているが、遺伝子発現レベルでは若い人と老人の毛包の間に違いはなく、白髪と毛包の老化が同一のメカニズムで支配されていない可能性があることである。しかし、彼らの頭皮サンプルは4人の中国人から採取したものであり、年齢による変化を正確に把握するためには、より多くの検体を検査する必要があります。
加齢に伴う白髪の遺伝子発現の差に関する問題に対処するためには、研究方法、材料、技術を技術開発とともに常に改善する必要がある(Bergenstrahle et al.、2022、Wu and Zhang、2020)。個体内および毛包間の不均一性は、もっぱら白髪の遺伝的な病理学と一致しないため、同じ頭皮サンプルから黒毛と白毛の毛包を直接比較し、より大きなサンプルサイズで単一の毛包器官レベルでの白髪の調査を明示する価値が強く強調されている(Wu et al.、2022)。白髪の遺伝学に関するモデル
個人から採取した毛髪標本とは別に、多くの研究が加齢に伴う白髪の具体的なメカニズムを探るために、加齢と白髪のモデルを確立している(表3)。現在のマウスモデルは、自然老化に起因する加齢性白髪を3つの側面からシミュレートしています: 1. 毛髪色素の減少や脱毛などの外見的症状 (Veis et al., 1993)。2. 毛球の減少、毛軸の細さ、色素分布の変化、毛乳頭の可視化、メラノサイトの減少などの顕微鏡的特徴 (Peters et al., 2013). 3. MITF、ATR、TYRなどのメラニン形成やメラノサイトの運命制御因子に関するいくつかの重要な遺伝子の発現(Choi et al., 2008, Harris et al., 2013, Ruzankina et al., 2007)。メカニズムとしては、遺伝子発現の観点からメラノサイトの運命を能動的に制御する、あるいは外的要因に対してメラノサイトが受動的に応答することにモデルの成立が由来している。
表3. 加齢に伴う白髪の特徴を持つモデルの代表的なもの。
モデル加齢に伴う白髪との関係制限または特徴参考文献ATR欠損、Cre-ERT2トランスジェニックマウス系統を8-12週齢でTAM処理類似点:皮下脂肪層の薄膜化、表皮の肥厚、毛包の喪失。
マウスモデルを用いたATRの欠失は、幹細胞や前駆細胞のプールを枯渇させることにより、成人期の細胞増殖に極めて大きな影響を与える(Ruzankina et al., 2007)。
Tyr::CreERT2およびMitfvga9miceDifference: premature hair graying先天性の白斑と早期の白髪(Harris et al., 2013)RET-transgenic miceSimilarity: MSCs and descendant melanocytes in RET-mice decrease with hair graying is along to human.Acceleration of hair cycle, senescence.
ヘアサイクルの促進、老化、老化したKSCのET-1発現量の低下、ET-1発現量の低下によるメラノサイトのEdnrb発現量の低下、毛球内の子孫メラノサイト数の減少(Iida et al., 2020) Hair graying mice by serial plucking or shaving類似点:ヒトと同様に自己再生するMSCが消失している。
相違点:繰り返しプラッキングを行った結果、マウスの全毛包のうち4%までしか白髪にならず、70歳以上のヒトのほとんどが白髪か白髪であることに明確な違いを示す。プラッキングやシェービングによる毛髪再生の人工刺激により、マウスの正常寿命が設定するヘアサイクルの可能回数の限界を広げる。(Endu et al、 2014)Bcl-2欠損マウス類似性:このモデルの胸腺と脾臓は、齧歯類の毛髪交換の正常パターンと一致する大規模なアポトーシスの退縮を起こす.酸化還元制御メラニン合成の欠陥(Veis et al、 1993)Notch1Δ/Δ;Notch2Δ/Δ mouse; NotchIC transgenic mouseDifference: the number of melanoblasts and bulb melanocytes decreases embryonically and postnatally.Mouse expressing Notch1 receptor could rescue the phenotype of hair graying via breeding.(Schouwey et al.)、 2010)電離放射線照射後の器官培養白髪毛包類似性:老化やメラニン色素の特徴に関するパラメータは、ヒトの白髪の本質的な特徴とほぼ一致している。
差異がある: 一部の遺伝子は白髪や白髪と同じ傾向を示したが、統計的に有意な差は見られなかった。ヒトサンプル(Dai et al., 2023)
ケラチノサイト幹細胞(KSC)の老化を促進するためにヘアサイクルを集約することにより、加齢に伴う白髪の新規モデルマウスが作製されました。このモデルでは、KSCとMeSCの相互作用が機能不全に陥り、KSCのエンドセリン-1発現とMeSCのエンドセリン受容体B発現がダウンレギュレーションすることが特徴である。MSCと子孫メラノサイトの減少は、ヒトの白髪と一致している(Iida et al.、2020)。別の受容体とリガンドであるNotchシグナルを遮断すると、胚15.5日目と生後6日目にメラノブラストと球根メラノサイトの量が減少する。研究者らは、リガンド活性型受容体として機能するNotch1受容体の細胞内ドメインを発現するトランスジェニックマウスモデルを作成した。このマウスを白髪を特徴とするNotch欠損マウスと交配させると、早発性の白髪を完全に色素沈着させることができた(Schouwey et al., 2010)。また、Bcl2欠損マウスでは、トランスフォーミング成長因子β(TGF-β)が、静止期に入ったMSCのアポトーシスを誘導するシグナルが注目されています。TGF-βによるMSCの死は、ヒトの白髪のある例の原因であると推測されている(Nishimura et al.、2010)。
多くの研究者が、メラニン生成やメラノサイトの恒常性に重要な遺伝子をノックアウトして動物モデルを作ろうと試みている。皮膚の毛包の大部分には十分な再生能力が存在するが、ATRモザイクノックアウトマウスでは毛包の発達が著しく遅れ、ATRのノックアウトはanagen初期の毛包形成の遅れと関連している。毛球メラノサイトは3回目の脱毛で枯渇し、元々白髪だった毛髪は生えなくなりました(Ruzankina et al., 2007)。白髪の最も上流に位置するMITFは、Sox10によってメラノサイトの分化に関与し、メラニン形成を操作し、未分化なMSCを維持するためにアップレギュレートされる可能性があります。Sox10ノックアウトによる色素沈着は、球根メラノサイトの全体的な喪失と出生後の色素産生の欠乏に起因する(Harris et al.、2013)。遺伝子操作により再現性の高い動物モデルを作成することができますが、この単一のシグナル伝達経路の変化は、加齢に伴う複雑な自然白髪とは異なります。
研究者は、遺伝子発現操作に加えて、剃毛や放射線照射などの物理的な方法によるモデル作りを試みている。別の白髪マウスモデルは、毛抜きや剃毛によって確立され、毛髪再生を人工的に刺激し、自己再生するMSCを失わせる結果となった(Endou et al., 2014)。しかし、バルジ細胞のアポトーシスや皮膚の炎症など、ヘアサイクルの繰り返し以外の要因で白髪が発生することがあることに注意が必要です(Chen et al., 2015、Ito et al., 2002)。そのため、脱毛を前提とした実験を行うことは、加齢に伴う白髪を理解する上で最も効果的な方法とは言えないかもしれません。5Gy照射後の器官培養白髪毛根は、メラノサイトの産生低下と毛包の発達・分化の阻害が現れる。照射はGO解析により毛包のミトコンドリアを破壊すると仮定した(Dai et al.、2023)。
これらのモデルに基づいて、これらの制御因子の発現レベルと相対的なシグナル伝達経路を色素沈着毛と非色素沈着毛の標本間で比較し、加齢による白髪を防ぐための有望な標的を開拓することができる。異なる加齢モデルを組み合わせることで、将来的には白髪と細胞の老化をより包括的に研究することができる。毛包周囲の微小環境
毛包の微小環境が、毛包幹細胞の挙動を制御する重要な因子であることを示す証拠が増えている。Zhangらは、レジニフェラトキシン(RTX)注射により急性ストレスを模倣した後、バルジからMeSCsが完全に失われる一方、同じ毛包内の分化したメラノサイトには影響がなく、次のアナゲンが始まると色素のない毛が出現することを発見しました。さらに、同じニッチを共有する毛包幹細胞ではなく、MeSCs上のβ2アドレナリン受容体ADRB2が、ストレス誘導性白髪の重要な分子であることがわかった。また、免疫不全マウスにRTXを注射すると白髪の情報が得られることから、ストレスがない場合は、ノルアドレナリンシグナルが白髪を誘発するのに十分であると思われる。しかし、交感神経系が加齢によるMeSCsの消失に関与しているかどうかは不明であり、さらなる検討が必要である(Zhang et al.、2020)。
報告されているように、I型自然免疫シグナルに関与する標的遺伝子の転写抑制におけるMITFの新規な役割は、白髪の病因および遺伝的背景と関連しており(Harris et al., 2018)、白毛包の免疫細胞集団には、その黒人の隣人と比較して著しい増加が存在する(Wu et al., 2022)。神経および免疫の微小環境とは別に、毛包は真皮の白色脂肪組織内に浸されている。毛包周囲真皮白色脂肪組織から分泌されるアディポネクチンは、毛母細胞内のMITF、TYRP1、WNT10Bの発現を抑制し、HGF受容体c-Metをダウンレギュレートし、その後メラニン生成を阻害した(Bangら、2017、Nicuら、2021)。結論的には、ヒトの毛包周囲微小環境における遺伝子の変化は、加齢に伴う白髪のメカニズムに部分的に光を当てるかもしれません。白髪の治療・予防への着想
白髪の正常な変異の遺伝的構造を明らかにすることは、基礎的な生物学的科学を超えた意味を持つ。人間の毛髪の目に見える表現型の中で、白髪はほとんどすべての人が経験するものであり、その特徴は化粧品産業によって顕著に利用されています(Matama et al., 2015)。これまで、一時的な染毛剤や着色剤の塗布は、白髪に対する最も一般的で利用しやすい治療法であり、毛包に悪影響を与え、その効果を維持するために頻繁に使用する必要があります(Pereira-Silvaら、2022年)。毛包に未分化幹細胞が存在することを理由に、白斑や老化の影響を受けた髪を再着色するために毛包移植が行われる(Gorenら、2017、Guptaら、2015)。そのほか、加齢に伴い活性化する経路を医薬品で阻害することで、P53阻害薬であるピフィトリンαなどの白髪を改善することが証明されています(Wu et al., 2022, Zhang et al., 2021)。セロトニン再取り込み阻害薬fluoxetineは、毛包内α-MSH発現をアップレギュレートすることにより、一部の白髪毛包の色素沈着をex vivoで逆転させるかもしれない(Cheret et al.、2020)。
治療に加えて、IRF4やNFAT2などの白髪の遺伝学やメカニズムを解明することによって、白髪を遅らせたりブロックしたりできるかどうかを鑑定し、白髪への介入目標を提供することは大きな価値がある(Adhikari et al., 2016)。したがって、メラニン生成の生物学的プロセスを標的とした新規治療薬、さらには予防薬、様式、技術に関する追加の研究を、今後、ex vivoからin vivoへ、動物モデルから実際の応用へと検証する必要がある(Chen et al., 2022)。結論と今後の展望
結論として、加齢に伴う白髪は、DNA、mRNA、タンパク質のレベルでも、動物モデルでも、メラニン合成と輸送における1つまたはいくつかの分子の調節不全につながる複数の経路を通じて、内因性および外因性の要因により引き起こされます(Chen et al., 2014, Choi and Artandi, 2009, Matsumura et al., 2016, Steingrimsson et al., 2004)。加齢に伴う白髪の遺伝学に関しては、加齢に伴う白髪に関連する一塩基多型(SNP)は、観察された表現型変動の10%以上を説明しなかった(Adhikari et al., 2016, Pospiech et al., 2020)。MeSCsやメラノサイトの発達やメラニン生成に関連する遺伝子の発現が、白毛包では黒毛包に比べて加齢とともに徐々に低下するか、あるいは遅れて完全に消失することが、個々の標本のみならず白髪のモデルにおいても確認されている(中村ら、2013、Rees、2003、Sulemら、2008)、特にTYR、TYRP1、TYRP2といった重要遺伝子が、白髪のモデルで確認されています。いくつかの研究がこのテーマを探求しているが、これらの知見は十分に深いものではなく、白髪における遺伝子の役割はまだ十分に理解されていない(O'Sullivan et al., 2021)。個体内および毛包間の不均一性に基づき、単一の毛包標本の遺伝子レベルおよびタンパク質レベルの両方で、加齢に伴う白髪に関連する遺伝子に言及する、より包括的な研究が探求されるべきである(Philpott、2021年)。
白髪を決定する遺伝的背景を研究することは、人間の老化のプロセスを理解する上で極めて重要であり、白髪のそのような形質を秩序立てて推進する選択的要因は、老化のメカニズムを研究するためのユニークな器官培養モデルシステムを形成する(ダイら、2022、リンとフィッシャー、2007、シュノーアーら、1998)。白髪の遺伝学は徐々に解明されてきているが、この問題の結果はより深い研究を必要とし、新しい知識によって、特に加齢に伴う白髪の基礎となる病態生理のより良い理解を探ることができる(Cheng and Bayliss, 2008)。白髪のある種の遺伝学は十分に注目されており、この問題の理解を続けることで、白髪の予防や治療、また老化のメカニズムを調べるための新しい機会が得られることが期待されます。
引用されていない参考文献
(Gene、2015、Suszynska-Zajczykら、2014)。
資金調達について国立高度病院臨床研究費(2022-PUMCH-B-092)
中国国家重点研究開発プログラム(2022YFC3601800)
利益相反について
著者は、本研究が潜在的な利益相反と解釈される商業的または金銭的関係がない状態で行われたことを宣言するものである。
謝辞
該当なし。
著者による貢献
記載されたすべての著者は、本作品に実質的、直接的、かつ知的な貢献をし、出版を承認している。
推奨論文
データの利用可能性
論文に記載された研究に使用されたデータはない。
参考文献
アドヒカリら、2016
K. Adhikari, T. Fontanil, S. Cal, J. Mendoza-Revilla, M. Fuentes-Guajardo, J.C. Chacon-Duque, F. Al-Saadi, J.A. Johansson, M. Quinto-Sanchez, V. Acuna-Alonzo, et al.
混血ラテンアメリカ人におけるゲノムワイド関連スキャンにより、顔や頭皮の髪の特徴に影響を与える遺伝子座が特定された
Nat Commun, 7 (2016), p. 10815
Scopusで見るGoogle Scholar
アークら、2006年
P.C. Arck, R. Overall, K. Spatz, C. Liezman, B. Handjiski, B.F. Klapp, M.A. Birch-Machin, E.M. Peters
白髪のフリーラジカル理論」に向けて:老化したヒト毛包のメラノサイトアポトーシスは、酸化ストレスによる組織損傷の指標である。
FASEB J., 20 (2006), pp.1567-1569
CrossRefGoogle Scholar
バングら、2017
S. バン、K.H.ウォン、H.R.ムーン、H.ユ、A.ホン、Y.ソング、S.E.チャーン
AMPK/CRTC経路を介したアディポネクチンによるメラニン生成の新規調節機構
Pigm Cell Melanoma R, 30 (2017), pp.553-557
CrossRefScopusGoogle Scholarで表示する。
バティステラら、2020
C. バッティステラ、N.C.マッカラム、K.グナナセカラン、X.周、V.カポネッティ、M.モンタルティ、N.C.ジャンネスキ
合成メラニンを用いた天然ヒト毛髪の色素沈着の模倣
ACS Cent Sci, 6 (2020), pp.1179-1188
CrossRefView in ScopusGoogle Scholar
ベルゲンストラーレら、2022年
L. Bergenstrahle, B. He, J. Bergenstrahle, X. Abalo, R. Mirzazadeh, K. Thrane, A.L. Ji, A. Andersson, L. Larsson, N. Stakenborg, and al.
ディープデータフュージョンによる超解像空間トランスクリプトミクス
Nat. バイオテクノロジー, 40 (2022), pp.476-479
CrossRefView in ScopusGoogle Scholar
ビエリンスキーら, 2011
S.J. Bielinski, H.S. Chai, J. Pathak, J.A. Talwalkar, P.J. Limburg, R.E. Gullerud, H. Sicotte, E.W. Klee, J.L. Ross, J.P. Kocher, and al.
Mayo Genome Consortia:ゲノムワイド関連研究のための遺伝子型-表現型リソースと循環ビリルビン値の解析への応用
Mayo Clin. Proc., 86 (2011), pp.606-614
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
ブルーメンら、2003
S.C. Blumen, S. Bevan, S. Abu-Mouch, D. Negus, M. Kahana, R. Inzelberg, A. Mazarib, A. Mahamid, R.L. Carasso, H. Slor, and al.
複雑な遺伝性痙性対麻痺の遺伝子座は染色体1q24-q32にマップされる
Ann. 神経学, 54 (2003), pp.796-803
Scopusで見るGoogle Scholar
チェンら、2014
C.C. Chen, P.J. Murray, T.X. Jiang, M.V. Plikus, Y.T. Chang, O.K. Lee, R.B. Widelitz, C.M. Chuong
老化マウスにおける再生毛髪波と毛包外調節因子フォリスタチン、dkk1、sfrp4
J. Invest. Dermatol., 134 (2014), pp.2086-2096
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
チェンら、2015
C.C. Chen, L. Wang, M.V. Plikus, T.X. Jiang, P.J. Murray, R. Ramos, C.F. Guerrero-Juarez, M.W. Hughes, O.K. Lee, S. Shi, and al.
器官レベルのクオラムセンシングは、毛幹細胞集団の再生を指示する
セル, 161 (2015), pp.277-290
PDFを見る記事を見るScopusGoogle Scholarで見る
チェンら、2022
J. チェン、Y. Zheng、C. Hu、X. Jin、X. Chen、Y. Xiao、C. Wang
毛包を超える白髪制御因子
Front. Physiol., 13 (2022), 記事 839859
Scopusで見るGoogle Scholar
チェンおよびベイリス、2008
A.S. チェン, S.J. ベイリス
毛軸障害の遺伝学
J. Am. Acad. Dermatol., 59 (2008), pp.1-22
PDFを見る記事を見るScopusGoogle Scholarで見る
Cheretら、2020年
J. チェレ、J.ゲラルディーニ、M.ベルトリーニ、R.パウス
フルオキセチンは生体外でヒト毛包の色素沈着を促進する:新しい抗緑化戦略としてのセロトニン再取り込み阻害?
Br. J. Dermatol., 182 (2020), pp.1492-1494
CrossRefScopusGoogle Scholarで見る
チョー他、2018年
H. チョー、D.J. ウー、B. バーガー
マルチパーティ計算を用いた安全なゲノムワイド関連解析
Nat. Biotechnol., 36 (2018), pp.547-551.
CrossRefScopusGoogle Scholarで見る
チョイら、2011
H.I. Choi, G.I. Choi, E.K. Kim, Y.J. Choi, K.C. Sohn, Y. Lee, C.D. Kim, T.J. Yoon, H.J. Sohn, S.H.Han, et al.
白髪は活発な毛髪成長と関連している
Br. J. Dermatol, 165 (2011), pp.1183-1189
CrossRefView in ScopusGoogle Scholar
チョイとアータンディ, 2009
J. チョイ、S. アータンディ
幹細胞の老化とニッチ内の異常な分化
セル・ステムセル, 5 (2009), pp.6-8
PDFを見る記事を見るGoogle Scholar
Choi et al., 2008
Y.J. Choi、T.J. Yoon、Y.H. Lee
ヒト白髪関連遺伝子の発現の変化
Eur J Dermatol, 18 (2008), pp.397-399
Scopusで見るGoogle Scholar
クリストファーセン、タイブヤーグ=ハンセン、2016年
M. クリストファーセン、A.タイブヤーグ=ハンセン
虚血性心疾患のリスクマーカーとしての目に見える老化兆候: 疫学、病態、臨床的意味合い
エイジング・レズ・レヴ, 25 (2016), pp.24-41
PDFを見る記事を見るScopusGoogle Scholarで見る
コンモとベルナール、2000年
S. コンモ、B.A.バーナード
ヒトの毛周期におけるメラノサイトのサブポピュレーションのターンオーバー:免疫組織化学的研究
色素細胞研究, 13 (2000), pp.253-259
CrossRefView in ScopusGoogle Scholar
コンモら、2004
S. コモ、O.ガイヤール、B.A.ベルナール
ヒトの白髪は、球根と外根鞘の両方に影響を及ぼす毛包メラノサイトの特異的枯渇と関連している。
Br. J. Dermatol.、150 (2004), pp.435-443
CrossRefView in ScopusGoogle Scholar
D'Melloら、2016年
S.A. D'Mello、G.J. Finlay、B.C. Baguley、M.E. Askarian-Amiri
メラニン形成におけるシグナル伝達経路
イント. J. Mol. Sci.、17 (2016)
pp.
グーグル スカラー
ダイら、2022年
D.M. Dai, Y. He, Q. Guan, Z.X. Fan, Y. Zhu, J. Wang, S. Wu, J. Chen, D. Le, Z.Q. Hu, et al.
組織老化の側面を研究するための貴重なツールとしての照射によるヒト白髪のモデリング
ジェロサイエンス (2022)
グーグルスカラー
ダイら、2023年
D.M. Dai, Y. He, Q. Guan, Z.X. Fan, Y. Zhu, J. Wang, S. Wu, J. Chen, D. Le, Z.Q. Hu, et al.
組織老化の側面を研究するための貴重なツールとしての照射によるヒト白髪のモデリング
ジェロサイエンス, 45 (2023), pp.1215-1230
CrossRefScopusGoogle Scholarで見る
デナットら、2014
L. デナット、A.L.カデカロ、L.マロ、S.A.リーチマン、Z.A.アブデルマレク
酸化ストレスの扇動者と犠牲者としてのメラノサイト
J. Invest. Dermatol., 134 (2014), pp.1512-1518
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
遠藤ら、2014年
M. 遠藤、青木宏、小林稔侍、國貞毅
メラノサイトの増殖・分化促進因子による白髪予防効果
日本皮膚科学会誌, 41 (2014), pp.716-723
CrossRefScopusGoogle Scholarで表示する。
エヴァンゲロウとイオアニディス、2013年
E. エヴァンゲロウ、J.P.イオアニディス
ゲノムワイド関連研究のためのメタアナリシス手法とその先
Nat Rev Genet, 14 (2013), pp.379-389
CrossRefScopusGoogle Scholarで見る
フーステリとミュレンダーズ, 2008
M. フーステリ、L.H.マレンダース
哺乳類細胞における転写共役型ヌクレオチド除去修復:分子機構と生物学的効果
細胞研究, 18 (2008), pp.73-84
CrossRefView in ScopusGoogle Scholar
フランブールら、2003
A. フランブール、P.ハレゴ、F.バルテンネック、C.トゥータン、F.ルロワ
エスニック・ヘアに関する現在の研究
J. Am. Acad. Dermatol., 48 (2003), pp.S115-S119
PDFを見る記事を見るScopusGoogle Scholarで見る
藤岡ら、2002
Y. 藤岡、木俣、野間口、渡辺、河野貴美子
DNA修復に関与するSMC5-SMC6複合体の新規非構造化染色体維持(SMC)構成因子の同定
J. Biol. Chem, 277 (2002), pp.21585-21591
PDFを見る記事を見るScopusGoogle Scholarで見る
Ge et al., 2020
Y. Ge, Y. Miao, S. Gur-Cohen, N. Gomez, H. Yang, M. Nikolova, L. Polak, Y. Hu, A. Verma, O. Elemento, et al.
加齢に伴う皮膚の微小環境は、幹細胞の挙動を規定する
Proc Natl Acad Sci U S A, 117 (2020), pp.5339-5350
CrossRefScopusGoogle Scholarで見る
ジーン, 2015
C. ジーン(Gene
オントロジー、ジーン・オントロジー・コンソーシアム:ゴーイング・フォワード
ヌクレイック・アシッズ・レズ, 43 (2015), pp.D1049-D1056
グーグル・スカラー
ジーセンら、2011
M. Giesen, S. Gruedl, O. Holtkoetter, G. Fuhrmann, A. Koerner, D. Petersohn
加齢はヒト毛包のケラチンおよびKAPの発現に影響を及ぼす
Exp Dermatol, 20 (2011), pp.759-761
CrossRefView in ScopusGoogle Scholar
ゴンら、2012
H. Gong, H. Zhou, G.W. McKenzie, Z. Yu, S. Clerens, J.M. Dyer, J.E. Plowman, M.W. Wright, R. Arora, C.S. Bawden, et al.
ケラチン関連タンパク質(KAP)の最新の命名法
Int. J. Biol. Sci., 8 (2012), pp.258-264
CrossRefScopusGoogle Scholarで表示する。
ゴーレンら、2017
A. ゴーレン、Z.ボランカ、T.ロッティ、M.シトゥム
産毛の白髪を再着色するための新規技術
Dermatol. サー,30(2017).
pp.
グーグル スカラー
ガンら、2009
D.A. Gunn, H. Rexbye, C.E. Griffiths, P.G. Murray, A. Fereday, S.D. Catt, C.C. Tomlin, B.H. Strongitharm, D.I. Perrett, M. Catt, et al.
年齢の割に若く見える女性がいる理由
PLoS One, 4 (2009), Article e8021
CrossRefScopusGoogle Scholarで見る
グプタら、2015
S. グプタ、A.クマール、A.マヘンドラ、S. Gupta
白斑における非培養表皮細胞懸濁液移植のためのドナー組織採取の低侵襲、無瘢痕化技術
J. Am. Acad. Dermatol., 73 (2015), pp.e213-e215
PDFを見る記事を見るScopusGoogle Scholarで見る
ハンら、2008
J. Han, P. Kraft, H. Nan, Q. Guo, C. Chen, A. Qureshi, S.E. Hankinson, F.B. Hu, D.L. Duffy, Z.Z. Zhao, et al.
ゲノムワイド関連研究により、髪の色と皮膚の色素沈着に関連する新規対立遺伝子が同定された
PLoS Genet.、4(2008)、記事e1000074
CrossRefScopusGoogle Scholarで表示する。
ハリスら、2013
M.L. Harris, K. Buac, O. Shakhova, R.M. Hakami, M. Wegner, L. Sommer, W.J. Pavan
出生後のメラノサイト系譜の維持とメラノサイト幹細胞前駆細胞の分化におけるSOX10の二重の役割
PLoS Genet, 9 (2013), Article e1003644
CrossRefScopusGoogle Scholarで見る
ハリスら、2018
M.L. Harris, T.D. Fufa, J.W. Palmer, S.S. Joshi, D.M. Larson, A. Incao, D.E. Gildea, N.S. Trivedi, A.N. Lee, C.P. Day, and al.
MITF、自然免疫、白髪の間の直接的な関連性
PLoS Biol, 16 (2018), 記事 e2003648
CrossRefScopusGoogle Scholarで見る
ハントら、2018年
S.E. Hunt, W. McLaren, L. Gil, A. Thormann, H. Schuilenburg, D. Sheppard, A. Parton, I.M. Armean, S.J. Trevanion, P. Flicek, and al.
エンセンブル・バリエーション・リソース
データベース(オックスフォード), 2018 (2018)
pp.
グーグル・スカラー
ハッシュチャら、2021年
Y. ハシュチャ、I.ブロ、L.オトン-ゴンザレス、G.D.マウロ、F.マルティーニ、M.トグノン、M.マッテイ
メラニン形成の制御におけるマイクロRNA
Int. J. Mol. Sci.、22(2021)年
pp
グーグル・スカラー
飯田ら、2020
M. 飯田、田崎淳、矢島一郎、大上直樹、田口直樹、後藤祐樹、熊坂正宏、A. Prevost-Blondel、河野正樹、秋山正樹、他。
がん原性RET保有マウスにおける加齢に伴う白髪の発生
エイジング・セル, 19 (2020), 記事 e13273
Scopusで見るGoogle Scholar
猪俣ら, 2009
K. 猪俣、青砥、N.T.Binh、岡本直樹、谷村聡、若山毅、井関聡、原英夫、増永徹、清水博、他。
遺伝毒性ストレスは、メラノサイト幹細胞の分化を促進することにより、メラノサイト幹細胞の更新を阻害する。
細胞, 137 (2009), pp.1088-1099
PDFを見る記事を見るScopusGoogle Scholarで見る
インターナショナルハップマップ他、2007年
C. International HapMap, K.A. Frazer, D.G. Ballinger, D.R. Cox, D.A. Hinds, L.L. Stuve, R.A. Gibbs, J.W. Belmont, A. Boudreau, P. Hardenbol, and al.
310万以上のSNPsからなる第2世代ヒトハプロタイプマップ
ネイチャー, 449 (2007), pp.851-861
Google Scholar
伊藤ら, 2002
M. 伊藤、木澤恭一郎、豊田誠一郎、諸橋眞一郎
バルジ領域のラベル保持細胞は、摘出後に細胞死に向かい、その後、生存する毛髪胚芽から治癒する
J Invest Dermatol, 119 (2002), pp.1310-1316
PDFを見る記事を見るScopusGoogle Scholarで見る
伊藤ら, 2004
N. 伊藤、伊藤忠、A.ベターマン、R.パウス
ヒト毛球はCRHの供給源であり標的である
J. Invest. 皮膚科学, 122 (2004), pp.235-237
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
伊藤ら、2005
N. 伊藤、伊藤忠、A. Kromminga、A. Bettermann、滝川雅彦、F. Kees、R. H. Straub、R. Paus
ヒト毛包は、視床下部-下垂体-副腎軸と同等の機能を持ち、コルチゾールを合成する
FASEB J., 19 (2005), pp.1332-1334
CrossRefScopusGoogle Scholarで表示する。
かねひさら、2016
M. 兼久、佐藤祥子、川島睦美、古道睦美、田辺真理子
遺伝子とタンパク質のアノテーションのための参照リソースとしてのKEGG
ヌクレイック・アシッズ・レズ, 44 (2016), pp.D457-D462
CrossRefScopusGoogle Scholarで表示する。
かねひさら、2017
M. 兼久, 古道, 田辺, 佐藤, 森島恭平
KEGG: ゲノム、パスウェイ、疾患、薬剤に関する新しい視点
ヌクレイック・アシッズ・レズ, 45 (2017), pp.D353-D361
CrossRefScopusGoogle Scholarで表示する。
カプランら、2011年
P.D. Kaplan, T. Polefka, G. Grove, S. Daly, L. Jumbelic, D. Harper, M. Nori, T. Evans, R. Ramaprasad, R. Bianchini
白髪:光保護された集団における色素の消失に伴う毛髪繊維の変化に関する臨床調査
Int. J. Cosmet. Sci, 33 (2011), pp.171-182
CrossRefScopusGoogle Scholarで表示する。
カウザーら、2011
S. カウザー、G.E.ウェストゲート、M.R.グリーン、D.J.トビン
ヒト毛包と表皮のメラノサイトは、カタラーゼが関与する老化プロファイルに顕著な違いを示す
J. Invest. Dermatol., 131 (2011), pp.979-982
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
キョウとウォルシュ、1965年
E.V.キョウ、R.J.ウォルシュ
ヒトの毛髪の白髪化率
ネイチャー, 207 (1965), pp.877-878
CrossRefScopusGoogle Scholarで見る
コボルトら、2013
D.C. Koboldt, K.M. Steinberg, D.E. Larson, R.K. Wilson, E.R. Mardis
次世代シーケンサー革命とゲノミクスへの影響
セル, 155 (2013), pp.27-38
PDFを見る記事を見るScopusGoogle Scholarで見る
クビスタら、2006年
M. Kubista, J.M. Andrade, M. Bengtsson, A. Forootan, J. Jonak, K. Lind, R. Sindelka, R. Sjoback, B. Sjogreen, L. Strombom, et al.
リアルタイムポリメラーゼ連鎖反応
Mol. アスペクツ・メッド, 27 (2006), pp.95-125
PDFを見る記事を見るScopusGoogle Scholarで見る
リーら、2021年
Y.I. Lee, S. Choi, W.S. Roh, J.H. Lee, T.G. Kim
皮膚微小環境における細胞老化と炎症について
Int. J. Mol. Sci., 22 (2021)
pp.
Google Scholar
リーら、2010
Y.S. Lee, D.W. Kim, S. Kim, H.I. Choi, Y. Lee, C.D. Kim, J.H. Lee, S.D. Lee, Y.H. Lee
NFAT2のダウンレギュレーションはB16メラノーマ細胞におけるメラニン形成を促進する
Anat. 細胞生物学, 43 (2010), pp.303-309
CrossRefGoogle Scholar
リーら、2022年
Y. Li, X. Ge, F. Peng, W. Li, J.J. Li
ヒト集団サンプルを解析する際に、一般的な差分発現法で生じる誇張された偽陽性
Genome Biol, 23 (2022), p. 79
グーグル・スカラー
リャオら、2017
C.P. Liao、R.C. Booker、S.J. Morrison、L.Q. Le
毛髪色素沈着のニッチを作る毛軸前駆体の同定
Genes Dev.、31(2017)、744-756ページ
CrossRefScopusGoogle Scholarで見る
リンとフィッシャー, 2007
J.Y.リン、D.E.フィッシャー
メラノサイトの生物学と皮膚の色素沈着
ネイチャー, 445 (2007), pp.843-850
クロスリーフScopusGoogle Scholarで見る
リューら、2013
F. リュー、ウェン、カイザー(M. Kayser)
ヒトにおけるカラフルなDNA多型
Semin. Cell Dev. Biol., 24 (2013), pp.562-575
PDFを見る記事を見るScopusGoogle Scholarで見る
マーアンドヘー、2022
Y. マー、C. ヘー
毛包組織が付着した毛軸根のリピドーム解析による加齢に伴う白髪の潜在的脂質バイオマーカーの探索
J Cosmet Dermatol, 21 (2022), pp.6118-6123
CrossRefView in ScopusGoogle Scholar
マルテインら、2014
J.A. Marteijn、H. Lans、W. Vermeulen、J.H. Hoeijmakers
ヌクレオチドエクスキジョン修復とがんおよび老化におけるその役割の理解
Nat. Rev. Mol. Cell Biol., 15 (2014), pp.465-481
CrossRefScopusGoogle Scholarで見る
マタマら、2015
T. マタマ、A.C.ゴメス、A.カヴァコ=パウロ
遺伝子制御によるヘアカラー化: ファクトかフィクションか?
トレンド・バイオテクノ, 33 (2015), pp.707-711
PDFを見る記事を見るScopusGoogle Scholarで見る
マツムラら、2016
H. 松村、毛利陽子、N.T.Binh、森永博之、福田真由美、伊藤真由美、倉田聡、J. Hoeijmakers、西村英紀
毛包の老化は、COL17A1タンパク質分解を介した幹細胞の経表皮排除によって引き起こされる
サイエンス, 351 (2016), p. aad4395
Scopusで見るGoogle Scholar
マクマレンとジャコヴィッチ、2004年
R. マクマレン、J.ヤチョヴィッチ
毛髪の光学的性質--様々な毛髪タイプにおける鏡面反射パターンの詳細な検討
J Cosmet Sci, 55 (2004), pp.29-47
Scopusで見るGoogle Scholar
ナグル、1995
W. ナグル
髭の色素性毛と白毛の成長速度の違い:分化と増殖の違い?
Br. J. Dermatol., 132 (1995), pp.94-97
CrossRefScopusGoogle Scholarで表示する。
中村ら、2013
M. 中村、M.R.シュナイダー、R.シュミット-ウルリッヒ、R.パウス
毛包の形態形成、循環、および/または構造に異常がある変異実験室マウス:最新情報
J. Dermatol. Sci., 69 (2013), pp.6-29
PDFを見る記事を見るScopusGoogle Scholarで見る
ニクら、2021
C. Nicu, J.D.B. O'Sullivan, R. Ramos, L. Timperi, T. Lai, N. Farjo, B. Farjo, J. Pople, R. Bhogal, J.A. Hardman, and al.
真皮脂肪組織はHGFを分泌し、ヒトの毛髪の成長と色素沈着を促進する
Journal of Investigative Dermatology, 141 (2021), p. 1633
PDFを見る記事を見るScopusGoogle Scholarで見る
西村ら, 2005
西村英紀、S.R.グランター、D.E.フィッシャー
白髪のメカニズム:ニッチにおけるメラノサイト幹細胞維持の不完全性
サイエンス, 307 (2005), pp.720-724
CrossRefScopusGoogle Scholarで表示する。
西村ら, 2010
西村英紀、鈴木雅之、V. Igras、J. Du、S. Lonning、宮地洋一、J. Roes、F. Beermann、D. E. Fisher
メラノサイト幹細胞維持におけるトランスフォーミング成長因子βの重要な役割
セルステムセル, 6 (2010), pp.130-140
PDFを見る記事を見るScopusGoogle Scholarで見る
オサリバンら、2021年
J.D.B.オサリバン、C.ニク、M.ピカール、J.シェレ、B.ベドニ、D.J.トビン、R.パウス
ヒトの白髪の生物学
Biol. Rev. Camb. Philos. Soc., 96 (2021), pp.107-128
CrossRefScopusGoogle Scholarで表示する。
パンハードら、2012
S. パンハード、I.ロザノ、G.ルスアン
人間の髪の白髪:世界的な調査、経験則「50」の再検討
Br. J. Dermatol, 167 (2012), pp.865-873
CrossRefScopusGoogle Scholarで表示する。
パパッチョら、2022年
F. パパッチョ、D.A.A、S.カプート、B.ベレーイ
皮膚の老化における酸化ストレスの寄与に着目して
アンチオキシダント(バーゼル), 11 (2022)
pp.
グーグル スカラー
パウスら、2014
R. パウス、E.A.ランガン、S.ヴィダリ、Y.ラモット、B.アンデルセン
毛包の神経内分泌学:原理と臨床的展望
トレンド・モル・メッド, 20 (2014), pp.559-570
PDFを見る記事を見るScopusGoogle Scholarで見る
パヴァンとシュトルム、2019年
W.J.パヴァン、R.A.スターム
ヒトの皮膚と毛髪の色素沈着の遺伝学
Annu Rev Genomics Hum Genet, 20 (2019), pp.41-72
CrossRefScopusGoogle Scholarで表示する。
ペレイラ=シルバら、2022年
M. ペレイラ=シルバ、A.M.マルティンス、I.ソウザ=オリベイラ、H.M.リベイロ、F.ベイガ、J.マルト、A.C. パイバ=サントス
ヘアケアとトリートメントにおけるナノマテリアル
アクタバイオマター, 142 (2022), pp.14-35
PDFを見る記事を見るScopusGoogle Scholarで見る
ピータースら、2013
E.M. Peters、C. Liezmann、K. Spatz、U. Ungethum、R.J. Kuban、M. Daniltchenko、 J. Kruse、 D. Imfeld、 B.F. Klapp、 R. Campiche
白髪のヒト毛包のmRNAプロファイリングは、その老化を評価するための有望な最先端ツールである:模範的報告
J Invest Dermatol, 133 (2013), pp.1150-1160
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
フィルポット、2021
M.P.フィルポット
髪が白髪になるのを見る
エライフ, 10 (2021)
pp.
グーグル・スカラー
ピライヤル他、2015年
T. ピライヤル、M.マニッカム、S.H.ユング
メラニン生成の阻害剤:特許レビュー(2009年~2014年)
エキスパート・オピニオン Ther. Pat.、25 (2015), pp.775-788
CrossRefScopusGoogle Scholarで見る
ポスピエヒら、2020
E. Pospiech, M. Kukla-Bartoszek, J. Karlowska-Pik, P. Zielinski, A. Wozniak, M. Boron, M. Dabrowski, M. Zubanska, A. Jarosz, T. Grzybowski, and al.
全エクソームデータとターゲットNGSデータを用いてDNAからヒト頭髪の白髪を予測する可能性を探る
BMCゲノミクス, 21 (2020), p. 538
Scopusで見るGoogle Scholar
プラエトリウスら、2013
C. Praetorius, C. Grill, S.N. Stacey, A.M. Metcalf, D.U. Gorkin, K.C. Robinson, E. Van Otterloo, R.S. Kim, K. Bergsteinsdottir, M.H. Ogmundsdottir, et al.
IRF4の多型は、チロシナーゼ依存のMITF/TFAP2A経路を通じてヒトの色素沈着に影響を与える
セル, 155 (2013), pp.1022-1033
PDFを見る記事を見るScopusGoogle Scholarで見る
ラモットら、2021年
Y. ラモット、M.ボーム、R.パウス
ヒト皮膚のトランスレーショナル神経内分泌学: コンセプトと展望
トレンド・モル. Med., 27 (2021), pp.60-74
PDFを見る記事を見るScopusGoogle Scholarで見る
リーズ,2003
J.L.リーズ
髪と肌の色の遺伝学
Annu. 遺伝学, 37 (2003), pp.67-90
CrossRefScopusGoogle Scholarで見る
リヴィエールら、2011
J.B. Riviere, S. Ramalingam, V. Lavastre, M. Shekarabi, S. Holbert, J. Lafontaine, M. Srour, N. Merner, D. Rochefort, P. Hince, and al.
シナプス小胞の軸索輸送体であるKIF1Aは遺伝性感覚・自律神経障害2型に変異している
Am. J. Hum. Genet., 89 (2011), pp.219-230
PDFを見る記事を見るGoogle Scholar
ルザンキナら, 2007
Y. Ruzankina, C. Pinzon-Guzman, A. Asare, T. Ong, L. Pontano, G. Cotsarelis, V.P. Zediak, M. Velez, A. Bhandoola, E.J. Brown
成体マウスにおける発生学的に必須な遺伝子ATRの欠失は、加齢に関連した表現型と幹細胞の喪失をもたらす
細胞幹細胞, 1 (2007), pp.113-126
PDFを見る記事を見るScopusGoogle Scholarで見る
シュノアら、1998
P. シュノア、J.ナイボー、P.ランゲ、G.イェンセン
13,000人の男女における長寿と白髪、禿げ、顔のしわおよび老人性円弧:Copenhagen City Heart Study
J. Gerontol. A Biol. Sci. Med. Sci., 53 (1998), pp.M347-M350
CrossRefScopusGoogle Scholarで見る
シュウエイら、2010
K. Schouwey, L. Larue, F. Radtke, V. Delmas, F. Beermann
メラノサイトにおけるNotchの遺伝子組み換え発現は、RBP-Jkappa依存のシグナル伝達を示す
色素細胞メラノーマ研究, 23 (2010), pp.134-136
Scopusで見るGoogle Scholar
下村・クリスティアーノ, 2010
Y. 下村、A.M.クリスティアーノ
毛髪の生物学と遺伝学
Annu Rev Genomics Hum Genet, 11 (2010), pp.109-132
CrossRefScopusGoogle Scholarで表示する。
シンら、2015
H. シン、リュウ・エイチ、ユン・ジェイ、ジョウ・セイ、ジャン・セイ、チェ・マイ、クォン・オ、ジョウ・セイチ
早発白髪と家族歴、喫煙、肥満との関連:横断的研究
J. Am. Acad. Dermatol., 72 (2015), pp.321-327
PDFを見る記事を見るScopusGoogle Scholarで見る
シッキンクら、2020年
S.K. Sikkink, S. Mine, O. Freis, L. Danoux, D.J. Tobin
ヒト白髪の毛包におけるストレス感知: カンジタ症になりやすい頭皮の毛球メラノサイトにおけるAtaxia Telangiectasia Mutated (ATM) depletion
Sci. Rep., 10 (2020), p. 18711
ScopusGoogleスカラーで見る
Steingrimssonら、2004年
E. ステイングリムソン、N.G.コープランド、N.A.ジェンキンス
メラノサイトと小眼球の転写因子ネットワーク
Annu. Rev.Genet.、38 (2004), pp.365-411
CrossRefScopusGoogle Scholarで表示する。
シュトゥルム, 2009
R.A.シュトルム
ヒトの色素多様性の分子遺伝学的研究
Hum. Mol. Genet., 18 (2009), pp.R9-R17
CrossRefScopusGoogle Scholarで見る
スレムら、2008
P. Sulem, D.F. Gudbjartsson, S.N. Stacey, A. Helgason, T. Rafnar, M. Jakobsdottir, S. Steinberg, S.A. Gudjonsson, A. Palsson, G. Thorleifsson, et al.
ヨーロッパ人における色素沈着の2つの遺伝的決定因子が新たに同定される
Nat. Genet., 40 (2008), pp.835-837
CrossRefView in ScopusGoogle Scholar
スジンスカ=ザイチクら、2014年
J. スジンスカ=ザイチク、O. ウティロ、H. ヤクボウスキ
メチオニンによる高ホモシステイン血症およびブレオマイシンヒドロラーゼ欠損は、腎臓病に関与するマウス腎臓タンパク質の発現を変化させる
Mol. Genet. Metab.、112 (2014), pp.339-346
PDFを見る記事を見るScopusGoogle Scholarで見る
トビンら、1998
D.J. トビン、E. ハーゲン、V.A. ボッチカレフ、R. パウス
毛球メラノサイトは毛包退行(カタゲン)時にアポトーシスを起こすか?
J Invest Dermatol, 111 (1998), pp.941-947
PDFを見る記事を見るScopusGoogle Scholarで見る
トビンとパウス、2001年
D.J.トビン、R.パウス
白髪:毛包色素ユニットのジェロントバイオロジー
Exp Gerontol, 36 (2001), pp.29-54
PDFを見る記事を見るScopusGoogle Scholarで見る
ヴァン・ビークら、2008
N. van Beek, E. Bodo, A. Kromminga, E. Gaspar, K. Meyer, M.A. Zmijewski, A. Slominski, B.E. Wenzel, R. Paus
甲状腺ホルモンはヒト毛包の機能を直接変化させる:毛母細胞の増殖と毛髪色素沈着の両方を刺激するアナゲン延長作用
J. Clin. Endocrinol. メタブ, 93 (2008), pp.4381-4388
CrossRefView in ScopusGoogle Scholar
ヴァンネステ、2004
D. ヴァン・ネステ
女性の頭髪の太さ、髄鞘、成長率は、加齢に伴う色素沈着と頭皮の位置によって大きく変化する。
Eur. J. Dermatol., 14 (2004), pp.28-32
Scopusで見るGoogle Scholar
ヴァンネステとトビン、2004年
D. ヴァン・ネステ、D.J.トビン
毛周期と毛髪色素沈着:動的相互作用と加齢に伴う変化
ミクロン, 35 (2004), pp.193-200
PDFを見る記事を見るScopusGoogle Scholarで見る
ヴェイスら、1993
D.J.ベイス、C.M.ソレンソン、J.R.シャッター、S.J.コルスマイヤー
Bcl-2欠損マウスは、劇症型リンパ球のアポトーシス、多嚢胞性腎臓、および低色素性毛髪を示す。
セル, 75 (1993), pp.229-240
PDFを見る記事を見るScopusGoogle Scholarで見る
ワイスブロッドら、2018年
O. ワイスブロッド、J.フリント、S.ロセット
症例対照研究におけるSNPベースの遺伝率および遺伝的相関を直接および要約統計で推定する
Am. J. Hum. Genet., 103 (2018), pp.89-99
PDFを見る記事を見るScopusGoogle Scholarで見る
ウッドら、2009年
J.M. Wood, H. Decker, H. Hartmann, B. Chavan, H. Rokos, J.D. Spencer, S. Hasse, M.J. Thornton, M. Shalbaf, R. Paus, et al.
老人性白髪: H2O2を介した酸化ストレスは、メチオニンスルホキシド修復を鈍らせることでヒトの髪色に影響を与える
FASEB J., 23 (2009), pp.2065-2075
CrossRefView in ScopusGoogle Scholar
ウーら、2022年
S. Wu, Y. Yu, C. Liu, X. Zhang, P. Zhu, Y. Peng, X. Yan, Y. Li, P. Hua, Q. Li, et al.
シングルセル・トランスクリプトミクスにより、ヒト頭皮毛包の系統軌跡が明らかになり、白髪のメカニズムに迫る
Cell Discov, 8 (2022), p. 49
グーグル・スカラー
呉・張、2020年
Y. 呉、K.Zhang
高次元のシングルセルRNAシーケンスデータ解析のためのツール
Nat Rev Nephrol, 16 (2020), pp.408-421
Google Scholar
Yuら、2012年
M. Yu, R.H. Bell, M.M. Ho, G. Leung, A. Haegert, N. Carr, J. Shapiro, K.J. McElwee
ヌクレオチド切除修復ファミリー遺伝子(特にERCC3)活性の欠損は、非色素性毛髪繊維の成長に関連する
PLoS One, 7 (2012), Article e34185
CrossRefScopusGoogle Scholarで表示する。
Zhangら、2020
B. Zhang、S. Ma、I. Rachman、M. He、P. Baral、S. Choi、W. A. Goncalves、Y. Shwartz、E. M. Fast、Y. Su、et al.
交感神経の過活性化がメラノサイト幹細胞の枯渇を促進する
Journal of Investigative Dermatology, 140 (2020), p. S102-S102
グーグルスカラー
チャンら、2021年
Y. Zhang、Z. Lv、Y. Liu、H. Cao、J. Yang、B. Wang
PIN1はPI3K/Akt/mTOR経路の阻害により、毛髪細胞および聴覚HEI-OC1細胞を老化から保護する
Oxid. Med. セル(Cell. Longev., 2021 (2021), p. 9980444
スコープスで見るGoogle Scholar
周ら、2018年
S. 周、P.A.ディオン、G.A.ルーロー
頭蓋内動脈瘤の遺伝学
ストローク, 49 (2018), pp.780-787
CrossRefScopusGoogle Scholarで表示する。
Zhouら、2021年
S. Zhou, H. Zeng, J. Huang, L. Lei, X. Tong, S. Li, Y. Zhou, H. Guo, M. Khan, L. Luo, et al.
メラニン生成のエピジェネティック制御
エイジング・レズ・レヴ, 69 (2021), 記事 101349
PDFを見る記事を見るScopusGoogle Scholarで見る
引用者:(0)
© 2023 The Author(s). 発行:エルゼビアB.V.
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
Copyright © 2023 Elsevier B.V.またはそのライセンサーもしくは寄稿者。ScienceDirect® はElsevier B.V.の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
