
持久系アスリートにおける運動時の血漿内生エンドトキシンコア抗体の反応性
スポーツ医学の国際ジャーナル
ティーメ・メディカル・パブリッシャーズ
持久系アスリートにおける運動時の血漿内生エンドトキシンコア抗体の反応性
パスカル・ヤング、クリストファー・ラウチ、[...]、リカルド・J・S・コスタ
論文追加情報
要旨
本研究は、実験室で制御された労作ストレスおよび労作-熱ストレスが血漿中の内因性エンドトキシン中核抗体(EndoCAb)濃度に及ぼす影響について調査することを目的とした。44名(男性26名、女性18名)の持久力トレーニング(V̇ O 2max 56.8min/kg/min)参加者は、以下のいずれかを行った。P1-2h 高強度インターバル走、P2-2h 60%V̆O2max 35°C T amb、P3-3h 60%V̆O2max 23°C T ambのいずれかを実施した。血漿中のIgM、IgA、IgG濃度を測定するため、運動前後に血液を採取した。血漿Igの運動前の全体的な安静時濃度は、それぞれ173MMU/ml、37AMU/ml、79GMU/mlであった。血漿IgM濃度は、すべてのプロトコルで運動前後で大きな変化はなく、IgMの運動前後の変化の大きさはプロトコル間で差がなかった(p=0.135)。血漿中IgAとIgGは、P2のみ運動前後に増加したが(それぞれp=0.017、p=0.016)、標準範囲内(35-250MU/ml)にとどまった。P2はP1、P3と比較して、血漿中IgA(p=0.058)、IgG(p=0.037)に大きな障害を生じた。EndoCAbについては、運動前および運動に伴う変化について、生物学的性別の間に実質的な差は観察されなかった。労作ストレスおよび労作-熱ストレスは,全身性のEndoCAb反応に緩やかな障害をもたらし,運動消化器病学においてEndoCAbバイオマーカーは管理実験デザインに対して低感度な反応を示すことが示唆された.
キーワード:消化管,上皮,エンドトキシン,炎症性サイトカイン,免疫グロブリン,運動
はじめに
持久的運動は,運動誘発性胃腸症候群(EIGS)1 2 3 4 の主要経路(循環器-神経内分泌-胃腸)により,胃腸上皮の健全性障害を促進することが明らかにされている.これらの障害の二次的な結果として、上皮の破裂を伴うまたは伴わない腸管上皮細胞傷害および透過性亢進が生じることがある。このような腸管上皮の完全性の障害は、腸管内腔から病原性物質(リポ多糖(LPS)などの細菌性エンドトキシン)の循環への移行をもたらし、長時間の激しい運動ストレスで一般的に観察される全身性の炎症反応を高める可能性があります5 6 。これらのEIGSバイオマーカーは、暑い中での運動(周囲温度35℃以上)、すなわち中心体温39.0℃以上の運動7 8 9 10、および運動時間が長い(3時間以上)場合に悪化するようである11 。これらのバイオマーカーの増加は、運動による熱ストレスおよび運動ストレスの持続時間が、運動による消化管の健全性の障害の大きさ、ひいては腸管内腔由来の病原細菌の移動の大きさに重要な役割を果たす可能性を示唆している。上皮の健全性が損なわれると、このような転 移は臨床的(敗血症など)または亜臨床的(胃腸症状 など)な意味を持つことがある4 12 13 14 15 16 、運動に対する障害と 関連する可能性がある17 18 19 。
全身性エンドトキシン血症は、以前の野外調査により、細菌性エンドトキシンの運動前後での変化量が5pg/ml以上で、それに伴って抗エンドトキシン抗体免疫グロブリン(Ig)、すなわちIgMおよびIgGが減少するものと分類されているが、これらの運動による変化は、潜在的曝露および免疫寛容のために、まだ臨床的意義は明らかにされていない12 13 20 21 22 23 24 . さらに、野外研究および実験室対照研究のいずれにおいても、抗エンドトキシン抗体の裏付けとなる分析を行わずに血漿中エンドトキシン濃度を測定することが一般的である。しかしながら、最近の実験室管理型研究では、内因性エンドトキシンコア抗体(EndoCAb)がEIGSバイオマーカーの一群に組み込まれており、抗エンドトキシン抗体の測定は、エンドトキシン評価(例えば、LAL発色エンドポイントアッセイ)単独と比較して、耐久運動に対するエンドトキシン転流活性のより包括的かつ信頼性の高い解釈を提供するかもしれないと示唆している9 10 25。本提案は、以下によるものである。1) 検体の採取、処理、および分析手続き上の問題 26 27 28 ; 2) 循環細菌性エンドトキシンの免疫および肝クリアランスに対する責任 29 30 31 ; 3) 病原性を有する膨大な数の細菌性エンドトキシンをグローバルに検出する評価手順の欠如 32 33 34 35 . これらの潜在的な限界は、運動随伴性エンドトキシ ン血症の全容や、運動随伴性エンドトキシン血症を正確に判断 するための交絡因子としての寄与を覆い隠す可能性がある。
EndoCAb は主にリンパ球の B 細胞や形質細胞によって産生され、多くのグラム陰性細菌種抗原に反応する 22 。そのため、血漿中 EndoCAb 濃度は、全身性エンドトキシン暴露のマーカーとなることが示唆されている36 。健康なヒトの安静時血漿中濃度は 35-250 MU/ml である。この値は、抗体価の高い健康な献血者において観察された中央値と一致する37 38 。適度な急性の一過性エンドトキシン曝露(例えば、≦0.3 EU/ml)に反応して、リンパ球Bおよび/または形質細胞の免疫活性化に関連した循環EndoCAb(例えば、〜100〜250 MU/ml)の一過性の増加がある36 39 40。敗血症の場合のように、全身的なエンドトキシン負荷(例えば 0.5-1.0 EU/L)が大きいと、 EndoCAb の減少(例えば≦35 MU/ml)が観察されるが、これはおそらく、抗体利用の増加により、ベースラインおよび現場での生産レベルを上回 るためであろう。この機能的側面は、EndoCAb が、EIGS 評価 9 10 25 41 の一環として、運動関連全身性エンドトキシン、およびその後の全身性炎症反応プロファイルを全体的かつ正しく解釈する上で重要な役割を果たす可能性を示唆している。
そこで本研究では、労作ストレスおよび労作-熱ストレスが全身性 EndoCAb(すなわち、IgG、IgM、および IgA の総称)濃度に及ぼす影響について調査することを目的とした。これまでの運動消化器研究の成果や、全身性エンドトキシン曝露に伴うEndoCAbの変化の臨床症状に基づいて、提案した労作ストレスではEndoCAbの濃度が上昇し、労作-熱ストレスでは反応が抑制されると仮定した。
材料と方法
参加者
持久走のトレーニングを受けた44人(男性26人、女性18人)が、この研究と実験にボランティアとして参加した(表1)。すべての参加者は、地元の倫理委員会の承認を得た上で、書面によるインフォームドコンセントを提供し、「人間研究倫理に関する2008年ヘルシンキ宣言」に準拠し、「国際スポーツ医学ジャーナル」の倫理基準を満たしている42 。この研究室の標準的な除外基準は、以前に報告されている17 。女性参加者については、月経周期の初期~中期卵胞期(n=14)、経口避妊薬服用時(n=1)、または閉経後(n=3)に実験試験が予定されていた。安静時エストロゲン値(DKO003/RUO; DiaMetra, Italy)は検証のために測定され(50 pg/ml未満)、試験間で差はなかった43 。
表サムネイル
表1 3種類の実験的ランニング運動プロトコルのいずれかを実施したボランティアの記述的参加者特性(P1-HIIT:温帯環境下でのプライオメトリック・ドロップジャンプを伴う2時間の高強度インターバルトレーニング・ランニング、P2-EHS:ランニング・トレーニング、P2-EHS:ランニング・トレーニング)。
予備評価
最初の実験に先立ち、身長(Stadiometer, Holtain Limited, Crosswell, Crymych, United Kingdom)、多周波生体電気インピーダンス分析(MBIA, Seca 515 MBCA, Seca Group, Hamburg, Germany)による体重および身体組成、V̇ O 2max(Vmax Encore Metabolic Cart, Carefusion, San Diego, CA, United States)を記録し、ランニング運動の手順を熟知した上で、ベースラインの測定を実施した。V̇ O 2maxは、既報の通り、電動トレッドミル(Technogym, Cesena, Italy)上で自発的疲労までの連続増分運動テストによって推定した44 。各運動試行の走行速度を決定するために、1%の勾配で V̇ O 2maxの約60%の速度(10.1±1.6km/h)を決定し、V̇ O 2 - ワークレートの関係から検証した。また、高強度インターバルトレーニング(HIIT)については、約50(7.3±1.0)km/h、55-60(8.6±1.4)km/h、70-75(10.5±1.6)km/h、80-85(12.3±2.0)km/h)% V❸Maxと1%勾配の速度を外挿して検証を実施した。
実験手順
運動負荷試験の1週間後に低FODMAP食(9.8±2.1MJ/日(143±31kJ/kg/日)エネルギー、351±64g/日(5.1±0.9g/kg/日、総エネルギー摂取量の62%)糖質、92±33g/日タンパク質(1.0±0.5g/kg/日)を提供された。 炭水化物:92±33 g/日、たんぱく質:1.3±0.5 g/kg/日、総エネルギー摂取量:16%)、脂質:56±21 g/日、食物繊維:44±8 g/日、総FODMAP:2±0 g/日)であり、前日食からのGIS交絡を軽減するために実施した7 45. 食事と水分は、持久系アスリートのための現行の栄養ガイドラインに従って設計され、Cunningham方程式によって決定された推定1日総エネルギー消費量は、非トレーニング日の安静時に調整された46 。さらに、FODMAPに特化したデータベース(Monash University, FoodWorks Professional 7, Xyris, Brisbane, Australia)により、1食あたり2g未満のFODMAPを提供することを目的とした。参加者は、試験前の標準的な低FODMAP食(2.9±0.7 MJ、99±28 g炭水化物、25±6 gタンパク質、20±5 g脂質、11±4 g繊維、1±1 g総FODMAP)を0700時に摂取し、0800時に実験室に報告された。この食事は運動開始の2時間前に摂取され、対象者における実際のトランスレーショナルな実践をシミュレートしている47 48。処方食を記載した食事記録により、摂取の遵守と食品の無駄を判断した。参加者は、各試験の48時間前に激しい運動を控えた。
運動開始の0900時前に、参加者はヌード体重測定と総体水分量(TBW)を測定するためのMBIAの前に排泄するよう指示された。血液サンプルは、前十二指腸静脈からヘパリンリチウム(6ml、1.5IU/mlヘパリン)およびK 3 EDTA(4ml, 1.6mg/ml EDTA)バキューテナーに静脈穿刺により採取された。運動前の安静時直腸温(T re )は、参加者が外肛門括約筋の12cm先に熱電対を挿入して記録した(Alpha Technics Precision Temperature 4600 Thermometer, Oceanside, CA)。他で報告されている運動による消化器系介入研究の一環として、参加者は3つの持久運動プロトコルのうちの1つを実施した(図1)。

図1
図 1
3 種類の運動プロトコルの模式図。P1-HIIT:温暖な環境下での2時間の高強度インターバルトレーニング、P2-EHS:高温環境下での2時間の定常走行、P3-SS:...である。
プロトコル1(P1-HIIT):参加者(n=17)は脱水状態(血漿浸透圧:291±8 mOsmol/kg、TBW:60.7±3.4%)で開始し、温帯環境条件(周囲温度(T amb )23.4±0.9℃ 相対湿度(RH)43±7%)、デュアルファン風速設定 10.6 km/時の条件で2時間高強度インターバルランニング運動(HIIT)セッションに参加しました。プロトコルは、55-60% V゙ O 2maxで3.5分間のランニング、65-70% V゙ O 2maxで1分間のランニング、75-80% V゙ O 2maxで30分間のランニング、そして、交互に足を開いてのプライオメトリック ドロップ(50cm)ジャンプを20回繰り返した。その後、参加者はトレッドミルに戻り、20分サイクルが終了するまで歩いた。これを6回繰り返した。運動中、参加者には3ml/kgBM/h(208±32ml/h)に相当する室温の水が提供された。2時間のプロトコルの総距離は16.2±2.5 kmで、120回のプライオメトリック・ドロップジャンプが行われた。運動による体重減少および運動後の血漿浸透圧はそれぞれ1.8±1.0%および293±10 mOsmol/kgであった。
プロトコル2(P2-EHS)。プロトコール2(P2-EHS):参加者(n=14)は無水状態(血漿浸透圧:296±4 mOsmol/kg、TBW:59.4±3.5%)から、高温環境下(T amb 35.7±0.9°C, 23.3%±3.2% RH)、デュアルファン風速 10.6 km/hの環境下で、60% V̇ O 2maxを表すあらかじめ定められたスピードの電動トレッドミル上で走る運動を2時間実施する労熱的ストレス(EHS) を受けた。プログラム飲水によるGISの発生を最小限に抑えるため、飲水パターンの自律性のために室温の水を自由摂取させた(662±279 ml)。2時間のプロトコルの総走行距離は21.5±3.3 kmであった。運動による体重減少および運動後の血漿浸透圧はそれぞれ2.1±0.9%および297±6 mOsmol/kgであった。
プロトコル3(P3-SS)。参加者(n=13)は無水状態(血漿浸透圧:293±9 mOsmol/kg, TBW:57.5±3.5% )から、温帯環境下(T amb 23.1±1.2℃, 43.6±5.5% RH)、デュアルファン風速を10.6 km/hに設定して、60% V̇ O 2maxを表す速度をあらかじめ決定し、モーター付きトレッドミルで3時間の定常走行(SS)エクササイズを実施した。運動中、参加者は最初の2時間、0分とその後20分ごとに64±15g/h、10%w/v、509mOsmol/kgの室温糖質(ブドウ糖-果糖液)飲料を与えられ、水は自由に摂取することを許可された。最初の2時間の総水分摂取量は650±147 ml/hであった。3時間目には室温の水を自由摂取させ、276±15mlとした。3時間のプロトコルの総走行距離は27.3±2.1 kmであった。運動によるBMロスおよび運動後の血漿浸透圧はそれぞれ1.1±0.4%および292±9 mOsmol/kgであった。
運動プロトコルは、消化管上皮の完全性を臨床的および性能的に重要なレベルまで乱すことが知られている過去の運動実験モデルに従って採用された。標準的な生理学的負荷変数(すなわち、T re、心拍数(HR)、自覚的労作評価(RPE)、McGinnis 13点熱的快適性評価(TCR)、体格)は、既報の通り、ランニング中に一定の間隔で測定した7 11 49 50 51 。運動直後には、血液サンプルを採取し、既報と同様にヌード体格を測定した。
試料分析
全血ヘモグロビンはヘモキューシステム(Hb201; HemoCue, Ängelholm, Sweden)により、ヘマトクリットはマイクロヘマトクリットリーダー(ThermoFisher Scientific)を用いたキャピラリー法により、いずれもヘパリン全血試料から決定された。ヘモグロビンおよびヘマトクリット値は、ベースラインに対する血漿量(P V )の変化を推定するために用いられ、血漿変数の補正に使用された。残りのヘパリンおよびK 3 EDTA全血試料は、試料採取後15分以内に4000 rpm(1500 g)で10分間遠心分離された。血漿は 1.5 ml マイクロチューブに分注し,分析まで -80°C で凍結した.ただし,2 x 50 µl ヘパリン血漿は凍結点浸透圧法 (Osmomat 030, Gonotec, Berlin, Germany) により血漿浸透圧 (P Osmol ) を二重測定 (CV: 1.7%) に使用した.内因性エンドトキシンコア抗体(EndoCAb)IgM、IgA、およびIgGの血漿濃度は、ELISA(EndoCAb, HK504, Hycult Biotech, Uden, Netherlands)により測定された。すべての変数は、製造元の指示に従い、各プレートに標準品と対照品を置いて二重に分析され、各参加者は同じプレートでアッセイされた。血漿中IgM、IgA、IgGのCVは、それぞれ7.9%、7.7%、13.2%であった。
データ解析
主要な研究に対する十分な統計的検出力の確認は、既に述べたとおりである。データ収集時の参加者と研究者は、データが様々な労作および労作-熱ストレスプロトコルに反応する運動前後の血漿抗エンドトキシン抗体濃度の分析に使用されることを知らなかった。統計検定、平均、標準偏差、効果量に基づき、標準アルファ値(0.05)とベータ値(0.80)を適用すると、今回の参加者サンプルサイズは、運動の大きさとサブグループの有意差を検出するための十分な統計的検出力(検出力* 0.80-0.99)を提供し、EIGS 9 10 25 52 53 に対する消化管上皮の完全性バイオマーカーの調査に以前使用した参加者サンプルサイズと同じになると推定された。本文中の記述的データは、平均値±標準偏差(SD)で表示されている。本文および表中の一次および二次変数データは、特に断りのない限り、平均値および95%信頼区間として表示した。図中のデータは、わかりやすくするために、個々の回答および平均値で示した。すべてのデータは、適切なパラメトリックまたはノンパラメトリック統計検定を適用する前に、Shapiro-Wilks検定により正規分布が確認された。一対の標本t検定またはノンパラメトリック検定(Wilcoxon signed-rank)は、運動負荷における運動前後の抗エンドトキシン抗体濃度を評価するために使用された。一元配置分散分析またはノンパラメトリック(Wilcoxon signed-rank)、およびポストホック分析が、運動負荷間の運動前の抗エンドトキシン抗体濃度および運動前後の反応の大きさを評価するために使用された。統計はSPSS統計ソフトウェア(v.27.0、IBM SPSS Statistics、IBM Corp.、Armonk、NY、USA)を用いて分析し、p<0.05で有意性が認められた。
結果
食事と運動のコントロール
P1-HIIT、P2-EHS、P3-SSにおいて、参加者に提供された食品・水分と実際の消費量との間に有意差は認められなかった。全体として、3つの実験デザインにおいて、参加者に提供された食品および水分の95%以上が消費された。すべての参加者は、各試験の48時間前に激しい運動を控えることを確認した。
生理的・体温調節的負荷
P1-HIITでは、RPE(p<0.001)に有意な変化が認められたが、HR(160(157→163)bpm)およびTCR(8(8→9))は認められず、最初の20分間のHIITサイクル(11(10→11))から第4サイクル(80分、13(12→14))およびそれ以降(120分、14(12→15))にRPEが増加することが確認された。T reは運動前と運動直後に測定され、運動前(36.5(36.1→36.8)℃)から運動後(37.9(37.6→38.1)℃)に有意な上昇(p<0.001)が観察されました。
P2-EHS中のRPE(p=0.02)では、運動開始15分(10(9→11))に比べ、運動終了時(120分)(13(11→14))に有意な増加が観察された。運動前の安静時値(37.0(36.8→37.3)℃)から、運動30分後から運動終了時(ピークT re : 38.9(38.5→39.4)℃) までT reが有意に上昇した(p<0.001)。HRは144(134→153)bpm(15-min)から158(145→172)bpm(120-min)へ上昇したが、その上昇幅は有意でなかった。TCRはP2-EHSを通して一定であった(9(9→9))。
P3-SSではRPE(p=0.002)とT re(p=0.036)に有意な変化がみられた。RPEは運動開始90分から終了まで(13(12→15))、30分(11(10→11))に比べ増加した。T reは、運動前(36.9(36.7→37.1)℃)に比べ、運動終了までの30分間(ピークT re : 38.6(38.3→38.8)℃) で上昇した。HRは133(128→138)bpm(15分)から141(134→148)bpm(180分)へ上昇したが、その上昇幅は有意でなかった。TCRはP3-SSを通して一定であった(8(7→8))。
血漿中EndoCAb濃度に対する運動プロトコルの影響
各プロトコルの運動前後の血漿濃度を表2に記載する。血漿IgM、IgA、IgGの運動前の全体的なレベルは、それぞれ173(132から214)MMU/ml、37(29から44)AMU/ml、79(48から109)GMU/ml(平均と95%CI)であった。運動前の安静時血漿中IgM濃度はプロトコル間で有意差があり(p=0.035)、P2-EHSはベースライン平均値が最も低かった(表2)。運動前の血漿中IgA濃度(p=0.742)およびIgG濃度(p=0.308)はプロトコル間で有意差はみられなかった。P1-HIITとP3-SSでは、すべてのEndoCAbの血漿中濃度は、運動前と運動後で有意差はなかった。P2-EHSでは、IgA(p=0.017)、IgG(p=0.016)の抗エンドトキシン抗体の血漿中濃度が運動前から運動後まで有意に上昇したが、IgM(p=0.158)の血漿中濃度は上昇していなかった。
表サムネイル
表2 3種類の実験用ランニング運動プロトコル(P1-HIIT:温帯環境下でのプライオメトリック・ドロップジャンプを伴う2時間の高強度インターバルトレーニング・ランニング、...)の運動前後の抗エンドトキシン抗体血漿中濃度。
プロトコール間の血漿中EndoCAb濃度
図2は、プロトコール間の抗エンドトキシン抗体血漿濃度の運動前と運動後の変化の平均値と参加者個人の大きさを示している。血漿中IgM濃度の運動前後の変化の大きさには、プロトコル間で有意差はなかった(p=0.135)。血漿中IgA濃度については、プロトコール間で有意差はなかったが、運動前後の変化の大きさに傾向がみられた(p=0.058)。血漿中IgG濃度の運動前と運動後の変化の大きさについては、プロトコル間で有意差が認められた(p=0.037)。しかし、多重検定のBonferroni補正により有意性を調整したところ、抗エンドトキシン抗体IgGの運動前後の変化の大きさについては、プロトコル間で有意差は認められなかった(p>0.05)。
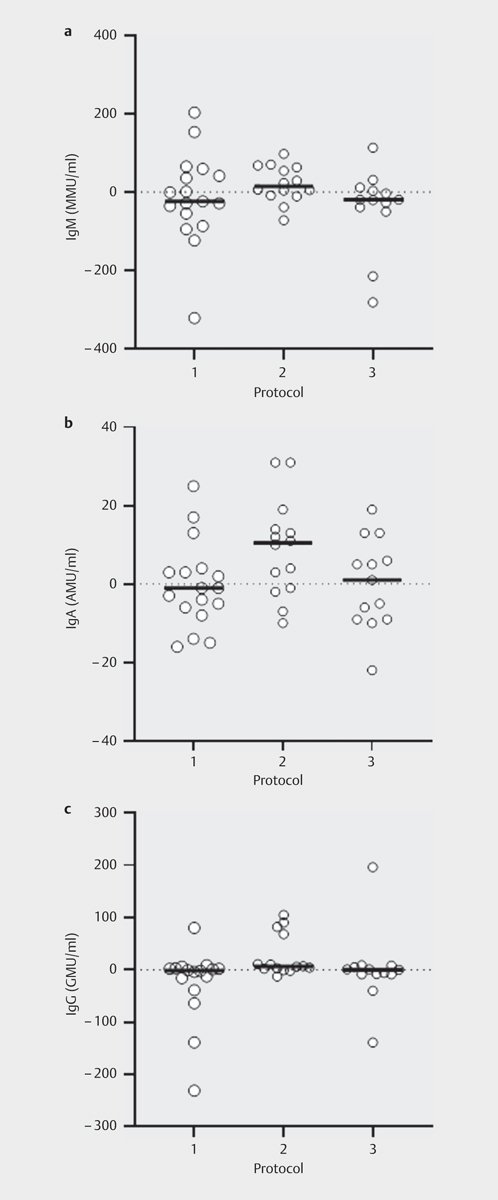
Fig 2
図2
3種類の異なるランニング運動プロトコル(P1-HIIT:2時間の高強度インターバル運動、P2-HIIT:2時間の高強度インターバル運動、P2-HIIT:2時間の高強度インターバル運動)における内因性エンドトキシン中核抗体(EndoCAb)IgM(A)、IgA(B)およびIgG(C)の血漿濃度の運動前後の変化の大きさ(P1-HII)。
血漿中EndoCAbの生物学的性状別
運動前の抗エンドトキシン抗体濃度IgM、IgA、IgGは、3つの運動プロトコルで男女とも同じであった。運動に対する抗エンドトキシン抗体IgA(p<0.05)の血漿濃度には生物学的性別の有意差があり、運動前から運動後にかけて女性参加者の平均増加(8.61 (2.48 to 14.70) AMU/ml)と男性参加者の減少(- 1.34 (-5.57 to 2.90) AMU/ml) ( Fig 3 ) がみられた。
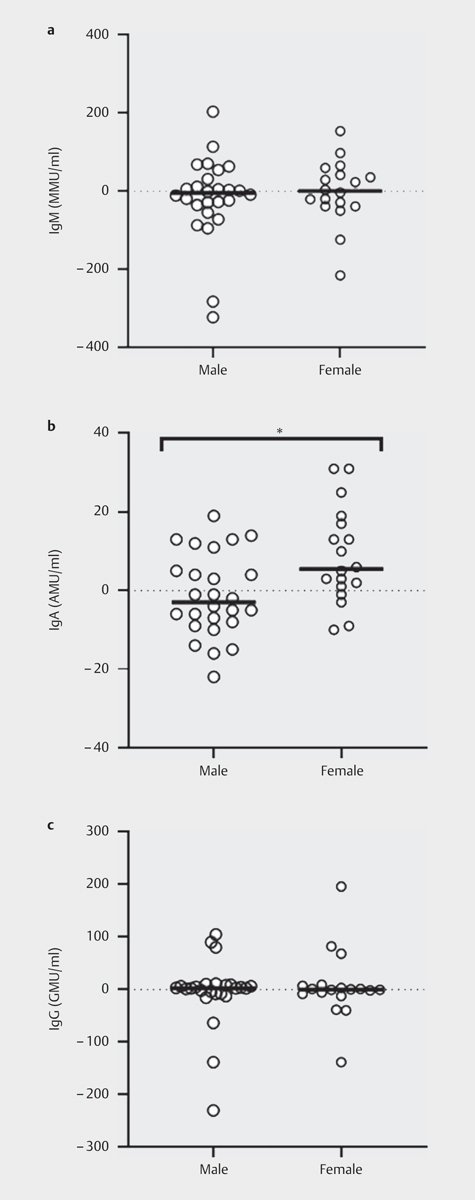
Fig 3
図3
内因性エンドトキシンコア抗体(EndoCAb)IgM(A)、IgA(B)、IgG(C)の血漿濃度の運動前から運動後への変化の大きさ(生物学的性別)。平均値および個々の反応(n=44):p< 0.05 vs 生物学的性別。異常値を削除
考察
本研究は、労作ストレスおよび労作-熱ストレスが全身EndoCAb濃度に及ぼす影響を調査することを目的とした。我々の知る限り、本研究は、様々な運動ストレスモデルに対するEndoCAb反応を包括的に評価し、運動に対する消化管上皮の完全性を乱すことが知られている交絡因子の人為的影響を避けるために厳格なコントロールを用いた最初のものである。我々の仮説に反して、本研究で測定されたすべての全身性抗エンドトキシン類抗体は、3時間の定常運動と2時間の高強度インターバル走で特徴づけられる労作ストレスに大きな影響を受けることはなかった。すべてのEndoCAb Igが労作-熱ストレスに反応して減少すると予想される代わりに、血漿IgA(Δ運動前から運動後(9(2〜16)AMU/ml))とIgG(27(3〜50) GMU/ml)濃度で有意な増加が観察され、血漿IgM濃度(21(-6〜47)MMU/ml)では観察されなかった。しかし、IgAとIgGの変化の大きさは控えめで、安静時の健常者集団の標準値の範囲内であった37 38 。腸管内腔病原性エンドトキシンの全身循環への移行を示す間接的なバイオマーカーは、運動ストレスに特に敏感でないことが示唆された。これは、次のような背景がある。1)本研究における厳密な交絡因子制御(すなわち、運動前および運動中の食事・水分摂取、水分補給状態、概日変動、周囲環境、女性の月経周期、EIGS悪化因子として知られる生理的・熱的負荷の測定)3、2)使用した運動実験モデルの多様性、3)実験モデルの全体的身体負荷は、EIGS促進要因と同義1 2)である。さらに、EndoCAb反応に男女間の有意差(生物学的性差)が観察されたが、その差の大きさは控えめで、安静にしている健康なヒト集団の標準的な参照値の範囲内にあり、臨床的関連性はないようである。
健常者では、安静時の EndoCAb の血漿濃度は免疫力として十分であり、高 Ig 力価の健常者献血に基づくと、35 から 250 MU/ml の任意の値の範囲にある37 38 。全身循環中のEndoCAb反応は、主に微生物のエンドトキシン(例えば、大腸菌のような様々な病原性細菌からの粗面と平面のLPSやリピドA)をタグ付けし、免疫細胞の検出、中和、自然免疫反応や適応免疫反応によるクリアランスに働く 22 54 55。例えば、EndoCAb活性の機構的説明としては、Fc受容体抗体依存性の食細胞の免疫活性化(すなわち、IgA)、補体依存性の細胞傷害性(すなわち、IgMおよびIgG)、および/または抗体依存性の細胞傷害性(すなわち、IgAおよびIgG)56 57 58 が考えられる。適度な急性一過性エンドトキシン曝露(例えば、≦0.3 EU/ml、30 pg/mlに相当)に反応して、循環エンドトキシン曝露活性化により、エンドトキシンの由来する細菌種に関係なく、一般的に循環エンドトキシンCAB(例えば、IgM≧250 MU/ml、IgG〜100〜250 MU/ml)が一過性に増加することが以前に記録された 36 39 40。敗血症の場合のように、かなりの全身エンドトキシン負荷(例えば、0.5-1.0 EU/L、50-100 pg/mlに相当)がある一方で、EndoCAbの低下が観察され(例えば、≦35 MU/ml)、これはおそらく、抗体利用の増加により、ベースラインの開始および現場での生産レベルを無効にしたと考えられる36 39 40 59 。したがって、臨床的意義は35MU/ml未満で示され、病気や病原性感染に反応してIg消費量>産生量となり、免疫抑制状態にあることが示唆される36 . 本研究では、血漿中EndoCAb IgM、IgA、IgGの運動前安静時レベルは、それぞれ173 (132 から 214) MMU/ml、37 (29 から 44) AMU/ml、79 (48 から 109) GMU/ml であった。したがって、血漿中IgA濃度は、IgMおよびIgGの濃度よりも一般に低いことが認識され、受け入れられているが、これはIgAが消化管内腔で主に機能し(例えば、上皮細胞を通じて内腔にIgAを分泌)、必ずしも内部循環に含まれないため60であると考えられる。今回の研究でIgAとIgGが含まれたことは、科学文献への新しい貢献であるが、IgMの運動前安静時値は、これまでの研究と同様であり、90から127MMU/mlの平均値が報告されている9 10 25。EndoCAbの運動前の安静時値は、本研究のプロトコルと過去の研究で大きく異なるが、安静時の標準的な範囲内であった。
EndoCAb の循環レベルは、全身循環における軽度のエンドトキシンの存在に反応して上昇するが、重度の過度のエンドトキシン負荷に反応して低下することが報告されている 36 59 。エンドトキシン血症と EndoCAb の反応との間のこのような臨床的特徴は、運動研究においても観察されている。トライアスロンやマラソンなどの長時間の持久系競技やウルトラマラソンでは、検出可能な全身性エンドトキシン負荷が生じ、それに伴って EndoCAb IgM や IgG が減少する 20 21 22 23 、さらに SIRS を模した全身性炎症性サイトカインの変動が認められる 13 。したがって、十分な大きさの労作ストレスおよび/または労作-熱ストレスが同様の結果を示すと予想される。2時間の労作-熱ストレス(60% V ̆ O 2max , 35°C T amb)を使用し、運動後の血漿中エンドトキシン負荷(Δ 9.6 pg/ml)を報告した実験室の対照研究では、20℃および 30°C T ambでの運動と比較して、抗エンドトキシン抗体 IgM(12%)が適度に減少し、より大きな全身性炎症反応を伴うことも観察されている 9 10 25。水分補給のために水を消費する労作-熱ストレスモデルを除けば、他のすべての運動モデルは、栄養補給の有無にかかわらず、運動前から運動後にかけて血漿中IgM濃度の上昇を示した。他の研究では、より微妙なストレスモデルを用いており、その後、運動前後の抗エンドトキシン抗体値(例えば、30分間の60-65%心拍予備、温帯および高温環境下での90分までの歩行)に全くあるいは非常に小さな障害がないことを報告している62 63 64 。これらの観察から、労作による熱ストレスと労作ストレスの持続時間が、運動に関連した消化管の健全性の障害の大きさ、ひいては腸管内腔由来の病原微生物の転位量の大きさに重要な役割を果たす可能性があることが示唆される。
本研究では、2時間の高強度インターバル走とプライオメトリックジャンプは、循環EndoCAb値の実質的な変化を促進しないことが明らかになった。この運動ストレス負荷は、sCD14、LBP、SIR-profileに実質的な変化をもたらさないことが報告されていることを考慮すれば、これは驚くべきことではない49 50 51 。同様に、3時間の定常走行では、IgMが運動前と運動後で23%減少したものの、循環血中EndoCAb値に実質的な変化はなかったが、その程度は大きくなく、個人差が大きいことが示された。これらの結果は、この運動ストレス負荷が運動前後のsCD14、LBP、SIR-profileの大幅な増加をもたらすことが以前に報告されていることを考えると驚くべきことである11 、運動関連内毒素血症の何らかの証拠が示唆されたが、それに応じてEndoCAbが反応しなかったことを示す。最後に、2時間の労作-熱ストレスは、すべてのEndoCAbを中程度に増加させ、IgMは有意に増加させることができなかった。これらの結果は、同じ運動と熱負荷を用いた以前の研究で、IgM反応の低下が報告されていることを考えると、驚くべきものであった9 25 。しかし、EIGSと同義である実質的な胃腸の完全性障害(循環器-胃腸経路)を促進するために設定された目標閾値(すなわち≥39.0℃)に達しなかった本研究(すなわち38.9℃および10-ホット)に比べ、先行研究のピークT reおよびTCRは大きかった(それぞれ39.6℃および11-ベリーホット)ことに留意することが重要であり、このことから、EndoCAb成果、すなわちIgMにおける差異について何らかの洞察を得られる可能性もある。しかしながら、本研究の労作による熱ストレスは、運動前後の sCD14、LBP、SIR-profile 7 のわずかな増加を伴っており、軽度のエンドトキシン曝露であり、敗血症を伴う EndoCAb 全身への放出および消費と同義ではないことを示唆している36 。研究および実践の観点から、運動前後の血漿中EndoCAb Ig濃度が標準値内であったことを総合すると、熱負荷を追加した、または追加しない激しい長時間運動の実験プロトコルでも、EndoCAbが臨床的に関連するほど大きくはならない(例えば、250 MU/ml以上の活性化または35 MU/ml未満の抑制)ことがわかりますが、これは超持久系のフィールドイベントでのみ観察されているものです。
結論として、労作および労作-熱ストレスは、EIGSと同義であり、病原性細菌エンドトキシンの全身循環への移行とそれに続く全身性炎症反応につながる腸管上皮の完全性の乱れは、循環EndoCAb濃度に適度な障害をもたらすことが判明した。運動前後の値はいずれも健常者の標準範囲内であり、運動によるEndoCAbバイオマーカー(IgM、IgA、IgG)の変化の大きさは、様々な労作および労作-熱ストレス負荷に対して低い反応感受性を示すことが示唆された。EIGSでは、EndoCAb Igを全身循環におけるエンドトキシン暴露を検出するマーカーとして使用するという以前の提案は、運動モデル内で、主要バイオマーカーではなく、補助的バイオマーカーとして慎重に使用すべきであるとされています。
謝辞
まず最初に、この研究にボランティアで参加してくれたすべての参加者、モナシュ大学スポーツ栄養学・極限生理学グループ、および社内外の協力者に対し、様々な実験デザインの開発支援から、データおよびサンプル収集、および/またはサンプル分析中の実験室での支援まで、実験手順に沿った支援をいただいたことに感謝したい。また、モナシュ大学の Graduate Research Industry Partnership- Food and Dairy Program(P1)の一環として、産業界の協力者である Greg Holden と Katrina Strazdins の支援と産業界の意見に感謝したい。著者は、本研究の結果が明確かつ正直に、捏造、改ざん、および/または不適切なデータ操作なしに提示されていることを宣言する。R.J.S.C.が研究の着想と設計を行い、R.J.S.C.、C.E.R.、S.K.G、および I.R. が実験を行い、 R.J.S.C.、 P.Y.., とZ.D.がデータを分析し、実験結果を解釈した。P.Y.は図を作成した。P.Y.とR.J.S.C.は原稿を起草し、P.Y.とC.E.R.とS.K.G., I.R., Z.D. and R.J.S.C.が編集し改訂し最終版の承認をした。P1は、Monash University Industry Partnership (GRIP) プログラムの一環として、Lion Dairy&Drink Australia Pty Ltdの支援を受けた。P2は、モナシュ大学、医学看護健康科学部、栄養学食餌学&食品学科、Be Active Sleep Exercise (BASE) Facilityの支援を受けた。P3は、2019年ウルトラスポーツ科学財団の助成を受けた。資金提供者は、実験プロトコルの開発、データ収集、分析、結果の解釈には関与していない。また、知見の報告に関しても制限を設けなかった。
脚注
利益相反 著者らは、利益相反がないことを宣言する。
論文情報
Int J Sports Med. 2022 Nov; 43(12): 1023-1032.
オンライン公開 2022 Jul 22. doi: 10.1055/a-1827-3124
PMCID:PMC9622302
PMID:35426092
Pascale Young,1 Christopher Rauch,1 Isabella Russo,1 Stephanie Gaskell,1 Zoe Davidson,1 and Ricardo J. S. Costa1
1オーストラリア、クレイトン、モナシュ大学医学部看護・健康科学科栄養学・食物学
通信 准教授 Ricardo J. S. Costa Monash University, Dept Nutrition Dietetics & Food, Level 1, 264 Ferntree Gully Road, 3168 Notting Hill, Victoria, , Australia, 00 61 3 99024270 , Fax: 00 61 3 99024270, ude.hsanom@atsoc.odracir
Received 2022 Jan 23; Accepted 2022 Apr 5.
Copyright The Author(s). 本論文は、Creative Commons Attribution-NonDerivative-NonCommercial-License の条件の下、Thieme が発行したオープンアクセス論文であり、原著作物に適切なクレジットが付与されている限り、コピーと複製を許可する。コンテンツは、営利目的での使用、または翻案、リミックス、変形、構築することはできません。(https://creativecommons.org/licenses/by-nc-nd/4.0/)。
本論文は、Creative Commons Attribution-NonCommercial-NoDerivatives Licenseの条件の下で配布されるオープンアクセス論文であり、非商業目的に限り、無制限の複製と配布、および、原著を適切に引用した上で、非商業目的に限り、改作物の使用と複製(配布ではない)を許可しています。
参考文献
Costa RJ S, Gaskell S K, McCubbin A J et al. Exertional-heat stress associated gastrointestinal perturbations-management strategies for athletes preparing for and competing in the 2020 Tokyo Olympic Games.熱ストレスによる胃腸障害と2020年東京オリンピックに向けたアスリートの管理戦略. 温度(オースティン)2020;7:58-88。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Costa R J, Snipe R M, Kitic C M et al. Systematic review: exercise- induced gastrointestinal syndrome-implications for health and intestinal disease. Aliment Pharmacol Ther. 2017;46:246-265. [PubMed][Google Scholar].
Gaskell S K, Costa RJ S, Lis D. Sydney, NSW, Australia: 2021. Gaskell SK, Costa RJS, Lis D. 第21章:運動誘発性胃腸症候群、胃腸障害、食物不耐性およびアレルギー. で。バークL、ディーキンV、ミネハンM(EDS)。臨床スポーツ栄養学、6e。マグロウヒル教育。[Google Scholar].
Gaskell S K, Rauch C E, Costa RJ S. Gastrointestinal assessment and therapeutic intervention for the management of exercise-associated gastrointestinal symptoms: a case series translational and professional practice approach.「運動に関連する胃腸症状の管理のための胃腸評価と治療的介入:ケースシリーズのトランスレーショナルおよびプロフェッショナルプラクティスアプローチ」. フロントフィジオール、2021;12:719142。[PMC無料記事] [PubMed] [Google Scholar].
Peake J M, Della Gatta P, Suzuki K et al. 骨格筋細胞によるサイトカインの発現と分泌:調節機構と運動効果. Exerc Immunol Rev. 2015;21:8-25. [PubMed][Google Scholar].
Suzuki K, Tominaga T, Ruhee R T et al. 排気的運動に対する全身性炎症反応の特徴および調節と酸化ストレスとの関連. Antioxidants. 2020;9:401. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Gaskell S K, Taylor B, Muir J et al. 24時間低・高発酵性オリゴ・ジ・モノ・サッカライド・ポリオール食が労作-熱ストレスに対する運動誘発性胃腸症候群のマーカーに与える影響. Appl Physiol Nutr Metab. 2020;45:569-580. [PubMed][Google Scholar].
Snipe R, Costa RJ S. Does the temperature of water ingested during exertional-heat stress influence gastrointestinal injury, symptoms, and systemic inflammatory profile? J Sci Med Sport. 2018;21:771-776. [PubMed] [Google Scholar] を参照してください。
Snipe R, Khoo A, Kitic C et al. 労作-熱ストレスが胃腸の完全性、胃腸の症状、全身性エンドトキシンおよびサイトカインプロファイルに与える影響. Eur J Appl Physiol. 2018;118:389-400. [PubMed] [Google Scholar].
Snipe R, Khoo A, Kitic C et al. 長時間ランニング中の軽度の熱ストレスは、腸管上皮傷害と胃腸症状を悪化させる. Int J Sports Med. 2018;39:255-263. [PubMed] [Google Scholar].
Gaskell S K, Parr A, Rauch Cら、Diurnal versus nocturnal exercise-impact on the gastrointestinal tract.日中運動と夜間運動の違いによる消化管への影響。Med Sci Sports Exerc. 2021;53:1056-1067. [PubMed][Google Scholar].
Gill S K, Hankey J, Wright A et al. 24時間ウルトラマラソンが循環系エンドトキシンとサイトカインプロフィールに与える影響. Int J Sports Med. 2015;36:688-695. [PubMed][Google Scholar].
Gill S K, Teixeira A, Rama Lら、多段階ウルトラマラソン競技中の労作-熱ストレスに対する循環器エンドトキシン濃度およびサイトカインプロファイル。Exerc Immunol Rev. 2015;21:114-128。[PubMed][Google Scholar].
Laitano O, Leon L R, Roberts W O et al. 労作性熱中症の診断、予防、治療における論争(Controversies in exertional heat stroke diagnosis, prevention, and treatment). J Appl Physiol (1985) 2019;127:1338-1348。[PubMed][Google Scholar].
Roberts W O, Armstrong L E, Sawka M N et al. ACSM expert consensus statement on exertional heat illness: recognition, management, and return to activity.労作性熱中症に関するACSM専門家コンセンサスステートメント(ACSM expert consensus statement on exertional heat illness: recognition, management, and return to activity)。Curr Sports Med Rep.2021;20:470-484。[PubMed][Google Scholar].
Robson-Ansley P, Toit G D. Pathophysiology, diagnosis and management of exercise-induced anaphylaxis(運動誘発性アナフィラキシーの病態、診断、管理). Curr Opin Allergy Clin Immunol. 2010;10:312-317. [PubMed] [Google Scholar].
Gut-training: the impact of two weeks repetitive gut-challenge during exercise on gastrointestinal status, glucose availability, fuel kinetics, and running performance.コスタ R J, ミオール A, クー A 他(ガットトレーニング:運動中の2週間の反復ガットチャレンジが消化管状態、グルコース利用可能性、燃料動態、ランニングパフォーマンスに及ぼす影響)。Appl Physiol Nutr Metab. 2017;42:547-557. [PubMed] [Google Scholar].
Costa R J, Snipe R, Camões-Costa V et al. 胃腸症状および皮膚科的損傷がウルトラマラソン競技中の栄養摂取量および水分補給状態に与える影響. Sports Med Open. 2016;2:16. [PMC無料論文] [PubMed] [Google Scholar].
Miall A, Khoo A, Rauch Cら、2週間の反復的なガットチャレンジは、運動に関連する胃腸症状および吸収不良を軽減する。Scand J Med Sci Sports. 2018;28:630-640. [PubMed] [Google Scholar].
Bosenberg A T, Brock-Utne J Gら、激しい運動は全身性エンドトックス血症を引き起こす。J Appl Physiol (1985) 1988;65:106-108。[PubMed] [Google Scholar].
長距離レース後の疲労したランナーにおける内毒素血症。S Afr Med J. 1988;73:533-536. [PubMed] [Google Scholar].
Camus G, Nys M, Poortmans J R et al. Endotoxaemia, production of tumour necrosis factor alpha and polymorphonuclear neutrophil activation following strenuous exercise in human. Eur J Appl Physiol Occup Physiol 1998;79:62-68。[PubMed] [Google Scholar].
Camus G, Poortmans J, Nys M et al. Mild endotoxaemia and the inflammatory response induced by a marathon race(軽度の内毒素血症とマラソンレースによる炎症反応). Clin Sci. 1997;92:415-422. [PubMed] [Google Scholar].
Camus G, Nys M, Poortmans J R et al. Possible in vivo tolerance of human polymorphonuclear neutrophil to low-grade exercise-induced endotoxaemia. Mediators Inflamm. 1998;7:413-415. [PMC フリーアーティクル] [PubMed] [Google Scholar].
スナイプ R、クー A、キティック C 他 労作-熱ストレス時の炭水化物およびタンパク質摂取は、腸管上皮傷害および小腸透過性を改善する。Appl Physiol Nutr Metab. 2017;42:1283-1292. [PubMed] [Google Scholar].
Basauri A, González-Fernández C, Fallanza M et al. LPSとLPS結合分子間の生化学的相互作用. Crit Rev Biotechnol. 2020;40:292-305. [PubMed][Google Scholar].
Cao Y、Zhang Y、Qiu F. エンドトキシンの低回収率とエンドトキシン検出への影響。Biopolymers. 2021;112:e23470. [PubMed】【Google Scholar】。
Gnauck A, Lentle R G, Kruger M C. Limulus Amebocyte Lysate assay may be unsuitable for detecting endotoxin in blood of healthy female subjects. J Immunol Methods. 2015;416:146-156. [PubMed][Google Scholar].
Gnauck A, Lentle R G, Kruger M C. Chasing a ghost? ヒト血液中のエンドトキシンの循環レベルの測定の問題点。Crit Rev Clin Lab Sci. 2016;53:197-215. [PubMed][Google Scholar].
Gnauck A, Lentle R G, Kruger M C. The characteristics and function of bacterial lipopolysaccharides and their endotoxic potential in humans.(細菌性リポ多糖の特性と機能およびヒトにおける内毒性ポテンシャル). Int Rev Immunol. 2016;35:189-218. [PubMed][Google Scholar].
Guerville M, Boudry G. Gastrointestinal and hepatic mechanisms limiting entry and dissemination of lipopolysaccharide into the systemic circulation(リポ多糖の全身循環への侵入と拡散を制限する消化管と肝臓のメカニズム). Am J Physiol Gastrointest Liver Physiol. 2016;311:G1-G15。[PubMed][Google Scholar].
Hurley J C, Nowak P, Öhrmalm L et al. グラム陰性菌による菌血症が疑われる患者の診断手段としての内毒素血症:40年間の研究のメタアナリシス(A meta-analysis of 4 decades of studies). J Clin Microbiol. 2015;53:1183-1191. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Irving A T, Mimuro H, Kufer T A et al. 免疫受容体NOD1およびキナーゼRIP2は、初期エンドソーム上の細菌ペプチドグリカンと相互作用してオートファジーと炎症シグナルを促進する。Cell Host Microbe. 2014;15:623-635. [PubMed] [Google Scholar].
Kaparakis-Liaskos M, Ferrero R L. Immune modulation by bacterial outer membrane vesicles. Nat Rev Immunol. 2015;15:375-387. [PubMed] [Google Scholar].
Kulp A, Kuehn M J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles.(細菌外膜小胞の生物学的機能と生合成). Annu Rev Microbiol. 2010;64:163-184. [PMC フリーアーティクル] [PubMed] [Google Scholar].
エンドトキシン曝露のマーカーおよび予後指標としての内因性エンドトキシンコア抗体(EndoCAb):レビュー(Review). Prog Clin Biol Res.1995;392:263-272。[PubMed] [Google Scholar].
Scott B B, Barclay G R. IgG antibodies to Gram-negative endotoxin in human sera. II. を⽤いて、エンドトキシンコアに対する交差反応性抗体のオプソニン活性を調べた。セロディアグ イミュン インフ D. 1990;4:39-51. [Google Scholar]
Scott B B, Barclay G R, Smith DG E 他:ヒト血清中のグラム陰性エンドトキシンに対する IgG 抗体。I. LPS コアに対する抗体によるリポポリサッカライド(LPS)の交差反応性。セロディアグ イミュン インフ D. 1990;4:25-38. [Google Scholar].
Barclay G R. Antibodies to Endotoxin in Health and Disease(健康と病気におけるエンドトキシンに対する抗体). Rev Med Microbiol. 1990;1:133-142. [Googleのスカラー]を
グラム陰性敗血症性ショックの 3 例における抗エンドトキシン-IgG 抗体およびエンドトキシン血症の変化。循環ショック。1989;29:93-106. [PubMed][Google Scholar].
Bennett C, Snipe R, Henry R et al. Is the gut microbiota bacterial abundance and composition associated with intestinal epithelial injury, systemic inflammatory profile, and gastrointestinal symptoms in response to exertional-heat stress? J Sci Med Sport. 2020;23:1141-1153. [PubMed][Google Scholar].
Harriss D J, Macsween A, Atkinson G. Ethical Standards in sport and exercise science research: 2020年最新版。Int J Sports Med. 2019;40:813-817. [PubMed] [Google Scholar].
Snipe RM J, Costa RJ S. Does biological sex influence intestinal epithelial injury, small intestine permeability, gastrointestinal symptoms and systemic cytokine profile in response to exertional-heat stress? J Sports Sci. 2018;36:2827-2835. [PubMed] [Google Scholar].
Costa R J, Oliver S J, Laing S J et al. 運動後の炭水化物-タンパク質摂取のタイミングが選択した免疫指標に与える影響。Int J Sport Nutr Exerc Metab. 2009;19:366-384. [PubMed] [Google Scholar].
Ong D K, Mitchell S B, Barrett J S et al. Manipulation of dietary short chain carbohydrates alters the pattern of gas production and genesis of symptoms in irritable bowel syndrome.食事性短鎖炭水化物の操作により、過敏性腸症候群の症状発現のパターンが変化する。J Gastroenterol Hepatol。2010;25:1366-1373. [PubMed] [Google Scholar].
トーマスD T、Erdman K A、バークLM。スポーツ医学のアメリカ大学共同ポジションステートメント。栄養とアスレチックパフォーマンス。Med Sci Sports Exerc. 2016;48:543-568. [PubMed][Google Scholar].
Costa R J, Gill S K, Hankey J et al. Perturbed energy balance and hydration status in ultra-endurance runners during a 24 h ultra-marathon. Br J Nutr.2014;112:428-437。[PubMed][Google Scholar].
Costa R J, Swancott A, Gill S et al. Compromised energy and macronutrient intake of ultra-endurance runners during a multi-stage ultra-marathon conducted in a hot ambient environment.高温環境下での多段階ウルトラマラソンにおけるウルトラ耐久ランナーのエネルギーおよび多量栄養素の摂取量。Int J Sports Sci.2013;3:51-61。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Russo I, Della Gatta P A, Garnham A et al. Carbohydrate and carbohydrate-protein containing recovery beverage を用いた運動回復過程の全般的な評価. Front Physiol.2021;12:628863。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Russo I, Della Gatta P A, Garnham A et al. 乳製品をベースにした回復飲料の栄養組成は、運動後の胃腸と免疫状態、およびその後の高強度インターバル運動に対する回復最適化のマーカーに影響を与えるか?Front Nutr.2021;7:622270。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Russo I, Della Gatta P A, Garnham A.The effects of an acute "train-low" nutritional protocol on markers of recovery optimization in endurance-trained male athletes.The effects of an acute "train-low" nutritional protocol on markers of recovery optimization in endurance-trained male athletes. Int J Sports Physiol Perform 2021; 16: 1764-1776 [PubMed].
Costa RJ S, Camões-Costa V, Snipe RM J et al. The impact of exercise-induced hypohydration on intestinal integrity, function, symptoms, and systemic endotoxin and inflammatory responses.運動による低水和が腸の完全性、機能、症状、および全身のエンドトキシンと炎症反応に及ぼす影響について。J Appl Physiol (1985) 2019;126:1281-1291に記載されています。[PubMed] [Google Scholar].
Snipe R, Costa RJ S. Does the temperature of water ingested during exertional-heat stress influence gastrointestinal injury, symptoms, and systemic inflammatory profile? J Sci Med Sport. 2018;21:771-776. [PubMed] [Google Scholar] を参照してください。
Gonzalez-Quintela A, Alende R, Gude F et al. 一般成人集団における免疫グロブリン(IgG, IgA, IgM)の血清レベルおよびアルコール摂取、喫煙、一般的な代謝異常との関連性. Clin Exp Immunol. 2008;151:42-50. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hurley J C, Nowak P, Öhrmalm L et al. Endotoxemia as a diagnostic tool for patients with suspected bacteremia caused by gram-negative organisms: a meta-analysis of 40 years of studies. J Clin Microbiol. 2015;53:1183-1191. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cavaillon J M, Adib-Conquy M. Bench-to-bedside review: Endotoxin tolerance as a model of leukocyte reprogramming in sepsis.ベンチからベッドサイドへのレビュー:敗血症における白血球再プログラムのモデルとしてのエンドトキシン耐性。Crit Care. 2006;10:233. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Keyt B A, Baliga R, Sinclair A M et al. Structure, function, and therapeutic use of IgM antibodies.(キート B ア、バリガ R、シンクレア A M 他、IgM 抗体の構造、機能、および治療目的). Antibodies. 2020;9:53. [PMC フリーアーティクル] [PubMed] [Google Scholar].
López-Collazo E, del Fresno C. Pathophysiology of endotoxin tolerance: mechanisms and clinical consequences. Crit Care。2012;17:242. [PMC無料記事] [PubMed][Googleスカラー]。
Allan E, Poxton I R, Barclay G R. Anti-bacteroides lipopolysaccharide IgG levels in healthy adults and sepsis patients(健常者と敗血症患者における抗バクテロイデス菌リポ多糖IgGレベル)。FEMS Immunol Med Microbiol. 1995;11:5-12. [PubMed] [Google Scholar] 。
Bemark M, Angeletti D. Know your enemy or find your friend? 粘膜表面におけるIgAの誘導。Immunol Rev. 2021;303:83-102。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Hoffman M D, Snipe RM J, Costa RJ S. Ad libitum drinking adequately supports hydration during 2 h of running in different ambient temperatures(異なる周囲温度での2時間のランニング中、自由摂取の飲酒は水分補給を適切にサポートする。Eur J Appl Physiol. 2018;118:2687-2697. [PubMed] [Google Scholar].
Nehlsen-Cannarella S L, Nieman D C, Jessen J et al. 急性中等度運動のリンパ球機能と血清免疫グロブリンレベルへの影響. Int J Sports Med. 1991;12:391-398. [PubMed][Google Scholar].
また、「震災の影響により、被災された方々への支援活動や、被災地の復興に貢献できるような活動を行いたい。Aviat Space Environ Med. 1989;60:634-638. [PubMed] [Google Scholar].
高血圧患者の自然免疫反応と適応免疫反応に対する1回の最大下限持久運動の効果。J Sports Med Phys Fitness 2022; 62: 244-249 [PubMed].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
