
腸内細菌叢を標的とした食事はヒトの免疫状態を変化させる
腸内細菌叢を標的とした食事はヒトの免疫状態を変化させる
Hannah C. Wastyk, Gabriela K Fragiadakis, [...], and Justin L. Sonnenburg
論文追加情報
関連データ
補足資料
データの利用可能性
要約
食事は腸内細菌叢を調節し、その結果、免疫系に影響を与える可能性がある。ここでは、植物性食物繊維または発酵食品という2つのマイクロバイオータを標的とした食事介入が、健康な成人におけるヒトのマイクロバイオームおよび免疫系にどのような影響を及ぼすかを明らかにした。17週間の無作為前向き研究(n = 18/arm)を、広範な免疫プロファイリングを含むマイクロバイオームと宿主のオミックス測定と組み合わせて実施し、食事特有の効果を見いだした。高繊維食は、微生物群集の多様性が安定しているにもかかわらず、マイクロバイオームがコードする糖鎖分解CAZymesを増加させた。Cytokine Response Score(主要評価項目)は変化しなかったが、高繊維食摂取者における3つの異なる免疫学的トラジェクトリーは、ベースラインの微生物相の多様性に対応したものであった。あるいは、高発酵食品食は、微生物叢の多様性を着実に増加させ、炎症性マーカーを減少させた。このデータは、食事介入と詳細かつ縦断的な免疫およびマイクロバイオームプロファイリングとを組み合わせることで、個人および集団全体の知見が得られることを強調している。発酵食品は、工業化社会に蔓延するマイクロバイオームの多様性の低下と炎症の増加に対抗する上で有用である可能性がある。
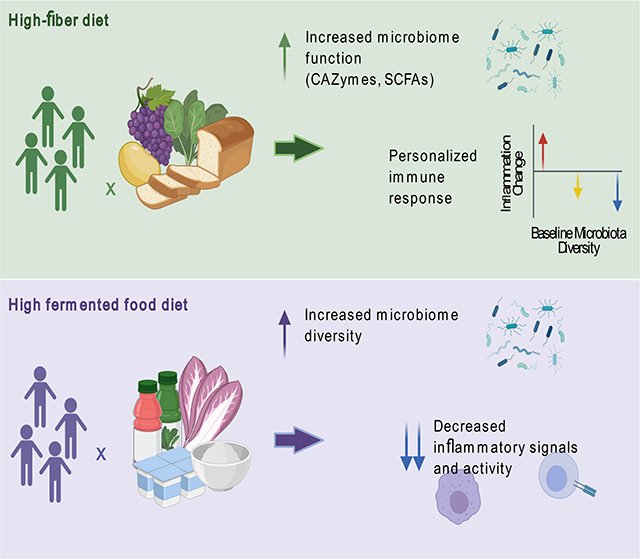
グラフィカルアブストラクト
画像やイラストなどを保持する外部ファイル。
オブジェクト名は nihms-1722178-f0001.jpg です。
はじめに
人間の健康における腸内細菌叢(マイクロバイオーム)の重要性(Lynch and Pedersen, 2016)から、この微生物群の構成と機能に影響を与える要因について理解を深める必要がある。食事は、微生物叢の組成および機能における駆動因子として浮上している(Flintら、2017;Mueggeら、2011;Rothschildら、2018;Zhernakovaら、2016)。ヒトにおける食事と微生物叢の間の深い関連性は、例えば、長期的な食事パターンと微生物叢の多様性、分類学的組成、およびマイクロバイオーム遺伝子含有量の測定との結合によって、多数の方法で実証されている(Smitsら、2017;Jhaら、2018;Yatsunenkoら、2012;Arumugamら、2011)。前向き食事介入試験中の食事の短期的な変化も、ヒトの腸内細菌叢を急速に変化させることが示されている(David et al.、2014)。しかし、私たちや他の研究者は、短期間(数日から数ヶ月)のヒトの微生物叢の一般的な回復力と、高度に個人化された微生物叢のアイデンティティの保持を報告しています(Wuら、2011;Fragiadakisら、2020年)。
腸内細菌叢が人間の生物学に統合されていることから、腸内細菌の操作が人間の健康の多様な側面を変化させる強力な手段になる可能性があることが示唆される。腸内細菌叢を標的とした食事療法は、特定の機能性や分類を強化、導入、除去することで、精密医療を実現するための強力な手段となる可能性があります。操作がない場合でも、腸内マイクロバイオームには、特定の食品に対する個人固有の食後反応を予測する際に有益な特徴がある(Zeeviら、2015年、Brand-MillerおよびBuyken、2020年)。1つの重要な疑問は、集団全体の健康増進のために現存する微生物-宿主相互作用を活用できる、広範で非個人化された食事推奨が存在するかどうかということである。
非伝染性慢性疾患(NCCDs)は慢性炎症に大きく左右され、その割合は工業化とともに急速に増加している。偶然にも、工業化に伴う腸内細菌叢の変化もよく知られている。米国移民では、微生物叢の急速な「西洋化」が観察されており、宿主の健康の悪化マーカー、BMIの増加、および工業化集団に典型的な炎症マーカーの上昇を伴う微生物機能および分類群の損失が見られる(Vangayら、2018;SonnenburgおよびSonnenburg、2019)。アフリカ系アメリカ人がアフリカの田舎の食事を摂取し、アフリカの田舎の人が典型的なアフリカ系アメリカ人の食事を摂取する2週間の食品交換研究では、食事介入の簡潔さにもかかわらず、マイクロバイオータおよびがんリスクのマーカーに測定可能な変化が明らかになった(O'Keefeら、2015年)。ヒトのマイクロバイオームが炎症状態に影響を及ぼすことが知られていることから、腸内マイクロバイオームを標的とした食事が健康な人の全身性炎症を減退させることができるかどうかが重要な疑問となる。
食物繊維の消費量が多いほど死亡率が低いという用量反応関係など、健康における食物繊維の役割を支持する多様な文献があります(Liuら、2015)。動物モデルにおける機構的研究は、腸内細菌叢の多様性および代謝の支援における食物繊維に存在する微生物叢アクセス可能炭水化物(MAC)の役割、および腸内細菌叢による繊維発酵の産物である短鎖脂肪酸の、腸バリアの健康維持および炎症の減衰における正の役割を明らかにしている(Makkiら、2018;SonnenburgおよびSonnenburg、2014にレビューあり)。総炭水化物、全粒粉、レジスタントスターチ対小麦ふすまの消費量の増加など、食物繊維を特に変化させる食事介入は、研究参加者の健康マーカーの改善とともにマイクロバイオータへの影響を示している(Duncanら、2007; Martínezら、2013; Walkerら、2011)。これらの知見と、アメリカの平均的な食事における食物繊維の消費量と推奨量の間の不足は、食物繊維の摂取量を増やすことが、微生物叢を介して人間の免疫系を調節する強力な方法である可能性を示唆しています(Deehan and Walter, 2016)。
コンブチャ、ヨーグルト、キムチなどの発酵食品は、動物モデルおよびヒトにおける潜在的な健康上の利点の報告が出てきたため、人気を集めている(Dimidiら、2019年;Villarreal-Sotoら、2020年)。大規模なコホート研究だけでなく、限定的な介入研究でも、発酵食品の消費と体重維持および糖尿病、がん、および心血管疾患のリスク低下が関連付けられています(Mozaffarianら、2011;Díaz-Lópezら、2016;Gilleら、2018)。アメリカのガットプロジェクト参加者のサブセットの最近の縦断研究では、発酵食品消費者と非消費者の間で、微生物叢の組成と糞便メタボロームに違いがあることがわかりました(Taylor et al.、2020)。発酵食品が歴史的に世界中の多くの食生活の一部であったことを考えると、発酵食品を消費することは、進化的に重要な相互作用を再び取り入れる効果的な方法を提供する可能性がある。また、工業化環境の衛生化の過程で失われた安全な環境微生物や食品由来微生物への代償的な曝露を提供する可能性もある。
微生物叢を標的とした食事がヒトの生物学にプラスの影響を与えることができるかどうかを調べるために、我々は健康な成人の微生物叢と免疫状態を縦断的にモニターしながら食事介入を行った。ここでは、高発酵食品または高繊維食品の2つの食事の効果について研究している(Fermented and Fiber-rich Food (FeFiFo) Study; ClinicalTrials.gov Identifier: NCT03275662) のヒト免疫系への影響を、最先端の免疫プロファイリングを含む-オミックスプロファイリングを用いて、無作為化前向き研究デザインで検討した。我々は、各介入が明確な反応をもたらし、ある反応は一般的、すなわちコホート全体であり、他の反応は個別的であることを観察した。驚くべきことに、10週間の介入期間中、発酵食品を摂取している個体では多くの炎症性マーカーがコホート全体で減少し、同時に微生物叢の多様性が増加したことが観察された。これらの結果は、発酵食品がヒトの微生物-免疫系軸の強力な調節因子であり、NCCDに対抗する手段を提供する可能性があることを示唆している。
結果
参加者は、研究期間中、割り当てられた食物繊維または発酵食品の消費量を増やすことに成功した。
食事がマイクロバイオームと免疫系に及ぼす影響を調べるため、一般的な健康成人を募集して10週間の食事介入(介入前と介入後を含む17週間のプロトコル)に参加させ、参加者を2つの食事アーム(高繊維食または高発酵食品食)のいずれかにランダムに割り付けた(図1A, 表S1)。適格性を評価した381人のうち、39人の参加者が、高繊維食(n=21、ランダム化(R)19、非ランダム化(NR)2)または高発酵食品食(n=18)という2つの介入のいずれかに割り付けられた(募集期間:2016年8月~2017年1月)。参加者のうち1名は個人的な理由で脱落し、2名は試験期間中に抗生物質を処方されたため、解析から除外された。参加者の最終的な人数は、各アームで同じn=18となった。参加者は成人(年齢51±12歳[平均±SD])、平均BMI25±4kg/m2、女性(73%)、白人(81%)が多く、教育水準は高い(89%が大卒以上)(表S1)。この研究は、スタンフォード大学人間対象委員会により毎年承認されている。血液と便のサンプルは、介入前の3週間(「ベースライン」)に沿って縦断的に収集され、その後、参加者がそれぞれの食事の摂取量を徐々に増やす4週間のランプ期(「ランプ」)、次に参加者が食物繊維または発酵食品のいずれかの摂取量を高レベルで維持する6週間の維持期(「維持」)、最後に4週間の選択期(「選択」、図1B)があり、参加者が望む範囲で食事を維持できるようになっていた。便サンプルは、微生物叢の構成、機能、および代謝出力を評価した。血液サンプルは、循環サイトカインレベル、細胞特異的サイトカイン応答シグナル、定常状態での細胞頻度および免疫細胞シグナルの測定を含む免疫系のシステムレベルのビューを生成するために使用された(図1B、STARの方法)。各実験プラットフォームおよびタイムポイントについて分析した参加者サンプルの数は、サンプルの入手可能性に応じて若干変化した(表S2)。重要なのは、ベースライン時の参加者の腸内細菌叢は、アルファおよびベータ多様性測定によって決定されるように、2つのアーム間で差がなかったことである(図S1A、S1B)。

図1.
図1.
食物繊維発酵食品研究の概要。
参加者が2週間ごとに作成した食べ物のログから抽出した多量栄養素および微量栄養素のデータによって判断すると、参加者は食物繊維または発酵食品の消費量を増やすことに成功した(図S2)。高繊維食群の参加者は、ベースライン時の1日平均21.5±8.0gから維持期終了時には1日45.1±10.7gまで繊維消費量を増やした(図1C)。高発酵食品食群の参加者は、ベースラインで1日平均0.4±0.6食の発酵食品を消費し、維持期終了時には1日平均6.3±2.9食に増加した(図1D)。重要なことは、高繊維食群の参加者は発酵食品の消費を増加させず(図1C、破線)、高発酵食を摂取した参加者も試験期間中に繊維摂取量を増加させなかった(図1D、破線)ことである。
特定のマクロおよび微量栄養素の分析により、高繊維食群ではいくつかの栄養素の消費量にベースラインから維持期終了時まで差があることが明らかになった。高繊維食群の参加者は、水溶性および不溶性食物繊維、炭水化物、植物性タンパク質の摂取量を増やし、カロリーも適度に増加し、鉄、マグネシウム、カリウム、ビタミンC、カルシウムも増加した。これらの参加者はまた、動物性タンパク質とナトリウムの消費を減少させた(表S3)。さらに、不溶性食物繊維と水溶性食物繊維の比率は、ベースラインから試験終了時まで有意に増加した(比率=ベースライン時2.6+0.6、10週目3.5+1.1;p=0.002)。逆に、高発酵食品ダイエット参加者は、発酵乳製品の消費量が増加したため、動物性タンパク質の摂取量が増加した。注目すべきは、発酵野菜と野菜ブライン飲料の消費量が増えたにもかかわらず、発酵食品群ではベースライン食と比較して総ナトリウム摂取量に変化がなかったことである(表S3)。参加者が食物繊維または発酵食品の摂取量をどのように増やしたかをより詳細に理解するために、食物繊維が豊富な食品および発酵食品をサブカテゴリーに分類した(STARの方法を参照)。食物繊維の豊富な食品は、果物、野菜、豆類、穀類、ナッツ類、種子類、その他に分類された。発酵食品は、ヨーグルト、ケフィア、発酵カッテージチーズ、発酵野菜、野菜塩水飲料、コンブチャ、その他の発酵非アルコール飲料、その他の食品に分類された。すべての参加者が食事介入の要件を守っていたが、摂取した食物繊維が豊富な食品または発酵食品の特定のサブカテゴリーに関しては、それぞれが異なる形で介入を実施した(図S2A、S2B)。
ベースラインから介入終了までのサイトカイン反応スコア(Shen-Orrら、2016)の差という主要アウトカムは、研究のいずれのアームでも有意ではなく(表S4)、人種または性別も有意な共変量ではなかった。しかし、副次的および探索的アウトカムにおいていくつかの変化が観察された。ベースラインから介入終了時までの炎症マーカーの減少および微生物叢多様性の増加は、発酵食品群で有意であり、短鎖脂肪酸(SCFA)の特定のサブセットは、高繊維群でベースラインから介入終了時まで有意に減少していた。これらの結果については、原稿の後半でさらに詳しく説明する。主要および副次的な結果の完全な報告については、表S4を参照のこと。研究期間中の参加者の全体的な健康を評価するために、血糖値、インスリン、トリグリセリド、LDL-C、HDL-C、血圧およびウエスト周囲径を測定した;しかしながら、この一般に健康なコホートでは、2群間でも縦断的(以内)にも違いは観察されなかった(データは示されていない)。胃腸症状評価尺度(Svedlundら、1988)による評価に基づいて、高繊維食の参加者は、ベースライン(平均ブリストル便型=3.3±0.3)からランプ期の終わり(便型=4.1±0.3、p=0.04、ペアt検定)および維持期の終わり(便型=4.1±0.3、p=0.004、ペアt検定)に便の柔らかさが増加したと報告している。一方、発酵食品ダイエット群では、ベースライン(腹部膨満感スコア=0.06 +/- 0.06)からランプ期終了時(スコア=0.4 +/- 0.1; p=0.03; ペアt検定)までに膨満感の増大が報告されたが、維持期終了時にはもはや有意ではなくなっていた。さらに、ストレス、健康、疲労、身体活動、認知を評価するための有効な調査を参加者に行ったが、2群間または群内の縦断的な有意な変化は観察されなかった(データは示されていない)。
高繊維食と高発酵食品食は、腸内細菌叢と宿主免疫系に異なる影響をもたらす
参加者が割り当てられた食事介入を順守することに成功したことから、それぞれの食事介入によって参加者の微生物叢または生物学の側面に特徴的な変化が生じるかどうかを検討した。ベースライン(便サンプルの場合は第2週、血液サンプルの場合は第3週)と維持期終了時(第10週)の差として定量化された特徴を用いて、各アッセイ(図1Bに記載)ごとに別々のモデルを作成し、ランダムフォレストモデルを作成した(図2A)。各モデルでは、再帰的特徴除去法を用いて、最も高い精度を維持しながら最も少ない特徴数を持つモデルを選択した。(ポジティブコントロールとして、栄養摂取を独自のモデルで使用し、91%の精度で食事療法群ごとに参加者を分類した(leave one out cross-validation, LOOCV)。このモデルは、動物性タンパク質、食物繊維、不溶性食物繊維の摂取量に依存して分類された。ネガティブコントロールとして、2つのベースライン時点をモデルのパラメータとして使用したが、予測精度は偶然と同等(48%)であった。

図2.
図2.
食物繊維対発酵食品の介入による宿主およびマイクロバイオームへの食事特異的効果。
栄養摂取量を除けば、食事内容の予測精度が最も高かったのは、ヒトの便のプロテオミクス変化を利用したモデルであった(精度89%)。このモデルは、230 個の入力宿主タンパク質から、高発酵食品食群で増加したミオシン 1 という 1 つのパラメータを選択した(図 2B)。ミオシン-1は、小腸の刷子縁内の微絨毛に高発現しています。その増加は、高発酵食群では小腸内の上皮細胞のターンオーバーが増加していることを示唆しているのかもしれない(Benesh et al.) 高繊維食群と高発酵食群のプロテオミクス的差異に関するより詳細な解析は、以前に報告されている(Gonzalez et al.、2020)。
次に性能の高い4つのモデルは、すべて16S rRNAベースの全体組成(80%の精度)、便の微生物プロテオミクス(74%)、便の短鎖脂肪酸(67%)、糖質活性酵素のメタゲノム測定(67%)などの微生物叢の測定を使用して生成されたものであった。微生物叢の多様性は、参加者がどの食事をしているかを見分ける上で、あまり有効なモデルではなかった(60%)。全体的な微生物叢組成モデルは、ベースラインと比較して、高繊維食群ではLachnospira属が増加し、高発酵食群では減少することが特徴であった(図2C)。Lachnospiraは、ヒトの前向き研究において、高食物繊維消費と正の相関があった(Linら、2018)。我々は、両方の食事アームにおいて、参加者の腸内細菌叢組成は、介入終了時に食事によってクラスタリングするのではなく、介入中に高度に個別化したままであり、以前のヒト微生物叢研究(Johnsonら、2019;Wuら、2011)において報告されたものと同様の知見であることを見いだした。しかし、ブレイ・カーティス・ベータ多様性を用いて、線形混合効果モデルを用いたセントロイドからの距離対時間の線形回帰は、高繊維食アームおよび高発酵食アームともに負の係数を有した(それぞれ、傾き=-4.2e-3、p値=1.6e-3;および、傾き=-5.3e-3、p値=1.4e-4)。つまり、介入期間中、個人の微生物叢組成は、個性の強いシグナルを維持しながらも、同じarm内の他の参加者の微生物叢組成とより類似するようになった。
内因性免疫細胞シグナル伝達(61%)、炎症性サイトカイン(61%)、免疫細胞頻度(58%)などの宿主免疫パラメータの測定値を用いて作成したモデルは、食事療法群の予測因子であったが、上記の微生物叢の変化の多くに比べるとその程度は小さかった。免疫細胞シグナル伝達能力(49%)を用いて作成したモデルは、食事療法群の予測において偶然の一致を上回らなかった。これらのモデルは、2つの食事介入によって、参加者のヒトおよび微生物の生物学に特徴的な反応が生じたことを実証している。食事によって誘発された微生物叢の変化は、腸内微生物叢を標的とした介入にしたがって、免疫系の反応よりも個人間で一貫性がある可能性がある。
食物繊維の摂取は、炭水化物の処理能力と微生物叢の代謝出力をシフトさせる
予測モデルにより参加者の食事特異的な反応が明らかになったため、それぞれの食事が宿主微生物叢にどのような影響を与えるかをより徹底的に調査した。高繊維食群は、微生物叢の組成、多様性、機能、および微生物由来の発酵産物の変化について評価された。マウスおよびヒトにおける介入研究、および高繊維食と微生物叢多様性の増加との間の長期的な関連研究に基づいて、食物繊維の消費を増やすと微生物叢多様性の増加につながるという仮説を立てた(Sonnenburgら、2016;De Filippoら、2010;Cotillardら、2013;Le Chatelierら、2013)。しかし、観察されたASVの数、シャノン多様性、または系統的多様性によって決定されるアルファ多様性は、介入期間中、コホート全体で変化しなかった(図3A、図S1C、S1D)。また、食物繊維の摂取量とα多様性を研究間で変化させ、参加者で補正した線形混合効果モデルを用いて決定したように、参加者あたりの食物繊維の消費量と相関させても、α多様性に変化は見られなかった(p > 0.05)。しかし、ベースライン(第2週および第0週)から維持期の終わり(第10週)まで、高繊維食群の便1グラムあたりの微生物タンパク質の相対存在度の増加が観察され、食物繊維の高摂取によって微生物叢内の微生物の密度が増加した可能性が示唆された(図3B)。高繊維食群全体で経時的に相対存在量に変化を示した特定の分類群(ASV)はなかった。高繊維食群では、高発酵食品食群と比較してLachnospira相対存在度の増加が観察されたが(図2C)、この属はベースラインから維持期の終わりまで高繊維食群内で有意に増加しなかった。この不一致は、1つの食物群内だけで比較するとサンプルサイズが小さいため、または介入期間中、高発酵食群のLachnospiraの相対存在量が減少したためである可能性がある。

図3.
図3.
食物繊維を摂取している参加者は、マイクロバイオームの機能プロファイルにシフトを示す。
高繊維食群では微生物叢の多様性や組成に一般的な変化は見られなかったものの、便中の微生物タンパク質の割合が増加したことから、繊維が繊維分解に長けた細菌の増殖を促進する可能性があることが示唆された。メタゲノム解析により、11種類の炭水化物活性酵素(CAZymes)の相対的な存在量が増加していることが明らかになった。相対的な存在量が減少したCAZymesはなかったことから、高繊維食は糖質利用機能の再構成だけでなく、コホート全体の複合糖質処理能力の全体的な上昇につながったことが示された。したがって、食物繊維の摂取は一貫してCAZymeの存在量を増加させるようであるが、こうした増加をもたらす分類学的変化は参加者間で異なる可能性がある。CAZymesの増加に対する分類学的解決策の個別化は、各人の腸内の微生物の個別的な集まりを反映しているかもしれないが、同一ではない高繊維食を食べていた参加者が摂取した異なる種類の複合炭水化物の結果である可能性もある。
高繊維食群の微生物叢の代謝出力を評価するため、糞便中の短鎖脂肪酸(SCFA)濃度を測定した。食物繊維の摂取に関するいくつかの研究で以前に報告されたような酪酸の増加は観察されなかった(Soら、2018)。しかしながら、食物繊維研究間の酪酸の結果には、おそらく不完全な発酵および/または宿主による大腸吸収に起因する、有意な不均一性が存在する(Soら、2018年)。我々は、ベースラインから維持期の終わりまで、分岐鎖脂肪酸(BCFA)であるイソ酪酸およびイソ吉草酸、ならびに吉草酸の減少を観察した(図3D)。イソ酪酸およびイソ吉草酸の上昇は、高コレステロール血症(Granado-Serranoら、2019)および自閉症スペクトラム障害(Liuら、2019)の吉草酸の上昇と関連している。BCFAにおけるこれらの変化が、微生物叢による産生が減少した結果なのか、BCFAを多く含む乳製品や牛肉の消費が減少した結果なのかは明らかではありません(Ran-Ressler et al.、2014年)。
CAZymeプロファイルとSCFAレベルの変化が観察されたにもかかわらず、この群では食物繊維の消費量が大幅に増加したため、微生物叢の反応が大きくなかったことに驚かされた。我々は、食物繊維摂取量の増加に微生物叢が十分に適応するためには、介入が短すぎたのではないかと考えた。特に、食物繊維の摂取量の増加が、参加者の微生物叢の発酵能力を圧倒しているのではないかと考えた。便サンプルから炭水化物を抽出し、酸加水分解して単糖を遊離させ、HPLCで測定した。参加者の食物繊維摂取量の増加と便中の総炭水化物の増加との間に有意な相関が観察された(p値=8e-4;参加者の経時的変化を補正したLME、図3E)。これらのデータは、参加者のマイクロバイオータによる炭水化物分解が、増加した食物繊維の消費を処理するには不十分であったことを示唆しており、工業化されたマイクロバイオームの分析(Smitsら、2017;Vangayら、2018)と一致する。より長い介入によって、外部ソースからの十分な微生物叢のリモデリングとリクルートが可能になった可能性がある。あるいは、微生物叢の発酵能力を高めるために、繊維消費型微生物を意図的に導入することが必要である可能性もある。
高次元の免疫系プロファイリングにより、食物繊維摂取に対する宿主反応のサブタイプが明らかになった
高繊維食群における微生物叢の変化から、参加者の免疫系が偶然に影響を受けたのかどうかが気になった。我々は、細胞内およびサイトカインメディエーターを介した免疫細胞シグナル伝達活性の相補的な側面を捉えるために選択したアッセイで測定した参加者の免疫状態が変化しているかどうかを検証した(図4A)。マルチプレックス・プロテオミクス・プラットフォームは、炎症に特異的なパネル(Olinkテクノロジー、表S6)を用いて、血清中の循環サイトカインと追加の免疫調節因子を評価するものであった。全血は、主要な免疫細胞の種類(細胞頻度)と正規の免疫細胞シグナル伝達経路の活性化(内因性シグナル伝達、表S6)を明らかにするために、50パラメータの抗体パネルで単一細胞マスサイトメトリー(CyTOF、表S6、図S3)に供された。最後に、リポポリサッカライド(LPS)または炎症性シグナル伝達に関与する5種類のサイトカイン(IL-6、IL-2、IL-10、IFNa、IFNg)の1つで末梢血をex vivoで刺激して免疫シグナル伝達能を測定した。細胞型特異的応答は、フローサイトメトリによってJAK/STATおよびMAPキナーゼ経路で測定した(Table S6)。これらのアッセイのそれぞれから、免疫活性の記述子として一連の免疫特徴を導き出した(STAR Methodsを参照)。

図4.
図4.
繊維消費参加者は、マイクロバイオーム組成および多様性の違いに追従する多様な免疫反応を示す。
高繊維食参加者のベースラインから維持期終了までの免疫特性を比較すると、参加者の3つのクラスタが、異なる免疫応答プロファイルを表していることがわかった(図4B)。これらのクラスターは、内因性シグナル伝達の変化、特に2つのクラスター(「低炎症i」および「低炎症ii」)でのシグナル伝達の減少、および「高炎症」クラスターでのシグナル伝達の増加によって駆動されていた。高炎症」クラスター内の個々の免疫機能を調べると、単球、B細胞、CD4およびCD8 T細胞でJAK/STATおよびMAPキナーゼのシグナル伝達が増加していることがわかった。低炎症」クラスターでは、いずれもこれらのマーカーが減少していた(図4C、S4)。これらのデータは、高繊維質介入に対する免疫系の反応の相違を示唆しており、「高炎症」参加者は定常状態の免疫活性化において幅広い増加を示し、「低炎症」参加者は定常状態の免疫活性化において減少を示した。注目すべきは、食物繊維の総摂取量に炎症クラスタ間の差は見られず、BMIにも有意差はなかったことである(t検定、p値>0.05)。
これらの多様な免疫系の表現型が参加者のマイクロバイオームに反映されているかどうかを判断するために、3つの炎症クラスタに関連するアルファ多様性とマイクロバイオータ組成を調べた。具体的には、各グループのベースライン時点(第2週および第0週)で観察されたASVを比較したところ、「高炎症」グループと比較して「低炎症ii」グループでより高い微生物叢の多様性が明らかになった(p値=0.037、対応のないt検定)(図4D)。高炎症」群と「低炎症i」群の間の微生物叢α多様性に有意差はなかったが(p値=0.096)、「低炎症i」群では観察された中間炎症反応に続いて微生物叢多様性が増加する傾向があった。これらのデータは、水溶性食物繊維の増加を含む食事介入は、マイクロバイオームの豊かさが低い個人では炎症マーカーの改善効果が低いことを示した以前の研究(Cotillardら、2013)と一致する。
経時的なクラスタ間の分類群の存在量または存在の違いを識別するためのゼロインフレートベータ回帰(ZIBR)モデル(Chen and Li, 2016)により(表S7)、高繊維食介入中に「高炎症」クラスタと比較して「低炎症i」においてCoprococcus、Ruminococcus、Oscillospira、Anaerostipesがより多く存在していることが判明した(図4E)。Coprococcusは、より高いQOL指標と関連しており、RuminococcusとOscillospiraの両方は、リーンネスと脂質プロファイルの改善を含む健康指標の改善と関連している(Valles-Colomerら、2019;Klimenkoら、2018;Chenら、2020)。AnaerostipesはZIBRモデルで有意な共同p値を有し(表S7)、以前は「高酪酸産生菌」として記述されていた(2014)。一方、Akkermansiaは、「低炎症ii」クラスターに対して「高炎症」クラスターに濃縮されていた。Akkermansiaは、代謝の健康と正の関連があるが(Derrienら、2017)、低繊維食とも関連があり、伝統的な食事を消費する集団では稀である(Earleら、2015;Desaiら、2016;Smitsら、2017)。2つの低炎症クラスター間で、Lachnospiraceaeの1つの分類群に緩やかな違いがあった。特定の分類群が人間の健康に有益かどうかを判断することは、効果が非常に文脈に依存する可能性が高く、亜種(すなわち、株)固有の違いに影響される可能性があることを考えると、問題がある。
発酵食品の摂取は微生物叢の多様性を高める
高繊維食群とは対照的に、高発酵食品食を摂取した参加者の微生物叢は、全体的なASV、PD全木、およびシャノン多様性によって判断すると、介入期間中にアルファ多様性が全体的に増加した(図5A、 ,5B,5B, S2E)。この多様性の増加は、発酵食品摂取量がベースラインより多かったが維持期間終了時よりは少なかった選択期間中も持続した。このことは、多様性の増加が消費量の即時反映ではなく、腸内生態系のリモデリングに関与している可能性が高いことを示唆するものである。さらに、アルファ多様性と時間のモデルにおいて、性別、人種、BMIを共変量として評価したが、いずれも有意な関連は認められなかった(LME、p>0.05)。最近の研究で、アルコール摂取が腸内細菌叢研究における交絡因子となり得ることが報告された(Vujkovic-Cvijinら、2020)。ベースライン時のアルコール消費量に群間差はなく、研究期間中のアルコール消費量も有意に変化しなかった(LME、p>0.05)。注目すべきは、消費した発酵食品の食数は多様性の増加と相関していたが、この関係は多様性と時間との関係ほど強くなかった(図 5C)。高発酵食品食群の参加者は、ヨーグルト、ケフィア、発酵カッテージチーズ、コンブチャ、野菜塩水飲料、キムチなどの発酵野菜など、さまざまな発酵食品を摂取していた。興味深いことに、1日に摂取する発酵食品の総食べ数はα多様性と正の相関があったが、ヨーグルトまたは野菜ブライン飲料の食べ数が最も強い相関があった(図5C)。ヨーグルトと野菜の塩水飲料は、他の種類の発酵食品に比べて消費量が多く、このことがより強い相関に寄与している可能性がある。高繊維食を摂取した参加者とは異なり、高発酵食品群では便 1 グラム当たりの微生物タンパク質の相対存在度の増加は観察されず、微生物密度の変化が多様性の増加に伴っていないことが示された(データは示されていない)。

図5.
図5.
高発酵食品食は微生物叢の多様性を増加させ、組成を変化させた。
特定の分類群がコホート全体で経時的に変化したかどうかを調べるため、ASVをサンプルごとにランク正規化し、線形混合効果モデルを使用して時間との関係をモデル化した。9つのASVが時間とともに増加し、そのすべてがFirmicutes門に属し、Lachnospiraceae科の4つ、Ruminococcaceae科の2つ、Streptococcaceae科の1つが含まれていました(図5D)。重要なのは、検出された新しい分類群が、発酵食品から直接得られた微生物であるかどうかという点です。本研究で一般的に消費された発酵食品に存在する分類群を16S rRNAアンプリコン配列決定(図S5)により同定し、介入中に参加者の微生物叢で新たに観察された分類群と比較した。新しい微生物叢のASVのうち、発酵食品で見つかったものと共通していたのはごく一部であった。新しい微生物叢のASVと発酵食品のASVの重複のピークは、参加者の全体的な微生物叢の多様性が維持期終了時よりも低い介入初期に生じた(5.4%、図5E)。それ以降の時点では、発酵食品群における新たな微生物叢ASVと発酵食品ASVの重複は、高繊維食群で見られたものと変わらなかった(図5E)。これらのデータは、高発酵食品食群における微生物叢の多様性の増加は、主に消費された微生物によるものではなく、むしろ常在コミュニティのシフトまたは新たな獲得の結果であることを示唆している。これらのデータは、発酵食品の摂取が微生物叢の多様性に間接的な影響を及ぼし、微生物叢が以前は検出されていなかった菌株を腸内に取り込んだり、その数を増やしたりできるようにすることを裏付けている。
高発酵食品群では、いくつかのCAZymeファミリーの存在量がベースラインから維持期の終わりまで変化した(図S6A)。しかし、これらの変化は、高繊維食群で観察されたものと同じではなかった。具体的には、高繊維食群で差が見られた11種のCAZymesはすべて、ベースラインから維持期の終わりまで存在量が増加した。しかし、発酵食品群では、8つのCAZymes(そのうち3つはデンプン分解、5つは植物分解と注釈されている)のみが相対的存在量に差があり、ベースラインと比較して維持期にはすべて減少していた。
発酵食品摂取は宿主の炎症マーカーを減少させる
定常状態でのサイトカインレベルの上昇は、慢性的な低悪性度炎症に関連している。血清中の循環サイトカインを評価する炎症パネルを使用して、発酵食品介入期間中に減少したサイトカイン、ケモカイン、およびIL-6、IL-10、IL-12bなどの炎症性血清タンパク質93種のうち19種を確認した(図6A、SAM、FDR ≦ 0.05、q値 ≦ 0.1)。IL-6は、慢性炎症の重要なメディエーターであり、関節リウマチ、2型糖尿病、および慢性ストレスなどのいくつかの慢性炎症状態で上昇し、炎症の一般的な指標である(Tanakaら、2014に総説あり)。注目すべきは、高発酵食群で減少した19種類のサイトカインのうち、高繊維食群ではどれも差がなかったことです。これらの変化の大きさは、ビン詰めされた「高」発酵食品消費者と「低」発酵食品消費者の間で有意な差はなく(t検定、調整p値>0.05、n=19)、どの変化もBMIと相関がなかった。我々はまた、4つの主要な細胞タイプから15個のタンパク質の活性化レベルを測定することによって決定される、内因性シグナル伝達の全体的な減少を観察した。CD4+T細胞、CD8+T細胞、B細胞、および古典的単球の4つの主要な細胞タイプから15個のタンパク質の活性化レベルを測定することによって決定された。具体的には、60種類の細胞タイプ特異的なシグナル伝達反応のうち14種類で活性化レベルの減少が見られ、シグナル伝達の増加は1種類だけであった(図6B)。このシグナル伝達の低下は、試験した4種類の細胞すべてで観察され、発酵食品を摂取する個人における免疫状態の幅広い変化と一致した。より大きな免疫細胞タイプのセットの頻度を同定するためのCyTOFデータの解析は、エフェクターメモリーCD4+ T細胞が介入中に増加し、非古典的単球が減少したことを明らかにした(図6C、S3)。免疫細胞の消耗と老化の状況で損なわれうる免疫刺激に対する応答強度を評価するために、我々はex vivo刺激に対するCD4+ T細胞、CD8+ T細胞及びB細胞のシグナル伝達能力を測定したが、いずれの食事療法群でもシグナル伝達能力の変化は見つからなかった。これらのデータを合わせると、発酵食品ダイエット群ではコホート全体で炎症が減少していることと矛盾しない。

図6.
図6.
発酵食品摂取は炎症のレベルを低下させる。
血中の代謝産物は、宿主の生理的プロセスに結びついており、食事、腸内細菌叢、宿主の代謝プロセスに由来する。発酵食品を摂取した人の血清メタボロームプロファイルの変化が、高発酵食品食群で観察された炎症性サイトカインの全体的な減少を反映しているかどうか、私たちは興味を持ちました。ベースライン(第2週)および維持期間終了時(第10週)の血清試料について、アンターゲットハイスループット液体クロマトグラフィー質量分析法(LC-MS)を用いてメタボロミクスを実施した。血清代謝物の変化が炎症性サイトカインの変化と有意に関連しているかどうかを調べるために、各代謝物-サイトカインペアの相関を計算した。38の相関が統計的に有意であり(Pearson、調整p値≤0.05、Benjamini-Hochberg補正)、そのうち18が陽性、20が陰性であった(図S6B)。
宿主と微生物の協調関係を明らかにする方法としてのシステムレベルのマイクロバイオームおよび免疫系縦断プロファイリング
食品選択のばらつき、参加者のマイクロバイオータの個別性、および生成された広範なマイクロバイオータおよび免疫系-オミックスデータは、新規のヒトのマイクロバイオーム-免疫関係を明らかにするユニークな機会を可能にした。変化した状態のマイクロバイオータと免疫系の関係を明らかにするため、介入終了時(10週目)とベースライン時(血液は-3週目、便は-2週目)の差を各パラメーターについて算出した。これらの差分を用いて、各微生物学的特徴タイプ(ASV、α多様性、SCFA、微生物プロテオミクス、便中メタボロミクス、CAZymes)と各宿主特徴タイプ(炎症性サイトカイン、免疫細胞シグナル伝達、免疫細胞頻度、宿主プロテオミクス)間のスピアマン相関を決定した。マイクロバイオータと宿主の特徴タイプの間に多くの有意な相関(Benjamini-Hochberg仮説補正を用いて補正)が確認され、マイクロバイオータCAZymesによる宿主便タンパク質は高い割合で有意な相関を有していた(図7A)。宿主タンパク質は、Ingenuity Pathway Analysis Core Analysis、Diseases and Functions Analysisによって定義された疾患関連または機能によって注釈され、分類された(STARの方法、表S8)。CAZymesと疾患関連タンパク質との間の相関の大部分は陰性であり、炎症反応に割り当てられたタンパク質は、有意な相関の数が最も多かった(図7B)。これらの関連は、CAZymesと宿主タンパク質が食事介入に対して協調的でありながら相反する方向で反応し(すなわち、CAZymeの存在量の増加は炎症関連タンパク質のレベルの低下と相関する)、食事、マイクロバイオームおよび宿主生理学の間の直接的なリンクとして機能する可能性を示唆するものであった。

図7.
図7.
宿主免疫系とマイクロバイオータの相互作用。
我々の解析では、免疫細胞の頻度と便中短鎖脂肪酸の間に比較的高い割合で有意な相関があることも明らかになった。具体的には、糞便中の酪酸が増加すると、B細胞頻度は減少した(図7C)。B細胞枯渇治療薬は、多発性硬化症、関節リウマチ、1型糖尿病などの免疫介在性疾患に対する有効な治療法となり得る(Fillatreau, 2018)。興味深いことに、高繊維食介入中に糞便酪酸はコホート全体で有意に増加しなかったが、B細胞頻度が減少しながら酪酸が増加した参加者の大部分は、高繊維食群であった。両群のデータを統合すると、糞便中酪酸値とB細胞頻度との間にこのような負の相関があることが明らかになり、より大規模なコホートが高繊維食群の酪酸値の有意な上昇をもたらした可能性があることが示された。
免疫細胞シグナル伝達能と微生物にコードされたCAZymesとの間に確認された相関関係から、特定のCAZymesの存在量は細胞シグナル伝達能と大きく負の相関があることが明らかになった(図7D)。これらのデータは、基礎レベルのリン酸化の減少によって示される見かけ上の炎症の減衰は、CAZymに関連した炎症性の合図に対する細胞の反応性の低下によってさらに促進される可能性があることを示している。言い換えれば、参加者のマイクロバイオームCAZymesが相対的に増加すると、基礎的な炎症状態が減少し、サイトカイン刺激後の反応性が低下することが示唆された。
考察
腸内細菌科学分野の広範なデータにより、食事が個人の腸内に存在する生物種と機能の主要な推進要因であることが立証されている。貧しい食事は、より多くの人口が西洋風の食事を採用するにつれて世界的に急速に広がっている非伝染性慢性疾患(NCCD)の既知の原因である(Lozanoら、2012;GBD 2015 Mortality and Causes of Death Collaborators、2016)。さらに、多くのNCCDは、腸内細菌叢によって調節される免疫学的状態である慢性炎症によって駆動されています。腸内細菌科学の論理的な次の段階は、腸内細菌叢に影響を与える食事がヒトの免疫状態をどのように変調させるかを確立することである。本研究では、無作為化前向き食事介入モデルを用いて、腸内細菌と相互作用することが知られている食事の2つの要素、高繊維食品と発酵食品が、ヒトのマイクロバイオームと免疫系にどのような影響を与えるかを評価した。
最先端のシークエンスと免疫プロファイリング技術を含む、マイクロバイオームと宿主パラメータの複数の-オミックス測定を使用して、高繊維食品と高発酵食品の摂取がマイクロバイオームとヒト生物学に異なる方法で影響を与えることを発見した。この2つの食事法の顕著な違いの1つは、腸内細菌叢の多様性に対する影響であった。低い微生物叢の多様性は、肥満や糖尿病などの多くのNCCD(Turnbaughら、2009;Le Chatelierら、2013)、および個人がNCCDになりやすいことが知られている工業化されたライフスタイルと関連している(SonnenburgおよびSonnenburg、2019にレビューあり)。食物繊維が豊富な食品は、微生物がアクセス可能な炭水化物(MAC)を豊富に含んでおり、微生物に発酵可能な炭素源を提供する。これらの参加者において、6週間にわたり多様な植物由来の食物繊維を高いレベルで持続的に摂取したにもかかわらず、高繊維食群ではコホート全体の微生物叢の多様性の増加は観察されなかった。本研究の比較的短い期間が、微生物叢に新しい分類群を採用するのに十分ではなかった可能性があり、これは参加者の環境内で新しい微生物への曝露が制限されたことの表れである可能性がある。環境的に制約された多様性は、(i)工業化された集団における高いレベルの衛生状態は、個人間の微生物の共有の減少につながる(Martínezら、2015)、(ii)マウスモデルにおいて腸内細菌叢の多様性を回復するための食物繊維+投与微生物の必要性(Sonnenburgら、2016)、(iii)米国の移民で観察される菌株およびその関連糖鎖分解能力の損失(Vangayら、2018)と一致します。高繊維食参加者の便から植物糖鎖由来の炭水化物が検出されたことは、工業化された微生物叢で予想される不完全な微生物叢発酵と整合的である。
発酵食品食群で観察された微生物叢の多様性の増大は、異なる技術で測定された多数の炎症マーカーの低下と一致していた。これらの相関した変化は、微生物叢の多様性の低下とNCCD有病率の増加との間の関連性を示す広範な研究と一致する(Moscaら、2016に総説あり)。注目すべきは、多様性の増加に寄与する新しい分類群は、大部分が発酵食品自体からではなく、微生物叢の改造に対するその摂取の間接的効果を示していることである。これらの「新しい」分類群は、環境から新たに微生物叢に採用されたのか、あるいはすでに存在していたが検出されず、介入中に検出可能なレベルまで相対的な存在量が増加したのかは不明である。多様性がゆっくりと増加する軌跡は、発酵食品の摂取量がベースラインよりも多かったが維持期間よりも少なかった「選択」段階で観察された最大の微生物叢の多様性につながった。ゆっくりと着実に増加する多様性は、食事によるマイクロバイオーム組成のリモデリングに時間がかかることを示唆しており、食事による急速なリモデリングに対してヒトのマイクロバイオータが比較的不利であることとも一致する(Wu et al.) 食物繊維によって誘発される微生物叢の多様性の増加は、本研究で達成された6週間の持続的な大量消費よりも長い時間を必要とする、より緩やかなプロセスである可能性がある。重要なのは、食物繊維の大量摂取によって、便の微生物タンパク質密度、炭水化物分解能力、およびSCFA産生量の増加がみられたことで、研究期間内にマイクロバイオームのリモデリングが起こっていることが示されたが、総種数の増加によるものではないことである。これら2つの食事に対する参加者の反応が異なることから、高繊維食品と発酵食品の両方からなる食事が相乗効果を発揮して宿主微生物叢と免疫系に影響を与えるかどうかは、まだ解明されていない興味深い可能性である。
ヒトのマイクロバイオームの可鍛性、免疫系への統合、および食事への反応性から、マイクロバイオームは治療介入のための非常に魅力的なターゲットとなります。特定の食事療法がマイクロバイオータにどのような影響を与えるかについての知識を活用することで、人間の健康を改善する効果的な食事療法を開発できる可能性があります。食事の成分は、典型的な医薬品とは異なり、ヒトに使用するための規制当局の承認を必要としないので、来るべきグローバルNCCD健康危機(GBD 2015 Mortality and Causes of Death Collaborators, 2016)を回避するために、マイクロバイオータの劣化を和らげ、人間の健康を迅速に改善する道を提供します。私たちは、ここで行われたような追加的な研究から2つの主要な成果を想定しています。第一に、1種類の食事介入が個人にどのように異なる影響を与えるかについての正確な洞察であり、食事を多くの、個人特有の臨床状況で活用することを可能にするものである。第二に、公衆衛生政策、食事に関する推奨事項、および個人の選択の指針となる、健康を広く改善する食事に関する集団全体の洞察である。例えば、発酵食品の摂取は、介入期間中、コホート全体にわたって炎症マーカーを減衰させるという結果を招いた。この群の参加者は食事内容をほとんど変えず、さまざまな発酵食品を摂取していた(すなわち、発酵乳製品を主に食べる人もいれば、発酵野菜製品を主に食べる人もいた)ことを考えると、この結果は特に印象的である。発酵食品とその健康への影響についてさらに厳密な調査を行えば、健康的な食生活の重要な構成要素として発酵食品を取り入れることにつながるかもしれない。
ヒトを対象とした研究には、ヒトの生物学に関連する微生物と宿主の関係を明らかにするという利点がある一方で、機構解明という代償を払うことになる。我々は、ヒトに関連するデータに基づいて機構的な探求のために動物モデルに知見を逆輸入する能力を考えると、これは価値あるトレードオフであると考える(Spencer et al.、2019)。例えば、ここで同定した宿主タンパク質とCAZymeの関係は、炭水化物利用酵素を増やす食事と炎症性タンパク質を減らす食事の因果関係を理解することを目的とした機構的なマウス研究に情報を提供できる。さらに、ヒトの食餌摂食に関する縦断的な相関データ(マイクロバイオームと免疫系の関係など)が蓄積されれば、これらのデータを活用して、マイクロバイオームとヒト生物学の相互作用のマップを解明することができる。このようなマップは、疾病の原因となる免疫異常の修正に役立つだけでなく、健康や疾病の様々な場面で応用でき、最適な身体的・精神的パフォーマンス、がんや多くの慢性疾患との戦い、あるいは感染症との戦いのために生物学を調整することができる。
研究の限界
本研究は、マルチオミクスを用いて、マイクロバイオータを標的とした食事がヒトのマイクロバイオームと免疫系の両方に及ぼす影響を探ることを目的としています。本研究は、食物繊維を多く含む食事や発酵食品を多く含む食事が微生物の組成や活性、免疫状態に及ぼす影響について重要な知見を提供しましたが、今後の研究で対処できることを期待するいくつかの限界があります。この研究では、参加者数が控えめ(n = 18/arm)であったため、統計的検出力が制限され、結果の一般化可能性に関して課題がある。この研究には対照群がなく、代わりに2つの食事療法群間の比較および長期にわたる参加者内の比較に依存した。食事介入段階は4週間の立ち上がり期間と6週間の維持期間にわたって行われた;観察された多くの変化の耐久性や、より長い介入期間中にさらなる変化が生じるかどうかは分からない。この研究は健康な人を対象に行われた。今後の研究では、病気や炎症状態におけるこれらの食事の効果や、食物繊維と発酵食品の両方を豊富に含む食事との相乗効果の可能性について検討する必要がある。最後に、現在のデータでは、これらの食事がマイクロバイオームと免疫状態の両方に大きな影響を与えることが示されているが、今後の研究では、さらなる実験モデルを用いて、ヒト生物学の相互に関連するこれらの側面の因果関係を、メカニズムの裏付けに重点を置いて検討する必要がある。
STARメソッド
リソース
主席研究員 Justin Sonnenburg (ude.dorfnats@grubnennosj)宛に、すべての情報および追加リソースの要請を行う。
材料利用可能性 この研究では、新しい独自の試薬は生成されませんでした。
Data and Code Availability データセットと解析用コードは https://github.com/SonnenburgLab/fiber-fermented-study/ で入手可能である。
実験モデルおよび被験者の詳細
参加者の募集と選択 参加者は、さまざまなコミュニティグループでのオンライン広告、および今後の研究のために連絡を受けることに同意した過去の研究参加者への電子メールを通じて、地域コミュニティから募集された。本研究では、381名の参加者の適格性を評価した。彼らは、2016年7月から2017年1月の間に、オンラインスクリーニング質問票とクリニック訪問を完了した。主要な包含基準は、年齢≧18 yおよび一般的に良好な健康状態であった。参加者は、潰瘍性大腸炎、クローン病、または不定型大腸炎を含む活動性の制御不能な炎症性腸疾患(IBD)、過敏性腸症候群(IBS)(中程度または重症)、感染性胃腸炎、大腸炎または胃炎の既往がある場合は除外された。Clostridium difficile感染症(再発)またはHelicobacter pylori感染症(未治療)、吸収不良(セリアック病など)、過去5年間に胆嚢摘出および虫垂切除を除く消化管の大手術、またはいかなる時点でも大腸切除を受けたことがある。その他の除外基準には、BMI≧40、糖尿病、腎臓疾患、重大な肝酵素異常、妊娠または授乳、喫煙、CVD、炎症性疾患、悪性新生物の既往が含まれた。食物繊維の摂取量が多い(1日20g以上)、または発酵食品を1日2食以上摂取している参加者は除外された。図1Aに示す参加者募集のコンソートフロー図と表S1に示す人口統計表。36人の参加者(25人が女性で性別が判明、11人が男性で性別が判明)が、平均年齢52±11歳で完全解析に使用された。すべての研究参加者は、書面によるインフォームドコンセントを提供した。本研究は、食事介入に伴う微生物叢と免疫系の変化を発見するための探索的アプローチとして設計された。本試験は、スタンフォード大学人間対象委員会により毎年承認されている。臨床試験はClinicalTrials.govに登録された(識別子:NCT03275662)。NCT03275662 に登録された。
検体採取 2週目から14週目の観察終了まで、2週間ごとに便を採取した。便検体はすべて氷嚢に包んで参加者の自宅の冷凍庫(-20℃)に保管し、氷上で研究室に移送して-80℃で保存した。
血液サンプルは7つの時点で採取された。-3週間、介入開始、4週間(ランプアップ終了)、6週間、8週間、10週間(最大摂取中の3時点)、14週間(観察終了)。PBMC用血液および全血アリコートをヘパリン処理したチューブに採取した。全血アリコートをProteomic Stabilization Buffer (Smart tube, Fisher Scientific) と共に室温で12分間インキュベートし、-80℃で保存した。PBMCはFicoll-Paque PLUS (Sigma-Aldrich) を用いて分離し、PBSで洗浄後、-80℃で24時間凍結し、LN2に移して長期保存した。血清はSST-tiger top tubeに採取し、1,200xgで10分間スピンした後、分注し、-80℃にて保存した。血漿はEDTAチューブに採取し、1,200xgで10分間スピンした後、分注し、-80℃で保存した。
方法詳細
介入 参加者は、食物繊維を多く含む食事、または発酵食品を多く含む食事に無作為に割り付けられた。無作為化は、介入やデータ収集に関与していない統計学者が行った乱数発生器(Excel)を用いて、2群について行った。2人の参加者が高繊維食にすることを希望し、非ランダム化された。参加者と栄養士は、食事の変更を実行し、カウンセリングを行うために、ランダム化の割り当てについて盲検化することはできず、研究チームも盲検化されなかった。参加者は、介入開始後の4週間に、食物繊維/発酵食品を多く含む食品の摂取を増やすよう指示され、食物繊維群ではベースラインの消費量に少なくとも20g/日、発酵食品群では1日6食の発酵食品/日を加えることを目標とし、耐えられる場合はそれ以上摂取するよう奨励された。その後6週間は、高いレベルの摂取量を維持するよう指示された。食物繊維源(豆類、種子、全粒穀物、ナッツ、野菜、果物)または発酵食品(発酵乳製品、発酵野菜、発酵非アルコール飲料)を多様に取り入れるよう、参加者に詳しい指示が出された。参加者は、介入期間終了後、さらに4週間追跡された。すべての参加者は、ベースライン時、立ち上げ終了時、および高摂取期間中は2週間ごとに栄養士と面談した。参加者は、試験期間中、隔週で週3日(平日2日、週末1日)、詳細な食事記録をつけるよう求められた。フードログは管理栄養士によって確認され、遵守状況を評価し、忍容性に応じて食事中の繊維・発酵食品の量や種類を増やすよう勧告された。参加者は2週間ごとに胃腸症状調査(GSRS)(Svedlundら、1988)および症状変化(WinhamおよびHutchins、2011)に記入し、これらは栄養士との面会時に議論された。
食事データ 参加者は、HealthWatch360アプリを使用して、ランプ期は毎週3日間(平日2日、週末1日)、それ以外の期間は隔週ですべての飲食物摂取量を記録した。管理栄養士は参加者とともに入力内容を確認し、入力内容や分量の正確さを評価した。各時点では、3日間の平均値が使用された。時点:ベースライン、4週目、10週目、14週目のエントリーは、管理栄養士によってNutrition Data System for Research(NDSR)2019データベースに再入力された。食品を食品群に分類するために、NDSR付録10を使用した。
食物繊維の摂取量は、介入の各週について1日あたりの平均摂取量(グラム)として報告された。食物繊維源のカテゴリーは、果物、穀物、豆類、ナッツ/種子、野菜、肉、乳製品、その他に分類された。発酵食品の摂取量は、介入期間中の各週における1日あたりの平均サービング数として報告された。発酵食品1食分は以下のように定義された:コンブチャ、ヨーグルト、ケフィア、バターミルク、クワス=6オンス、キムチ、ザワークラウト、その他の発酵野菜=1/4カップ、野菜ブライン飲料=2オンス。 介入期間中に繊維または発酵食品の摂取量が有意に変化したかどうかを判断するため、第2週から他のすべての時点までペアのt検定が実施された。発酵食品の大分類は、カッテージチーズ、ケフィア、コンブチャ、野菜ブライン飲料、野菜、ヨーグルト、その他の食品、およびその他の飲料に分類された。
参加者は以下の有効な健康調査を使用した。PROMIS v1.1 global health、PROMIS v1.0 - fatigue、WHO well-being index、PROMIS applied cognition short form、Perceived Stress Scale (Cohen et al., 1983) 、および International Physical Activity Questionnaire (Craig et al., 2003)であった。
16SアンプリコンシーケンスのDNAは、Earth Microbiome Projectのプロトコル(Gilbertら、2014)に従ってMoBio PowerSoilキットを用いて便および発酵食品から抽出し、16SリボソームRNA(rRNA)サブユニット遺伝子のV4領域で増幅して250塩基(nt)イルミナシーケンスリードが作成された。1サンプルあたり平均20,119リードで、1,000リード未満のサンプルはフィルタリングで除外した(338サンプル中7サンプル削除)。フィルタリング、ノイズ除去、キメラ除去を行った結果、1サンプルあたり平均15,292リードが回収されました。参加者がよく使うのと同じ銘柄の発酵食品を購入し、16S配列決定法にかけた。これらの食品に関する我々の知見は、自分で発酵食品を購入した参加者が食べた正確な食品の組成を直接反映していない可能性がある(例えば、バッチのばらつきによる)ことに留意することが重要である。
便サンプルと発酵食品サンプルの両方から得た 16S rRNA 遺伝子アンプリコンシークエンスデータを、QIIME パイプラインバージョン 1.8 (Caporaso et al., 2010) を使用してデマルチプレックスした。アンプリコン配列バリアント(ASV)は、Rのdada2パッケージを使用して、学習型配列エラー補正モデル(DADA2法)(Callahanら、2016)を用いて同定した。
ɑダイバーシティは、Rのphyloseqパッケージ(バージョン3.4.0)を用いて、希薄化したサンプルで観測されたASVの数、シャノン多様性、またはPD全体の木として定量化した。Rのphyloseqパッケージを用いて、1サンプルあたり3,649リード(リードの最低10%、全331サンプル中299サンプルを保持)に希釈したデータを使用した。
β-diversityは、Rのphyloseqパッケージ(バージョン3.4.0)のordinate関数を用いて、加重および非加重Unifracについて計算された。高繊維食群と高発酵食群がベースラインで有意に異なるかどうかを判断するため、サンプルを-2週目にフィルタリングし、β-多様性を算出し、距離行列を用いた分散分析をRのveganパッケージ(バージョン2.5.6)のadonis関数(メソッド=「ユークリッド」)を使って計算した。
メタゲノムシーケンス ショットガンメタゲノムシーケンスのためのDNA抽出は、16Sアンプリコンシーケンスの方法に記載されているように、MoBio PowerSoilキットを用いて行った。ライブラリー調製には、Nextera Flexキットを使用し、最低10ngのDNAを入力として、入力濃度に応じて6または8サイクルのPCRを行った。12塩基対のデュアルインデックスバーコード(CZ Biohub)を各サンプルに加え、Agilent Fragment Analyzerでライブラリーを定量した。さらに、AMPure XP beads (Beckman) を用いて、450bpのフラグメント長(350bpのサイズインサート)をターゲットにサイズセレクションを行った。DNAペアエンドシーケンス(2×146bp)は、S4フローセル(CZ Biohub)を用いてNovaSeq 6000で実施した。各サンプルの平均ターゲット深度は2330万ペアエンドリードであった。
データ品質解析は、生シーケンスリードのデマルチプレックスと、さらなる解析の前にターゲットデプスのために複数のシーケンスランを必要とするサンプルのデータを連結することによって実施されました。BBtools suite (https://sourceforge.net/projects/bbmap/))を用いて生リードを処理し、真核生物で広く保存されている領域(http://seqanswers.com/forums/showthread.php?t=42552)をマスクしてトリミング後、ヒトゲノム(hg19)に対してマッピングしました。正確な重複リード(subs=0)はclumpifyでマークし、アダプターや低品質塩基はbbduk(trimq=16, minlen=55)でトリミングした。最後に、FastQC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/) を用いて、十分な品質が得られるようにリードを処理した。
糖鎖活性酵素(CAZymes)は、FragGeneScan(Rho et al., 2010)から呼び出した遺伝子について、dbCAN(v2.0.11)(Huang et al., 2018; Yin et al., 2012)を用いて注釈を付した。マージされたリードから、CAZymesという要件を持つマージされていないリードを、diamond (Buchfink et al., 2015) と hotpep (Busk et al., 2017) の両方を用いて同定した。最終的なリード数は、各サンプルの各CAZymeサブファミリーの100万あたりのリード数を計算することで正規化した(CAZyme count/sum all sample counts/1e6)。CAZymeの解析は、GHとPLに限定した。ベースライン(-2週目、欠測の場合は0週目)から維持期終了時(10週目、欠測の場合は8週目)まで相対存在量が有意に変化したCAZymeサブファミリーを決定するために、Rのsiggenesパッケージ(SAM two-class paired, FDR ≦ 0.05, q-val ≦ 0.1)を用いて、CAZymeサブファミリーを決定した。
便プロテオミクス 便の調製、質量分析プロトコル、タンパク質検索の方法は、Gonzalez et al.に記載されている。簡単に言うと、1サンプルあたり100~200mgの便を96ウェルプレートにロードしてセラミックビーズで溶解、遠心分離、上澄みタンパク質のアルキル化、洗浄、消化、Sトラッププレートによる溶出を測定した。タンパク質濃度を標準化し、TMT-11マルチプレキシングキットを用いて各個人の縦断的サンプルを標識した。ペプチドサンプルは、Dionex Ultimate 3000 HPLCを用いた逆相クロマトグラフィーに注入し、Thermo Fusion Lumos質量分析計で実行し、400-1500 m/z範囲内でポジティブイオンモードでMSデータを収集しました。得られたマススペクトルの生データファイルは、Proteome Discoverer 2.2を用いて、内蔵のSEQUEST検索アルゴリズムと内蔵のTMTバッチ補正を用いて検索された。3つのFASTAタンパク質配列データベースを使用した。Uniprot Swiss-Prot Homo sapiens (taxon ID 9606, FASTA file downloaded January 2017), the Human Microbiome Project (FASTA file downloaded from https://www.hmpdacc.org/hmp/HMRGD/ on January 2017), and an in-house curated database containing common preparatory contaminants.の3つのFASTA配列データベースを採用した。Proteome Discoverer 2.2に組み込まれたPercolatorアルゴリズムを使用して、ペプチドおよびタンパク質レベルの両方で、0.01の厳格なFDRカットオフでターゲットデコイ検索が採用された。質量分析プロテオミクスデータは、ProteomeXchange Consortium の PRIDE パートナーリポジトリにデータセット識別子 PXD021786 で寄託されています。
タンパク質の存在量は、2回の実行の平均から記録され、log2(x+1) 変換され、与えられたサンプル中のすべての定量されたタンパク質についてのレポーター強度の合計の割合(単一のタンパク質強度/総サンプル強度)として正規化された。タンパク質は、Human Microbiome Projectのタンパク質配列データベースとの高い信頼性の一致に基づいて、宿主または微生物由来のいずれかで示された。報告された微生物タンパク質およびタンパク質量は、同一の説明を持つタンパク質データベースエントリの合計を表し、微生物タンパク質の変数は、5,372のユニークなタンパク質から4,315のユニークな説明に減少しています。すべての宿主タンパク質は一意の記述を有していた。多重仮説検定のパラメータ数を減らす教師なし手法として、宿主タンパク質は上位75%(230タンパク質)、微生物タンパク質は上位50%(2,157タンパク質)を含むようにフィルタリングし、被験者間の分散(介入終了からベースラインへの被験者固有の差)が最も大きいタンパク質を含むようにフィルタリングされた。すべてのプロテオーム解析は、前述のフィルター処理されたデータセットを用いて完了した。
便中短鎖脂肪酸 試料調製のため、1 サンプルあたり約 20 mg の便を 1.5 mL のエッペンドルフチューブに入れ、短鎖脂肪酸の絶対定量のため Metabolon 社に送った。すべてのサンプルは凍結保存され、ドライアイスで輸送された。短鎖脂肪酸のレベルがベースラインから介入終了まで有意に変化したかどうかを判断するために、Paired Welsh t-testが使用された。可視化のため、プロットには外れ値を表示していない。統計解析には全ポイントを使用した。
便の炭水化物 GC-MSを用いた便サンプル中に存在する単糖の測定方法は、(DeJongh et al., 1969)に記載されている。簡単に言えば、便サンプルを10%エタノール水溶液中でホモジナイズし、真空濃縮機を用いて乾燥させた。既知の乾燥重量(0.5-0.8mgの間)の試料をガラス加水分解チューブに移し、超音波で懸濁し、加熱し、凍結乾燥させた。次に、サンプルを1M MeOH-HClでメタノリゼーションし、MeOH: Pyridineで再N-アセチル化した。無水酢酸 (3:1:1 v/v) を用いて再N-アセチル化した。最後に、Tri-Sil試薬 (Thermo Scientific) を用いてTMS-エーテルに変換し、乾燥窒素フラッシュで乾燥させ、ヘキサンで抽出した。メチルグリコシドのTMS誘導体はGC-MSで分析し、単糖のプロファイリングはResteck 5MS溶融シリカキャピラリーカラムを用いて、オーブン温度勾配で完了させた。1uLの試料がスプリットレスモードでGCカラムに注入された。サンプル中に存在する単糖の絶対値を比較・定量するために、異なる単糖の標準混合物も実行されました。線形混合効果モデルを用いて、便中の炭水化物の割合と食物繊維の摂取量を変化させた。
CyTOF 全血サンプルを解凍し、Thaw Lyse buffer (Smart Tube, inc) を用いて赤血球を室温で10分間2回溶解し、細胞染色用培地 (CSM: 0.5% BSAおよび0.02% Na azide入りPBS) で2回洗浄した。各サンプルから1×106個の細胞を、以前に記載されたようにバーコード化した(Behbehaniら、2014)。簡単に言えば、細胞を、0.02%サポニンを含むPBSを用いてわずかに透過化し、次に、機能化された安定パラジウム同位体の独自の組み合わせで、室温で15分間染色した。サンプルはCSMで洗浄し、染色用に1本のチューブにプールした。細胞をhuman TruStain FcX block (Biolegend) でブロックした後、細胞外抗体カクテルで染色した。抗体カクテルは、以前に記載されたように、4xカクテルとして賦形剤B144を有するLyoSpheres(BioLyph)に凍結乾燥した後、CSMで再水和した(Fragiadakisら、2019年)。抗体パネルは、表S6に記載されている。次に、サンプルをメタノールを用いて4℃で10分間透過させ、細胞内抗体カクテルで染色した。細胞は、CyTOF取得の前にイリジウムインターカレーターで一晩染色した。サンプルは水で2回洗浄し、正規化ビーズ(Fluidigm)に再懸濁し、セルストレーナーで濾過した。サンプルは、Helios CyTOFで実行された。
サンプルはRのpremessaパッケージを使用して正規化およびデバーコードされた。細胞集団はCell Engine (immuneatlas.org, ゲーティング戦略、図S3)を使用してゲーティングされた。細胞頻度はCD45+細胞の割合として計算され、好中球は例外で、一重項細胞の割合として定量化された。内因性シグナル伝達は、特定の細胞集団におけるシグナル伝達タンパク質の変換レベルの中央値とした(変換=arcsinh(値/5))。シングル化した細胞の数が10,000個未満の場合、サンプルは除外された。両方のベースラインサンプルでデータが利用可能な場合は、最初のベースラインを使用し、そうでない場合は、2番目のベースラインを使用した。ヒートマップでは、欠損データは全参加者の特徴の平均値を用いてインプットされた。有意差解析では、欠損データのある参加者は除外された。シグナル伝達タンパク質の有意性解析では、特徴を4つの主要な細胞タイプ(CD4+ T細胞、CD8+ T細胞、B細胞、古典的単球)のものに限定し、Rのsiggenesパッケージ(SAM 2クラスペア、FDR ≦ 0.05、q値 ≦ 0.1)を使用して解析を行った。細胞頻度の有意性は、Wilcoxon paired testを用いて評価した。
血清サイトカイン サイトカインデータは、Olink Proteomicsに提出された血清サンプルから作成し、92の分析物からなる炎症パネルアッセイ(Olink INFLAMMATION、表S6)を用いて分析した。92個のタンパク質のうち、67個が75%以上のサンプルで検出され、解析に使用された。データは正規化タンパク質発現値(NPX、Olink Proteomics、log2スケールの任意単位)として提示されている。有意性はRのsiggenesパッケージを用いて評価した(SAM two-class paired, FDR ≦ 0.05, q-value ≦ 0.1)。
フローサイトメトリー このアッセイはスタンフォード大学のHuman Immune Monitoring Centerによって行われた。PBMCは温めた培地で解凍し、2回洗浄後、0.5×106個の生存細胞/mLで再懸濁した。96ウェルのディープウェルプレートに1ウェルあたり200uLの細胞をプレーティングした。37℃で1時間静置した後、50 ulのサイトカイン(IFNa, IFNg, IL-6, IL-10, or IL-2)またはLPSを添加して細胞を刺激し、37℃で15分間インキュベートした。その後、PBMCをパラホルムアルデヒドで固定し、メタノールで透過処理し、一晩-80℃に置いた。各ウェルをPacific OrangeとAlexa-750色素(Invitrogen, Carlsbad, CA)の組合せでバーコード化し、チューブにプールした。細胞をFACSバッファ(2% FBSと0.1%アジ化ナトリウムを添加したPBS)で洗浄し、以下の抗体(すべてBD Biosciences, San Jose, CA製)で染色した。CD3 Pacific Blue, CD4 PerCP-Cy5.5, CD20 PerCp-Cy5.5, CD33 PE-Cy7, CD45RA Qdot 605; サイトカインサンプルはさらに pSTAT-1 FITC, pSTAT-3 APC, pSTAT-5 PE で染色し、LPSサンプルは pERK APC , pP38 FITC, pPLCg2 PE で染色した (Table S6). その後、サンプルを洗浄し、FACSバッファーに再懸濁した。LSRIIフローサイトメーター(BD Biosciences)上のDIVA 6.0 ソフトウェアを使用して、刺激条件ごとに10万個の細胞を収集した。ゲーティングはFlowJo v9.3を用い、前方散乱対側方散乱プロファイルに基づく生細胞へのゲーティング、前方散乱面積対高さに基づく単一細胞へのゲーティング、次いで細胞サブセット特異的ゲーティングによって行った。
シグナル伝達マーカーは90パーセンタイル値で定量した。シグナル伝達能力を定量化するために、サイトカイン刺激時と非刺激時のリン酸化タンパク質の変化量を計算した。解析のために、平均fold changeが2以上の特徴量に限定した。有意性はRのsiggenesパッケージで評価した(SAM two-class paired, FDR ≤ 0.05, q-value ≤ 0.1)。
非標的血清メタボローム 高発酵食品参加者血清サンプルからの代謝物をLC-MSグレードのメタノール(4:1 v/v)で抽出した。血清サンプル中のタンパク質の沈殿は、サンプルを室温で5分間インキュベートした後、5,000xgで10分間遠心分離することにより行いました。サンプル上清を移し、蒸発させ、内部標準混合物 (50%メタノール) に再溶解させた。代謝物サンプルは、LC-MS qTOF装置で逆相C18ポジティブ法、C18ネガティブ法、HILICポジティブ法を用いて、記載の方法で分析した (Wikoff et al., 2009)。化合物のアノテーションは、MSDIALソフトウェア(Tsugawa et al.、2015)および真正標準参照ライブラリを使用して実施された。代謝物レベルを定量するために、アノテーションされた各代謝物の曲線下面積は、各サンプルの内部標準の合計を使用して正規化した。
定量化および統計解析
本文中の統計詳細の位置 各実験の結果は、結果および図の説明文に記載されています。また、統計検定の有意な値は、図中にアスタリスクで示されている。各データタイプの参加者数は、補足表1に記載されている。
主要評価項目の統計解析 ClinicalTrials.govに記載された主要評価項目は、各群におけるベースライン(第2週)から維持期終了時(第10週)までのCytokine Response Scoreの変化であった。CRSは、(Shen-Orr et al., 2016)に記載された方法を用いて算出した。有意な変化は、ペアのt検定を用いて評価した(表S4)。無作為化された参加者のみが主要アウトカムの計算に含まれた(高繊維食の2人の参加者は除外された)。統計解析計画は事前に公表されなかったが、多重仮説検定補正は全体を通して説明されたように適用された。
データのセンタリングとスケーリング 異なる種類のデータを互いに比較する解析では、実験的バイアスを排除するために、パラメータをセンタリングし、(列間で)スケーリングした。データのセンタリングとスケーリングを記述するすべてのメソッドは、基本Rのスケール関数(scale function, center=TRUE, scale=TRUE)を使用して行われた。中心化されたデータは、各値から列の平均を引くことによって計算された。スケーリングされたデータは、中心化された列をその標準偏差で割ることによって計算された。
再帰的特徴ランダムフォレスト 高繊維食群と高発酵食群の区別において、どのデータ型が最も正確かを決定するために、再帰的特徴ランダムフォレスト(caret, rfeControl, number=100, leave one out cross validation)が使用されました。各データタイプのパラメータは、介入終了時(10週目)からベースライン(便は-2週目、血液は-3週目)までの参加者固有の差とした。参加者がある実験プラットフォームについてベースラインと介入終了時点の両方を有していない場合、それらは解析から除外された。すべてのパラメータはセンタリングおよびスケーリングされた。大規模な特徴量セットの冗長なパラメータを減らすために、教師なしパラメータフィルトレーションを使用した。16Sデータは、少なくとも25%のサンプルに存在するASVのみにフィルタリングし、(Callahanら、2017)により記載された方法に従って各サンプル内でランク正規化された。宿主タンパク質は上位75%(合計230タンパク質)に、微生物タンパク質は参加者間で最も高い分散を持つ上位50%のタンパク質(合計2,157タンパク質)にフィルタリングされました。CAZymeサブファミリーは、サンプル間でファミリーレベルで合計された。再帰的特徴ランダムフォレストモデルは、最高の精度を得るために必要な最小限の特徴セットを返した(表S5)。
マイクロアレイの有意性解析(SAM)を用いた多重検定 異なる時点における食事群間(非対)または同一参加者内(対)で差次的に発現するパラメータの同定および偽発見率(FDR)の推定は、Rのsiggenesパッケージを使用して計算された。
線形混合効果モデル 同一参加者が複数のサンプルをモデルに提供した場合(すなわち、複数の時点の参加者)、2つの変数間の線形相関を評価するために線形混合効果モデルを使用した。同一参加者からのサンプルは互いに独立ではなく、自己相関が導入されるため、RのnLMEパッケージを用いたlme関数で参加者の項をランダム変数として用いた。性別、人種、BMIの項は、経時的多様性の分析において共変量としてモデルに含まれた。
総繊維摂取量(グラム)は、lme関数と参加者をランダム変数とする線形混合効果モデルを用いて、便中の炭水化物の割合と相関させた。
順位付けされたASV数対時点(週)およびα多様性(観察されたASV数)対発酵食品摂取量の関連は、lme関数と参加者をランダム変数として用いて評価された。時間との関連におけるすべてのASVのP値は、Benjamini-Hochberg補正を用いて多重仮説検定のために調整された。
経時的に観察されたASVの数が高繊維食の炎症群間で異なるかどうかを判断するために、ペアワイズLMEモデルを使用した。観察されたASVの数を結果変数とし、時間(週単位)と炎症群(2値変数)の両方を共変量とした。炎症群は一度に2群しか比較しないので、繊維炎症群間の有意性を判断するために、高炎症 vs. 低炎症 i、高炎症 vs. 低炎症 ii、低炎症 i vs. 低炎症 iiの合計3つのモデルを作成した。高炎症と低炎症iを比較したモデルでは、炎症グループ因子は有意であったが(p値=7.2e-4)、時間変数は有意でなかった(p値=0.69)。他の2つのモデルは、有意なp値を示さなかった。
発酵食品摂取量が、観察されたASVの数、lme関数、参加者を確率変数として有意に変化するかどうかを決定するために、発酵食品摂取量の合計と各発酵食品群を別々にモデル化し、p値はBenjamini-Hochberg補正を用いて調整された。
ゼロインフレートベータランダム効果モデル(ZIBR)を用いた相対的存在度と存在度/存在度の経時的変化におけるASVのモデル化 高繊維食群における炎症クラスター間の存在度および/または分類群の経時的差異を特定するために、RのZIBRパッケージを使用してゼロインフレートベータ回帰モデルを適合させた。 フィルタリングデータセットは(Chen and Li, 2016)に記載のようにキュレーションされた。ASVはtip_glom(Rのphyloseqパッケージ、h=0.1)を用いて前処理し、GreenGenesで特性化されていない場合は削除し、少なくとも25%のサンプルに存在するASVのみにフィルタリングした。ZIBRは欠損データを扱うことができないため、欠損サンプルは各タイムポイントにおける各グループの平均ASV存在量で埋めた。ベースライン係数が有意な分類群は、食事介入によって誘発された有意差に焦点を当てるため、フィルターで除外されました(表S7)。
発酵食品からも検出された参加者サンプルの新規ASV 参加者の便サンプルの新規ASVは、各参加者とタイムポイントの新規ASVを集計して合計することにより算出した。新規ASVには、ベースライン時点(第2週、0週)には存在せず、介入期間中(第2〜9週)の他のいずれかの時点で検出されたものが含まれる。250カウント未満の発酵食品ASV(表S5)は、フィルターで除外した。介入中に新たに獲得したASVと発酵食品で検出されたASVの重なりは、各時点で全参加者にわたって合計された。
血清代謝物の変化とサイトカインの間のピアソン相関 高発酵食品食群について血清メタボロミクスが収集された。各代謝物のピーク面積は、各サンプルの内部標準の総和を用いて正規化した。各血清代謝物および炎症性サイトカインについて、10週目と-2週目の差を算出した。各代謝物-サイトカインペア間のピアソン相関を計算し、Benjamini-Hochberg仮説補正を用いてp値を補正した。図S6Bに示す有意な相関(p値補正≦0.05)。
データ型間のスピアマン相関 すべてのパラメータ間のスピアマン相関を計算した。データ入力は、両群からの参加者固有の差異を包含し、中心化および尺度化された。参加者が、与えられた実験プラットフォームについてベースラインと介入終了時点の両方を持たない場合、それらは分析から除外された。パラメータは、ランダムフォレストで説明したのと同じ方法でフィルタリングし、それぞれの実験プラットフォームにグループ化し、宿主由来または免疫由来に指定した。相関はBenjamini-Hochberg仮説補正の前に、宿主-微生物間の比較のみにフィルタリングされた。宿主タンパク質と微生物タンパク質の相関は、同じサンプルと実験プラットフォームに由来し、他のクロスオミクス比較と比較して内部バイアスが膨らんでいたため、ここでは示していない。CAZymes(図7B)との関連性を分析するための宿主タンパク質アノテーションは、Ingenuity Pathway Analysis Core Analysis, Diseases and Functions Analysisを使用して割り当てた。各ビンにおけるタンパク質の完全なアノテーションは、表S8で見ることができる。
ハイライト
システムプロファイリングを用いた食事介入により、食事-マイクロバイオーム-免疫軸の関連性が明らかになった
高繊維食はマイクロバイオーム機能を変化させ、個別の免疫応答を引き起こす
発酵食品を摂取すると、マイクロバイオームの多様性が増大し、炎症マーカーが減少する。
補足資料
1
資料S1:表S1、S2、S3、S7
クリックすると表示されます(278K, pdf)
2
表S4、図1関連:一次および二次臨床試験結果
クリックすると表示されます(15K, xlsx)
3
表S5, 図2関連: 食事療法群を予測するランダムフォレストモデルで選択された特徴量
クリックすると表示されます(20K, xlsx)
4
表S6、図4とand6:6に関連する。免疫プロファイリングパネル。Olink、CyTOF surface makers、CyTOF intracellular markers、Phospho-flowのパネルが含まれる。
クリックすると表示されます(17K, xlsx)
5
Table S8、図7関連:タンパク質疾患アノテーション。
クリックすると表示されます(16K, xlsx)
6
図 S1、図 1、,33、5:5 に関連する。高繊維食群および高発酵食群のαおよびβ多様性測定値。
(A) 高発酵食品群および高繊維食群のベースライン(-2週目および0週目)の平均アルファ多様性指標(観察されたASV、PD全木、およびシャノン)。
(B)高発酵食品群および高繊維食群のベースライン(第2週)における加重ユニフラックベータ多様性。
(C) 高繊維食群におけるシャノンアルファ多様性。
(D) 高繊維食群における系統的多様性(PD)全木アルファ多様性。
(E) 高発酵食品群におけるPD全木アルファ多様性。* は2週目に対する有意なp値(p値≦0.05)。線形混合効果モデルを用いた線形回帰で有意(p-value=1.3e-2)。
こちらをご覧ください(426K, pdf)
7
図S2、図1関連:参加者個人の高繊維食・高発酵食アーム群の摂取量。
(A)高食物繊維食armの参加者固有のカテゴリー別食物繊維摂取量。
(B)高発酵食品ダイエットarmの参加者固有のカテゴリー別摂取量。
クリックすると表示されます(455K, pdf)
8
図S3、図4と図6の関連:6: CyTOFゲーティング戦略
こちらをクリックしてご覧ください(689K, pdf)
9
図S4, 図4関連:高繊維食群炎症群における内因性シグナル伝達の変化。CyTOFによって測定され、ベースライン(第3週)から維持期間終了時(第10週)まで、箱ひげ図横の斜線ボックスで示された有意な変化(FDR ≦ 0.05, q値 ≦ 0.1, siggenesパッケージによるSAMテスト)として識別された内因性シグナリングレベル(赤=高炎症群で有意に変化、青=低炎症ii群で有意に変化)。
こちらをご覧ください(233K, pdf)
10
図S5、図5関連:発酵食品の16S ASV解析。250カウント未満のASVはフィルタリングし、同属にビンディングされたカウントを合計した。属が未指定の場合は、同じ目や科に基づいてASVを合計した。
こちらをご覧ください(102K, pdf)
11
図S6、図5と図6:6に関連する。高発酵食品食群で観察された変化。
(A) ベースラインから維持期の終わりまで相対量が有意に変化したメタゲノム配列から同定されたCAZymes (FDF ≤ 0.05, q-value ≤ 0.1, siggenesパッケージによるSAMテスト)。CAZymesはdbCanを使用してアノテーションされ、機能カテゴリに割り当てられた。
(B) 血清代謝物の差は、ピアソン相関を用いて炎症性サイトカインの差と相関している(調整済みp値≤0.05)。円の大きさが大きくなるにつれて、調整後のp値が小さくなる。代謝物とサイトカインの相関が正のものは赤丸で、負のものは青丸で示した。
クリックすると拡大します(176K, pdf)
謝辞
本研究の実施にご協力いただいた参加者の方々、技術的なサポートをしていただいたMichelle St. また、Human Immune Monitoring CoreのKavita MathiとNatalia Sigalには、染色とphosphoflowおよびCyTOFアッセイの実行について感謝したい。Mark Davis と Kari Nadeau の支援と指導、および Institute for Immunity, Transplantation and Infection と Sean N. Parker Center for Allergy & Asthma Research からの種 子資金に感謝する。この研究は、Center for Human Microbiome Research、Paul and Kathy Klingenstein、Hand Foundation、Heather Buhr and Jon Feiber、Meredith and John Pasquesiへの寛大な寄付金によって行われました。G.K.F.はNIH T32 AI 7328-29とスタンフォード大学学長ポストドクトラルフェローシップの支援を受けている。H.C.W.はNSF Graduate Student Fellowshipの支援を受けている。J.L.S.はChan-Zuckerberg Biohubの研究者である。
脚注
高繊維食または発酵食品食の縦断的効果を調査するヒトでの前向き無作為化マルチオミクス研究では、マイクロバイオームの多様性に対する両者の効果に差があり、後者は炎症マーカーの低下と免疫反応の調節に顕著な影響を及ぼすことが示されている。
利害関係者の宣言
Hannah Wastykは、インターフェイス・バイオサイエンスの創業者であり、株主でもあります。William Van Treurenはインターフェイス・バイオサイエンシズの創業者であり、株主です。Justin SonnenburgはJanuary AIおよびNovome Biotechnologiesの創業者、株主であり、科学諮問委員会にも所属しています。
その他のリソース
臨床試験登録番号 NCT03275662:https://clinicaltrials.gov/ct2/show/NCT03275662
出版社からの免責事項:本書は、出版が承認された未編集の原稿をPDFファイル化したものです。お客様に対するサービスとして、この初期バージョンの原稿を提供しています。この原稿は、コピー編集、組版、校正を経て、最終的な形として出版されます。また、本誌に適用されるすべての法的免責事項が適用されることをご了承ください。
論文情報
細胞 著者原稿; PMC 2022 Aug 5で入手可能。
最終編集版として掲載
Cell. 2021 Aug 5; 184(16): 4137-4153.e14.
オンライン公開 2021 Jul 12. doi: 10.1016/j.cell.2021.06.019
pmcid: pmc9020749
NIHMSID: NIHMS1722178
PMID: 34256014
Hannah C. Wastyk,#2 Gabriela K Fragiadakis,#1 Dalia Perelman,3 Dylan Dahan,1 Bryan D Merrill,1 Feiqiao B. Yu,5 Madeline Topf,1 Carlos G. Gonzalez,4 William Van Treuren,1 Shuo Han,1 Jennifer L. Robinson,3 Joshua E. Elias,4 Erica D. Sonnenburg,1,6,† Christopher D. Gardner,3,† and Justin L. Sonnenburg1,6,†≠ † † † † † † † † † † † † † † † † † † † † Diahiahiahiahiahiai
1スタンフォード医科大学微生物学・免疫学教室(カリフォルニア州スタンフォード、94305 米国
2バイオエンジニアリング部門、スタンフォード医科大学、スタンフォード、カリフォルニア州、94305 USA
3スタンフォード予防研究センター、医学部、スタンフォード大学医学部、カリフォルニア州スタンフォード、94305米国
4スタンフォード大学医学部化学・システム生物学教室、スタンフォード大学、カリフォルニア州、94305 USA
5チャン・ザッカーバーグ・バイオハブ、サンフランシスコ、カリフォルニア州、94158米国
6ヒトマイクロバイオーム研究センター、スタンフォード大学医学部、スタンフォード州、カリフォルニア州、94305 アメリカ
#等しく貢献した 。
≠主な連絡先
著者の貢献
H.C.W.、G.K.F.、M.T.、J.L.S.、C.D.G.、E.D.S.は実験を行い、データ解析を設計し実行した。D.P.は患者との対話、食事のカウンセリング、分析を行った。D.D.、B.D.M.、F.B.Y.はメタゲノム実験と分析を主導した。C.G.G.とJ.E.E.は、便のプロテオミクス実験を計画・実施し、その分析を指導した。J.L.R.は、患者の募集と試験デザインの実施を監督した。H.C.W., G.K.F., J.L.S., C.D.G. and E.D.S. は本研究を構想し、原稿を執筆した。
† 宛先 Justin Sonnenburg (Lead contact), ude.drofnats@grubnennosj, Christopher Gardner, ude.drofnats@rendragc, Erica Sonnenburg, ude.drofnats@grubnennos.acire.
著作権表示
出版社の免責事項
この論文の出版社による最終編集版はCellにあります。
参考文献
Arumugam M、Raes J、Pelletier E、Le Paslier D、Yamada T、Mende DR、Fernandes GR、Tap J、Bruls T、Batto J-M、他 (2011). ヒト腸内細菌群の腸型。Nature 473, 174-180. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Behbehani GK, Thom C, Zunder ER, Finck R, Gaudilliere B, Fragiadakis GK, Fantl WJ, and Nolan GP (2014).を参照。サポニンによる一過性の部分透過化により、表面マーカー染色に先立つ細胞バーコーディングが可能になった。Cytom. パート J. Int. Soc. Anal. Cytol. 85, 1011-1019. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Benesh AE, Nambiar R, McConnell RE, Mao S, Tabb DL, and Tyska MJ (2010). 腸細胞の微小管におけるクラスIミオシンの異なる局在と動態。Mol. Biol. Cell 21, 970-978. [PMC フリーアーティクル] [PubMed] [Google Scholar].
ブランド-ミラーJ、およびBuyken A(2020)。食後反応のマッピングは、ターゲットを絞った食事アドバイスのためのシーンを設定します。Nat. Med. 26, 828-830. [PubMed][Google Scholar].
Buchfink B, Xie C, and Huson DH (2015). DIAMONDを用いた高速かつ高感度なタンパク質アライメント。Nat. Methods 12, 59-60. [PubMed][Google Scholar].
Busk PK, Pilgaard B, Lezyk MJ, Meyer AS, and Lange L (2017). Homology to peptide pattern for annotation of carbohydrate-active enzymes and prediction of function(糖質活性酵素のアノテーションと機能予測のためのペプチドパターンへの相同性)。BMC Bioinformatics 18, 214. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Callahan BJ, McMurdie PJ, Rosen MJ, Han AW, Johnson AJA, and Holmes SP (2016). DADA2: Illuminaアンプリコンデータからの高分解能サンプル推論。Nat. Methods 13, 581-583. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Callahan BJ, Sankaran K, Fukuyama JA, McMurdie PJ, and Holmes SP (2017). Workflow for Microbiome Data Analysis: from raw reads to community analyses(マイクロバイオームデータ解析のためのワークフロー:生リードからコミュニティ解析まで). Bioconductor. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Peña AG, Goodrich JK, Gordon JI, etc. (2010). QIIMEによりハイスループットなコミュニティシークエンスデータの解析が可能になりました。Nat. Methods 7, 335-336. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Chen EZ, and Li H (2016). 縦断的なマイクロバイオーム組成データを分析するための2部混合効果モデル。バイオインフォマ。Oxf. Engl. 32, 2611-2617. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Chen Y-R, Zheng H-M, Zhang G-X, Chen F-L, Chen L-D, and Yang Z-C (2020). High Oscillospira abundance indicates constipation and low BMI in the Guangdong Gut Microbiome Project(広東省腸内細菌プロジェクトにおける高いオシロスピラ存在比は便秘と低BMIを示す。Sci. Rep. 10, 9364. [PMC フリーアーティクル] [PubMed] [Google Scholar].
コーエンS、カマルクT、およびMermelstein R(1983)。知覚されたストレスのグローバルな測定。J. Health Soc. Behav. 24, 385-396. [PubMed] [Google Scholar].
Cotillard A, Kennedy SP, Kong LC, Prifti E, Pons N, Le Chatelier E, Almeida M, Quinquis B, Levenez F, Galleron N, et al.(2013)。腸内細菌遺伝子リッチネスに対する食事介入の影響。ネイチャー500、585-588。[PubMed][Google Scholar].
Craig CL, Marshall AL, Sjöström M, Bauman AE, Booth ML, Ainsworth BE, Pratt M, Ekelund U, Yngve A, Sallis JF, et al. (2003). 国際身体活動調査票(International physical activity questionnaire)。12カ国の信頼性と妥当性。Med. Sci.スポーツエクササイズ。35, 1381-1395. [PubMed][Google Scholar].
David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, et al.(2014).。食事は、迅速かつ再現性高くヒトの腸内細菌を変化させる。ネイチャー505, 559-563. [PMCフリーアーティクル] [PubMed] [Google Scholar].
De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, Collini S, Pieraccini G, and Lionetti P (2010). 腸内細菌叢の形成における食事の影響は、ヨーロッパとアフリカの農村部の子供たちにおける比較研究によって明らかになった。Proc. Natl. Acad. Sci. U. S. A. 107, 14691-14696. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Deehan EC, and Walter J (2016). 食物繊維のギャップと消えゆく腸内細菌叢。Implications for Human Nutrition. Trends Endocrinol. Metab. tem 27, 239-242. [PubMed] [Googleスカラー]。
DeJongh DC, Radford T, Hribar JD, Hanessian S, Bieber M, Dawson G, and Sweeley CC (1969). 炭水化物のトリメチルシリル誘導体のガスクロマトグラフィーおよび質量分析による分析。J. Am. Chem. Soc. 91, 1728-1740. [Google Scholar] (英語
Derrien M, Belzer C, and de Vos WM (2017). Akkermansia muciniphilaとその宿主機能調節の役割.Microb. Pathog. 106, 171-181. [PubMed][Google Scholar].
Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, Pudlo NA, Kitamoto S, Terrapon N, Muller A, et al.(2016). 食物繊維を奪われた腸内細菌叢は、大腸粘液バリアーを劣化させ、病原体感受性を増強する。Cell 167, 1339-1353.e21. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Díaz-López A, Bulló M, Martínez-González MA, Corella D, Estruch R, Fitó M, Gómez-Gracia E, Fiol M, García de la Corte, F.J., Ros, E., et al.(2016). 心血管リスクの高いスペインの地中海系高齢者集団における乳製品消費と2型糖尿病リスク。Eur. J. Nutr. 55, 349-360. [PubMed][Google Scholar].
ディミディE、コックスSR、ロッシM、ウィーランK(2019)。発酵食品。定義と特徴、腸内細菌叢への影響、消化管の健康と疾患への影響。ニュートリエンツ11. [PMC無料記事] [PubMed] [Google Scholar].
ダンカンSH、Belenguer A、Holtrop G、ジョンストンAM、フリントHJ、およびLobley GE(2007)。肥満被験者による炭水化物の食事摂取量の減少は、糞便中の酪酸および酪酸産生菌の濃度を低下させる。Appl. Environ. Microbiol. 73, 1073-1078. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Earle KA, Billings G, Sigal M, Lichtman JS, Hansson GC, Elias JE, Amieva MR, Huang KC, and Sonnenburg JL (2015). 定量的イメージングによる腸内細菌叢の空間的組織化。Cell Host Microbe 18, 478-488. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Fillatreau S (2018). B細胞とそのサイトカイン活性のヒト疾患における意味合い. Clin. Immunol. オーランド・フラ 186, 26-31. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Flint HJ, Duncan SH, and Louis P (2017). 栄養が腸内細菌群に与える影響。Curr. Opin. Microbiol. 38, 59-65. [PubMed][Google Scholar].
Fragiadakis GK, Bjornson-Hooper ZB, Madhireddy D, Sachs K, Spitzer MH, Bendall SC, and Nolan GP (2019). ヒトにおける免疫細胞応答のバリエーションは、細胞タイプにまたがる性特異的な協調的シグナル伝達を明らかにする(Immunology)。[PMCフリーアーティクル] [PubMed] [Google Scholar].
Fragiadakis GK, Wastyk HC, Robinson JL, Sonnenburg ED, Sonnenburg JL, and Gardner CD (2020). 長期的な食事介入は、食事と体重の変化にもかかわらず、腸内細菌叢の回復力を明らかにする。Am. J. Clin. Nutr.111、1127-1136。[PMC無料論文] [PubMed] [Google Scholar].
GBD 2015 Mortality and Causes of Death Collaborators (2016). 世界、地域、国の平均寿命、全死因死亡率、249の死因別死亡率、1980-2015:Global Burden of Disease Study 2015のための系統的分析(A systematic analysis for the Global Burden of Disease Study 2015). ランセットLond. Engl. 388, 1459-1544. [PMC無料記事] [PubMed] [Google Scholar].
Gilbert JA, Jansson JK, and Knight R (2014). アースマイクロバイオームプロジェクト:成功と抱負。BMC Biol. 12, 69. [PMC無料記事] [PubMed] [Google Scholar].
Gille D, Schmid A, Walther B, and Vergères G (2018). 発酵食品と非伝染性慢性疾患。レビュー(A Review). ニュートリエンツ 10. [PMC無料論文] [PubMed] [Google Scholar].
Gonzalez CG, Wastyk HC, Topf M, Gardner CD, Sonnenburg JL, and Elias JE (2020). High-Throughput Stool Metaproteomics(ハイスループット スツール メタプロテオミクス)。Method and Application to Human Specimens. MSystems 5, e00200-20, /msystems/5/3/msys.00200-20.atom. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Granado-Serrano AB, Martín-Garí M, Sánchez V, Riart Solans M, Berdún R, Ludwig IA, Rubió L, Vilaprinyó E, Portero-Otín M, and Serrano JCE (2019). 高コレステロール血症における糞便細菌と短鎖脂肪酸のシグネチャー。Sci.Rep.9、1772。[PMCフリーアーティクル] [PubMed] [Google Scholar].
Huang L, Zhang H, Wu P, Entwistle S, Li X, Yohe T, Yi H, Yang Z, and Yin Y (2018). dbCAN-seq: a database of carbohydrate-active enzyme (CAZyme) sequence and annotation.(炭水化物活性酵素(CAZyme)の配列とアノテーションのデータベース。Nucleic Acids Res. 46, D516-D521. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Jha AR, Davenport ER, Gautam Y, Bhandari D, Tandukar S, Ng KM, Fragiadakis GK, Holmes S, Gautam GP, Leach J, et al.(2018). ヒマラヤのライフスタイル勾配を越えた腸内細菌叢の変遷。PLoS Biol. 16, e2005396. [PMC無料記事] [PubMed] [Google Scholar].
Johnson AJ, Vangay P, Al-Ghalith GA, Hillmann BM, Ward TL, Shields-Cutler RR, Kim AD, Shmagel AK, Syed AN, Personalized Microbiome Class Students, et al.(2019).(英語)。Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans(毎日のサンプリングで、ヒトの食事とマイクロバイオームの関連性を明らかにする)。Cell Host Microbe 25, 789-802.e5. [PubMed][Google Scholar].
Klimenko NS, Tyakht AV, Popenko AS, Vasiliev AS, Altukhov IA, Ischenko DS, Shashkova TI, Efimova DA, Nikogosov DA, Osipenko DA, et al.(2018). 市民科学プロジェクトのフレームにおける制御されていない短期間の食事介入に対するマイクロバイオーム反応。ニュートリエンツ10. [PMCフリーアーティクル] [PubMed] [Google Scholar].
ル・シャトリエE、ニールセンT、秦J、プリフティE、ヒルデブランドF、ファロニーG、アルメイダM、アルムガムM、バットJ-M、ケネディS、その他(2013)。ヒト腸内細菌群の豊かさは、代謝マーカーと相関する。ネイチャー500、541から546。[PubMed] [Google Scholar].
Lin D, Peters BA, Friedlander C, Freiman HJ, Goedert JJ, Sinha R, Miller G, Bernstein MA, Hayes RB, and Ahn J (2018).を参照。成人における食物繊維の摂取量と腸内細菌叢の関連性。Br. J. Nutr. 120, 1014-1022. [PMC無料記事] [PubMed] [Google Scholar].
Liu L, Wang S, and Liu J (2015). 食物繊維の摂取と全死亡、心血管死亡、がん死亡:コホート研究のシステマティックレビューとメタアナリシス。Mol. Nutr. Food Res.59、139-146。[PubMed] [Google Scholar].
Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, Ahn SY, etc. (2012). 1990年と2010年の20の年齢層における235の死因による世界と地域の死亡率:Global Burden of Disease Study 2010のための系統的分析. Lancet Lond. Engl. 380, 2095-2128. [PubMed] [Google Scholar].
Lynch SV, and Pedersen O (2016). The Human Intestinal Microbiome in Health and Disease(健康と病気におけるヒト腸内細菌群)。N. Engl. J. Med. 375, 2369-2379. [PubMed] [Google Scholar].
Makki K, Deehan EC, Walter J, and Bäckhed F (2018). 宿主の健康と疾患における食物繊維の腸内細菌叢への影響(The Impact of Dietary Fiber on Gut Microbiota in Host Health and Disease). Cell Host Microbe 23, 705-715. [PubMed][Google Scholar].
Martínez I, Lattimer JM, Hubach KL, Case JA, Yang J, Weber CG, Louk JA, Rose DJ, Kyureghian G, Peterson DA, et al.(2013).。腸内マイクロバイオーム組成は、全粒粉誘発性免疫学的改善と関連している。isme j. 7, 269-280. [PMC無料記事] [PubMed] [Google Scholar].
Martínez I, Stegen JC, Maldonado-Gómez MX, Eren AM, Siba PM, Greenhill AR, and Walter J (2015). パプアニューギニアの農村部の腸内細菌叢:組成、多様性パターン、および生態学的プロセス(The gut microbiota of rural papua new guineans: composition, diversity patterns, and ecological processes). セルレップ 11, 527-538. [PubMed][Google Scholar].
Mosca A, Leclerc M, and Hugot JP (2016). 腸内細菌叢の多様性とヒトの病気。私たちの生態系に主要な捕食者を再導入すべきか?Front. Microbiol. 7, 455. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Mozaffarian D、Hao T、Rimm EB、Willett WC、およびHu FB(2011). 食事とライフスタイルの変化と女性および男性における長期的な体重増加。N. Engl. J. Med. 364, 2392-2404. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Muegge BD、Kuczynski J、Knights D、Clemente JC、González A、Fontana L、Henrissat B、Knight R、およびGordon JI(2011). 哺乳類の系統間およびヒトの腸内細菌群の機能は、食事によって収束する。サイエンス332、970から974。[PMC フリーアーティクル] [PubMed] [Google Scholar].
オキーフSJD、Li JV、Lahti L、Ou J、Carbonero F、Mohammed K、Posma JM、Kinross J、Wahl E、Ruder E、その他(2015).アフリカ系アメリカ人とアフリカ農村部における脂肪、繊維、がんリスク。Nat. Commun. 6, 6342. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ran-Ressler RR, Bae S, Lawrence P, Wang DH, and Brenna JT (2014). 米国における食品の分岐鎖脂肪酸含有量と推定摂取量。Br. J. Nutr. 112, 565-572. [PMC無料記事] [PubMed][Googleスカラー]。
Rho M, Tang H, and Ye Y (2010). FragGeneScan:短くてエラーが起こりやすいリードの遺伝子を予測する。このような場合、「萌芽的研究」と呼ばれます。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Rothschild D, Weissbrod O, Barkan E, Kurilshikov A, Korem T, Zeevi D, Costea PI, Godneva A, Kalka IN, Bar N, et al.(2018). ヒト腸内細菌叢の形成において、宿主遺伝学よりも環境が優位に立つ。ネイチャー 555, 210-215. [PubMed][Google Scholar].
Shen-Orr SS, Furman D, Kidd BA, Hadad F, Lovelace P, Huang Y-W, Rosenberg-Hasson Y, Mackey S, Grisar FAG, Pickman Y, et al.(2016). Defective Signaling in the JAK-STAT Pathway Tracks with Chronic Inflammation and Cardiovascular Risk in Aging Humans(JAK-STAT経路におけるシグナル伝達の欠陥は、老化したヒトの慢性炎症と心血管リスクを追跡する。Cell Syst. 3, 374-384.e4. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Smits SA, Leach J, Sonnenburg ED, Gonzalez CG, Lichtman JS, Reid G, Knight R, Manjurano A, Changalucha J, Elias JE, et al.(2017).。タンザニアのハッザ族狩猟採集民の腸内マイクロバイオームにおける季節的な循環。サイエンス 357, 802-806. [PMCフリーアーティクル] [PubMed] [Google Scholar].
So D, Whelan K, Rossi M, Morrison M, Holtmann G, Kelly JT, Shanahan ER, Staudacher HM, and Campbell KL (2018). 健康な成人における腸内細菌叢組成に対する食物繊維の介入:系統的レビューとメタ分析。Am. J. Clin. Nutr.107、965-983。[PubMed][Google Scholar].
Sonnenburg ED, and Sonnenburg JL (2014). Starving our microbial self: the deleterious consequences of a diet deficient in microbiota-accessible carbohydrates.(微生物がアクセスできる炭水化物を欠く食事)。Cell Metab. 20, 779-786. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Sonnenburg ED, and Sonnenburg JL (2019). 先祖代々の腸内細菌叢と工業化された腸内細菌叢、および人間の健康への影響。Nat. Rev. Microbiol. 17, 383-390. [PubMed][Google Scholar].
Sonnenburg ED, Smits SA, Tikhonov M, Higginbottom SK, Wingreen NS, and Sonnenburg JL (2016). 腸内細菌叢の食事誘発性絶滅は、世代を超えて複合する。ネイチャー 529, 212-215. [PMC フリーアーティクル] [PubMed] [Google Scholar].
スペンサーSP、フラギアダキスGK、およびソネンブルグJL(2019)。ヒトに関連する腸内細菌叢と免疫の相互作用を追求する。Immunity 51, 225-239. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Svedlund J, Sjödin I, and Dotevall G (1988). GSRS--過敏性腸症候群および消化性潰瘍疾患患者における胃腸症状の臨床的評価尺度。Dig. ディス。科学33、129から134まで。[PubMed] [Google Scholar].
田中崇・楢崎正樹・岸本哲也 (2014). IL-6 in inflammation, immunity, and disease. Cold Spring Harb. Perspect. Biol. 6, a016295. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Taylor BC, Lejzerowicz F, Poirel M, Shaffer JP, Jiang L, Aksenov A, Litwin N, Humphrey G, Martino C, Miller-Montgomery S, et al.(2020年)。発酵食品の消費は、腸内マイクロバイオームとメタボロームの系統的な差異と関連する。MSystems 5. [PMC無料論文] [PubMed] [Google Scholar].
ヒトマイクロバイオームプロジェクトコンソーシアム (2012). ヒトマイクロバイオーム研究のためのフレームワーク。ネイチャー486, 215-221. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Tsugawa H, Cajka T, Kind T, Ma Y, Higgins B, Ikeda K, Kanazawa M, VanderGheynst J, Fiehn O, and Arita M (2015). MS-DIAL: data-independent MS/MS deconvolution for comprehensive metabolome analysis. Nat. Methods 12, 523-526. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Turnbaugh PJ、Hamady M、Yatsunenko T、Cantarel BL、Duncan A、Ley RE、Sogin ML、Jones WJ、Roe BA、Affourtit JP、他(2009). 肥満とリーン双子のコア腸内細菌叢。ネイチャー457、480から484。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Valles-Colomer M, Falony G, Darzi Y, Tigchelaar EF, Wang J, Tito RY, Schiweck C, Kurilshikov A, Joossens M, Wijmenga C, et al.(2019)。QOLとうつ病におけるヒト腸内細菌叢の神経活性の可能性。Nat. Microbiol. 4, 623-632. [PubMed][Google Scholar].
Vangay P, Johnson AJ, Ward TL, Al-Ghalith GA, Shields-Cutler RR, Hillmann BM, Lucas SK, Beura LK, Thompson EA, Till LM, et al.(2018). 米国移民はヒト腸内細菌を西洋化する。Cell 175, 962-972.e10. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Villarreal-Soto SA, Bouajila J, Pace M, Leech J, Cotter PD, Souchard J-P, Taillandier P, and Beaufort S (2020). 発酵飲料、コンブチャにおけるメタボローム・マイクロバイオーム・シグネチャーズ。Int. J. Food Microbiol. 333, 108778. [PubMed][Google Scholar].
Vujkovic-Cvijin I, Sklar J, Jiang L, Natarajan L, Knight R, and Belkaid Y (2020). 宿主変数がヒト疾患の腸内細菌叢研究を混乱させる。ネイチャー 587, 448-454. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze X, Brown D, Stares MD, Scott P, Bergerat A, etc. (2011). ヒトの大腸内細菌叢における優勢および食事反応性細菌群。イズムJ. 5, 220-230. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, and Siuzdak G (2009). Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites.The Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites. Proc. Natl. Acad. Sci. 106, 3698-3703. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Winham DM, and Hutchins AM (2011). 3 つの摂食試験における成人の豆消費による鼓腸の認識。Nutr. J. 10, 128. [PMC無料記事] [PubMed][Googleスカラー]。
呉GD、陳J、ホフマンC、ビッティンガーK、陳Y-Y、キールボーSA、ビュートラM、ナイツD、ウォルターズWA、ナイトR、ら(2011)。長期的な食事パターンと腸内細菌の腸型との関連性。サイエンス 334, 105-108. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Yatsunenko T, Rey FE, Manary MJ, Trehan I, Dominguez-Bello MG, Contreras M, Magris M, Hidalgo G, Baldassano RN, Anokhin AP, et al.(2012)。年齢や地理的な違いを超えて見られるヒト腸内細菌叢。ネイチャー486, 222-227. [PMC フリーアーティクル] [PubMed] [Google Scholar].
このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。Nucleic Acids Res.40、W445-451. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zeevi D, Korem T, Zmora N, Israeli D, Rothschild D, Weinberger A, Ben-Yacov O, Lador D, Avnit-Sagi T, Lotan-Pompan M, et al.(2015). 血糖値反応の予測によるパーソナライズド栄養学. Cell 163, 1079-1094. [PubMed][Google Scholar].
Zhernakova A, Kurilshikov A, Bonder MJ, Tigchelaar EF, Schirmer M, Vatanen T, Mujagic Z, Vila AV, Falony G, Vieira-Silva S, et al.(2016). 集団ベースのメタゲノム解析により、腸内細菌叢の組成と多様性のマーカーが明らかになった。サイエンス 352, 565-569. [PMCフリーアーティクル] [PubMed] [Google Scholar].
(2014). Butyrate: food sources, functions and health benefits (New York: Nova Science Publishers, Inc; ). [Google Scholar] を参照してください。
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
