バリア機能動態追跡のための生体外腸管透過性アッセイ(X-IPA)
オープンアクセス
公開日:2023年7月3日
バリア機能動態追跡のための生体外腸管透過性アッセイ(X-IPA)
https://www.nature.com/articles/s41522-023-00409-0


ハダー・ブーツ=マオズ
アリエル・サイモン
...
ニッサン・イサチャー
著者を表示する
バイオフィルムとマイクロバイオーム 9巻 記事番号:44 (2023) この記事を引用する
13 Altmetric
メトリクス詳細
概要
腸管上皮バリアは、恒常的な宿主-微生物叢相互作用と免疫寛容を促進する。しかしながら、管腔刺激に伴うバリアダイナミクスのメカニズム解明は大きな課題である。ここでは、全組織レベルでの腸管透過性動態を定量的に解析するための、生体外腸管透過性アッセイであるX-IPAについて述べる。特定の腸内細菌や代謝産物が、用量依存的に腸管透過性を急速に上昇させることを示し、バリア機能を精密に調べるための強力なアプローチを提供する。
腸内細菌叢は、腸上皮細胞(IEC)の単層によって内腔に閉じ込められている。Lgr5+腸管幹細胞によるIEC層の継続的な補充と、上皮間タイトジャンクション(TJ)タンパク質による物理的補強は、バリアの完全性と組織の恒常性を維持するために極めて重要である1。病原微生物や薬剤などによる)上皮バリアの完全性の阻害は、腸管透過性の亢進につながり、それまで閉じ込められていた(そして潜在的に有害な)微生物が組織内や、二次リンパ節や肝臓などの遠位に移動し、炎症反応を引き起こすことを可能にする2,3,4。実際、上皮バリア機能の障害と「リーキーガット」は、アレルギー性疾患や自己免疫疾患、炎症性腸疾患、過敏性腸症候群、がんなど、腸管および腸管外の病態に関与している5。
上皮バリア機能と腸管透過性を評価する既存の方法には、経上皮電気抵抗(TEER)アッセイ、ウッシングチャンバーでのイオン輸送の測定、蛍光標識分子を経口投与し、血清蛍光を定量化する方法などがある6。しかし、これらのアプローチは、無傷の全組織を対象としたリアルタイムの摂動や読み出しには対応していないため、バリアダイナミクスの時間的な情報は得られない。
宿主と微生物叢の相互作用を詳細に解析するために、われわれは、ナイーブな腸組織構造を維持し、厳密な実験的制御が可能な独自の腸臓器培養系を開発した7。このシステムは、特定の細菌株7、全ヒト微生物叢サンプル8,9、薬剤や代謝産物10に対する腸の反応を迅速に調べるのに理想的であることを実証した。腸内細菌叢とそれに関連する代謝産物が腸管バリア機能を制御しているという新たな知見10,11,12により、われわれは腸管臓器培養システムの利点を利用して、微生物による腸管透過性制御の根底にあるメカニズムを解明できるかどうかを調べることになった。
ここでは、厳密に制御された実験条件と高い時間分解能で、複数の腸管組織において、管腔刺激後の腸管透過性の迅速かつ微妙な変化を測定することを目的とした。我々は、フルオレセインイソチオシアネート(FITC)-デキストランを培養腸組織の内腔に直接注入する生体外腸管透過性アッセイ(X-IPA)を開発し、最適化した(図1A)。管腔内FITC-デキストランの腸管外培養液への移行は、上皮バリアの完全性に依存する。したがって、腸管外培地の蛍光強度は、上皮バリアの完全性と透過性に対応している。
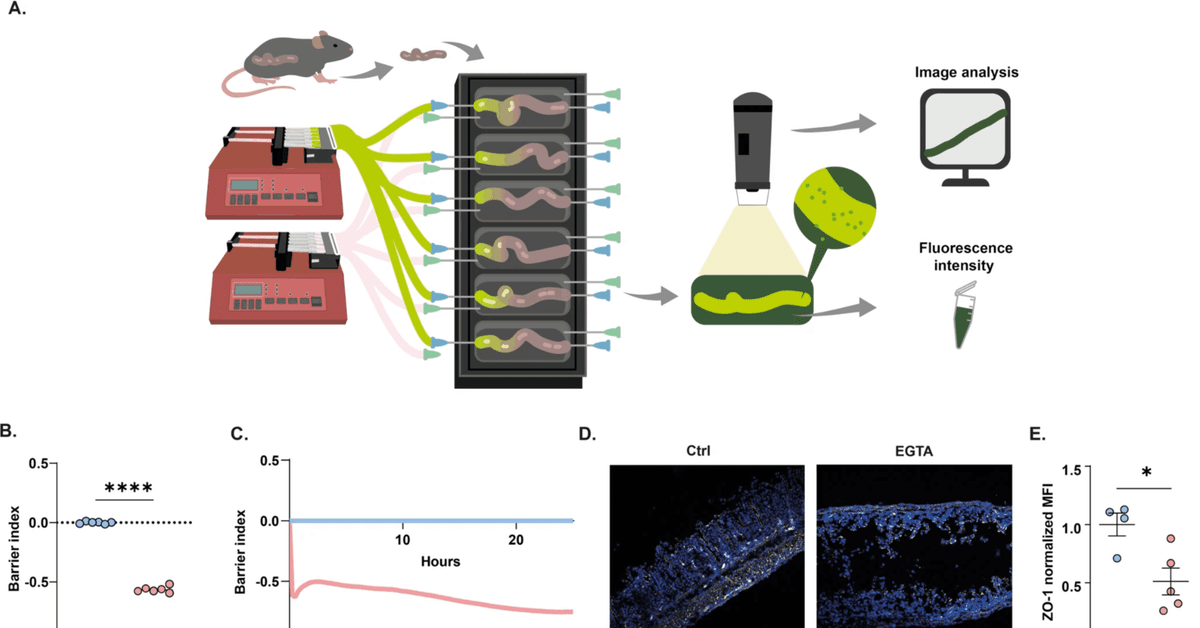
図1:生体外腸管透過性測定法(X-IPA)の開発。
A 無傷の腸管マウス組織を腸管臓器培養装置に接続し、FITC-デキストランを腸管内腔に注入する。経時的拡散は、腸管透過性の程度と経時的動態の指標として、腸管外培地の蛍光強度(タイムラプスイメージング)および実験終了時点(蛍光光度計)で定量化される。B, C EGTAを添加したCaco-2細胞の8時間後(B)および時間に対する正規化TEER値(C)。D, E 8時間培養した結腸セグメントの共焦点イメージング、ZO-1の免疫染色(白;DAPI核染色は青)(D)、およびEGTA注入後のZO-1 MFIの定量(p = 0.03)(E)。F 2時間後(p = 0.02)および8時間後(p = 0.04)に、EGTAの有無にかかわらず4kDa-FITC-デキストランを注入した結腸培養液の腸管外蛍光を正規化したもの。H FITC-デキストランのみ(Ctrl)またはEGTAとともに注入した腸臓器培養を示すフィルムストリップ。擬似カラー画像は腸管外培地中のFITC-デキストラン濃度のMFI定量を示す。フレームの間隔は15分。I EGTAまたは無菌培地(Ctrl)を注入した組織における腸管外培地の正規化MFIを示す単一結腸の時間トレース。円は平均透過率を示す。J MFIと培地蛍光強度(O.D)は密接に相関している(R2 = 0.9822)。K 4時間後にEGTAまたは無菌培地(Ctrl)を注入した小腸臓器培養の腸管外培地蛍光の正規化(p = 0.0001)。L 5%EtOHまたは無菌培地(Ctrl)を注入した結腸培養の4時間後の腸管外培地蛍光を正規化したもの(p = 0.0033)。2群間の統計的有意性はStudentのt検定、または一元配置分散分析(3群以上の独立群)により決定した: ****<0.0001; ***<0.001; **<0.01; nsは有意ではない。すべてのパネルについて、平均値と標準偏差を示した。
フルサイズ画像
一連の原理実証実験では、TJの完全性と副細胞バリア機能を破壊するカルシウムキレート剤であるEGTAを管腔内に導入した場合の生体外での腸管透過性を測定した(動的TEERアッセイ(図1B、C)とCaco-2単層でのZO-1染色(図S1A)を用いて確認)。特異的病原体フリー(SPF)条件下で飼育した14歳マウスから大腸組織を摘出し、既述のように腸管培養装置に接続した(装置あたり6組織;図1A)7,8,13。FITC-デキストラン(4 kDa)を含む培養液を、EGTA(25 mM)を添加した場合と添加しない場合のいずれかで、培養結腸の内腔に直接注入した。コントロールと比較して、EGTAの内腔注入は、ZO-1 TJタンパク質発現の顕著な減少によって示されるように、上皮バリアの完全性を破壊した(図1D, E)。これと一致して、EGTAの管腔注入は、実験期間中(2時間、8時間)、内部対照と比較して、腸管外FITC-デキストランの迅速かつ有意な増加をもたらし(図1F)、腸管透過性の変化を評価するX-IPAシステムの有用性を支持した。
次に、図1Fで観察されたEGTAによるバリア損失が、TJ制御による副細胞透過性の亢進(リーク経路)に起因するのか、それとも非特異的な上皮損傷(非制限経路)に起因するのかを検討した。この疑問を解決するために、我々は70kDaのFITC-デキストランを使用した。70kDaのFITC-デキストランは、制限のない方法でのみバリアーを通過することができる大きな分子である(一方、4kDaのFITC-デキストランは、細胞間透過性の亢進を介して通過することができる14)。興味深いことに、EGTAと70 kDa FITC-デキストランを管腔内に注入しても、腸管外培地の蛍光は増加しなかった(図1Gおよび図S1D)。このことは、X-IPAシステムが上皮バリアの生存能力と機能的完全性を維持し、TJ制御による細胞間透過性の変化を検出するために使用できる可能性を示唆している。
腸管臓器培養系の大きな利点は、実験的摂動に対する腸管の迅速な反応を経時的に追跡できることである。バリアダイナミクスを定量化するために、われわれは3台の直立蛍光デジタル顕微鏡(Dino-Lite)を腸管培養システムのセットアップに加え、それぞれの顕微鏡が2つの培養腸片を追跡するようにした(図1A)。このセットアップを用いると、平均蛍光強度(MFI)測定値を定量化することで、FITC-デキストランの培地濃度の微妙な変化を効率的に検出することができた(ダイナミックレンジ:1-100μg/mL;図S1B)。
内腔にEGTAを導入した後の腸管培養のタイムラプスムービーを、5分(2時間の実験)または15分(8時間の実験)の時間分解能で取得した(図1H、Iおよび補足ビデオ1)。自動解析と定量化のために、我々はMATLABベースの画像解析ツールとユーザーフレンドリーなインターフェース(X-IPAアナライザー;図S1Cと拡張データ)を開発した。このソフトウェアにより、数十の単一組織の時間トレースを生成し、腸管外培地MFIを定量化することができ、複数の組織における腸管透過性動態を経時的に正確かつ同等に特徴付けることができた(図1I)。タイムラプスムービーの自動解析により、非刺激組織では腸管外MFIがゆっくりと連続的に増加していることが明らかになった(平均傾きm = 0.17)。対照的に、EGTAを注入した組織では、腸管外MFIの急激な増加が見られ(平均勾配m = 0.75)、刺激後2時間ですでに観察された(図1Iおよび補足ビデオ1)。組織の完全性を検証し、FITC-デキストランが入力ポートまたは出力ポートから漏れる可能性を除外するために、各腸断片に沿ってFITC-デキストランの空間分布を分析した(補足図2A)。さらに、実験終点での培地蛍光(蛍光光度計で測定)と対応する画像MFI(画像解析で算出)はよく相関しており(R2 = 0.9822)、タイムラプスイメージングと解析により、腸管透過性動態を確実に追跡・定量できることが実証された(図1J)。
さらに、X-IPAシステムを利用して、EGTAを注入した小腸臓器培養(回腸、図1Kおよび補足ビデオ2)およびバリア破壊エタノール15に反応した腸管透過性動態(大腸培養、図1L、図S1Eおよび補足ビデオ3)を追跡した。
次に、X-IPAシステムが腸内代謝産物によって誘導される腸透過性の変化を検出できるかどうかを調べるため、腸臓器培養にプトレシンを注入した。プトレシンは、腸内細菌叢によって産生されるポリアミン化合物で、最近、腸上皮バリアの強力な破壊因子として同定された10。刺激後4時間で、プトレスシンを注入した臓器培養では、コントロールと比較して、用量依存的な腸透過性の増加が観察された(平均勾配:33 mM m≈ 0; 66 mM m = 0.28; 100 mM m = 0.42)(図2A)。自動画像解析の結果、プトレシン濃度の増加に反応して、FITC-デキストラン拡散速度が徐々に増加する(線形スロープが急になる)ことが明らかになった(図2B、Cおよび補足ビデオ4)。これらの結果は、TJ開口は内腔シグナル強度(プトレスシン濃度)によって直線的に調整される連続的なプロセスであり、その結果、透過性が増加するというモデルを支持するものである。
図2:代謝産物と腸内細菌による腸管透過性の迅速な調節。
A, D プトレシン濃度の増加(A)、またはB. adolescentisもしくはB. fragilis培養液の等価負荷(D)を注入した腸内培養液の、注入後4時間における腸管外培地蛍光を正規化したもの(内部対照に対して正規化)。B, E FITC-デキストランのみ(Ctrl)、プトレシン(B)または微生物培養物(E)を注入した腸臓器培養を示すフィルムストリップ。擬似カラー画像は腸管外培地中のFITC-デキストラン濃度のMFI定量を示す。フレームの間隔は10分。C, F プトレシン(C)または微生物培養液(F)および無菌培地(Ctrl)を注入した組織における腸管外培地の正規化MFIを示す単一結腸時間トレース。G, H E. gallinarum(G)またはB. acidifaciens(H)と共培養したCaco-2細胞のTEER値を経時的に正規化したもの。I E. gallinarum(p<0.0001)またはB. acidifaciensを4時間注入した腸内培養液の腸外培地蛍光を正規化したもの: ****<0.0001; ***<0.001; **<0.01; nsは有意ではない。
フルサイズ画像
最後に、腸内細菌叢によって誘導される腸管透過性の変化を調べようとした。嫌気性常在菌であるビフィドバクテリウム・アドレッセンティス(Bifidobacterium adolescentis)に対する大腸の反応を解析した。ビフィドバクテリウムはTh17を誘導する微生物16であり、最近、in vitroおよびin vivoでTJの完全性を変化させ、腸のバリア機能を破壊する食餌感受性病原体として同定された9。我々は、FITC-デキストランと同量のB. adolescentisまたはB. fragilis(嫌気性ヒト共生細菌で、Th17の発生17を誘導せず、上皮バリア9を破壊しない)を含む培地を大腸臓器培養の内腔に注入した。刺激後4時間で、バリア破壊性のB. adolescentisには反応したが、B. fragilisには反応せず、腸管外MFIの増加が観察された(図2D)。これと一致して、B. adolescentisを管腔内に導入すると腸管外MFIが急速に上昇する(平均勾配m = 0.22)のに対し、B. fragilisを注入した組織は対照と区別がつかなかった(平均勾配m≈0)ことが、タイムラプス動画から明らかになった(図2E、Fおよび補足動画5)。
同様の結果が、in vitro TEERアッセイ(図2G、H)およびX-IPAシステム(図2I)を用いて、バリアを破壊するE. gallinarum3に対して、破壊しないB. acidifaciens18,19,20と比較して得られた。
以上のことから、われわれは、臓器培養をベースとしたユニークな腸管透過性アッセイ法を提示している。X-IPAシステムは、腸管透過性に対する管腔の擾乱の影響について、全組織レベルで定量的な洞察を提供し、その結果、簡便なin vitroアッセイと複雑なin vivo動物モデルとのギャップを埋める。さらにこのシステムは、腸管バリアの動的な挙動を、経時的に、高い時間分解能で定量化することを可能にする。X-IPAシステムの現在の限界を認めるべきである。現在の設定では、このシステムはおそらく細胞横断的な上皮通過を検出できず、マウス(ヒトではない)から解剖した組織の短期培養(最大24時間)に限られている。培養組織に適用される付加的なリードアウト(次世代シークエンシング、セルソーティング、イメージングを含む)は、動的透過性測定を補完し、宿主とマイクロバイオームの相互作用を統合的に研究するための強力なアプローチを提供する。
バリア調節薬の新たな治療的可能性を考えると、複数の腸管組織に障害を与え、その後の腸管バリア機能を追跡する能力は、メカニズム解明とトランスレーショナルな発見をさらに進めるものと期待される。
方法
マウス
生体外臓器培養システムで使用する小腸および大腸組織は、犠牲にしたC57BL/6J(B6)マウスから解剖した。マウスはEnvigo RMS社(イスラエル)から入手し、Bar-Ilan大学(イスラエル)の特異的病原体フリー(SPF)施設で飼育した。腸管臓器培養透過性アッセイには、14日齢の同腹子から腸組織を解剖した。すべての実験は、Bar-Ilan大学倫理委員会(倫理承認番号BIU-BIU-IL-2203-131-1)により承認された動物プロトコルに従って行われた。
腸臓器培養システムとX-IPA透過性アッセイ
腸臓器培養装置の作製と腸臓器培養実験(Yissacharら7)は、黒色で不透明な腸臓器培養装置を作製するために、PDMS(184 ®SYLGARD#761036)混合物にカーボンブラック(Holland-Moran Cas#1333-86-4)を添加して行った。簡単に説明すると、SPF条件下で飼育した14日齢のC57BL/6マウス同腹子から無傷の全大腸を無菌的に解剖した。固形内腔の内容物を穏やかに洗浄し、滅菌した外科用糸を用いて腸臓器培養装置の内腔入出口ポートに腸断片を通し固定した。培養装置を37℃の温度を維持する特注のインキュベーターに入れ、組織を無菌の無血清培養液(Iscove's Modified Dulbecco's Medium without phenol-red (IMDM, GIBCO)に20%のKnockOut血清置換液(GIBCO)、2%のB-27と1%のN-2サプリメント(GIBCO)、1%のL-グルタミン、1%の非必須アミノ酸、1%のHEPESを添加したもの)にシリンジポンプで半分浸した状態に維持した。FITC-デキストラン(4kD)(0.5mg/mL;Sigma-Aldrich Cas#60842-46-8)をフェノールレッドを含まない滅菌培養液に再懸濁し、シリンジポンプを用いて、EGTA(25mM)(Sigma-Aldrich Cas#13368-13-3)、5%EtOH、精製細菌培養物(B. adolescentis, B. fragilis, E. gallinarum or B. acidifaciens at 107-9 CFU/mL)またはプトレシン(Sigma、最終濃度33/66/100 mMに希釈)を添加した。装置の蓋にはガス排出口があり、加湿濾過された医療グレードの95% O2/5%CO2混合ガスを装置内に流すことができた。実験は刺激後2~8時間で終了した。蛍光ビデオ顕微鏡(Dino-Lite, Iner Tech Dino-Capture 2.0 AM4115T-GRFBY)は、培養組織とその周囲の培養液のタイムラプスムービーを取得し、下流の画像解析と蛍光定量化に利用した。実験終了時点で、蛍光光度計(励起485 nm、発光520 nm)を用いて蛍光強度を定量することにより、腸管外培地中のFITC-デキストラン濃度を測定した。培養後、組織はさらなる分析(免疫蛍光染色と画像化を含む)に供した。
タイムラプスイメージングの画像解析
ソフトウェアの開発
タイムラプス動画の自動コンピュータ画像解析は、MathWorks 2020プラットフォームで作成されたカスタムメイドのMATLABソフトウェアであるX-IPA Analyzerを用いて行った。このソフトウェアの主な機能は、画像の前処理、組織のセグメンテーション、各チャンバー内の腸管外培地の緑色蛍光強度の経時的な定量化である(補足図1)。
実験デザイン
実験は、各チャンバーに無傷の結腸組織と外部培地が入った6つのチャンバーを含む器官培養装置内で行われた。3台のDino-Lite顕微鏡カメラが装置の上に設置され、それぞれが2つのチャンバーを撮影できるようにした。画像は5分(2時間実験)、10分(4時間実験)、15分(8時間実験)の一定間隔で撮影された。チャンバーごとに一連の画像を解析した。
解析アルゴリズム
アルゴリズムは以下のように動作する: 組織画像を読み込み、手動でトリミングして、測定領域を表すピクセル座標を選択する。この領域には結腸組織そのものと外部組織培地が含まれる。ユーザーの確認後、RGBモデルの緑チャンネルが選択され、標準偏差2のガウシアンフィルターを用いて画像ノイズ除去が行われる。ノイズ除去された画像は、グレイレベルヒストグラム(2値化)から大津の方法を用いた自動閾値によってセグメンテーションされ、組織セグメンテーションは各方向にさらに8ピクセルずつ拡大される。画像ごとに、中位の画素(セグメンテーションの外側の領域)が測定され、その平均値が計算される。これらの平均値をプロットし、MFI(平均蛍光強度)の経時変化を示す。
O.D比は、FITC-デキストランの最終濃度(μg/mL)を無菌培地の最終濃度(Ctrl)で割ることにより算出した。MFI比は、FITC-デキストラン正規化-MFI最終値を無菌培地(Ctrl)正規化-MFI最終値で割ることにより算出した。
解析の全ステップはユーザーフレンドリーなインターフェースで簡単に実行できる(詳細なユーザーマニュアルはオンライン拡張データに掲載)。
細菌培養
B. adolescentis、B. fragilis、B. acidifaciensはDSMZ(ドイツ)から入手した。E. gallinarumはMartin Kriegel教授(ミュンスター大学、ドイツ)の好意により提供された。細菌の分類は、16 S遺伝子のサンガー配列決定によってさらに検証された。微生物は豊富な液体培地(2%プロテオースペプトン(Thermo Fisher Cat#LP0085)、0.5%NaCl(Mercury Cat#1064041)、0. mg/mL グルコース(Mercury Cas#50-99-7)、250 mg/mL K2HPO4(Holland Moran Cas#7758-11-4)、50 mg/mL L-システイン(Merck Cas#52-90-4)、5 mg/mL Hemin(Mercury Cat#3741)および5 μL/mL ビタミンK1(Merck Cas#84-80-0)を添加した5%酵母エキス(Merck Cas#8013-01-2))を嫌気条件下で一晩培養した。B. acidifaciensはまず刻み肉培地で培養し、その後リッチ液体培地に移した。
細胞株
Caco-2細胞株はOhad Gal Mor教授(Sheba Medical Center、イスラエル)の好意により提供された。細胞は37℃、5% CO2で80%コンフルエントになるまで培養した。共培養実験では、Caco-2細胞を抗生物質を含まない増殖培地で培養し、24ウェルプレートに播種した(1ウェルあたり2×105細胞)。細胞を4日間培養した後、2 mM EGTA、またはCaco-2増殖培地に懸濁した精製細菌培養液とインキュベートした。
動的経上皮電気抵抗(TEER)測定
Caco-2細胞を、CytoView Z、96ウェルインピーダンスプレート(1ウェルあたり5×105細胞)(Axion BioSystems; cat: Z96-IMP-96B-25)に播種し、Maestro Edgeプラットフォーム(Axion BioSystems)により、完全なコンフルエンス(800-1200Ω、通常4日以内)に達するまでモニターした。バリア指数(バリアの完全性を表す)は、低周波(1 kHz)と高周波(41 kHz)の細胞抵抗の比として、Axionの「インピーダンス」モジュールによって計算された。共培養実験では、微生物を4200×gで10分間遠心分離し、抗生物質を含まない1.5mLの細胞培養液に再懸濁した。連続希釈後、各ウェルに最終容量200μLを添加した。各実験で微生物負荷量(CFU/mL)を算出した。バリア指数は24時間、1分という高い時間分解能で測定され、基準時間(t = 0)に対して正規化された。さらに、非刺激細胞のバリア指数に正規化することで、追加補正を行った。
組織切片の免疫蛍光染色と共焦点イメージング
組織切片の染色では、腸組織をOCTに包埋し、-80℃で保存した。新鮮凍結組織をクライオスタット(CM1950)を用いて7μmの切片にスライスした。切片を冷アセトン(100%)で20分間固定し、PBSで2回洗浄した後、室温で1時間ブロックした(10%ロバ血清、0.1%トリトン、PBS)。その後、組織切片を1:100に希釈したZO-1(Invitrogen Cat 40-2200)を4℃で一晩染色した。過剰の抗体を3回洗浄し、二次抗体(Cy3抗ウサギJackson-immuno Cat#711-165-152; 1:250希釈)とともに室温で1時間インキュベートした。洗浄後、切片をDAPI(Merck Cat#1246530100)で染色し、アンチフェード試薬(Sigma F6182)を用いてマウントした。
組織切片は共焦点蛍光顕微鏡(Leica)を用いて可視化し、ImageJソフトウェアを用いて処理・解析した。腸管上皮周辺部のみのZO-1強度を測定するために、以下のワークフローでImageJマクロを使用した: 画像はまずガウス平滑化(シグマ=2)され、次にE-カドヘリン染色を用いてパーセンタイル自動閾値アルゴリズムによりセグメンテーションされた。均一なレイヤーを得るために2値ホールを埋めた。次に、ZO-1染色を囲む腸陰窩の縁を表すROI(関心領域)バンドを以下のように作成した: まず、セグメント化した組織を複製し、侵食してより薄いセグメントを得た。次に、セグメント化した組織画像を複製し、拡張して幅の広いセグメントを得た。最後に、拡張した画像から浸食した画像を減算し、組織のエッジを表すバンドを得る。マクロでは浸食と拡張のピクセル数を調整できるが、ZO-1をカバーする画像に最適な数が決定されると、これらの因子はすべての処理と各実験タイプで一定に保たれた。最後に、ROI内の全ZO-1(Cy3)の強度を測定するために、Analyze Particlesを採用した。
培養細胞中のZO-1の強度は以下のように測定した: ZO-1画像(チャンネル3のCy3)にガウスぼかし(シグマ=1)を用いてスムージングを行った。次に、バックグラウンドを減算した(rolling ball = 10)。次に、自動大津アルゴリズムを用いて細胞をセグメンテーションした。最後に、ZO-1マーカーの強度を2値セグメンテーションされた画像に従って計算した。
培養細胞の免疫蛍光染色
細胞を70% EtOHで洗浄した13 mmのカバースリップ上に4日前に播種し、24ウェルプレートでPDL(0.08 μg/mL)で処理した。その後、Caco-2細胞をPBSで洗浄し、EGTA(2 mM)で1時間共培養した。Caco-2細胞を固定し、3分間透過処理(3%PFA中0.5%トリトン)した後、PBSで洗浄した。その後、細胞をさらに30分間固定し(3%PFA)、PBSで10分間2回洗浄した。細胞をブロッキング液(10%ロバ血清)で1時間インキュベートした後、1:200に希釈したZO-1に対する一次抗体(BD cat:610967)で4℃で一晩標識した。過剰の抗体をブロッキング液で3回洗浄し、細胞を2次抗体(Cy3抗マウス、1:500希釈、Jackson cat:715-165-151)と室温で1時間インキュベートした。細胞を洗浄し、fluoro-mount-Gを用いてマウントした。共焦点蛍光顕微鏡(Leica)を用いて細胞を可視化した。
報告概要
研究デザインに関する詳細は、本論文にリンクされているNature Research Reporting Summaryを参照されたい。
データの利用可能性
本研究で作成・解析したすべてのデータは、本文および/または補足資料で入手可能である。本研究で作成したコードとスクリプトは、補足資料で入手可能である。本研究の結果を裏付けるために必要と思われる追加情報は、対応する著者からの合理的な要請があれば入手可能である。
参考文献
Turner, J. R. 健康および疾患における腸粘膜バリア機能。Nat. Rev. Immunol. 9, 799-809 (2009).
論文 CAS PubMed Google Scholar
腸内病原体の宿主内進化が肝臓への移行を促進する。Nature 607, 563-570 (2022).
論文 CAS PubMed PubMed Central Google Scholar
マンフレド・ヴィエイラ(Manfredo Vieira)ら、マウスとヒトにおける腸管病原体のトランスロケーションが自己免疫を促進する。Science 359, 1156-1161 (2018).
論文 CAS PubMed Google Scholar
Ruff, W. E., Greiling, T. M. & Kriegel, M. A. 免疫介在性疾患における宿主-微生物叢相互作用。Nat. Rev. Microbiol. 18, 521-538 (2020).
論文 CAS PubMed Google Scholar
上皮バリア仮説はアレルギー、自己免疫、その他の慢性疾患の増加を説明できるか?Nat. Rev. Immunol. 21, 739-751 (2021).
論文 CAS PubMed Google Scholar
腸管バリアと現在の腸管透過性評価技術。細胞 9, 1909 (2020).
論文 CAS PubMed PubMed Central Google Scholar
Yissachar, N. et al. 腸管臓器培養系から、微生物と免疫のクロストークにおける神経系の役割が明らかになった。Cell 168, 1135.e12 (2017).
記事 Google Scholar
Duscha, A. et al. プロピオン酸は免疫調節機構によって多発性硬化症の病態を形成する。Cell 180, 1067.e16 (2020).
論文 Google Scholar
Bootz-Maoz, H. et al. 過敏性腸症候群における大腸のホメオスタシスの再構築。Cell Rep. 41, 111657 (2022).
論文 CAS PubMed Google Scholar
Groshevaら、腸管バリア機能の宿主および微生物叢制御因子をハイスループットスクリーンで同定。Gastroenterology 159, 1807-1823 (2020).
論文 CAS PubMed Google Scholar
腸管上皮における細胞アイデンティティと微生物応答性の基盤となる転写プログラム(Heppert, J. K. et al. Nat. Gastroenterol. Hepatol. 18, 7-23 (2021).
論文 PubMed Google Scholar
代謝性炎症を煽る腸内細菌叢(Tilg, H., Zmora, N., Adolph, T. E. & Elinav, E. Nat. Rev. Immunol. 20, 40-54 (2019).
論文 PubMed Google Scholar
Azriel、S.、Bootz、H.、Shemesh、A.、Amidror、S.およびYissachar、N.宿主と微生物叢の相互作用を分析するための腸管臓器培養システム。J. Vis. Exp. https://doi.org/10.3791/62779 (2021)。
IL-22は上皮クローディン-2をアップレギュレートし、下痢と腸内病原体のクリアランスを促進する。Cell Host Microbe 21, 671.e4 (2017).
論文 Google Scholar
Elamin, E. et al. エタノールは、マイトジェン活性化プロテインキナーゼシグナル伝達を介してヒトの腸管バリア機能を障害する:in vivoとin vitroを組み合わせたアプローチ。PLoS ONE 9, e107421 (2014).
論文 PubMed PubMed Central Google Scholar
ヒト腸内共生細菌のうち、単独でマウスの腸管Th17細胞を誘導できる菌種を同定した。Proc. Natl Acad. Sci. USA 113, E8141-E8150 (2016).
論文 CAS PubMed PubMed Central Google Scholar
Mazmanian, S. K., Round, J. L. & Kasper, D. L. 微生物の共生因子が腸の炎症性疾患を予防する。Nature 453, 620-625 (2008).
論文 CAS PubMed Google Scholar
Wang, H. et al. 腸内のバクテロイデス・アシディファシエンスはCD95を介した肝障害に対して保護的役割を果たす。Gut Microbes 14, 2027853 (2022).
論文 PubMed PubMed Central Google Scholar
腸内常在菌Bacteroides acidifaciensはマウスの肥満を予防し、インスリン感受性を改善する。Mucosal Immunol. 10, 104-116 (2017).
論文 CAS PubMed Google Scholar
Huang, G. et al.ジンセノサイドRb3およびRdはポリープ形成を抑制する一方で、ApcMin/+マウスの腸内細菌叢と腸内微小環境を回復させる。Sci. Rep. 7, 12552 (2017).
論文 PubMed PubMed Central Google Scholar
参考文献のダウンロード
謝辞
本研究は、親愛なる友人であり、指導者であり、インスピレーションの源であったNir Friedman z "l教授の慈愛に満ちた思い出に捧げます。原稿を厳しく編集してくれたSondra Turjeman、計算機による画像解析をしてくれたGitali Naim、Hagar Morad、Shir Ben-Aaron、Nadav Vernia、洞察に満ちた議論をしてくれたYissachar研究室のメンバーに感謝する。本研究は、イスラエル科学財団(助成金第1384/18号)、イスラエル科学財団-ブロード研究所共同プログラム(助成金第2615/18号)、イスラエル科学財団-イスラエル精密医療パートナーシップ(助成金第3061/22号)、イスラエル・ガスナー医学研究基金の支援を受けた。
著者情報
著者および所属
グッドマン生命科学部、バルイラン大学、ラマットガン、5290002、イスラエル
Hadar Bootz-Maoz、Ariel Simon、Sara Del Mare-Roumani、Yifat Bennet、Einat Toister、Hadar Romano、Sivan Amidror & Nissan Yissachar
バルイラン大学ナノテクノロジー・先端材料研究所、ラマットガン、5290002、イスラエル
Hadar Bootz-Maoz、Ariel Simon、Sara Del Mare-Roumani、Yifat Bennet、Einat Toister、Hadar Romano、Sivan Amidror & Nissan Yissachar
ワイツマン科学研究所システム免疫学部門、234ヘルツル通り、レホボット、7610001、イスラエル
鄭丹平 & エラン・エリナフ
ドイツ・ハイデルベルク、ノイエンハイマーフェルト280、69120、ドイツ・クレブフォルツングセンター(DKFZ)マイクロバイオーム・がん部門
エラン・エリナヴ
貢献
構想、S.D.M.-R.、H.B.-M.、S.A.、E.E.、N.Y.、調査、H.B.-M.、A.S.、S.D.M.-R.、Y.B.、D.Z.、S.A.、執筆、H.B.-M.、A.S.、N.Y.、資金獲得、N.Y.
責任著者
Nissan Yissachar宛。
倫理申告
競合利益
著者らは競合する利益はないと宣言している。
追加情報
出版社注:シュプリンガー・ネイチャーは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
補足情報
補足情報
報告概要
X-IPAのユーザーマニュアルとソースデータ
補足ビデオ1
補足ビデオ2
補足ビデオ3
補足ビデオ4
補足ビデオ5
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされています。このライセンスは、原著者および出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合にその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものです。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、または許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
この記事の引用
Bootz-Maoz, H., Simon, A., Del Mare-Roumani, S. et al. バリア機能動態追跡のための生体外腸管透過性アッセイ(X-IPA) npj Biofilms Microbiomes 9, 44 (2023). https://doi.org/10.1038/s41522-023-00409-0
引用文献のダウンロード
2022年11月22日受領
受理2023年06月09日
公開2023年07月03日
DOIhttps://doi.org/10.1038/s41522-023-00409-0
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有リンクを取得
コンテンツ共有イニシアティブSpringer Nature SharedItにより提供されています。
テーマ
生物学的手法
共生
バイオフィルムとマイクロバイオーム (npj Biofilms Microbiomes) ISSN 2055-5008 (online)
サイトマップ
Natureポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
ナノ
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
キャリア開発
ネイチャー・キャリア
ネイチャーコンファレンス
ネイチャーイベント
地域ウェブサイト
ネイチャー アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー
クッキーの使用
プライバシーポリシー/クッキーの管理
法的通知
アクセシビリティに関する声明
利用規約
アメリカ合衆国のプライバシー権
© 2023 シュプリンガー・ネイチャー・リミテッド
この記事が気に入ったらサポートをしてみませんか?
