
腫瘍内Lactobacillus reuteriが放出する食餌性トリプトファン代謝物が免疫チェックポイント阻害薬治療を促進する
2023年4月6日オンライン公開
In Press, Corrected Proofこれは何ですか?
記事
腫瘍内Lactobacillus reuteriが放出する食餌性トリプトファン代謝物が免疫チェックポイント阻害薬治療を促進する
著者リンクを開くオーバーレイパネルMackenzie J. Bender 1 14, Alex C. McPherson 1 2 14, Catherine M. Phelps 1 3, Surya P. Pandey 1, Colin R. Laughlin 1, Jake H. Shapira 1, Luzmariel Medina Sanchez 1 3, Mohit Rana 1, Tanner G. Richie 4, Tahliyah S. Mims 5, Angela M. Gocher-Demske 1 6, Luisa Cervantes-Barragan 7, Steven J. Mullett 8 9, Stacy L. Gelhaus 8 9, Tullia C. Bruno 1 6 10, Nikki Cannon 11, John A. McCulloch 11, Dario A.A. Vignali 1 6 10, Reinhard Hinterleitner 1 10, Alok V. Joglekar 1 10 12 ...Marlies Meisel 1 10 15
もっと見る
シェア
引用する
https://doi.org/10.1016/j.cell.2023.03.011Get 権利と内容
概要
免疫チェックポイント阻害剤(ICI)治療中の患者を含め、がん患者によるプロバイオティクスの利用は増加している。我々は、前臨床段階のメラノーマにおいて、プロバイオティクスから放出されたアリール炭化水素受容体(AhR)アゴニストであるインドール-3-アルデヒド(I3A)と腫瘍微小環境内のCD8 T細胞間の重要な微生物-宿主クロストークが、抗腫瘍免疫を強力に増強しICIを容易にすることを明らかにした。本研究では、プロバイオティクスであるLactobacillus reuteri(Lr)がメラノーマに移動し、コロニー形成し、持続することで、分泌されたトリプトファン異化物I3Aを介して、インターフェロン-γ産生CD8 T細胞を局所的に促進し、それによってICIを強化することを明らかにした。さらに、Lrから分泌されるI3Aは抗腫瘍免疫に必要かつ十分であり、CD8 T細胞内のAhRシグナルが失われるとLrの抗腫瘍効果は消失した。さらに、トリプトファン強化食は、CD8 T細胞のAhRシグナルに依存して、LrとICIによる抗腫瘍免疫の両方を増強させた。最後に、進行したメラノーマ患者におけるICIの有効性と生存を促進するI3Aの役割の可能性を示す証拠を提供する。
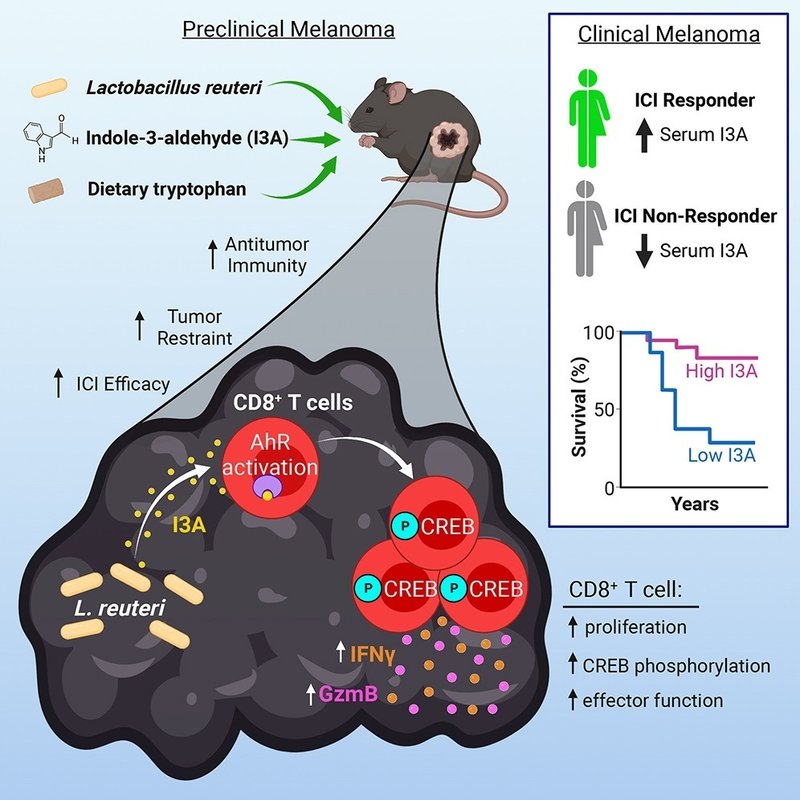
図解抄録
ダウンロード 高解像度画像ダウンロード(227KB)
ダウンロード フルサイズ画像をダウンロードする
はじめに
免疫チェックポイント阻害剤(ICI)治療による抗腫瘍免疫の再活性化は、がん治療の中核をなすものであり、一部のがん患者においてこれまでにない有効性を示しています1,2,3,4)。プログラム細胞死-1(PD-1)やそのリガンドであるPD-L1などの抑制性T細胞受容体の遮断は、抗腫瘍T細胞応答を引き出し5,6、強力な臨床効果を示すが、メラノーマ患者の40%しか治療に反応しない7。したがって、ICIの効果を高めるためには、抗腫瘍免疫をさらに増強するアプローチが必要である。腫瘍抗原提示8、腫瘍変異負荷9などの内因性因子、マイクロバイオーム構成10,11,12,13,14,15,16やプロバイオティクス摂取17などの外因性因子がICI効果を変調させます。がん患者は、健康増進のためにプロバイオティクスを利用することにますます関心を寄せています18。最近の報告では、がん免疫療法を開始した進行メラノーマ患者のコホートの約半数がプロバイオティクスを自己投与していることがわかりました17。興味深いことに、いくつかの研究では、プロバイオティクスであるビフィドバクテリウムがICI治療の促進に有益な役割を果たすことが報告されていますが、10,13最近の研究では、前臨床メラノーマにおけるICIの効果を抑制するプロバイオティクスビフィドバクテリウムとラクトバチルスラムノサスを発見しました17したがって、がん患者におけるICIの反応性にプロバイオティクスがどのような効果をもたらすのか、また、これらの効果をもたらすメカニズムがまだ十分に理解できていません。
本研究では、最も頻繁に使用されるプロバイオティクスのいくつかが、前臨床メラノーマにおける腫瘍の伸長に影響を与えるかどうかを検証することを目的とした。さらに、最も強力に腫瘍を抑制する菌株がICIの効果を高めることを可能にする宿主と微生物のクロストークを探り、進行したメラノーマ患者のコホートにおいて、この知見の臨床的関連性を検討した。
セクションの抜粋
前臨床メラノーマにおけるLactobacillus reuteriの抗腫瘍免疫誘導とICI促進作用について
我々は、前臨床黒色腫モデルを用いて、頻繁に使用される4種類のプロバイオティクス細菌Bifidobacterium longum(Bl)、Lactobacillus reuteri(Lr)、Lactobacillus johnsonii(Lj)、Escherichia coli(Ec)の抗腫瘍能を検証した。 19 抗生物質(ABX)投与ががん免疫療法に対する反応に悪影響を及ぼすこと11,12,16,20、およびプロバイオティクスは通常毎日補充されることを考慮して、我々はABX非投与の特定病原体フリー(SPF)マウスに毎日経口投与(OG)により、選択した細菌分類群を投与しました。我々は
ディスカッション
これらの結果から、前臨床段階のメラノーマにおいて、自発的な抗腫瘍免疫とICIを促進するTME内の重要な微生物-宿主のクロストークが明らかになった。具体的には、Lrが腫瘍内に移動し、コロニー化し、持続することで、放出されたAhRアゴニストと食事性Trp異化物であるI3Aを介して抗腫瘍Tc1免疫を局所的に促進することが示された。Lr由来のI3Aは、CD8 T細胞特異的なAhRシグナルを介して、腫瘍内でIFNγ産生を促進することが明らかになった。
キーリソース表
REAGENT or RESOURCEIDENTIFIE抗体抗マウスCD16/CD32 (Mouse BD Fc Block™, Rat, Clone 2. 4G2) unjugated)BD BiosciencesCat # 553142; RRID:AB_394657anti-Mouse CD45 monoclonal antibody (Rat, Clone 30-F11), Brilliant Violet 480 conjugatedBD BiosciencesCat # 566095; RRID: AB_2739499抗マウスCD45モノクローナル抗体(ラット、クローン30-F11)、APC-Cy™7 conjugatedBD BiosciencesCat # 557659; RRID:AB_396774 抗マウスCD45モノクローナル抗体 (Rat, Clone 30-F11), BUV 395 conjugatedBD Biosciences
謝辞
フローサイトメトリーのソーティングとリソースを提供していただいたピッツバーグ大学免疫学部のUnified Flow Core、10xゲノムワークフローとライブラリー生成を実施していただいたピッツバーグ大学のSingle Cell Core、サービスを提供していただいたピッツバーグ大学のGnotobiotic Core Facility、サービスを提供していただいたピッツバーグ大学のHealth Sciences Mass Spectrometry Coreに感謝いたします。資金提供:この研究は、Investigator Start-up Fundの支援を受けています、
参考文献(66件)
Y. Hao et al.
マルチモーダルなシングルセルデータの統合解析
セル
(2021)
K. Hezaveh et al.
トリプトファン由来の微生物代謝物が腫瘍関連マクロファージのアリール炭化水素受容体を活性化し、抗腫瘍免疫を抑制することがわかった
イミュニティ
(2022)
A. Kallies et al.
Blimp-1転写因子はエフェクターCD8(+)T細胞およびメモリー応答の分化に必要である
イミュニティ
(2009)
T. Zelante et al.
微生物由来のトリプトファン代謝産物がアリール炭化水素受容体に関与し、インターロイキン-22を介して粘膜反応性のバランスをとる
イミュニティ
(2013)
D.F. Zegarra-Ruiz et al.
食餌感受性常在乳酸菌株がTLR7依存性の全身性自己免疫を媒介する
細胞宿主微生物
(2019)
S.P. Pandey et al.
Tet2欠損による肝臓マイクロバイオーム異常症がTc1細胞自己免疫性肝炎の引き金を引く
細胞宿主微生物
(2022)
A. Fu et al.
腫瘍に常駐する細胞内細菌叢は乳がんの転移コロニー形成を促進する
セル
(2022)
E. Riquelme et al.
腫瘍マイクロバイオームの多様性と構成が膵臓がんの転帰に影響を与える
セル
(2019)
A. Elkrief et al.
免疫療法を受けたがん患者の転帰に及ぼす抗生物質の悪影響:新たな独立した予後予測因子か?
Ann. Oncol.
(2019)
M. Sade-Feldman et al.
メラノーマにおけるチェックポイント免疫療法への反応に関連するT細胞状態を定義する
セル
(2018)
参考文献をもっと見る
引用元: (0)
おすすめ記事 (6)
研究論文
アポトーシス細胞片が胚中心部のチンギブルボディマクロファージを局所的に活性化させる
Cell、第186巻、第6号、2023年、1144-1161.e18頁
抄録を表示する
研究論文
がん代謝とは何か?
細胞』186巻8号、2023年、1670-1688頁
抄録を表示する
研究論文
腸内細菌叢を介したヌクレオチド合成は直腸癌のネオアジュバント化学放射線療法に対する反応を減弱させる
キャンサーセル、41巻、1号、2023年、124-138.e6頁
抄録を表示する
研究論文
サイトメガロウイルス抗原を標的とした細胞傷害性CD4+ T細胞による老化細胞の排除について
Cell、第186巻、第7号、2023年、1417-1431.e20頁
抄録を表示する
研究論文
食餌性糖質によって誘導される微生物叢の不均衡は、免疫介在性メタボリックシンドロームからの保護に支障をきたす
Cell、第185巻、第19号、2022年、3501-3519.e20頁。
抄録を表示する
研究論文
微小環境アンモニアが大腸がんにおけるT細胞疲弊を促進させる
セルメタボリズム、35巻、1号、2023年、134-149.e6ページ
抄録を表示する
14
これらの著者は同じように貢献した。
15
リードコンタクト
全文を見る
© 2023 Elsevier Inc.
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
