腸内細菌叢の形成異常と糞便微生物移植による制御:総説
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
269
総閲覧数
5
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは2
レビュー記事
Front. 微生物学, 03 11月 2023
抗菌薬・耐性菌・化学療法セクション
第14巻-2023年|https://doi.org/10.3389/fmicb.2023.1286429
腸内細菌叢の形成異常と糞便微生物移植による制御:総説
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1286429/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit










Xianzhuo Zhang1† Xufei Luo2† Liang Tian1† Ping Yue3† Mengyao Li4 Kefeng Liu5 Daoming Zhu6 Chongfei Huang1 Qianling Shi1 Liping Yang3 Zhili Xia1 Jinyu Zhao1 Zelong Ma1 Jianlong Li1 Joseph W. Leung7 Yanyan Lin3* Jinqiu Yuan8* Wenbo Meng3* Xun Li3 Yaolong Chen2,9,10,11
1中国蘭州市蘭州大学第一臨床医学院
2中国蘭州大学基礎医学院エビデンスに基づく医学センター
3蘭州大学第一病院一般外科、中国蘭州市
4蘭州大学第二臨床医学院(中国・蘭州市
5中国鄭州市鄭州大学第一附属病院薬学科
6中国浙江省遠西突厥苗族自治州中央病院放射線科
7カリフォルニア大学デービス医療センターおよびサクラメントVA医療センター消化器肝臓科(米国カリフォルニア州サクラメント
8中国・深圳市・中山大学第七附属病院ビッグデータセンター臨床研究センター
9中国医学科学院、蘭州大学基礎医学院、エビデンスに基づく評価とガイドライン研究ユニット(中国、蘭州市
10中国蘭州市蘭州大学健康データ科学研究所
11WHOガイドライン実施・知識翻訳協力センター(中国、蘭州市
背景 腸内細菌叢異常症は様々な消化管疾患および消化管外疾患に関与しているが、治療適応のための糞便微生物叢移植(FMT)の有効性および安全性に関するエビデンスは依然として不明である。
方法 gutMDisorderデータベースを用いて腸内細菌叢異常と疾患との関連をまとめた。様々な疾患の治療におけるFMTの有効性と安全性に関するエビデンスの統合を決定するために、発表されたメタアナリシスの包括的レビューを行った。本研究はPROSPEROに登録された(CRD42022301226)。
結果 腸内細菌叢異常は117の消化管および消化管外と関連していた。大腸がんは92のディスバイオーシスと関連していた。ファーミキューテス門が関与するディスバイオーシスは34の疾患と関連していた。FMTに関する62のメタアナリシスを同定した。FMTは13疾患に有効であり、再発性Chloridoids difficile感染症(rCDI)の治癒率は95.56%(95%CI:93.88-97.05%)であった。エビデンスの質はrCDIでは高く、潰瘍性大腸炎とクローン病では中等度から高い質であったが、その他の疾患では低い質から非常に低い質であった。
結論 腸内細菌叢の異常は多くの疾患に関与している可能性がある。FMTが特定の適応症において臨床転帰を改善することを示唆するエビデンスは十分にあるが、エビデンスの質は特定の適応症、投与経路、注入頻度、糞便の前処理、ドナーの種類によって大きく異なる。このばらつきは、FMTに関する臨床的、政策的、および実施上の決定に役立つはずである。
はじめに
常在性微生物や病原性微生物を含む腸内微生物は、消化管(GI)に定着し、腸管バリアや免疫に影響を及ぼす様々な代謝産物を産生することにより、腸管の恒常性と宿主の健康に大きく影響する(Guarner and Malagelada, 2003)。病原性微生物や常在微生物は、疾患の発症や進行に頻繁に関連している(Guarner and Malagelada, 2003)。正常な状態では、腸内微生物は宿主と共生し、ダイナミックなバランスを保ち、代謝、栄養、保護、免疫調節、造血、抗炎症、抗腫瘍機能において主要な役割を果たしている(Guarner and Malagelada, 2003)。しかし、このバランスが崩れると、正常な身体機能が損なわれ、再発性クロストリジオイデスディフィシル感染症(rCDI)、炎症性腸疾患(IBD)、クローン病(CD)、肥満、メタボリックシンドロームなど、GIおよびGI外疾患が出現する可能性がある(Borody and Khoruts, 2011; Allegretti et al., 2019; Lloyd-Price et al.) 腸内細菌叢と疾患との関連をカタログ化したデータベースはいくつかあるが、データ解析と可視化は依然として限定的である(Janssens et al.、2018;Cheng et al.、2020)。腸内細菌叢と疾患との複雑な関連性を解明することで、新規治療が可能になる可能性がある。
スクリーニングされた健康なドナーの糞便を患者の消化管に移植することでマイクロバイオームの多様性と機能を回復させる糞便微生物叢移植(FMT)は、研究および臨床で人気を集めている(Allegrettiら、2019;Oka and Sartor、2020;van der Lelieら、2021;Sorbara and Pamer、2022)。特定の疾患やサブグループに対するFMTを検討したメタアナリシスは数多くあるが(Allegrettiら、2019;Greenら、2020)、研究全体の有効性と安全性を定量的に統合したり、エビデンスの質と強度を評価したりした研究はない。
我々は、腸内細菌叢異常と疾患との関係を系統的にレビューし、様々な適応症に対するFMTの有効性と安全性に関するエビデンスを明らかにすることを目的とした。
方法
データベース解析
ヒトの疾患と腸内細菌叢の関係をカタログ化したデータベースであるgutMDisorder(2019年6月10日、v1.0)を用いて関連を検討した(Cheng et al.) gutMDisorderには、579の腸内微生物と123の疾患との間の2,263のキュレーションされた関係、およびヒトに対して提示された77の介入が含まれている。gutMDisorderデータベースの各エントリには、腸内微生物、疾患名、介入手段、実験技術など、関連性に関する詳細な情報が含まれている。gutMDisorderは、腸内細菌叢の機能をアノテーションするための初の人手によるキュレーションリソースとして、分子機能を予測するためのこれまでの計算手法やツールを活用することで、新規の微生物叢機能の探索を可能にしている(Cheng et al.) 他のデータベースと比較して、gutMDisorderはより多くのソースからの文献データを集約し、より詳細な情報を含んでおり、データ量と情報の完全性に関する本研究の要件を満たしている。これらの複雑な関連性を解析・可視化し、ヒトの疾病に関連する主要な微生物を同定した。データ収集、クラスター分析、グラフ化コードには、Microsoft Excel(Microsoft Corporation, Redmond, WA, United States)を使用した。データベースの疾患とディスバイオシスの分析では、微生物の介入後の変化を除外し、疾患に直接関連する微生物のみを分析した。ChiPlot、Origin 2021(Origin Lab、Northampton)、Adobe Illustrator CS6(Adobe, San Jose, CA, United States)を用いてグラフを作成した。
アンブレラレビュー
ClinicalTrials.govで進行中のFMT試験を検索し、Cochrane living review guidelines (Elliott et al., 2017; Hunt et al., 2018)に従ってアンブレラレビューを実施した。アンブレラレビューは、システマティックレビューとメタアナリシスから得られたエビデンスの概要を提供するものであり、リビングレビューは継続的に更新される(Aromataris et al.) FMTが発展するにつれ、所見に影響を与える新たなエビデンスが現れる可能性があるため、レビューを更新する予定である。我々は、Preferred Reporting Items for Systematic Reviews and Meta-Analysis(PRISMA)2020ガイドラインに従い(Page et al., 2021; Gates et al., 2022)、プロトコールを登録した(CRD42022301226)。
検索戦略と選択基準
PubMed、Embase、Cochrane Database of Systematic Reviews、Web of Science、China National Knowledge Infrastructure、Chinese Biomedical Literature Database、Wanfang Databaseを経由してMEDLINEを検索し、FMTに関するランダム化臨床試験(RCT)または観察研究のメタアナリシスを2021年10月まで、2022年6月に言語制限なく更新した。同定された研究の参考文献リストを検索した(付録1)。
以下のような研究を適格とした: (1)研究デザイン:RCTおよび/または観察研究のメタアナリシス、(2)参加者:疾患の状態またはサブタイプを問わない、(3)介入: (3)介入:投与経路、ドナーの種類、注入頻度、菌体液の状態を問わないFMT、(4)転帰:臨床的寛解、奏効、有害事象。以下のものは除外した: (1)メタアナリシスを伴わないシステマティックレビュー、(2)プレ/プロバイオティクス研究、(3)動物実験。
研究の選択
重複を排除した後、2名のレビュアーが独立してタイトル、抄録、全文を審査した。意見の相違はコンセンサスまたは上級査読者へのアピールにより解決した。除外理由を記録した。
データ抽出
2名の査読者が独立してデータを抽出し、3人目が正確性をチェックした。各研究について、(1)特徴:著者、出版年、国、疾患、研究、参加者、年齢、性別、追跡、有害事象、(2)FMTの詳細:参加者、相対リスク(RR)、オッズ比(OR)、平均差(MD)、加重平均差(WMD)、標準化平均差(SMD)を含むアウトカム指標、異質性(I2、P)を抽出した。
質の評価
2名の査読者が、A Measurement Tool to Assess Systematic Reviews(AMSTAR-2)(16項目;Shea et al.) Grading of Recommendations Assessment Development and Evaluation(GRADE)アプローチを用いて、エビデンスの質を高い、中等度、低い、または非常に低いと評価した(Guyatt et al.、2011)。
データの統合
異質性(I2>50%、p<0.10)を推定しながら、各疾患について最新のメタアナリシスのデータを統合した。寛解率が報告されていない場合は、別のアウトカムを用いた。同じ疾患分類と転帰について同じ24ヵ月以内に2つ以上の研究が発表されている場合は、RCTまたはコホート研究の数が最も多い研究を選択した。同じ期間に発表された2つ以上の研究でRCTまたはコホート研究の数が同じ場合は、AMSTAR-2スコアが最も高い研究を対象とした。コホート研究と症例シリーズの両方がメタ解析に含まれ、サブグループ解析が研究デザインによって層別化されている場合は、サマリーフォレストプロットに含めるためにコホートデザインのサブ解析を選択した。投与経路、ドナーの種類、頻度、菌液の状態によるサブグループ解析をまとめた。
結果
検索結果
gutMDisorder、試験登録、データベースの系統的検索を行い、解析のために1,474件の微生物-疾患関連、データの可視化のために370件の試験登録を同定した(図1)。包括的レビューの結果、2,576件の論文が得られ、このうち62件のメタアナリシス(補足表S1)が組み入れ基準を満たした。
図1
www.frontiersin.org
図1. 組み入れ結果のフロー図。
腸内細菌叢と疾患との関連
479の腸内微生物のディスバイオーシスは、117の消化管および消化管外疾患と関連している(補足図S1)。図2は放射状のデンドログラムを用いて、腸内細菌叢異常症と関連する上位5疾患を表示した。大腸がんが最も多く(92)、次いでCD(71)、パーキンソン病(66)、IBD(61)であった。COVID-19患者では、抗炎症性のLachnospiraceae、Roseburia、Eubacterium、Faecalibacterium prausnitziiが減少していたが、Clostridium hathewayi、Enterobacteriaceae、Enterococcus、Actinomyces viscosus、Bacteroides nordiiなどの日和見病原体が増加していた(Zuoら、2020)。図3は、同様の放射状のデンドログラムを用いて、腸内細菌異常症を示す上位10種の腸内細菌とその関連疾患を示したものである。ファーミキューテス門が最も多く(34件)、次いでバクテロイデス門(30件)、バクテロイデーテス門(29件)、プレボテラ門(27件)であった。図4は、放射状の棒グラフを用いて、分類学的に重要な微生物の有病率を表示したものである。分類学的分類で区分することで、疾患に関連するさまざまなレベルの影響力のある微生物群を同定することができた。主要な調節異常微生物は門から種にまたがっていた: ファーミキューテス属(34)、クロストリジウム属(14)、腸内細菌科(22)、バクテロイデス属(30)、Faecalibacterium prausnitzii(13)、未分類のLachnospiraceae(2)であった。
図2
www.frontiersin.org
図2. 上位5疾患とそれに関連する腸内細菌異常症。木の幹は疾患を表し、葉は各疾患に関連する特定の微生物異常症を示す。内側の円のヒートマップは微生物の分類学的分類を示し、外側の円のヒートマップは各疾患クラスターにおける特定の微生物の過不足を明らかにする。完全な放射状のデンドログラムは補足図S1にある。微生物名はスペースの代わりにハイフンを使用。
図3
www.frontiersin.org
図3. 腸内細菌異常症トップ10とその関連疾患。木の幹は微生物を示し、葉は各微生物の腸内細菌異常症に関連する疾患を示す。内側の円のヒートマップは微生物の分類学的分類を示し、外側の円のヒートマップは各疾患クラスターにおける特定の微生物の過不足を明らかにする。完全な放射状のデンドログラムは補足図S2にある。微生物名はスペースの代わりにハイフンを使用。
図4
www.frontiersin.org
図4. 主要微生物の相対量を分類学的分類でグループ化した放射状棒グラフ。微生物名はスペースの代わりにハイフンを使用。(A)門;(B)綱;(C)目;(D)科;(E)属;(F)種;(G)ランクなし。
糞便微生物叢移植を用いた登録臨床試験
登録された370の臨床試験エントリーを分析した結果、2008年以降、様々な消化器疾患および非消化器疾患の治療に使用されたFMTの概要が示された(図5)。図5Aは、年ごとの登録試験数(赤)と累積総数(緑)を示した。図5Cは19のがん関連疾患を示しており、FMTは消化器がんそのものの治療だけでなく、他の臓器系のがんや他のがん治療から生じる消化器系の副作用にも適用されていた。図5Dは53の非消化器系疾患を示した。図5Eは42の消化器疾患を示した。
図5
www.frontiersin.org
図5. 2008年から2022年までに登録された、114の消化器疾患または非消化器疾患に対する糞便微生物叢移植を用いた臨床試験。(A)年ごとの試験数(赤)と累計(緑)。(B)62のメタアナリシスから得られた13の疾患。(C)19のがん関連疾患。FMTは消化器がんそのものだけでなく、他の臓器系のがんや他のがん治療から生じる消化器系の副作用の治療にも応用されている。(D)非消化器系疾患53例。(E)消化器疾患42例。
研究の特徴および質の評価
臨床転帰についてFMTを検討した62のメタアナリシスを同定した(詳細は補足表S1)。重複を除くと13疾患が残った(図5B): CDI(n=24)、UC(n=14)、IBD(n=6)、IBS(n=4)、CD(n=3)、AMR(n=2)、肥満(n=1)、メタボリックシンドローム(n=1)、機能性腸障害(n=1)、精神医学的転帰(n=1)、慢性袋炎(n=1)、機能性便秘(n=1)およびGVHD(n=1)である。われわれは、エビデンスマッピングアプローチを利用して、スクリーニング後の20疾患にわたるFMTの報告された有効性、安全性、および再発転帰を視覚的に提示した(図6)。マップでは、バブルの大きさがサンプルサイズを表し、絵文字がエビデンスの質の評価を示し、赤から黄色、緑までの色が疾患に対するFMT治療の有効性の程度を示し、エフェクトサイズの値に対応している。詳細なアウトカム指標はフォレストプロットで示されている(図7-10)。サブグループ解析(投与経路、注入回数、糞便調製、ドナーの種類)および詳細情報は、補足表S2に示す。
図6
www.frontiersin.org
図6. 様々な疾患の治療における糞便微生物叢移植の有効性、安全性、および再発転帰の報告のエビデンスマッピング。CDI、Clostridioides difficile感染症;CDAD、Clostridioides difficile関連下痢症;IBD、炎症性腸疾患。GRADE、Grading of Recommendations Assessment Development and Evaluationの略。
図7
www.frontiersin.org
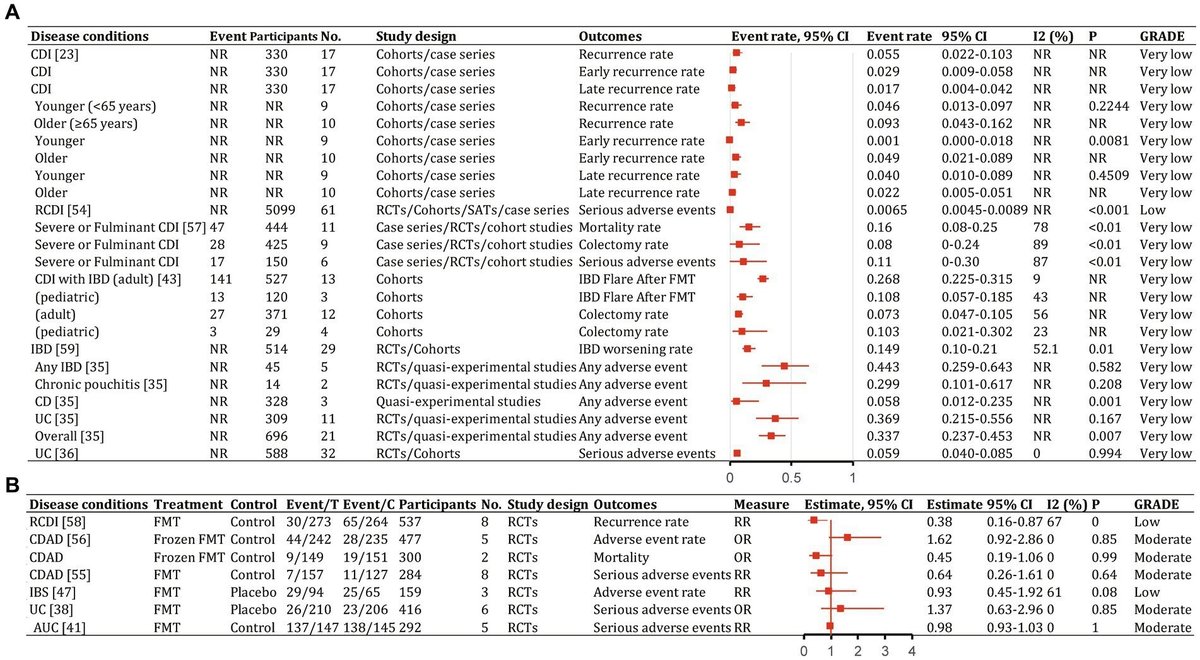
図7. 様々な疾患の治療における糞便微生物叢移植のイベント発生率(有効性)。95%CI、95%信頼区間、RCDI、再発性クロストリジウム・ディフィシル感染症、IBD、炎症性腸疾患、UC、潰瘍性大腸炎、AUC、活動性UC、CD、クローン病、AMR、抗菌薬耐性、IBS、過敏性腸症候群、CDAD、クロストリジウム・ディフィシル関連下痢症、GVHD、移植片対宿主病、RCT、無作為化臨床試験、SAT、単群試験、NR、報告なし、NA、該当なし。
図8
www.frontiersin.org
図8. 様々な疾患の治療における糞便微生物叢移植のカテゴリー別アウトカム(有効性)。95%CI、95%信頼区間、RCDI、再発性クロストリジウム・ディフィシル感染症、IBD、炎症性腸疾患、UC、潰瘍性大腸炎、AUC、活動性UC、CD、クローン病、AMR、抗菌薬耐性、IBS、過敏性腸症候群、CDAD、クロストリジウム・ディフィシル関連下痢症、GVHD、移植片対宿主病、RCT、無作為化臨床試験、SAT、単群試験、NR、報告なし、NA、該当なし。
図9
www.frontiersin.org
図9. 様々な疾患の治療における糞便微生物叢移植の連続アウトカム(有効性)。95%CI、95%信頼区間、RCDI、再発性クロストリジウム・ディフィシル感染症、IBD、炎症性腸疾患、UC、潰瘍性大腸炎、AUC、活動性UC、CD、クローン病、AMR、抗菌薬耐性、IBS、過敏性腸症候群、CDAD、クロストリジウム・ディフィシル関連下痢症、GVHD、移植片対宿主病、RCT、無作為化臨床試験、SAT、単群試験、NR、報告なし、NA、該当なし。
図10
www.frontiersin.org
図10. 様々な疾患の治療における糞便微生物叢移植の再発と安全性。95%CI、95%信頼区間、RCDI、再発性クロストリジウム・ディフィシル感染症、IBD、炎症性腸疾患、UC、潰瘍性大腸炎、AUC、活動性UC、CD、クローン病、AMR、抗菌薬耐性、IBS、過敏性腸症候群、CDAD、クロストリジウム・ディフィシル関連下痢症、GVHD、移植片対宿主病、RCT、無作為化臨床試験、SAT、単群試験、NR、報告なし、NA、該当なし。
対象研究の質スコアは補足表S1に示した。各結果のGRADEエビデンス評価は、フォレストプロットで表示した(図7~10)。全体として、CDIではエビデンスの質が高く、UCおよびCDでは中等度~高質であったが、その他の疾患では低~超低質であった。
消化器疾患
クロストリジオイデスディフィシル感染症
FMTはメタアナリシスにおいて一貫して、CDIに対する最も有効な治療法の一つであることが判明した。4,609人の参加者を含む132の研究の最近の包括的なメタアナリシスでは、便微生物叢移植(FMT)はrCDIに対して95.56%(95%CI、93.88-97.05%;中等度の質のエビデンス)の全最終治癒率を示した(図7;Laiら、2019年)。薬物療法単独と比較して、FMTはrCDI(RR、2.41;95%CI、1.20-4.83;低)に対して、原発性CDI(RR、1.00;95%CI、0.72-1.39;非常に低い;図8;Singhら、2021)よりも大きな治療効果を示した。年齢で層別化すると、FMT治癒率は高齢患者(65歳以上)と比較して若年患者(65歳未満)で高かった[99.4%(95%CI、96.9-100%)対87.0%(95%CI、81.6-91.6%)](補足表S2;Liら、2016)。反復FMT(RR、1.68;95%CI、0.96-2.94)は、単回FMT(RR、1.52;95%CI、0.90-2.58;図8;Singhら、2021)よりも高い奏効率を示した。送達経路別では、下部消化管への大腸内視鏡検査が最も高い治癒率を達成した(0.95;95%CI、0.92-0.97;補足表S2;Ramaiら、2021)。アジアおよびヨーロッパの研究では、FMTは下部消化管(それぞれ20.7%および40.5%)よりも上部消化管(それぞれ58.6%および45.2%)から実施した方がより効果的である傾向があると報告されたが、北米の研究では下部消化管(41.0%対23.9%;Laiら、2019)からFMTを実施することが好まれた。
FMTはCDIのサブタイプにも有益であると思われた。重症または劇症型CDIでは、1回のFMTで0.88(95%CI、0.83-0.91;中等度;図7;Songら、2022)の全解消成功率を示した。再発難治性CDIでは、全奏効率は0.92(95%CI、0.89-0.94;高;図7)であり、下部消化管経由の複数回注入が最良の奏効を達成した(0.95;95%CI、0.92-0.97;補足表S2;Quraishiら、2017)。
いくつかの抗生物質のネットワークメタ解析によると、バンコマイシン療法後のFMTは臨床的治癒(累積順位曲線スコア下表面、83%)およびrCDIの多発再発予防(75%)に最も有効なアプローチである可能性が高く、トレバマーも再発を予防した(87%)(Dembrovszkyら、2021年)。別のネットワークメタ解析では、特にバンコマイシンやフィダキソマイシンとの比較でFMTが最適であることが示された(Rokkasら、2019年)。rCDIでは、反復FMTは単回FMTよりも治癒率が高かった(0.93;95%CI、0.88-0.96、高値 vs. 0.85;95%CI、0.82-0.88、中値;図7;Coldら、2021)。反復FMT対バンコマイシンは、より有意な効果を示した(RR、3.33;95%CI、2.2-5.0;図8;Baunwallら、2020)。この所見は、別のメタアナリシスでも支持された(単回治療対反復治療による治癒率OR、0.09;95%CI、0.04-3.13;補足表S2;Yangら、2021)。
臨床的寛解などのアウトカムについて、大腸内視鏡によるFMTの下部消化管と上部消化管への投与について、ほぼ一貫した結果が得られた(Ianiroら、2018;Tariqら、2019;Baunwallら、2020;Pomares Bascuñanaら、2021)。新鮮なFMT対対照は、CDADを有意に治癒した(OR、6.70;95%CI、1.64-27.43;低質エビデンス;図8;Yangら、2021)。凍結FMTの2つの保存温度、-20℃(0.889;95%CI、0.684-1.000)と-70℃(0.901;95%CI、0.832-0.971)は、同程度の治癒率であった(補足表S2;Coldら、2021)。FMT前の腸内洗浄は、FMTなしよりも効果的であった(0.879;95%CI、0.812-0.947 vs. 0.822;95%CI、0.787-0.856)。好気性処理後の治癒率は0.844、嫌気性処理後の治癒率は0.803であった(補足表S2;Coldら、2021年)。
炎症性腸疾患(潰瘍性大腸炎、クローン病、慢性袋炎を含む)
FMTとプラセボの比較で、IBDの臨床転帰を改善するエビデンスがあった(臨床的寛解: RR、1.70;95%CI、1.12-2.56;中等度;図8;Scaldaferriら、2018)。メタアナリシスでは、37%の患者が臨床的寛解を達成し、54%が臨床的奏効を示した(Scaldaferri et al.) 有効性の結果は、凍結糞便材料と万能ドナーの方が優れていた。さらに、一次寛解率(UC:34.03% vs. CD:52.27%)、最終寛解率(UC:39.60% vs. CD:47.46%)、臨床的寛解率(UC:35.9% vs. CD:50.6% vs. 慢性袋炎:7.4%)、臨床的奏効率(UC: 55.2%対CD:71.7%対慢性袋炎:21.8%;補足表S2;Scaldaferriら、2018;Laiら、2019;Zhaoら、2020;Wuら、2021)。2013年から2020年までの累積メタアナリシスでは、FMTまたは新規のFMTに基づく治療薬の改善により、臨床的寛解率が経時的に増加している(0.348、95%CI、0.267-0.438)ことが示された(補足表S2;Scaldaferriら、2018年)。
潰瘍性大腸炎
UCに対するFMTの研究は、プラセボに対して有意な改善を示した(OR、3.392;95%CI、2.196-5.240;高;図8;Tangら、2020;Zhaoら、2020)。FMTによるUCの最終寛解率は39.6%(95%CI、25.39-54.61%;高;図7;Laiら、2019)であった。さらに、下部消化管経由のFMTと上部消化管経由のFMTでは、臨床的寛解率が高かった(44.0%対31.7%;Zhaoら、2020年)。総便量が275g以上と275g未満では、総便量が275g以上の方が高い臨床的寛解率を示した(51.9%対29.5%;Zhaoら、2020年)。患者の年齢、単回注入と反復注入、新鮮FMTと凍結FMT、抗生物質の前処置に基づく臨床的寛解に有意差はなかった(Paramsothyら、2017;Zhaoら、2020)。
活動性UCに対するFMTは、臨床的寛解(OR、3.634;95%CI、1.940-6.808;高)、臨床的奏効(OR、2.634;95%CI、1.441-4.815;中)、および内視鏡的寛解(OR、4.431;95%CI、1.901-10.324;中)を改善するという強いエビデンスがあった。しかし、小さなサブグループ解析では、内視鏡的奏効は有意な改善を示さなかった(OR、1.065;95%CI、0.432-2.625;中等度)(図8;Greenら、2020;Liuら、2021)。FMTと対照を比較すると、臨床的寛解と内視鏡的寛解を合わせた割合が高かった(RR、0.79;95%CI、0.70-0.88;中等度;図8;Liuら、2021)。下部消化管経由のFMTでは、臨床的寛解と内視鏡的奏効の組み合わせが多かった(RR、0.79;95%CI、0.70-0.89;補足表S2;Liuら、2021)。臨床的寛解率は、プールドナー便(ドナー2~7人)対プラセボまたは自家FMT(RR、0.69;95%CI、0.56~0.85)および複数回注入対対照(RR、0.76;95%CI、0.62~0.93;補足表S2;Liuら、2021)でわずかに高かった。
クローン病
要約推定では、CDに対するFMT後の最終寛解率は47.46%(95%CI、29.39-65.81%;中等度)、臨床奏効率は71.7%(95%CI、57.2-82.7%;非常に低い)であった(図7;Laiら、2019;Wuら、2021)。FMTは、CDにおける臨床的奏効(OR、2.57;95%CI、1.95-3.40;低い)および臨床的寛解(OR、1.50;95%CI、1.03-2.18;低い)を改善した(図8;Yeら、2020)。サブグループ解析では、小児の54.5%(95%CI、12.5-90.9%)と成人の38.4%(95%CI、15.2-68.4%)が臨床的寛解を達成した(補足表S2;Wuら、2021)。臨床的寛解率は、上部消化管への便注入では38.7%(95%CI、1.5-96.3%)であったのに対し、下部消化管では32.2%(95%CI、1.16-63.2%)であった(補足表S2;Wuら、2021)。新鮮便注入は、凍結便注入(29.9%;95%CI、4.4-79.8%;補足表S2;Wuら、2021)よりも良好な臨床的奏効率(50.0%;95%CI、21.8-78.2%)と関連していた。臨床的奏効率は、抗生物質の前処置なし(56.4%;95%CI、4.37-80.5%)の方が前処置あり(36.8%;95%CI、7.6-80.5%;補足表S2;Wuら、2021)よりも高かった。
慢性袋炎
慢性袋炎に対するFMTを検討した研究はほとんどない。14人の患者を対象とした2つの研究のメタアナリシスでは、臨床的寛解率は7.4%(95%CI、1.0-38.2%;非常に低い;図7;Scaldaferriら、2018)と報告されている。3つの研究で32人の患者が評価され、臨床的奏効率は21.8%(95%CI、3.7-66.8%;非常に低い;図7;Scaldaferriら、2018年)であった。
炎症性腸疾患を有するクロストリジオイデスディフィシル感染症患者
IBDとCDIを有する患者にとって、FMTは有効な治療法であった。成人のIBD患者におけるCDIの全臨床治癒率は78%(95%信頼区間、73~83%;低い)であり、小児患者では78%(95%信頼区間、58~93%;低い)であった(図7;Tariqら、2021年)。CDI治癒率はIBDの有無で有意差はなかった(RR、0.92;95%CI、0.81-1.05;低;図8;Chenら、2018)。サブグループ解析では、CD(0.78;95%CI、0.70-0.84;低)とUC(0.85;95%CI、0.77-0.91;低;補足表S2;Chenら、2018)で同様のCDI初回治癒率が認められた。IBD症状の改善については、成人231人中78人(33.8%;95%CI、26.7-42.1%;低)および小児31人中10人(32.2%;95%CI、15.4-59.3%;低)が改善を示した(図7;Tariqら、2021年)。
過敏性腸症候群
IBS患者では、57.8%(95%CI、45.6-69.9%;非常に低い)が有意な改善を示した(図7;Xuら、2019;Elhusein and Fadlalmola、2022)。大腸内視鏡または経鼻空腸チューブを介して投与された新鮮または凍結ドナー便は、すべて有意な改善を達成した(Ianiroら、2019;Xuら、2019)。しかし、FMT対プラセボは、12週時点でIBS症状を有意に改善しなかった(RR、1.19;95%CI、0.67-2.13;低い;図8;Xuら、2019;Elhusein and Fadlalmola、2022)。さらに、大腸内視鏡または経鼻空腸チューブによる単回FMT対自己FMTまたはプラセボは改善と関連したが(RR、1.59;95%CI、1.06-2.39;低)、複数回投与カプセルによるFMT対プラセボとしてのカプセル賦形剤によるFMTは、グローバルな改善の可能性が低いことと関連した(RR、0.54;95%CI、0.34-0.85;低;図8;Xuら、2019)。奏効率は、非経口プラセボで33.7%であったのに対し、カプセル治療では67.8%であった(Xuら、2019)。FMT対対照は、4週、8週、12週、24週時点のIBS QOLスコアが有意に高かったが、IBS重症度得点システムスコアには差がなかった(Myneeduら、2019;Elhusein and Fadlalmola、2022)。
精神医学的転帰
腸脳軸は、微生物が中枢神経系や神経疾患に影響を及ぼす可能性を示唆しているが、これらの疾患に対するFMTの臨床的有効性を検討したメタアナリシスはない。精神医学的転帰を評価した利用可能な研究は、IBS患者に焦点を当てている。1ヵ月後の疲労評価尺度(Fatigue Assessment Scale)の精神的健康(mental health)下位尺度では、30gのFMTを受けた患者はプラセボを受けた患者に対して有意な改善を示した(MD、-1.9;95%CI、-2.7~-1.1;低;図9)。同様に、60gのFMTを受けた患者では、プラセボに対して3ヵ月後に有意性が認められた(MD、-2.3;95%CI、-3.1~-1.5;低;図9;Greenら、2020)。Hospital Anxiety and Depression Scaleを用いて測定した不安・抑うつ症状には有意差はなかった(Green et al.)
機能性腸疾患
機能性腸疾患については、症状の改善も臨床的反応とIBS重症度得点システムスコアで評価される。FMTとコントロールの比較では、臨床的反応(OR, 1.699; 95%CI,0.273-10.588;低い;図8)やIBS重症度評価システムスコア(Hedge's G, 0.282; 95%CI,-1.373-1.937;非常に低い;図9)に有意差はなく、有意な異質性が認められた(Green et al.)
機能性便秘
FMTと緩下剤の併用療法は、緩下剤単独療法よりも総有効率(RR、1.35;95%CI、1.14~1.60;中等度;図8)、Bristol Stool Form Scaleスコア(WMD、1.04;95%CI、0.57~1.51;非常に低い)、Knowles-Eccersley-Scott-Symptomスコア(WMD、-5. 65;95%CI、-7.62~-3.69;低い)、ウェクスナースコア(WMD、-3.25;95%CI、-5.58~-0.92;非常に低い)、便秘QOL患者評価スコア(WMD、-18.56;95%CI、-26.43~-10.68;非常に低い;図9;Fang et al、 2021).
移植片対宿主病
全奏効率は64.4%(54/87例)であり、その内訳は完全奏効43.7%、部分奏効20.7%であった。移植片対宿主病の再発予防に最も有用な菌種としてクロストリジオイデス(Clostridioides)が浮上した。ほとんどの患者はFMT後に大きな合併症を起こさなかった(Hmら、2021年)。
抗菌薬耐性
FMTと従来型治療との比較では、AMR菌の除菌で寛解を達成できない割合が低かった(RR, 0.44; 95%CI,0.20-0.99;低;図8;Dharmaratneら, 2021)。FMTはより良好な臨床的寛解と関連していた(RR、0.37;95%CI、0.18-0.79;補足表S2;Dharmaratneら、2021)。1ヵ月間の脱コロナイズ成功率は0.58(95%CI、0.40-0.74;低い;図7;Dharmaratneら、2021)であり、以前の研究(0.45)よりも高かった(Tavoukjian、2019)。
消化管以外の疾患
肥満およびメタボリックシンドローム
FMTは、早期(2~6週間)のヘモグロビンA1c(MD、-1.69mmol/L;95%CI、-2.81~-0.56;低)および早期高密度リポ蛋白コレステロール(MD、0.09mmol/L;95%CI、0.02~0.15;低;図9;Proençaら、2020)の有益な変化と一貫して関連していた。FMTは、早期空腹時グルコース、早期トリグリセリド、早期総コレステロール、およびインスリン抵抗性のための恒常性モデル評価スコアの低下と関連していたが、有意には至らなかった(Proençaら、2020)。同様に、FMTは後期(12週)のヘモグロビンA1c、後期の低比重リポ蛋白コレステロール、後期の高比重リポ蛋白コレステロール、後期の中性脂肪の有益な変化と関連していたが、有意には至らなかった(Proençaら、2020年)。FMTはまた、初期段階の肥満度指数、後期段階の肥満度指数の低下、後期段階のヒップ幅の低下においても有益な変化と関連しているようであったが、有意には至らなかった(Proençaら、2020年)。
疾患の再発と安全性
FMTを受けたCDI患者において、先のメタ解析(Liら、2016年)では、全疾患再発率は5.5%(95%CI、2.2-10.3%)であり、早期(90日未満)再発は2.9%(95%CI、0.009-0.058%)、後期(90日以上)再発は1.7%(95%CI、0.4-4.2%;図10A)であった。重篤な有害事象の合計は0.65%(95%CI、0.45-0.89%;補足表S2;Rapoportら、2022年)であった。抗生物質の使用はほとんどの再発と関連していた。早期再発率と晩期再発率に有意差はなかった。若年患者は高齢患者より早期再発が有意に低かった(p = 0.0081; Li et al.) ドナーの種類、分娩経路、過去のCDIエピソード数は、統計学的に有意な群間差とは関連しなかった(Li et al.) 凍結FMTでは、CDIの有害事象、重篤な有害事象、死亡率が抗生物質よりも低かったが、その差は統計学的に有意ではなかった(Moayyediら、2017;Hanら、2021)。重症および劇症CDIに対するFMT後のプールされた大腸切除率は8%(95%CI、0~24%)であり、全死因死亡率は16%(95%CI、8~25%)、重篤な有害事象は11%(95%CI、0~30%)であった(図10A;Tixierら、2021)。FMTによる有害事象のほとんどは軽度から中等度であり、自己限定的であった(Huiら、2019)。
IBD患者におけるCDIでは、再発は19%(95%CI、13-27%;補足表S2;Chenら、2018)であった。成人では、26.8%(141/527;95%CI、22.5-31.5%)がFMT後にIBDフレアを起こし、7.3%(95%CI、4.7-10.5%)が大腸切除を必要とした(図10A)。小児では、10.8%(13/120;95%CI、5.7-18.5%)がFMT後にIBDフレアを呈し、10.3%(95%CI、2.1-30.2%)が大腸切除を必要とした(図10A;Tariqら、2021)。
全体として、IBD患者の14.9%(95% CI, 10-21%)がFMT後に症状が悪化した(図10A; Qazi et al., 2017)。何らかの有害事象の発生率は、慢性袋炎で29.9%(95%CI、10.1-61.7%)、CDで5.8%(95%CI、1.2-23.5%)、UCで36.9%(95%CI、21.5-55.6%)であった(図10A;Scaldaferriら、2018)。重篤な有害事象は潰瘍性大腸炎患者の5.9%(95%CI、4.0-8.5%)に発現した(図10A;Zhaoら、2020)。重篤な有害事象発生率はFMT群と対照群で有意差はなかった(OR, 1.37; 95%CI,0.63-2.96%;図10B; Tangら, 2020; Liuら, 2021)。
FMTを受けたIBS患者94人のうち、29人(30.9%)が少なくとも1つの有害事象を報告したのに対し、プラセボを受けた65人のうち25人(38.5%)が報告した(RR、0.93;95%CI、0.45-1.92;低;図10B;Ianiroら、2019)。その他の有害症状については、有意な群間差は認められなかった(Myneedu et al., 2019; Xu et al.)
AMR菌を除菌した患者の中には、嘔吐、下痢、腹部けいれん、腹部膨満感などの軽度かつ一時的な症状を経験した者もいた(Tavoukjian, 2019)。6ヵ月の追跡期間中、18人中4人が再コロニー化し、数人が自然に脱コロニー化し、6人が基礎疾患で死亡した。
メタボリックシンドロームと肥満の患者に対して、FMTは安全であることがRCTで明らかにされた(Proençaら、2020年)。重篤な有害事象は報告されていない。
4件の研究(Baxter and Colville, 2016; Lin et al., 2016; Lai et al., 2019; Rapoport et al., 2022)では、CDI、IBD、IBSに対するFMT後に、腹痛、下痢、発熱、手技または疾患に関連した合併症など、特定の症状の発生が報告された。
考察
主な所見
これまでの研究で、腸内細菌叢が疾患の進行に関係することが示されている。Cardingらは、疾患に関連する腸内細菌叢異常のいくつかを解明した先行研究を要約した(Cardingら、2015)。われわれは、より多くの現在のエビデンスをまとめ、微生物と疾患との関連を拡大し、複数の研究にまたがる重要な微生物を同定することで、この研究を発展させた。2008年、Jiaらは腸内微生物を標的とした戦略を提唱し、先駆的な理論的根拠を示した(Jia et al.) それ以来、微生物標的治療薬(MMT)が登場した。例えば、FMT、プレバイオティクス、生物製剤、微生物に着想を得た生物治療薬などである。疾患における腸内細菌叢異常や、様々な疾患に対するFMTの有効性と安全性について、多くの研究が発表されている。今回のデータベース解析では、117の消化管および消化管外疾患と479の腸内微生物との関連を解析した。研究者はこれらの結果を用いて、疾患と微生物叢の関連を明らかにし、異なる分類学的レベルにおける主要な病原性細菌を同定することができる。
今回の包括的レビューでは、13の疾患についてFMTを評価した質の高いメタアナリシスを同定した。rCDIについては、FMTは有益性を示す質の高いエビデンスを有していた。しかし、原発性CDIについては、エビデンスの質は非常に低かった。IBDについては、全体としてエビデンスの質は中等度であり、UCについては高または中等度、CDについては中等度から低または非常に低く、慢性袋炎については非常に低かった。IBD関連のCDIおよびIBSに対するFMTを支持する低品質のエビデンスがあった。AMR菌の除菌については、FMTを支持する低質エビデンスがあった。FMTは肥満やメタボリックシンドロームに効果があるかもしれないが、エビデンスの質は低いか非常に低い。
最近の研究(Martinezら、2022年)では、CDIで入院した高齢者は、Lachnospiraceae属、Ruminococcaceae属、Blautia spp.、Prevotella spp.、Dialister spp.、Bifidobacterium spp.、Roseburia spp.、Anaerostipes spp.の存在量が有意に低かった、 また、腸球菌科および腸球菌属が健常対照群に比べ増加していた。この研究によるいくつかの微生物の変化は、我々の放射状デンドログラムと一致することが観察された。FMTは胆汁酸代謝と大腸胆汁酸組成を回復させ、クロストリジオイデスディフィシル胞子の発芽に好ましくない環境を作り、rCDIの回復を促進する(Weingardenら、2014;Brownら、2018)。炎症性脂肪酸と非炎症性脂肪酸の比率は低下し、総脂肪酸は正常化した(Brown et al.) FMTは、糞便微生物叢の正常化とα多様性の回復と関連していた(Kellyら、2016)。現在のエビデンスを考慮すると、我々はFMTを主にCDI患者、特に最も恩恵を受けると思われる再発性CDI患者に使用することを推奨する。この適用は現行のガイドラインでも支持されている(付録6にFMTに関する現行の臨床診療ガイドラインとコンセンサスを示した)。欧州のガイドラインでは、rCDIに対しては抗生物質に加えてFMTまたはベズロトクスマブを推奨している(弱、中)。しかし、FMTには集学的リスク評価が必須であり、製剤の調製とスクリーニングは標準化されるべきである(weak, moderate; Van Prehn et al., 2021)。英国のガイドラインは、rCDIおよびその他の潜在的適応症に対するFMTを推奨しており、患者の選択、ドナーのスクリーニング、準備、投与、フォローアップ、サービス構成を明記している(strong; Mullish et al.) 英国のガイドラインでは、CDIの抗生物質戦略として、地域および病院環境における成人、若年者、小児(72時間以上)のCDI治療に対するFMTを支持している(National Institute for Health and Care Excellence, 2021)。米国のガイドラインでは、適切な抗生物質投与後の複数のrCDI再発に対してFMTを推奨していた(成人:強、中等度、小児:弱、非常に低い;McDonaldら、2018年)。我々は、大腸内視鏡を介した複数回の注入による新鮮なFMTがrCDIに最も有効であることを見出した。冷凍(-20℃または-70℃)や凍結乾燥FMTも有効である。腸内洗浄と好気性処理は治療成績を改善する可能性がある。
IBDの場合、活動性の疾患ではα多様性の低下とdysbiosisが認められる。CDでは、大腸菌のような通性嫌気性菌の減少とFaecalibacterium prausnitziiのような偏性嫌気性菌の増加がみられる(Lloyd-Price et al.) ルミノコッカス・トルクスとルミノコッカス・グナバスは、それぞれCDとUCのディスバイオシスで減少した(Lloyd-Price et al.) UCでは、より低い消化管FMTとより高い総便量は、より大きな臨床的寛解と関連していた。さらなる研究では、小児および成人患者、単回注入または反復注入、新鮮または凍結FMT、FMT前の抗生物質について検討すべきである。CDに対しては、抗生物質の前処置を行わない新鮮な上部消化管FMTの方がより良好な臨床的寛解が得られる可能性があるが、確認が必要である。
IBS、特に下痢優位のIBSでは、乳酸菌、ビフィズス菌、F. prausnitziiの減少が起こる(Liuら、2017年)。FMT後、症状は改善し、腸内細菌叢は時間とともに修復された(Holvoetら、2021年)。FMTはIBSを改善する可能性があるが、さらなる研究で、投与経路、ドナーの種類、注入頻度、FMTの種類、長期使用について検討すべきである。
ある試験では、FMTが2ヵ月間AMR菌量を有意に減少させ、ドナーの生着程度が糞便中の抗菌薬耐性遺伝子保有量の減少と直接関係していることが示された(Isgutら、2021年)。FMTは、多剤耐性グラム陰性菌を標的とするレジメンを脱コロナイズすると考えられた(Tacconelliら、2019)。しかし、ガイドラインはFMTの是非を推奨するにはエビデンスが不十分であると主張した。
その他の疾患についても、FMTの是非を推奨するエビデンスは不十分である。FMTの投与経路、ドナーの種類、注入頻度、および臨床使用のためのFMTの種類については、さらなる研究が必要である。
われわれの知見は、現在行われているいくつかの研究の知見と一致し、それに基づいている。BorodyとKhoruts(2011)は、FMTが疾患全体に有益である可能性を提唱したが、治療プロトコールにはさらなる最適化が必要であるとも指摘した。われわれの研究はこの観点に沿うものであり、さまざまな疾患を調整するための最適なFMTプロトコルを解明する必要性を強調している。具体的には、BorodyとKhoruts(2011)は抗生物質の前処置の必要性と投与頻度に関する未解決の問題について論じているが、我々の研究は有効性を向上させるためにこれらの詳細を最適化することを求め、現在のエビデンスをいくつかまとめている。SorbaraとPamer(2022)は、移植片対宿主病、メタボリックシンドロームと糖尿病、炎症性腸疾患などに対するFMTの可能性について検討した。同様に、われわれの研究は、FMTをCDI以外に適用する場合には、まだ慎重な評価が必要であることを示している。現在の文献(Allegrettiら、2019年)も、炎症性腸疾患、肝疾患の適応、過敏性腸症候群と機能障害、メタボリックシンドローム、再発性CDIに対する次世代FMTのFMTの状況に関する我々の議論と類似しているが、彼らの結論も、他の適応を模索する多くの試験が進行中であるにもかかわらず、FMTは再発性CDIにのみ推奨されていることを強調している。しかし、アンブレラ・レビューを通じて、本研究はFMTの適応拡大に対する実証的な裏付けを提供し、投与経路、注入頻度、糞便の前処理、ドナーの種類、その他のパラメータについて詳述した。全体として、他の疾患へのFMTの精密応用には、まだ質の高いエビデンスの蓄積が必要である。我々の研究は、個別化されたFMTプロトコールの設計を容易にする微生物-疾患マッピングの参考となる。
潜在的メカニズム
複数のメカニズムが相互に作用して疾患とその進行を引き起こす。多くの疾患では、細菌異常が重要な病因である。健康なドナーの糞便には、多様性を高め、微生物ネットワークとコアマイクロバイオータを強化し、症状を治療する、種が豊富なマイクロバイオーム、ビローム、マイコバイオームが含まれている(Jalanka et al.)
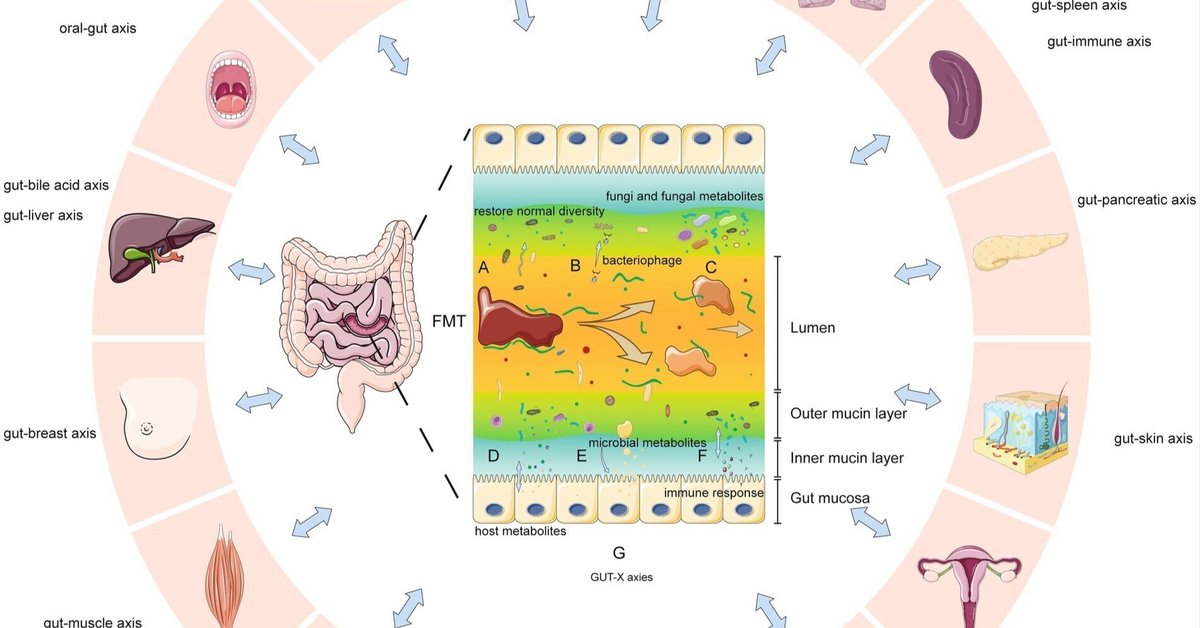
最近の研究(Hanssenら、2021年;De Vosら、2022年;Lamら、2022年;Leonardiら、2022年)では、FMTがヒトと微生物の生理を修正する7つの主要なメカニズムが示唆されている(図11): A. FMTは、正常な多様性を速やかに回復させ、微生物ネットワークと中心微生物を強化することができる(Jalankaら、2016)。B. CDIでは、無菌糞便濾液(細菌ではなくウイルス、代謝産物を含む)が寛解を達成し、腸内ウイルスの重要性を示した(Ott et al.) 最近の研究では、無菌糞便と糞便ウイルス移植を用いて、肥満、糖尿病、細菌過剰増殖、壊死性腸炎、抗生物質投与後の腸内細菌異常症における役割を研究している(Lamら、2022年)。C. FMTによりカンジダ・アルビカンスを減少させると、CDI/IBDの転帰が改善する可能性がある(Lamら、2022年)。腸内マイコバイオームの変化はIBS/GVHDの症状改善と関連していた(Lam et al.) 粘膜関連真菌は粘膜免疫を活性化する(Leonardiら、2022年)。D. FMTは、宿主に作用する微生物の代謝産物を変化させる(例えば、肝臓/免疫細胞の代謝;Hanssenら、2021)。代謝産物は、新規の細菌由来のものであっても、既存の細菌由来のものであってもよい。E. 微生物代謝産物は宿主細胞と相互作用し、シグナル伝達や健康を活性化/阻害する。細菌の代謝産物には、短鎖脂肪酸(腸に栄養を与え、透過性を変化させる)、ペプチドグリカン、リポ多糖類などがある(De Vosら、2022年)。F. 代謝産物、抗原、あるいはその他のメカニズムを変化させることによって、FMTは宿主の免疫応答に影響を与える。G. 腸内マイクロバイオームは、構造/代謝産物を通じて臓器/システムとつながり、おそらく組織の代謝を変化させる(GUT-X軸)。FMTはマイクロバイオームを変化させ、これらの潜在的な軸に影響を及ぼす。構造モチーフや生理活性代謝産物を介した腸内細菌叢と遠位臓器・システムとの推定される相互作用を概説する「GUT-X軸」という概念が、PubMed検索で同定された関連文献に基づいて策定された。これは、推定される微生物と臓器の相互作用を定義する暫定的な枠組みとして機能するものであり、さらなる軸を開発するための実証的研究を通じて、さらなる検証と疑問の提起が必要である。
図11
www.frontiersin.org
図11. 糞便微生物叢移植の主なメカニズムと潜在的な腸-臓器ネットワーク効果(GUT-Xの軸)。(A)微生物多様性の増加。(B)バクテリオファージ導入による腸内細菌の転写と生存への影響。(C)真菌と真菌の代謝物が部分的に移行する。(D)宿主からの代謝産物の生産が変化する。(E)特定の微生物代謝産物の産生増加。(F)代謝産物、エピトープ、またはその他の手段による免疫反応の変化。(G)腸内微生物は、構造、代謝産物または他の手段(いわゆる「GUT-X軸」)を介して複数の臓器と相互作用する。FMTはこれらの潜在的ネットワークを調節する可能性がある。
限界
本総説にはいくつかの限界がある。第一に、いくつかの知見は観察研究や小規模研究に依存しており、バイアスや異質性のリスクがあり、エビデンスの質が制限されている。また、非CDI適応のFMTパラメータ(例えば、送達経路、ドナーの種類、投与頻度、常在菌の調製)には改良が必要である。最後に、ClinicalTrials.govには現在進行中のFMT研究が疾患別に多数掲載されており、新たなエビデンスが出現すれば、結論が変わる可能性がある。インパクトのある新たな知見が発表された場合には、このレビューを更新して取り入れる予定である。
結論
要約すると、腸内細菌異常症は少なくとも117の消化管および消化管外疾患に関連している。FMTは、腸内細菌叢、ウイルス叢、マイコバイオーム、およびメタボロームを再構築する新たな方法を提供し、当該疾患の患者に恩恵をもたらす。メタアナリシスは、臨床におけるFMTの有効性と安全性を示唆しているが、推奨を強化するためにはより質の高いエビデンスが必要である。
今後の研究では、腸疾患との因果関係、ディスバイオシスの測定、疾患メカニズムの解明、FMTの分子効果の解明が必要である。FMTの標準化、技術革新、デリバリーの改善は、その有効性、安全性、適応症を高めるだろう。しかし、FMTの使用を拡大するには、大規模で厳密な研究が必要である。
(1)ディスバイオーシスが特定の疾患を引き起こすのか、あるいはその結果なのかを明らかにする。新しい技術によって、ディスバイオシスとその疾患特異的性質を定量化することができる。(2) 疾患に関連する微生物とFMTの作用機序を明らかにする。これにより、新たな治療標的や応用を明らかにすることができる(Chen et al.) (3) 標準化と技術革新によるFMTの調製、送達、投与の最適化。FMTによって、より正確な送達と制御が可能な人工細菌群やバクテリオファージに基づく療法を開発することができる(Yangら、2022;Airolaら、2023)。腸内細菌と機能性磁性ナノ粒子を組み合わせた人工細菌は、腸内細菌を正確に制御するための新たなアイデアを提供する。外部磁場制御を用いることで、人工細菌をうまく正確に凝集させ、腸内に定着させることができる。外部磁場はまた、遺伝子機能を遠隔制御するために、人工細菌の遺伝子発現を制御することもできる。これにより、人工細菌の機能をより精密かつ簡便に制御することができる。(4) 複雑な非CDI疾患に対するFMTについて、大規模なRCTおよび前向き研究を実施する。確実なエビデンスがあれば、ガイドラインの推奨や保険適用が可能になる。(5) マルチオミクスデータセットを統合し、腸内マイクロバイオームの膨大な複雑性を把握する。ゲノム、代謝産物、宿主のインタラクトームをマッピングすることで、疾患理解と腸内細菌叢の精密編集が一変する可能性がある。
著者貢献
XZ:概念化、データキュレーション、形式分析、調査、方法論、プロジェクト管理、資源、ソフトウェア、監修、検証、可視化、執筆(原案)、執筆(査読・編集)。XLu:概念化、データキュレーション、形式分析、調査、方法論、ソフトウェア、検証、視覚化、執筆-原案、執筆-校閲・編集。LT: 概念化、データキュレーション、調査、検証、視覚化、執筆-レビューと編集。PY: データ収集、形式分析、調査、リソース、検証、視覚化、執筆-レビューと編集。ML: データ収集、形式分析、調査、検証、視覚化、執筆-校閲・編集。KL: データキュレーション、調査、視覚化、執筆 - レビューと編集。DZ: データキュレーション、ビジュアライゼーション、ライティング - 査読と編集。CH: データ・キュレーション、執筆-校閲・編集。QS: データキュレーション、執筆-校閲・編集。LY: データキュレーション、執筆-校閲・編集。ZX: データキュレーション、執筆-校閲・編集。JZ: データ収集、執筆-校閲・編集。ZM: データキュレーション、執筆-校閲・編集。JL: データキュレーション、執筆-校閲・編集。JWL: 概念化、データキュレーション、形式分析、方法論、リソース、視覚化、執筆-校閲・編集。YL:概念化、データキュレーション、資金獲得、方法論、プロジェクト管理、リソース、執筆-校閲・編集。JY:概念化、データキュレーション、形式分析、方法論、プロジェクト管理、視覚化、執筆-校閲・編集。WM: 概念化、データキュレーション、形式分析、資金獲得、調査、方法論、プロジェクト管理、リソース、監督、検証、視覚化、執筆-レビュー&編集。XLi:リソース、監督、執筆-レビューと編集。YC: 概念化、方法論、プロジェクト管理、リソース、執筆-レビューと編集。
資金援助
著者は、本論文の研究、執筆、および/または発表のために財政的支援を受けたことを表明する。本研究は、中国国家自然科学基金会(32160255および82060551)および蘭州大学第一病院基金会(ldyyn2020-102)の支援を受けた。資金提供者は、研究デザイン、データ収集と解釈、論文投稿の決定には関与していない。
謝辞
中国国家自然科学基金会(32160255および82060551)および蘭州大学第一病院基金会(ldyyyn2020-102)からの支援に感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fmicb.2023.1286429/full#supplementary-material。
参考文献
Airola, C., Severino, A., Porcari, S., Fusco, W., Mullish, B. H., Gasbarrini, A., et al. 腸内細菌叢の今後の調節:ユビオティックからFMT、人工細菌、ファージ療法まで。doi: 10.3390/antibiotics12050868.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Allegretti, J. R., Mullish, B. H., Kelly, C., and Fischer, M. (2019). 糞便微生物叢移植の使用の進化と新たな治療適応。Lancet 394, 420-431. doi: 10.1016/S0140-6736(19)31266-8.
PubMed要旨|全文|Google Scholar
Aromataris, E., Fernandez, R., Godfrey, C. M., Holly, C., Khalil, H., and Tungpunkom, P. (2015). システマティックレビューの要約:アンブレラレビューアプローチの方法論的開発、実施、報告。Int. J. Evid. 13, 132-140. doi: 10.1097/XEB.000000000055
CrossRef 全文|Google Scholar
Baunwall, S. M. D., Lee, M. M., Eriksen, M. K., Mullish, B. H., Marchesi, J. R., Dahlerup, J. F., et al. 再発性Clostridioides difficile感染症に対する糞便微生物叢移植:最新の系統的レビューとメタアナリシス。EClinicalMedicine誌29-30:100642。
PubMed Abstract | CrossRef Full Text | Google Scholar
Baxter, M., and Colville, A. (2016). 糞便微生物移植における有害事象:文献レビュー。J. Hosp. Infect. 92, 117-127. doi: 10.1016/j.jhin.2015.10.024.
クロスレフ・フルテキスト|Google Scholar
Borody, T. J., and Khoruts, A. (2011). 糞便微生物叢移植と新たな応用。Nat. Rev. Gastroenterol. Hepatol. 9, 88-96. doi: 10.1038/nrgastro.2011.244
PubMedアブストラクト|全文|Google Scholar
Brown, J. R., Flemer, B., Joyce, S. A., Zulquernain, A., Sheehan, D., Shanahan, F., et al. Clostridioides difficile感染に対する糞便微生物叢移植の成功における微生物叢組成、胆汁および脂肪酸代謝の変化。BMC Gastroenterol. 18:131. doi: 10.1186/s12876-018-0860-5
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Carding, S., Verbeke, K., Vipond, D. T., Corfe, B. M., and Owen, L. J. (2015). 疾患における腸内細菌叢のディスバイオーシス。Microb. Ecol. Health Dis. 26:26191. doi: 10.3402/mehd.v26.26191.
クロスレフ・フルテキスト|Google Scholar
Chen, L., Zhao, N., Cao, J., Liu, X., Xu, J., Ma, Y., et al. Short-readおよびLong-readメタゲノミクスは、腸内細菌叢における個別化された構造変化を拡大する。Nat. Commun. 13:3175. doi: 10.1038/s41467-022-30857-9
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, T., Zhou, Q., Zhang, D., Jiang, F., Wu, J., Zhou, J. Y., et al. 炎症性腸疾患患者におけるクロストリジウム・ディフィシル感染症の治療に対する糞便微生物叢移植の効果:コホート研究の系統的レビューとメタ解析。J. Crohns Colitis 12, 710-717. doi: 10.1093/ecco-jcc/jjy031
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腸内細菌叢の異常による疾患と介入に関する包括的データベース。このデータベースは、腸内細菌叢の機能異常に関する包括的なデータベースであり、疾患や介入における腸内細菌叢の機能異常に関する包括的なデータベースである。
クロスレフ・フルテキスト|Google Scholar
Cold, F., Baunwall, S. M. D., Dahlerup, J. F., Petersen, A. M., Hvas, C. L., and Hansen, L. H. (2021). メタアナリシスによる系統的レビュー:カプセル化糞便微生物移植-臨床的有効性のエビデンス。Ther. Adv. Gastroenterol. 14:175628482110410.
パブコメ抄録|全文|Google Scholar
De Vos, W. M., Tilg, H., van Hul, M., and Cani, P. D. (2022). 腸内マイクロバイオームと健康:メカニズム的洞察。Gut 71, 1020-1032. doi: 10.1136/gutjnl-2021-326789.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dembrovszky,F.、Gede,N.、Szakács,Z.、Hegyi,P.、Kiss,S.、Farkas,N.、他(2021)。糞便微生物叢移植は、多発性クロストリジオイデスディフィシル(Clostridioides difficile)感染症の治療において最良の選択肢である可能性がある:ネットワークメタ解析。Infect. Dis. Ther. 10, 201-211. doi: 10.1007/s40121-020-00356-9
パブコメ抄録|全文|Google Scholar
Dharmaratne, P., Rahman, N., Leung, A., and Ip, M. (2021). 腸内の抗生物質耐性負荷の軽減に糞便微生物叢移植の役割はあるか?システマティックレビューとメタアナリシス。Ann. Med. 53, 662-681. doi: 10.1080/07853890.2021.1927170
パブコメ抄録|全文|Google Scholar
Elhusein, A. M., and Fadlalmola, H. A. (2022). 過敏性腸症候群患者における糞便微生物叢移植の有効性:最新の系統的レビューとメタ解析。Gastroenterol. Nurs. 45, 11-20. doi: 10.1097/SGA.000000000652
CrossRef 全文|Google Scholar
Elliott, J. H., Synnot, A., Turner, T., Simmonds, M., Akl, E. A., McDonald, S., et al. 生きているシステマティック・レビュー: 1. はじめに-なぜ、何を、いつ、どのように。J. Clin. Epidemiol. 91, 23-30. doi: 10.1016/j.jclinepi.2017.08.010.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fang, S., Wu, S., Ji, L., Fan, Y., Wang, X., and Yang, K. (2021). 成人の機能性便秘に対する糞便微生物叢移植と緩下剤の併用療法:ランダム化比較試験の系統的レビューとメタアナリシス。医学 100:e25390. doi: 10.1097/MD.0000000000025390
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gates,M.、Gates,A.、Pieper,D.、Fernandes,R. M.、Tricco,A. C.、Moher,D.、他(2022)。医療介入のレビューの概要に関する報告ガイドライン:PRIORステートメントの開発。doi: 10.1136/bmj-2022-070849.
CrossRef 全文|Google Scholar
Green, J. E., Davis, J. A., Berk, M., Hair, C., Loughman, A., Castle, D., et al. クロストリジウム・ディフィシル感染症以外の疾患の治療に対する糞便微生物叢移植の有効性と安全性:系統的レビューとメタ解析。Gut Microbes 12, 1-25. doi: 10.1080/19490976.2020.1854640
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Guarner, F., and Malagelada, J. R. (2003). 健康と病気における腸内細菌叢。Lancet 361, 512-519. doi: 10.1016/S0140-6736(03)12489-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Guyatt, G., Oxman, A. D., Akl, E. A., Kunz, R., Vist, G., Brozek, J., et al. GRADEガイドライン: 1. はじめに-GRADEエビデンスプロファイルと所見要約表。J. Clin. Epidemiol. 64, 383-394. doi: 10.1016/j.jclinepi.2010.04.026
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Han,L.L.、Yang,L.P.、Zhang,Z.G.、Jiang,L.J.、Ding,N.N.、Yao,L.、他(2021年)。C.difficile関連下痢に対する凍結糞便微生物叢移植の効果:メタアナリシス。Chin. J. Microecol. 33, 29-36. doi: 10.13381/j.cnki.cjm.202101005.
CrossRef 全文|Google Scholar
Hanssen, N. M. J., de Vos, W. M., and Nieuwdorp, M. (2021). ヒト代謝疾患における糞便微生物叢移植:不透明な過去から明るい未来へ?Cell Metab. 33, 1098-1110.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hm, A., Veeraballi, S., and Hashmi, S. K. (2021). 移植片対宿主病の治療選択肢としての糞便微生物叢移植:系統的レビューと今後の方向性。血液 138:4869.
クロスレフ・フルテキスト|Google Scholar
Holvoet, T., Joossens, M., Vázquez-Castellanos, J. F., Christiaens, E., Heyerick, L., Boelens, J., et al. 便微生物叢移植は、腹部膨満感を主訴とする過敏性腸症候群患者の一部において症状を軽減する:プラセボ対照無作為化試験の短期および長期結果。Gastroenterology 160:e8, 145-157.e8. doi: 10.1053/j.gastro.2020.07.013
クロスレフ・フルテキスト|Google Scholar
Hui, W., Li, T., Liu, W., Zhou, C., and Gao, F. (2019). 再発性C. difficile感染症治療のための糞便微生物叢移植:最新のランダム化比較試験メタアナリシス。PLoS One 14:e0210016. doi: 10.1371/journal.pone.0210016.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hunt, H., Pollock, A., Campbell, P., Estcourt, L., and Brunton, G. (2018). レビューの概要入門:概要に関連する研究課題と目的を計画する。Syst. Rev. 7:39. doi: 10.1186/s13643-018-0695-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ianiro, G., Eusebi, L. H., Black, C. J., Gasbarrini, A., Cammarota, G., and Ford, A. C. (2019). メタ解析を伴う系統的レビュー:過敏性腸症候群の治療に対する糞便微生物叢移植の有効性。Aliment. Pharmacol. Ther. 50, 240-248.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ianiro, G., Maida, M., Burisch, J., Simonelli, C., Hold, G., Ventimiglia, M., et al. クロストリジウム・ディフィシル感染に対する異なる糞便微生物叢移植プロトコルの有効性:系統的レビューとメタアナリシス。United European Gastroenterol J 6, 1232-1244. doi: 10.1177/2050640618780762.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Isgut, M., Sun, J., Quyyumi, A. A., and Gibson, G. (2021). 多遺伝子リスクスコアの高値は心筋梗塞リスクの予測因子として生後早期より優れている。Genome Med. 13:13. doi: 10.1186/s13073-021-00828-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jalanka, J., Mattila, E., Jouhten, H., Hartman, J., De Vos, W. M., Arkkila, P., et al. 再発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植における管腔および粘膜微生物叢と一般的に獲得される分類群に対する長期的効果。BMC Med. doi: 10.1186/s12916-016-0698-z
パブコメ抄録|クロスリーフフルテキスト|Google Scholar
Janssens, Y., Nielandt, J., Bronselaer, A., Debunne, N., Verbeke, F., Wynendaele, E., et al. Disbiomeデータベース:マイクロバイオームと疾患との関連。BMC Microbiol. 18:50. doi: 10.1186/s12866-018-1197-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jia, W., Li, H., Zhao, L., and Nicholson, J. K. (2008). 腸内細菌叢:薬剤ターゲティングのための潜在的な新領域。Nat. Drug Discov. 7, 123-129.
PubMedアブストラクト|Ref 全文|Google Scholar
Kelly, C. R., Khoruts, A., Staley, C., Sadowsky, M. J., Abd, M., Alani, M., et al. 多発性クロストリジウム・ディフィシル(Clostridium difficile)感染症の再発に対する糞便微生物叢移植の効果:無作為化試験。Ann. Intern. Med. 165, 609-616.
パブコメ抄録|クロスリーフフルテキスト|Google Scholar
Lai, C. Y., Sung, J., Cheng, F., Tang, W., Wong, S. H., Chan, P. K. S., et al. メタアナリシスを伴う系統的レビュー:糞便微生物叢移植の168件の臨床研究におけるドナーの特徴、手順、転帰のレビュー。Aliment. Pharmacol. Ther. 49, 354-363.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Lam, S., Bai, X., Shkoporov, A. N., Park, H., Wu, X., Lan, P., et al. 糞便微生物叢移植における腸内ビロームとマイコバイオームの役割。Lancet Gastroenterol. Hepatol. 7, 472-484. doi: 10.1016/S2468-1253(21)00303-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Leonardi、I.、Gao、I.H.、Lin、W.Y.、Allen、M.、Li、X.V.、Fiers、W.D.、他(2022年)。粘膜真菌は17型免疫を介して腸管バリア機能と社会行動を促進する。細胞 185:e14, 831-846.e14. doi: 10.1016/j.cell.2022.01.017
クロスレフ・フルテキスト|Google Scholar
Li, Y. T., Cai, H. F., Wang, Z. H., Xu, J., and Fang, J. Y. (2016). メタ解析による系統的レビュー:クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植の長期転帰。Aliment. Pharmacol. Ther. 43, 445-457.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Lin, L., Li, W. M., Tang, B. B., Ye, H. J., He, X. X., Zhang, W. Y., et al. 炎症性腸疾患の治療のための糞便微生物叢移植:システマティックレビューと単一率のメタアナリシス。J. Med. 論文番号:10.11969/j.issn.1673-548X.2016.06.031。
CrossRef フルテキスト|Google Scholar
Liu, X., Li, Y., Wu, K., Shi, Y., and Chen, M. (2021). 活動性潰瘍性大腸炎の治療としての糞便微生物叢移植:系統的レビューとメタ解析。Gastroenterol. Res. Pract. doi: 10.1155/2021/6612970
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu, H. N., Wu, H., Chen, Y. Z., Chen, Y. J., Shen, X. Z., and Liu, T. T. (2017). 過敏性腸症候群患者における腸内細菌叢の分子シグネチャの変化と健常対照との比較:系統的レビューとメタ解析。Dig. Liver Dis. 49, 331-337. doi: 10.1016/j.dld.2017.01.142.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lloréns-Rico, V., Simcock, J. A., Huys, G. R. B., and Raes, J. (2022). ヒトマイクロバイオーム研究におけるシングルセルアプローチ。細胞 185, 2725-2738. doi: 10.1016/j.cell.2022.06.040
クロスレフ・フルテキスト|Google Scholar
Lloyd-Price, J., Arze, C., Ananthakrishnan, A. N., Schirmer, M., Avila-Pacheco, J., Poon, T. W., et al. 炎症性腸疾患における腸内細菌生態系のマルチオミクス。Nature 569, 655-662.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Martinez, E., Taminiau, B., Rodriguez, C., and Daube, G. (2022). Clostridioides difficileのコロニー形成と感染に関連する腸内細菌叢組成。Doi: 10.3390/pathogens11070781.
クロスレフ・フルテキスト|Google Scholar
McDonald, L. C., Gerding, D. N., Johnson, S., Bakken, J. S., Carroll, K. C., Coffin, S. E., et al. 成人および小児におけるクロストリジウム・ディフィシル感染症の診療ガイドライン:米国感染症学会(IDSA)および米国医療疫学学会(SHEA)による2017年更新版。Clin. Infect. Dis. 66, 987-994. doi: 10.1093/cid/ciy149
パブコメ抄録|クロスリファレンス全文|Google Scholar
Moayyedi, P., Yuan, Y., Baharith, H., and Ford, A. C. (2017). クロストリジウム・ディフィシル(Clostridium difficile)関連下痢症に対する糞便微生物叢移植:ランダム化比較試験の系統的レビュー。Med. J. Aust. 207, 166-172.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mullish, B. H., Quraishi, M. N., Segal, J. P., McCune, V. L., Baxter, M., Marsden, G. L., et al. 再発性または難治性のクロストリジウム・ディフィシル感染症およびその他の潜在的適応に対する治療としての糞便微生物叢移植の使用:英国消化器病学会(BSG)と医療感染学会(HIS)の合同ガイドライン。Gut 67, 1920-1941. doi: 10.1136/gutjnl-2018-316818
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Myneedu, K., Deoker, A., Schmulson, M. J., and Bashashati, M. (2019). 過敏性腸症候群における糞便微生物叢移植:系統的レビューとメタアナリシス。United European Gastroenterol J 7, 1033-1041. doi: 10.1177/2050640619866990.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
米国国立医療技術評価機構(National Institute for Health and Care Excellence)。クロストリジウム・ディフィシル感染症:抗菌薬処方。ロンドン: 国立医療技術評価機構(National Institute for Health and Care Excellence)(2021年)。https://www.ncbi.nlm.nih.gov/books/NBK573295/ から入手可能。
Google Scholar
Neuenschwander, M., Ballon, A., Weber, K. S., Norat, T., Aune, D., Schwingshackl, L., et al. 2型糖尿病発症における食事の役割:前向き観察研究のメタアナリシスの包括的レビュー。BMJ 366:l2368. doi: 10.1136/bmj.l2368.
CrossRef 全文|Google Scholar
Oka, A., and Sartor, R. B. (2020). 炎症性腸疾患に対する微生物ベースおよび微生物標的療法。Dig. Dis. Sci.65、757-788.
パブコメ抄録|全文|Google Scholar
Ott, S. J., Waetzig, G. H., Rehman, A., Moltzau-Anderson, J., Bharti, R., Grasis, J. A., et al. クロストリジウム・ディフィシル(Clostridium difficile)感染症患者の治療における無菌糞便濾液移植の有効性。Gastroenterology 152:e7, 799-811.e7. doi: 10.1053/j.gastro.2016.11.010.
クロスレフ・フルテキスト|Google Scholar
Page, M. J., McKenzie, J. E., Bossuyt, P. M., Boutron, I., Hoffmann, T. C., Mulrow, C. D., et al. PRISMA 2020声明:システマティックレビュー報告のための更新されたガイドライン。doi: 10.1136/bmj.n71.
クロステキスト|Google Scholar
Paramsothy,S.、Paramsothy,R.、Rubin,D. T.、Kamm,M. A.、Kaakoush,N. O.、Mitchell,H. M.、他(2017)。炎症性腸疾患に対する糞便微生物叢移植:系統的レビューとメタ解析。J. Crohns Colitis 11, 1180-1199. doi: 10.1093/ecco-jcc/jjx063.
クロスレフ・フルテキスト|Google Scholar
Pomares Bascuñana, R., Veses, V., and Sheth, C. C. (2021). クロストリジオイデス・ディフィシル下痢症の治療に対する糞便微生物叢移植の有効性:系統的レビューとメタアナリシス。Lett. Appl. Microbiol. 73, 149-158.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Proença, I. M., Allegretti, J. R., Bernardo, W. M., de Moura, D. T. H., Ponte Neto, A. M., Matsubayashi, C. O., et al. 糞便微生物叢移植はメタボリックシンドロームパラメーターを改善する:ランダム化臨床試験に基づくメタアナリシスによるシステマティックレビュー。Nutr. doi: 10.1016/j.nutres.2020.06.018。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Qazi, T., Amaratunga, T., Barnes, E. L., Fischer, M., Kassam, Z., and Allegretti, J. R. (2017). 糞便微生物叢移植後の炎症性腸疾患の再燃リスク:系統的レビューとメタ解析。Gut Microbes 8, 574-588. doi: 10.1080/19490976.2017.1353848.
PubMed Abstract|RefRef Full Text|Google Scholar
Quraishi, M. N., Widlak, M., Bhala, N., Moore, D., Price, M., Sharma, N., et al. メタ解析を伴う系統的レビュー:再発性および難治性クロストリジウム・ディフィシル感染症の治療に対する糞便微生物叢移植の有効性。Aliment. Pharmacol. Ther. 46, 479-493.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Ramai,D.、Zakhia,K.、Fields,P. J.、Ofosu,A.、Patel,G.、Shahnazarian,V.、他(2021年)。大腸内視鏡を用いた糞便微生物叢移植(FMT)は、再発性Clostridioides difficile感染症の治療において、浣腸や経鼻胃管よりも優れているが、カプセルと同等である:系統的レビューとメタアナリシス。Dig. Dis. Dig.Dis.Sci.66、369-380、doi: 10.1007/s10620-020-06185-7
パブコメ抄録|全文|Google Scholar
Rapoport, E. A., Baig, M., and Puli, S. R. (2022). 糞便微生物叢移植における有害事象:系統的レビューとメタ解析。Ann. Gastroenterol. 35, 150-163. doi: 10.20524/aog.2022.0695
PubMed Abstract|RefRef Full Text|Google Scholar
Rokkas, T., Gisbert, J. P., Gasbarrini, A., Hold, G. L., Tilg, H., Malfertheiner, P., et al. 再発性クロストリジウム・ディフィシル感染症における糞便微生物叢移植の役割を探るランダム化比較試験のネットワークメタ解析。United European Gastroenterol J 7, 1051-1063. doi: 10.1177/2050640619854587.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Scaldaferri, F., Pecere, S., Petito, V., Zambrano, D., Fiore, L., Lopetuso, L. R., et al. 潰瘍性大腸炎における糞便微生物叢移植の有効性と作用機序:最初のメタアナリシスからの落とし穴と約束。Transplant. 50:305. doi: 10.1016/j.transproceed.2015.12.040
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shea, B. J., Reeves, B. C., Wells, G., Thuku, M., Hamel, C., Moran, J., et al. AMSTAR 2:医療介入に関する無作為化または非無作為化研究、あるいはその両方を含むシステマティックレビューのための批判的評価ツール。doi: 10.1136/bmj.j4008.
クロステキスト|Google Scholar
Singh,T.、Bedi,P.、Bumrah,K.、Gandhi,D.、Arora,T.、Verma,N.、他(2021)。クロストリジウム・ディフィシル(Clostridium difficile)感染症に対する便微生物叢移植と薬物療法のランダム化比較試験のメタアナリシス。J. Clin. Gastroenterol. 56, 881-888. doi: 10.1097/MCG.000000001610
CrossRef 全文|Google Scholar
Song, Y. N., Yang, D. Y., Veldhuyzen van Zanten, S., Wong, K., McArthur, E., Song, C. Z., et al. 重症または劇症Clostridioides difficile感染症に対する糞便微生物叢移植:系統的レビューおよびメタ解析。J. Can. Gastroenterol. 5, e1-e11. doi: 10.1093/jcag/gwab023
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sorbara, M. T., and Pamer, E. G. (2022). 微生物ベースの治療薬。Nat. Rev. Microbiol. 20, 365-380. doi: 10.1038/s41579-021-00667-9
クロスレフ・フルテキスト|Google Scholar
Tacconelli, E., Mazzaferri, F., de Smet, A. M., Bragantini, D., Eggimann, P., Huttner, B. D., et al. 多剤耐性グラム陰性菌保菌者の脱コロナイズに関するESCMID-EUCIC臨床ガイドライン。Clin. Microbiol. Infect. 25, 807-817. doi: 10.1016/j.cmi.2019.01.005.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tang, L. L., Feng, W. Z., Cheng, J. J., and Gong, Y. N. (2020). 異なる糞便微生物叢移植法における潰瘍性大腸炎の臨床的寛解:メタアナリシス。Int. J. Color. Dis. 35, 1025-1034. doi: 10.1007/s00384-020-03599-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tariq, R., Pardi, D. S., Bartlett, M. G., and Khanna, S. (2019). 再発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植の対照試験における低い治癒率:系統的レビューとメタ解析。Clin. Infect. Dis. 68, 1351-1358.
パブコメ要旨|全文|Google Scholar
Tariq,R.、Syed,T.、Yadav,D.、Prokop,L. J.、Singh,S.、Loftus,E. V.、他(2021年)。炎症性腸疾患におけるC. difficile感染に対する糞便微生物叢移植の成績:系統的レビューとメタ解析。J. Clin. Gastroenterol. 57, 285-293. doi: 10.1097/MCG.000000001633
クロスレフ・フルテキスト|Google Scholar
Tavoukjian, V. (2019). 腸内の抗生物質耐性菌の脱コロニー化のための糞便微生物叢移植:系統的レビューとメタ分析。J. Hosp. Infect. doi: 10.1016/j.jhin.2019.03.010
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tixier, E. N., Verheyen, E., Luo, Y., Grinspan, L. T., Du, C. H., Ungaro, R. C., et al. メタアナリシスによる系統的レビュー: 重症または劇症型クロストリジオイデスディフィシルに対する糞便微生物叢移植。Dig. Dis. Sci.67、978-988、doi: 10.1007/s10620-021-06908-4
クロスレフ・フルテキスト|Google Scholar
Van der Lelie, D., Oka, A., Taghavi, S., Umeno, J., Fan, T. J., Merrell, K. E., et al. 慢性免疫介在性大腸炎を治療し、腸の恒常性を回復させるために合理的に設計された細菌コンソーシアム。Nat. Commun. 12:3105. doi: 10.1038/s41467-021-23460-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Van Prehn, J., Reigadas, E., Vogelzang, E. H., Bouza, E., Hristea, A., Guery, B., et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin. Microbiol. Infect. 27, S1-S21. doi: 10.1016/j.cmi.2021.09.038
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Weingarden, A. R., Chen, C., Bobr, A., Yao, D., Lu, Y., Nelson, V. M., et al. 微生物叢移植は、再発性クロストリジウム・ディフィシル感染症において正常な便中胆汁酸組成を回復させる。Am. J. Physiol. Gastrointest. 306, G310-G319. doi: 10.1152/ajpgi.00282.2013
パブコメ要旨|全文|Google Scholar
Wu, K. N., Zhang, M., Liu, S. S., Zhong, E., and Zhou, X. D. (2021). クローン病に対する糞便微生物叢移植:メタ解析。Beijing Biomed. Eng. 61, 24-30. doi: 10.13764/j.cnki.ncdm.2021.04.005.
CrossRef 全文|Google Scholar
Xu, D., Chen, V. L., Steiner, C. A., Berinstein, J. A., Eswaran, S., Waljee, A. K., et al. 過敏性腸症候群における糞便微生物叢移植の有効性:系統的レビューとメタアナリシス。Am. J. Gastroenterol. 114, 1043-1050. doi: 10.14309/ajg.000000000198
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
楊良萍(Yang, L.P.)、韩良萍(Han, L.L.)、张子戈(Zhang, Z.G.)、张子戈(Zhang, C.Y.)、魏赫培(Wei, H.P.)、孟薇(Meng, W.B.)、他(2021)。再発性クロストリジウム・ディフィシル感染症の治療に対する新鮮糞便微生物叢移植の有効性と安全性:メタアナリシス。Chin. J. Microecol. 33, 765-769. doi: 10.13381/j.cnki.cjm.202107004.
クロステキスト|Google Scholar
Yang, L., Hung, L. Y., Zhu, Y., Ding, S., Margolis, K. G., and Leong, K. W. (2022). 腸内細菌叢とヒトの健康における物質工学。Research (Wash D C) 2022:9804014. doi: 10.34133/2022/9804014.
CrossRef 全文|Google Scholar
Ye, H. H., Hu, S. S., Chen, D. L., and Tang, L. P. (2020). クローン病治療における糞便微生物叢移植の有効性:システマティックレビューと単一率のメタアナリシス。Chin. J. Microecol. 25, 594-600. doi: 10.3969/j.issn.1008-7125.2020.10.004
CrossRef 全文|Google Scholar
Zhang, X., Lv, M., Luo, X., Estill, J., Wang, L., Ren, M., et al. 卵の消費と健康アウトカム:システマティックレビューの概要に基づくグローバルなエビデンスマッピング。Ann. Transl. Med. 8:1343.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhao, H. L., Chen, S. Z., Xu, H. M., Zhou, Y. L., He, J., Huang, H. L., et al. 潰瘍性大腸炎患者に対する糞便微生物叢移植の有効性と安全性:系統的レビューとメタ解析。J. Dig. Dis. 21, 534-548.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zuo, T., Zhan, H., Zhang, F., Liu, Q., Tso, E. Y. K., Lui, G. C. Y., et al. COVID-19患者の退院までの入院期間中の糞便真菌微生物叢の変化。Gastroenterology 159:e5, 1302-1310.e5. doi: 10.1053/j.gastro.2020.06.048
クロスリファレンス全文|Google Scholar
キーワード:腸内マイクロバイオーム、ディスバイオーシス、糞便微生物叢移植、メタアナリシス、アンブレラレビュー
引用 張X、羅X、田L、岳P、李M、劉K、朱D、黄C、石Q、楊L、夏Z、趙J、馬Z、李J、レオンJW、林Y、元J、孟W、李Xおよび陳Y(2023)腸内細菌叢のディスバイオーシスと糞便微生物叢移植による制御:アンブレラレビュー。Front. Microbiol. doi: 10.3389/fmicb.2023.1286429.
受理された: 2023年8月31日;受理された: 2023年10月18日;
発行:2023年11月03日
編集者
アブデラリ・ダダウア、グラナダ大学、スペイン
査読者
Laura Abisai Pazos-Rojas, プエブラ自治大学, メキシコ
Daniel Pacheco Sánchez、スペイン国立研究評議会(CSIC)、スペイン
Copyright © 2023 Zhang, Luo, Tian, Yue, Li, Liu, Zhu, Huang, Shi, Yang, Xia, Zhao, Ma, Li, Leung, Lin, Yuan, Meng, Li and Chen. 本記事は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Yanyan Lin, ldyy_linyy@lzu.edu.cn; Jinqiu Yuan, yuanjinqiu2006@163.com; Wenbo Meng, mengwb@lzu.edu.cn.
これらの著者は本研究に等しく貢献している。
免責事項:本論文で表明されたすべての主張は、あくまでも著者らのものであり、必ずしも所属団体、出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
Beauveria bassiana感染に対するPlagiodera versicoloraの感受性に及ぼす共生細菌の影響
メイ・リュー、ジンリー・ディン、ミン・ルー
システムマッピングに基づく大腸菌と黄色ブドウ球菌の競合・協調メカニズム
李彩峰、尹麗欣、何暁青、金毅、朱旭麗、呉栄玲
オルソケラトロジーレンズを装用した異方性小児における軸長の変化
秦健、青慧玲、季娜、柳天彬、馬慧、史孟海、余韶、馬祟輝、傅愛春
糖尿病と細菌感染は呼吸器合胞体ウイルス重症化の2つの独立した危険因子である。
Hakan Sivgin、Sirin Cetin、Ayse Ulgen、Wentian Li
β-ヒドロキシ酪酸投与は出生後成長遅延子豚の肝障害と代謝異常を改善する
王成明、王南、鄧元勲、趙安東、李俊瑶、譚碧、斉明、王静、尹玉龍
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
