共通テスト 化学
ニヒコテです。一応化学系の大学院生です。
今回は昨年度の共通テスト理系化学の解説をしていこうかと思います。問題はこちらからどうぞ。20分弱で解けたので長時間考えないと解けない難問はありません。ただ平均点は57.59/100とやや低め。しかも大幅な得点調整が入っているので正直言って機能しているとは思えませんね・・・。来年こそマトモな問題を作ってくれよと思っています。声なき声に力を。
第1問(配点:20点)
問1 ア:2価の陽イオンになりやすいのはMgとBaです。常識です。
イ:硫酸塩が水に溶けるのはMgとAlとKです。
よって答えは①です。正解して当然の問題です。
ちなみにバリウムの硫酸塩はレントゲンの造形剤として利用されています。
バリウムイオンは健康被害を及ぼすので只のバリウムではなく極めて水に難溶な硫酸バリウムを使う必要があります。
問2 頻出問題です。
体心立方格子の単位格子1個辺りに含まれる原子は2個です(1+(1/8)×8=2)。
これさえ分かれば後はd={(M/NA)×2}/L^3ですからNA=2M/L^3×dとなります。単位格子中の2個の原子の質量(M/NA)×2を単位格子の体積L^3で割ることで密度を求めます(要するにやっていることは密度=質量÷体積)。
以上より答えは⑤となります。
問3 Ⅰ:ヘキサンは分子式でC₆H₁₄の直鎖状のアルカンです。ヘキサン分子は無極性分子ですから水のような極性溶媒とは相性が悪いです。なので誤りはありません。
Ⅱ:ナフタレンは分子結晶(これは常識として覚えること)ですのですべての分子間にファンデルワールス力が働きます。なので誤りはありません。
Ⅲ:液体→気体とするとき、分子間力が小さいほど結合を引き離すのに必要なエネルギーが減少するため、沸点は低くなります。なので誤文です。
以上よりⅠ・Ⅱ→正・Ⅲ→誤となる②が正解です。
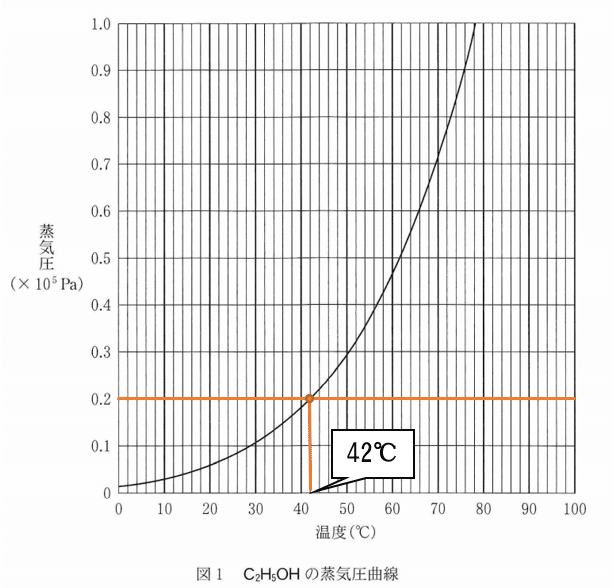
問4a ボイルの法則より温度一定下で体積を5倍すると、圧力は(1/5)倍となります。そのため蒸気圧は1.0×10^5×(1/5)=0.2×10^5Paです。
蒸気圧が0.2×10^5Paとなる時の温度は図1より42℃と読み取ることが出来まるかと思います(下図参照)。
よって4:④・5:②となります。
問4b すべてが気体の時は温度に比例して圧力が増加します。一方液体が含まれている時は飽和蒸気圧曲線に沿って圧力は増加します。飽和蒸気圧曲線は3点A・B・Cを通る曲線で、すべて液体のエタノールを加熱するところから始まる実験ですからスタート地点はAです。
この時点で①か②の2択です。次に考えるのはゴール地点の100℃の時です。
100℃で0.024molのエタノールがすべて気体となったと仮定し、仮の圧力を求めます。気体の状態方程式より、P×1.0=0.024×8.3×10^3×373ですからP≒0.74×10^5Paとなります。
100℃での飽和蒸気圧は少なくとも1.0×10^5Paよりかは大きいはずですので(80℃手前で飽和蒸気圧は1.0×10^5Paを超えます)、仮の圧力Pが飽和蒸気圧の値を上回ることはありません。
これより100℃ではエタノールはすべて気体だと分かるので100℃の時の気体エタノールの圧力はP≒0.74×10^5Paとなり、ゴール地点はGと分かります。
以上よりAスタート、Gゴールの①が正解となります。
第2問(配点:20点)
問1 ①塩素と水素の混合気体は光を照射すると連鎖的に反応します。気体分子が光子(光量子)を吸収するのですが、この反応は量子収率がものすごく高いため爆発的に反応するのです。詳しくは大学でやる内容です。誤りはありません。
②オゾンは紫外線によって酸素になりますので(2O₃→3O₂)オゾン層には紫外線をカットする作用があります。しかし近年オゾン層が都市ガスなどによって破壊されてしまい、紫外線が防ぎきれなくなってしまっています。誤りはありません。
③グルコースのような分子量を大きい物を燃焼するためには熱をたくさん要するので光合成は多量の熱を用いる吸熱反応となるのですが、受験生には意外と盲点のようです。なのでこれが誤文です。
④高校ではあまり触れることはないと思いますが、酸化チタン(Ⅳ)はアナターゼ型光触媒として有名な物質です。他にもn型半導体である、超親水性という性質があるといった点から様々な分野で研究がされている物質です。誤りはありません。
以上より③のみ誤りがありますので③が答えとなります。
問2 空気亜鉛酸電池は負極に亜鉛、正極に水酸化カリウムを用いた燃料電池(空気電池)の一種です。正極を充填するスペースはそこまで必要ないため亜鉛を多量充填することが可能です。なので小型化や容量持ちの良い電池としての利用が可能なのです。問題文通り、補聴器のボタンが正に一例です。
電池の質量増加は負極のZn→ZnOの変化(O原子の付加)で起こります。
流れた電流をx(mA)=x×10^-3(A)とすると、Zn:O:e⁻=1:1:2ですので、電子のmolの1/2相当のO原子(原子量16)が増加します。これが1.6×10^-3(g)ですから、
(x×10^-3×7720)/9.65×10^4×(1/2)×16=1.6×10^-3より、x=25となるので電流は25mAです。
以上より③が正解です。
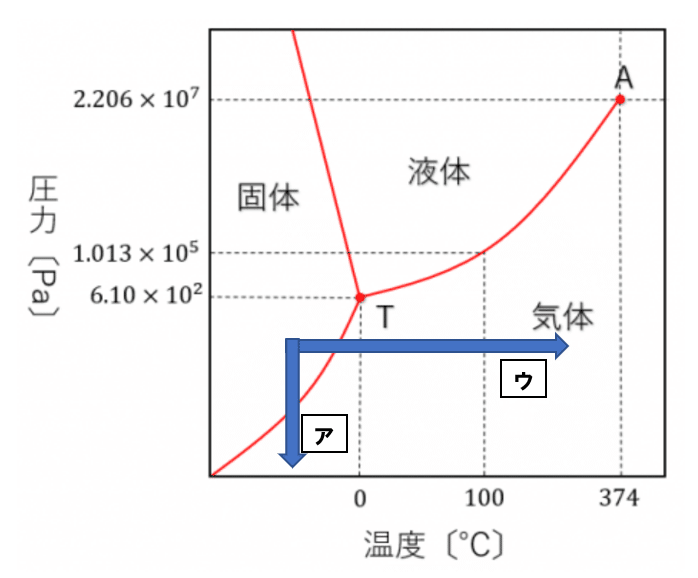
問3a 問題を見て水の状態図が思う浮かばない、書けないようではまだまだ演習不足です。氷を水蒸気へと昇華させる方法は以下の2通りあります。
Ⅰ:温度一定下で圧力を減少させる・Ⅱ:圧力一定下で温度を上昇させる
Ⅰはア、Ⅱはウですので答えは①となります。
問3b 水分子1個につき、水素結合は2個あります(HーOーH)。
氷の昇華熱は水素結合をすべて切るために必要なエネルギーの事ですから、水素結合1本切るのに必要なエネルギーはQ÷2=Q/2(kJ/mol)です。
以上より答えは②となります。
問3c エネルギー図が書いてあるのでものすごく親切な問題です。エネルギーが低→高となるときが発熱ですので正の値となります。Qを求めるためには以下の4ステップを踏む必要があります。
Ⅰ:0℃氷→0℃水:氷は1molですので融解熱と同じ値である6kJ/molです。
Ⅱ:0℃水→25℃水:水1molを1K温度上昇するのに必要なエネルギーは0.080kJですから、0.080×25=2kJ/molです。
Ⅲ:25℃水→25℃水蒸気:水は1molですので蒸発熱と同じ値である44kJ/molです。
Ⅳ:25℃水蒸気→0℃水蒸気:水蒸気1molを1K温度下降するのに必要なエネルギーは-0.040kJですから、-0.040×25=-1kJ/molです。
Ⅰ~Ⅳの全熱量を合計すると、Q=6+2+44-1=51kJ/molとなるので④が正解です。
第3問(配点:20点)
問1 ①陰極はアルミニウムよりもイオン化傾向の小さい金属なら電極としての利用が可能です(Alまでは溶融塩電解でしか単体金属を生成できないので)。イオン化傾向はNa>(Al>)Feですから誤りはありません。
②塩化ナトリウムの溶融塩電解では陰極からNa生成、陽極からCl₂発生ですので誤りはありません。
③反応式は2NaCl→2Na+Cl₂。Na単体が1mol生成されたとき、Cl₂は半分の0.5mol発生するはずですのでこれが誤文です。
④単体ナトリウムはイオン化合物で最も安定した形となるので只の電気分解では単体ナトリウムを生成することはできません。なので誤りはありません。
以上より③が正解です。
問2 よく出題される陽イオンの定性分離に関する問題です。
Ⅰ:希硫酸に溶けるのはSnとZnですから、ア・イはSn・Znのどちらか1つずつで、ウ・エはAg・Pbのどちらか1つずつです。
Ⅱ:ウの2価塩化物は熱水に溶けるとあるのでウはPbです。Pbは熱水に溶けるというのは知っていて当然の知識です。PbCl₂が2価の塩化物です。また、エがAgです。
Ⅲ:アはPbと同族元素ですからアはSnです。また、イはZnとなります。鉛とスズは共に14族元素となります。知らなかったら周期表をもっと眺めましょう。私の記事に周期表の話があるのでそちらも是非!(唐突な宣伝)
以上よりアは③、イは④が正解となります。
問3a Fe²⁺の検出に用いるのはK₃[Fe(CN)₆](ヘキサシアニド鉄(Ⅲ)酸カリウム)水溶液です。濃青色の沈殿を形成します(正確にはターンブル青といいます)。よって答えは③です。
ちなみに①の硫化水素はCu²⁺とZn²⁺の検出、④のKSCN(チオシアン酸カリウム)水溶液はFe³⁺の検出に使用します。
問3b 2[Fe(C₂O₄)₃]³⁻→[Fe(C₂O₄)₂]²⁻+C₂O₄²⁻+2CO₂は与えられているのでこれを用います。
1.0molの[Fe(C₂O₄)₃]³⁻中に含まれるシュウ酸イオンは1.0×3=3.0molです。反応後に注目すると、3.0molのシュウ酸イオンのうち2.0molは[Fe(C₂O₄)₂]²⁻に、1.0÷2=0.5molはC₂O₄²⁻に変化したことが分かります(係数比[Fe(C₂O₄)₂]²⁻:C₂O₄²⁻=1:2より)。ここから残った2CO₂は0.5molで、C₂O₄²⁻は1molで2mol分のCO₂を発生させる(C₂O₄²⁻→2CO₂+e⁻)ので、2CO₂とC₂O₄²⁻の物質量は等しくなります。
以上よりCO₂に変化したシュウ酸イオンは0.5molですから答えは①となります。
問3c CO₂に変化したシュウ酸イオンのmolを[Fe(C₂O₄)₃]³⁻の0.0109molで割って100を掛ければOKです。
[Fe(C₂O₄)₃]³⁻は0.0109molあるのでその中のシュウ酸イオンは0.0109×3=0.0327molです。
次にシュウ酸1水和物は4.36gですので式量146で割ると物質量が求まります。4.36/146=0.0300molです。シュウ酸1水和物1molにシュウ酸イオンは1.0mol含まれます。
これよりCO₂に変化したシュウ酸イオンは0.0327-0.0300=0.0027molと分かります。
更に[Fe(C₂O₄)₂]²⁻に変化したシュウ酸イオンはその倍の0.0027×2=0.0054molとなることが分かります(問3b参照)。
以上より(0.0054/0.0109)×100≒50だから、50%と分かります。
従って④が正解となります。
第4問(配点:20点)
問1 ①ナフタレンを酸化して精製するのはο-キシレンではなく無水フタル酸です。これが誤文です。知識で解きたいところ。
②ベンゼンに塩素を付加させるとクロロベンゼンが生成するので誤りはありません。
③ベンゼンをスルホン化するとベンゼンスルホン酸となるので誤りはありません。
④ベンゼンに水素を付加するとシクロヘキサンが生成するので誤りはありません。
以上より①を選べば正解です。
問2 油脂アレルギーの学生が多いですが、今回の問題はそこまで難しくありません。
①けん化価の定義はその通りです。けん化価が大きいほど油脂1g辺りのmolが大きくなりますので、同じ質量でのmolを比較すると平均分子量は小さくなります。なので誤りはありません。
②ヨウ素価の定義はその通りです。ヨウ素価が大きいほどC=Cなどの不飽和結合が多くなるため酸素と反応しやすくなります。酸化しやすい乾性油は不飽和結合をたくさん持つのでヨウ素価は大きくなるはずです。なので誤りはありません。
③硬化油に限らず油脂に水素を付加する反応は還元です。なのでこれが誤文です。
④油脂は高級脂肪酸(分子量の大きい脂肪酸)とグリセリンとのエステルです。油脂で当然知っておかねばならない常識です。もちろん誤りはありません。
以上より答えは③となります。
問3a アルコールを酸化してケトンになるのは第2級アルコールの話です。
第2級アルコールはヒドロキシ基が結合するC元素にH原子を1個持っているアルコールの事です。アは第1級アルコール、イ~エは第2級アルコールだと分かるので答えは3個となる③です。
問3b 下にそれぞれのアルコールを酸化させたものを記載します。
これよりアは1種類、イは3種類、ウは2種類、エは2種類となるので②が正解です。(ChemdrawだとCが省略されてしまうので手書きしました)
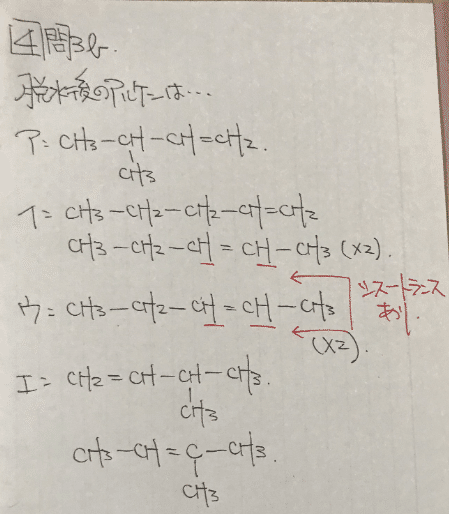
問4 高分子までしっかりと勉強されていれば難しくありません。
①ナイロン6はε-カプロラクタムが開環重合して形成された高分子化合物で、単量体の中に含まれるアミド結合は1個なのでこれが誤文です。
②ポリ酢酸ビニルを加水分解することでポリビニルアルコール作ります。ポリビニルアルコールは不安定なので只の重合反応では作ることが出来ません。誤りはありません。
③尿素樹脂は熱硬化性樹脂です。熱硬化性樹脂はフェノール樹脂・アルキド樹脂・メラニン樹脂などと、名称は「~樹脂」で終わります。誤りはありません。
④生ゴムに加硫することでゴム弾性を向上させることができます。やり過ぎるとめっちゃ硬いエボナイトになります。誤りはありません。
⑤ポリエチレンテレフタラートはポリテレフタル酸とエチレングリコールを縮合重合して作ります。繊維としても樹脂としての利用も可能です。誤りはありません。
以上より①を選べば正解です。
問5 ポリペプチド鎖Aにアミノ酸Bが何個あるのかを考えます。
ポリペプチドはアミノ酸の脱水縮合により作られますのでポリペプチドの単量体の分子量はアミノ酸Bから水の分子量18を引いた89-18=71となります。
ポリペプチドAの分子量は2.56×10^4ですので重合度(Bがくっついている数)は、2.56×10^4/71≒360となります。
らせんの全長Lは0.54nmがアミノ酸3.6個分に相当するので、Lは0.54×(360/3.6)=54nmとなります。
以上より答えは②となります。
第5問(配点:20点)
問1a 表1より、7.0h以降α-グルコースの物質量はずっと0.032molで、更に最初に溶かしたα-グルコースは0.100molなので、β-グルコースは0.100-0.032=0.068molとなります。
以上より答えは④となります。
問1b 変な問題です。
β-グルコースが平衡時の物質量の50%になる時はいつか?という問題です。
問1aより、平衡時のβ-グルコースは0.068molなのでその50%は0.068×(50/100)=0.034molです。
その際α-グルコースは0.100-0.034=0.066molなので0.5h(0.079mol)と1.5h(0.055mol)の間にあると分かります。
0.5hと1.5hの間となる答えは1.0hだけなので答えは②です。
問1c 温度が一定なら平衡定数の値は変化しません。
今回の反応は、α-グルコース⇄β-グルコースなので、平衡定数Kは、
K=(平衡時のβ-グルコースのmol/L)/(平衡時のα-グルコースのmol/L)=(0.068/1.0)/(0.032/1.0)=0.068/0.032となります。
β-グルコースを追加で0.100mol加えても、数時間後には0.100molのうちの何molかがα-グルコースに変化して再び平衡状態に戻りますので平衡後のβ-グルコースをx(mol/L)とおくと、平衡定数は一緒(同じ値)ですので、
0.068/0.032=x/(0.100+0.100-x)←全体0.200molから平衡後のβ-グルコースのmolを引けばα-グルコースのmolが求めることができます
計算すると、x≒0.136mol/Lです。
溶液は1.0Lですから物質量は0.136×1.0=0.136molとなります。
以上より④が正解です。
問2 引っ掛け問題です。
α-グルコースの1位のC原子にあるヒドロキシ基がメタノールと反応してエーテル結合を形成したわけですから水に溶かしたところで開環しませんしできません。
となるとα型のXがβ型のXに変化することなどあるわけないので、α型のXはずっと同じ物質量となります。
なので①が正解です。これはひどい・・・。
問3a C原子1個で銀鏡反応を示す物質はHCHO(ホルムアルデヒド)とHCOOH(ギ酸)しかありません。
Yを還元剤として~と言うことはY自身は酸化しているわけですからYを酸化してZとなるわけです。
このことからYはHCHOでZはHCOOHだと分かります。アルデヒドを酸化するとカルボン酸になるのは常識です。
以上より④が正解です。
問3b YとZは共にC原子が1個ですから、Y2.0mol、Z10.0molができるためにはC原子は2.0+10.0=12.0mol必要となります。
グルコースの化学式はC₆H₁₂O₆ですからC原子はグルコース1個につき6個あるわけです。グルコース1molにつきC原子は6molとなりますので、C原子が12.0molの時、グルコースは12.0÷6=2.0molとなります。
以上より①が正解です。
次回は神戸大学化学の昨年度入試問題です。お疲れさまでした!
この記事が気に入ったらサポートをしてみませんか?
