[130th海城祭 化学部] 『Kaijo Chemistry Club』
pdfでご覧になりたい方はこちら

部長挨拶
こんにちは、化学部部長の德山です。
化学部は現在部員 60 名ほどで、7つの班に分かれて活動しています。 この挨拶では、社会全体がコロナ禍の影響を受け、生活様式などが大きく変化した中 で、今年の化学部の活動の「変化した点」と「変わらない点」について語りたいと思 います。 まず、今年の化学部の活動で、例年の活動から「変化した点」が2つあります。 変化した点、1つ目はやはり「コロナ」です。コロナ禍の影響で、去年から今年にか けて活動が大幅に制限されてしまいました。非常に残念なのですが、今年は例年行っ ている各班のメインの実験の見直しはほとんど行いませんでした。ごめんなさい...。 その代わり、文化祭の開催形式がなかなか決まらない中、柔軟な発表スタイルに対応 できるように、各班で「サブ実験」として実験の種類を一つ増やして活動しました。 活動が制限される中、各班、いずれの実験においてもその内容を魅力的に伝える方法 を模索しました。この文化祭では、是非その集大成をご覧ください。オンラインでご 参加の方は、実験動画だけでなく、企画モノの動画も作っておりますので、是非、そ ちらもご確認ください。 変化した点、2つ目は「新理科館」です。新理科館へ引っ越し、化学部の実験室、実 験場所ともに二学期から新しくなりました。薬品管理の仕方や部室・実験室の使い方 も変わりましたが、新しい「新理科館」で今後とも楽しく部活動を行い、盛り上げて いきたいと思います。 このように大きく変化する環境の中でも「変わらない点」があります。 「白クマの化学」というサークル名、発表中心の展示方法、KCV(実験動画)等々、 先輩方が化学部で培ってきた数々の伝統を引き継ぎ、この文化祭に臨んでいます。新 しい場所に移っても変わらないものがあるっていいですよね。そして、仲良く実験や カードゲームをやっているような、海城化学部の「雰囲気」も変わっていないものの 一つです。実際に来ていただいている方には、そんな伝統や雰囲気も感じていただき たいなと思います。(ちょっとかっこいい風なこと書いてみたかった) さて、この挨拶を読んでいただいている皆様、化学部に興味を持っていただき本当に ありがとうございます。部員たちが全力で準備した(※部畜が多数発生したとも言 う)今年の文化祭発表を、皆さんに楽しんでいただければ幸いです。 それでは、どうぞ!
イントロダクション
ここでは、この部誌を読むうえで最低限必要な知識を解説します。
元素
全ての物質を構成する基本的な成分を元素という。 例えば金は「金」という元素で構成されており、水は「水素」と「酸素」という元素 で構成されている。現在知られている元素は 118 種類で、その内約 90 種類は天然に 存在し、その他の元素は人工的に作られたものである。 それぞれの元素を表す時に、元素記号が用いられる。元素記号はラテン語やギリシャ 語、地名や人名等の頭文字、又は頭文字に小文字を添えたもので表される(表1)。

原子
例えば、今あなたが見ているこの冊子は紙という物質でできている。この紙を細かく 切り分けていくとする。シュレッダーで細切りにしたものをずっっっっっっと細かく 切り分けていくと、原子と呼ばれる非常に小さい球状の粒(半径 0.0000000001~3m) にたどり着く。原子は、物質を構成する基本的な粒子であり、それぞれの元素に対応している。したがって原子はそれぞれ対応する元素と同じ名称で呼ばれ、元素記号を 用いて表される 化学の世界ではこれを最小単位としている。
例) 水素原子→H 硫黄原子→S 塩素原子→Cl
原子は原子核と、原子核の周りを回る負の電気を持つ電子から構成されており、更に 原子核は正の電気を持つ陽子と電気を持たない中性子からなる。原子では、陽子の数 と電子の数が等しく、正負の電気の量が釣り合って、互いに打ち消し合っているため 電気的に中性となる。電子は原子核を取り巻く電子殻と呼ばれる幾つかの層に分かれ 存在している(図を参照)。質量的には原子核が構成のほとんどを占めているが、化学 反応の大半は、実は電子の働きが重要である。
原子の持つ陽子の数は元素の種類によって決まっており、この数を原子番号という。

分子
原子が2つ以上くっついたものを分子という。例えば二酸化炭素が「CO2」と呼ばれて いるのは(おそらく)周知の事実であるが、これは二酸化炭素が炭素原子(C)1つと、 酸素原子(O)2つがくっついた分子であるからだ。
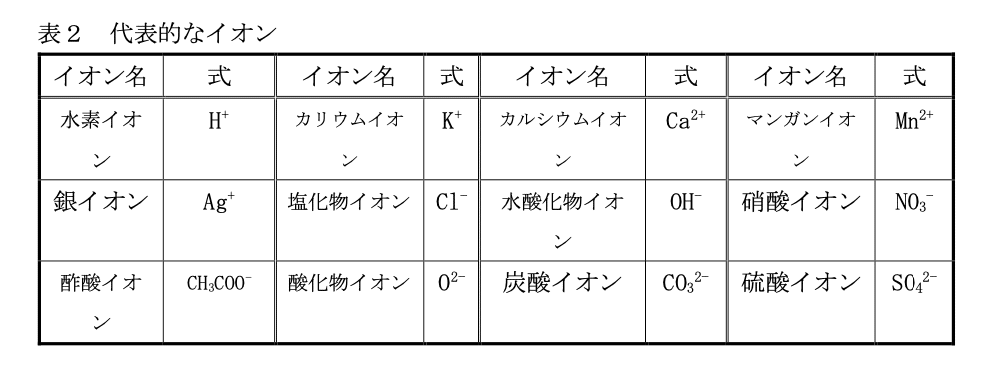
イオン
原子は先に述べた通り、陽子と電子それぞれの正負が打ち消しあって電気的に中性 になっているが、何らかの理由で電子を放出したり受け取ったりすることがある。こ の時、原子は正負どちらかの電気を持った状態になる。この状態の原子をイオンと呼ぶ(表2を参照)。例えばナトリウムが電子を1つ放出して正の電気を持ち、イオンに なったものをナトリウムイオンと呼び、Na⁺(この様な表し方をイオン式という)と表 す。また、イオンには2個以上から成るものも存在する。イオンになると正の電気を 持つようになる(⁺が付く)ものを陽イオン、逆に負の電気を持つようになる(-が付く) ものを陰イオンという。
イオンは、+と-の数が合うようにくっつく。
例)
H⁺ +Cl-→ HCl(塩酸) Na⁺ + OH⁻ → NaOH(水酸化ナトリウム)
Na⁺ + Cl⁻ → NaCl(食塩)
KCC Quiz について
今年も『KCC Quiz』を用意しました。演示実験ごとの出題となっております。それ ぞれの問題は演示実験に因んだものになっていますが、常識で解けるレベルの問題か ら、よく発表を聴いていれば答えられるような問題、発表内容だけでは分からない問 題と様々です。残念ながらこの問題を多く正解しても賞品等はございません。ですの で、純粋に問題をお楽しみください。回答・解説はこの冊子の p.30 にのせてありま す。中高生や大人の方には簡単に感じられるかもしれませんが、是非挑戦してみてく ださい。
銀鏡反応
5年◎高野 高岸 4年佐藤 福田
3年藤田 三品 2年角田 高橋 増岡
概要
我々が普段使っている鏡が作られる際に使われている原理と同じ方法で、鏡を作っていく。
実験試薬
硝酸銀 (AgNO₃) 0.2mol/L、アンモニア水 (NH₃) 適量、グルコース (R-CHO) 0.1mol/L、 水酸化ナトリウム (NaOH) 0.1mol/L
使用器具
50mL ビーカー×4、300mL ビーカー×2
2mL ピペット×3、5mL ピペット×1 メートルグラス×2、薬さじ、三脚、金網、ガスバーナー、時計皿
実験準備
1. 時計皿をクレンザーで洗う。
2. 300mLビーカーの1つに水を入れバーナーで加熱し、70°Cほどで保つ。
3. ビーカーの上に時計皿のへこんでいる部分が上になるように置く。
4. メートルグラス2つに水酸化ナトリウムとグルコースをそれぞれ2mLずつ入れる。
実験手順
1. 硝酸銀水溶液5mLを、50mLビーカーにとる。
2. 硝酸銀水溶液にアンモニア水を加えると褐色の沈殿ができる。その後、沈殿がなくなるまで適度にビーカーを振りながら、アンモニア水を加える。
3. メートルグラスに入れておいた2つの溶液を、手順2で作った溶液に入れる。
4. 作った溶液を素早く時計皿の上に注ぐ。
5. 数分間待って反応が適度に進行した後、残った溶液を廃液として捨て、時計皿の外側を見る。
原理説明
まず、手順 2 で褐色の沈殿ができたとき、塩基性を示すアンモニア(NH₃)が水(H₂O)と酸塩基平衡反応を起こして生じた水酸化物イオン(OH⁻)と銀イオン(Ag⁺)が結びつき、酸化銀 (AgO)が生成されている。この酸化銀は水に溶けないため、褐色の沈殿となっている。
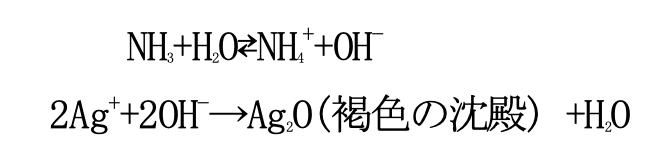
この酸化銀を含む水にアンモニア水をさらに加えることで酸化銀とアンモニアが反応して水溶性 のジアンミン銀(I)イオン ([Ag(NH₃)₂]⁺) ができる。
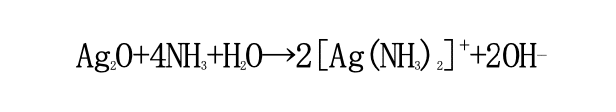
銀が単体でも存在するためには銀イオンの電荷が 0 でなければいけないため、ここに電子を加え て電荷を 0 にする必要がある。
そこで、手順 3 でグルコースに含まれるアルデヒド基(R-CHO)と水酸化ナトリウム(NaOH)を反応させて電子 (e⁻)を発生させる。この電子がジアンミン銀(I)イオン内の銀イオンと反応して、銀イ オンの電荷が 0 になることによって銀が単体でも析出するようになる。つまり鏡ができる。
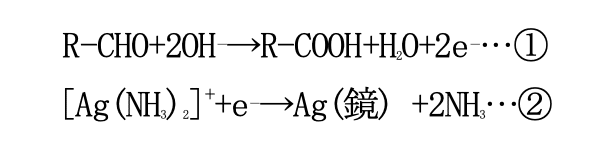
上記の 2 式を組み合わせて式が成り立つようにすると(①+②×2)、

となる。また、①の反応で出てきた水酸化物イオンは水酸化ナトリウムから供給されている。 この反応の実用例としては、ガラス製魔法瓶や鏡の銀メッキなどが挙げられる。
参考文献
卜部吉庸 『化学の新研究 理系大学受験』 三省堂 海城学園化学部『白クマの化学』2019 年
KCC Quiz 銀鏡反応編
Q1.この銀鏡反応は生活で使う色々なものに銀メッキをする際の方法として用いられている。 この銀鏡反応が使われているものを下から選べ。
①マイク ②缶 ③銀色のヘアカラー ④ガラス製魔法瓶
Q2.今回使った試薬のうちアルデヒド基が含まれているのはどれか。
①硝酸銀 ②アンモニア ③グルコース ④水酸化ナトリウム
Q3.金属鏡が初めて作られたのはいつ頃と考えられているか。
①紀元前5700年頃 ②紀元前2800年頃 ③400年頃 ④今
砂糖の発火
5年 ◎高野 村上 3年 水野 2年 西村 石井 1年 中村
概要
砂糖の発火
5年◎高野 村上 3年 水野 2年 西村石井1年中村
化学反応を使って、液体を掛けることで砂糖を燃やす。 実験試薬
白砂糖(C₁₂H₂₂O₁₁)、塩素酸カリウム(KClO₃)、濃硫酸(H₂SO₄)、マグネシウム粉末(Mg)
使用器具
2mL ピペット×1 水槽、三脚、ろ紙、アルミカップ、薬さじ
実験手順
以下全ての手順はドラフト内で行う。
1. 水槽に土を敷き、そこに三脚を立て、その上にろ紙を設置する。
2. アルミカップを2枚重ねた上に、塩素酸カリウムと砂糖を4:3で混ぜたものを乗せる。 3. 手順1のろ紙の上に手順2のアルミカップを乗せ、濃硫酸をその上に垂らす。
原理説明
<作用・条件>
今回の実験で火を使わずに砂糖(炭素)を燃やせたことには、
“硫酸の脱水作用”と“燃える 3 条件”が関わっています。 どのような作用・条件か以下で解説します。
1. 硫酸の脱水作用
硫酸には脱水作用という性質があります。 これは読んで字のごとく、物質から水分を抜き取る作用です。 この作用によって、水分を抜き取られた物質は熱を出します。 脱水作用が起こる仕組みは、硫酸が H⁺(水素イオン)を相手物質の非共有電子対の部分(OH)に投げ て、相手の OH と繋がり H₂O(水)として生成することで、水分が抜かれるというものです。わかりや すくするために以下の図に示します。

2. 燃える3条件
特に受験生は聞いたことがあるのではないでしょうか。これは物が燃えるために必ず必要な条件の ことを言い、「①燃えるもの ②発火点以上の温度 ③酸素」の3つが揃うことで物が燃えます。
<実験原理>
以上 2 つの作用・条件を踏まえて、実験における反応を解説していきます。
① 燃えるもの
今回の実験の主役である白砂糖の主成分はショ糖(C₁₂H₂₂O₁₁)と呼ばれる糖で、 C(炭素)を含んでいるので、”燃えるもの”である。
② 熱
硫酸を砂糖にかけると<硫酸の脱水作用>によって砂糖の水分が奪われ、”熱”が出る。

③ 酸素
砂糖と一緒に混ぜた塩素酸カリウム(KClO₃)は、分子内に大量の酸素を含んでおり、硫酸が存在する 条件下で強い酸化剤として働き、大量の”酸素”を放出する。
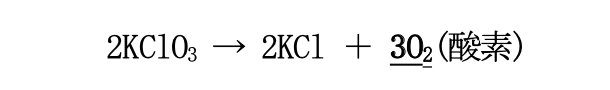
以上、<燃える3条件>が火を使わずに揃ったことで、 火を使わずに砂糖を燃やすことができた。 全体の反応式は以下の通りである。

補足説明
この実験では塩素酸カリウムが使われているため、炎の中に金属であるカリウムの赤紫色の炎色反 応が観察できる。また、砂糖はショ糖以外でも代用可能である。
よくある質問
Q1 硫酸の他に塩酸などは使えないの?
A1 今回は火を使わずに砂糖を燃やすという実験なので、火を使わずに熱を出すために硫酸の脱水 作用を用いました。また、酸素を出す物質である塩素酸カリウムは硫酸の酸性条件下でないと酸素 を放出しないという性質があります。そのため、硫酸と似ている、物質を溶かす性質をもった塩酸 や水酸化ナトリウムではこの実験は成り立ちません。
Q2 砂糖以外でもできるの?
A2 もちろん、できます(開き直りではない)
この実験において、燃える物である C と硫酸の脱水作用が働くための水分を持っていれば砂糖の代 用になります。なので、食パン・ご飯・おてての発火もあり得ますが、砂糖は粒状になっていて酸 素と反応する表面積が圧倒的に上に挙げたものより大きいため、反応しやすく激しく燃えるので砂 糖にしています。
Q3 なんでマグネシウムを入れてるの?
A3 燃えるとき火花が散ってキレイになるから。
参考文献
・2021 年度 海城化学部誌
・加藤俊二 『身の回りを化学の目で見れば』 pp.26~27 ・『希硫酸, 濃硫酸, 熱濃硫酸の違いと7つの性質』
https://yama-taku.science/chemistry/property-of-the-material/sulfuric-acid/
KCC Quiz 砂糖の発火編
Q1.砂糖の発火の実験で白砂糖の代わりにできないものは何でしょう?
① 塩 ② 皮膚 ③ 黒糖 ④ 小麦粉
Q2.砂糖の発火で使えるのはどれでしょう?
① 希硫酸 ② 濃硫酸 ③ 塩酸 ④ 酢酸
Q3.砂糖の致死量はどれくらいでしょう?
① 100g ② 1kg ③ 5kg ④ 10kg
小さな雷
5年 ◎古簱 菊川 3年 北川(聖) 武井
2 年 入江 北川(健) 清水 関 長尾(祥)
概要
2 つの液体と 1 つの個体から雷を起こします。
実験試薬
濃硫酸(H₂SO₄)、メタノール(CH₃OH)、過マンガン酸カリウム(KMnO₄)
使用器具
5mL ピペット×1、10mL ピペット×1、試験管×1 試験管立て、スタンド、薬さじ×1、水槽
実験手順
1 水槽に少し水を張り、スタンドに試験管を挟む。試験管が水槽の真ん中、そして試験管の口が 机と平行になるように位置を調整する。
2 5mLピペットを使って濃硫酸を3mL量り、試験管に注ぐ。
3 10mLピペットを使ってメタノールを6mL量り、試験管に注ぐ。
このとき、ピペットの先を試験管の内壁につけて、ゆっくり注ぐ。
4 薬さじで過マンガン酸カリウムを少量加える。
5 緑色の物質が試験管の底部に生成され、しばらくすると、バチバチを発しながら雷のようなものが落ちる。
原理説明
まず、濃硫酸(H₂SO₄)と過マンガン酸カリウム(KMnO₄)が反応して、七酸化二マンガン(Mn₂O₇) という緑色の物質が生成される。

七酸化二マンガンは酸化剤(他の物質から電子を奪う。相手を酸化させ、自身は還元する)でメタノ ール(CH₃OH)は還元剤(他の物質に電子を与える。相手を還元させ、自身は酸化する)なので、この二 つの物質の間で、激しい電子のやりとりが行われる。

この電子のやりとりで発生する熱によって、気化したメタノールが引火し、小さな爆発が発生する。今回は、この爆発を「小さな雷」として観察する。
補足説明・本物の雷との違いは?(簡単に)

図の出典・海城化学部『白クマの化学』2017 年度版
I: 雲の中には無数の氷の粒が存在しており、それが擦れ合うことによって静電気が発生している(髪の毛を下敷きで擦ると立つのと同じ原理)。また、小さな氷の粒はプラスに帯電し、大きな氷の粒は下に移動する。
II: 2種類の粒は図のように重さによって分かれ、大きな粒は下に移動する。それによって、地面にはプラスの電気が集まる。
III: 雲下部のマイナスの電気と地面のプラスの電気の電位(電圧の差)が限界値を超えると放電する。(絶縁破壊ともいう)
→ 電気の素が関わっているという点では「小さな雷」と同じ!!
ただし、サイズや雷が発生する原因は異なる。
参考資料
・東京大学サイエンスコミュニケーションサークル CAST 『イラストでサクサク覚える 東大生の元素ノート』すばる舎
・海城学園化学部『白クマの化学』2017,18 年 ・トレンドピックアップ「雷が発生する原理とは?音はなぜ鳴るの?」
https://santa001.com
KCC Quiz 小さな雷編
Q1.実験を行う際に、水槽に水を張っておいたのはなぜか?
①薬品が手についた時に早く手を洗えるようにするため。
②試験管内の危険な薬品が突沸した際に机に付かないようにするため。
③雷が激しく発生した時に消火するため。
Q2.濃硫酸とメタノールは比重の違いによって分離するが、比重の違いによって 分離する(浮き沈みする)ものとして知られるものは、次のうちどれか?(全て選ぶこと)
①水と氷 ②水と油 ③ミルクティーとタピオカ
Q3.今回の実験に使用した薬品について説明した文のうち正しいものはどれか?
①濃硫酸には脱水性があるので、乾燥剤などに用いられる。
②過マンガン酸カリウムは強い還元剤として働く。
③メタノールはお酒に含まれるアルコールなので人体に影響はない。
④反応終了後に析出する酸化マンガン(IV)は、乾電池の材料である。
時計反応
5年 ◎小口 4年 豊田 宇津木 山口
2年 松本 鳥野 1年 榎本
概要
無色の2つの溶液を混ぜると、数秒後に突然発色する。
実験試薬
A 液:硫酸(H₂SO₄)(2mol/L)、過酸化水素水(H₂O₂)(35%)
B 液:ヨウ化カリウム(KI)、チオ硫酸ナトリウム五水和物(Na₂S₂O₃・5H₂O)、デンプン ((C₆H₁₀O₅)n)
C 液:硝酸(1.38)(HNO₃)、硝酸鉄(III)九水和物(Fe(NO₃)₃・9H₂O)
D 液:ヨウ化カリウム(KI)、チオ硫酸ナトリウム五水和物(Na₂S₂O₃・5H₂O)、デンプン ((C₆H₁₀O₅)n)
使用器具
100mL ビーカー、300mL ビーカー、500mL ビーカー
2mL ピペット、5mL ピペット、10mL ピペット
1000mL メスフラスコ、100mL メスシリンダー、薬さじ、三脚、金網、ガスバーナー
実験準備
A 液: 2.0mol/L 硫酸 15mL に濃度 35%の過酸化水素水を 3.0mL 加えて混ぜ、水を加えて 125mL に希 釈する。
B 液: デンプン 10%溶液 3.0mL とチオ硫酸ナトリウム 0.20g と 1.0mol/L ヨウ化カリウム水溶液 6.0mL を混ぜ合わせて、水を加えて 125mL に希釈する。
C 液: 水 50mL に硝酸(1.38)3.5g を加える。そこに硝酸鉄(III)九水和物 1.6g を溶かし、125mL に 希釈する。
D 液: デンプン 10%溶液 3.0mL とチオ硫酸ナトリウム 0.20g と 1.0mol/L ヨウ化カリウム水溶液 6.0mL を混ぜ合わせて、水を加えて 125mL に希釈する。
実験手順
実験1 A液とB液を素早く混ぜる。
実験2 C液とD液を素早く混ぜる。
原理説明
○ヨウ素デンプン反応
皆さんはヨウ素デンプン反応という反応をご存知だろうか。ジャガイモにうがい薬を垂らすと色が青紫色になるあれのことだ。そんな性質をもつヨウ素(I₂)なのだが、ヨウ素自体は水に溶けに くく、ヨウ化カリウム水溶液(KI)には溶けやすいという性質をもっている。このことを式に表す と、(式1)のようになる。

これは、ヨウ化カリウムが水に溶けて発生したヨウ化物イオン(I⁻)と、ヨウ素が反応して水に溶 ける三ヨウ化物イオン(I₃⁻)となったことを表している。この原理を使って作られているのがヨー ドチンキ、いわゆる赤チンである。この赤色は三ヨウ化物イオンの色でもある。(ちなみに、コロ ナに効く(?)という話で有名になったポビドンヨードはヨウ素の強い酸化作用を利用した典型例)
○実験 1
さて、今回の実験では、溶液を混合した後 10 秒ほど経ってから、溶液の色が濃い紫色に変化した。先に言ってしまうと、この色の変化は上で説明した赤褐色の三ヨウ化物イオンが生成され、デ ンプン((C₆H₁₀O₅)n)と反応(ヨウ素デンプン反応)して青紫色になったということになる。
ここで重要になるのが、どのようにして三ヨウ化物イオンが生成されたのか、また、最初の 10 秒は何が起きていたのかということだ。式を見てみよう。
まず、B 液中のヨウ化カリウムが水溶してできたヨウ化物イオン×3と A 液中の過酸化水素水 (H₂O₂)が反応して、三ヨウ化物イオンが生成される。この反応は反応系の中で相対的に遅い反応 であるため、三ヨウ化物イオンはゆっくりと生成される。

しかし、生成された三ヨウ化物イオンはすぐに B 液中のチオ硫酸ナトリウム(Na₂S₂O₃)が水溶し てできたチオ硫酸イオン(S₂O₃₂⁻)によって、ヨウ化物イオンに分解される。この反応は比較的速い反応と言われている。
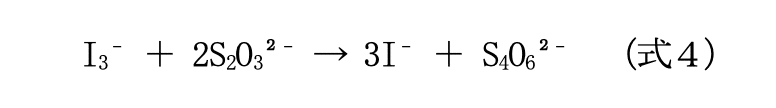
つまり、赤褐色の三ヨウ化物イオンが生成されてはすぐに無色のヨウ化物イオンに分解されると いう反応が繰り返し起こり、結果として、最初の 10 秒間、混合液はずっと無色の状態に見える。
しかし 10 秒後、(式2)で三ヨウ化物イオンを分解していたチオ硫酸イオンがすべて消費さ れ、(式2)の反応は起こらなくなる。すると、三ヨウ化物イオンが一方的に生成されるようにな る。これとデンプンが反応して、青紫色に呈色したのである。
○実験 2
一方、今回は実験 1 の過酸化水素を鉄(III)イオン(Fe³⁺)に変えた時計反応も行った。このでは、溶液を混ぜた後すぐに溶液が紫色に変化し、その後徐々に色が無色に近づいていき、ひとたび 無色になると今度は突然濃い青紫色に変化した。この時計反応でも、(式3)(式4)と同様の反応が起こっている。
まず、硝酸鉄(III)九水和物(Fe(NO₃)₃・9H₂O)に含まれていた鉄(III)イオンにより、ヨウ化カリウムのヨウ化物イオンが酸化され、有色の三ヨウ化物イオンが生成する。(式5)

しかし、先程の時計反応と同様に、チオ硫酸ナトリウムにより三ヨウ化物イオンが還元される。

この二つの反応式をよく見ると、先程の(式3)(式4)とほとんど一緒であることが分かると 思う。違う点は(式3)で過酸化水素が担っていたヨウ化物イオンを酸化させる役割を(式5)で は鉄(III)イオンが担っていたという点だけで大きな違いはない。そのため、(実験 1)と同じよう に、しばらく時間が経ってから青紫色に変化した。
では、なぜ溶液を混ぜた直後に紫色に変化し、段々無色になっていったのか。これは、硝酸鉄 (III)九水和物に含まれる鉄(III)イオン(正確にはヘキサアクア鉄(III)イオン([Fe(H₂O)₆]³⁺))とチオ 硫酸ナトリウムのチオ硫酸イオンが反応し、紫色の錯体を形成したためである。
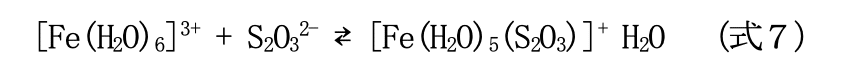
反応が進むと、徐々に(式6)でチオ硫酸イオンが消費されていくため、(式7)の平衡位置が 左に傾き(ルシャトリエの原理による)、紫色の錯体は徐々に減少していく。
(正確には未反応の鉄(III)イオンが含まれているので、無色というよりは黄色がかって見え る。)
この時計反応は(式7)の反応をもつため、チオ硫酸イオンの減少を視覚化することができ、呈 色までの間にも反応が起きていたということの根拠を示してくれる。
この二つの実験の視覚的な変化の過程を比較することで、実験1の溶液が無色であった間にも実 は反応が起きていたということが理解できたのではないだろうか。
○反応速度
また、先ほど「速い反応」「遅い反応」という話があったが、このような反応速度の違いによって、時計反応は成立している。仮に、(式2)の反応速度が(式3)よりも速いと、少しずつ三ヨ ウ化物イオンが生成され、色が徐々に出てくるため、時計反応は見映えが悪くなる、というか失敗 する。このように時計反応では、反応速度の違いが重要なのである。(式2)のように反応系の中 で最も遅い反応で、反応全体の速度を決める反応段階を「律速段階」という。また、溶液の量や濃 度、液性などの調整によって、呈色までの時間を変えることもできる。
反応速度を記述する式として、アレニウスの式というものがある。

この式を見ると、反応速度は反応の活性化エネルギーが小さいほど、また、温度が高いほど速く なることが分かる。これは何となく想像がつくだろう。
また、このアレニウスの式の両辺の対数をとると、
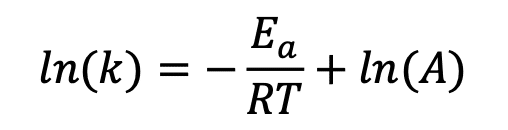
この式から ln(k)を縦軸、1/T を横軸にとりグラフにすると、傾き-Ea/R の直線が与えられること がわかる(アレニウスプロットという)。各温度における速度定数 k(各種濃度と反応時間から求 められる)をプロットしていくと、任意の温度での反応速度を予測することができる。
参考資料
Bassam.Z.Shakhashiri 「教師のための化学実験 ケミカルデモンストレーション 6」 pp81- 94,123-130,139-143
KCC Quiz 時計反応編
Q1.次のうち、デンプン水溶液を加えた時、ヨウ素デンプン反応を起こさない物質はどれ か。
①三ヨウ化物イオン ②ヨウ化物イオン ③ヨウ素 4イソジン
Q2.実験 1 で、(式 4)の反応が起こらなくなったのはなぜか。
①三ヨウ化物イオンがなくなったから ②チオ硫酸イオンが消費され切ったから
③(式 3)の反応が(式 4)の反応よりも速くなったから。
Q3.実験 1 で、誘導期間が長くなる操作はどれか。(難)
①チオ硫酸ナトリウムの濃度を高くする。
②硫酸の濃度を高くする。
③溶液を温めながら行う。
④時を止める(ザ・ワールド)
錬金術
5年◎山崎 3年大平 澤崎 高澤 谷合 横川
2年長尾 西岡 西口 1年 洪
概要
怪しげな錬金術師たちの手によって何の変哲もない銅板の色が変化!? 金属の色の変化をとくとご覧あれ。
実験試薬
亜鉛(Zn)、水酸化ナトリウム(NaOH)、銅片(Cu)
使用器具
500mL ビーカー×2、薬さじ×2、蒸発皿、ガラス棒 三脚、三角架、ガスバーナー、ピンセット、るつぼばさみ、キムタオル(キムワイプでも 可)
実験手順
I. 蒸発皿に蒸留水を半分ほど注ぎ、そこに水酸化ナトリウムを薬さじの大匙 1 杯ほど、亜 鉛粉末を薬さじの小匙 1 杯ほどを加えてガラス棒でかき混ぜる。
II. 「I」の手順で準備されたものを、ガスバーナーで軽く沸騰するまで熱する。
III. 蒸発皿に銅片を入れる。
IV. 銅片の色が変化しきったら、ピンセットで取り出した後、蒸留水ですすぎ、キムタオル で軽く拭う。(こびりついた亜鉛粉末を取り除く。)......物質 A が生成されたとする。
V. 物質 A をガスバーナーで色が変化し始めるまで熱し、500mL ビーカーに入った蒸留水で 急冷させる。...金属 B が合成された!
原理説明
原理が結構難しいので、コマごとに反応を見ていこう。
1 コマ目: 薬品の混合(手順 I・H₂O、NaOH、亜鉛を蒸発皿に投入したところ)

水酸化ナトリウム(NaOH)は、電解質と呼ばれる物 質の一つです。電解質は水(H₂O)に溶けるとイオン 化します。つまりここでは、ナトリウムイオン (Na⁺)と水酸化物イオン(OH⁻)に電離して存在して います。
2 コマ目: 水素イオン(H⁺)

※実は 1 コマ目の段階でも水素イオン(H⁺)は存在 していましたが、熱を加えると反応が促進され、 多く生成されます。
この水素イオン(H⁺)は、電子(-の電荷をもつ) と呼ばれる粒子を失った状態にあります。
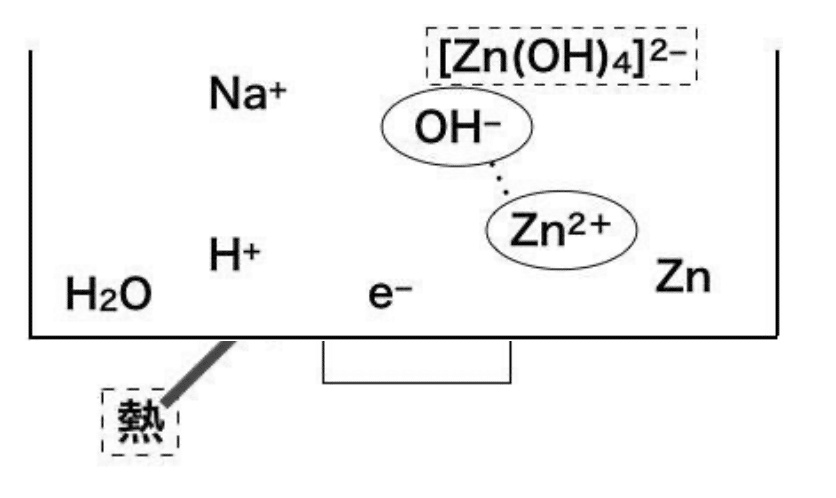
3 コマ目: 亜鉛(II)イオン(Zn²⁺)の発生(手順II)

2 コマ目で説明したように、水素イオン(H⁺)は電
子を失った存在です。そのため、亜鉛粉末(Zn)は 電子を水素イオンに渡すことが可能になります!亜鉛が電子を渡す(つまり放出する)と、水素イ オンと同じく電子を失った存在である、亜鉛(II)イオン(Zn²⁺)になるということです。
3 コマ目で生成された亜鉛(II)イオン(Zn²⁺)ですが、これは非常に不安定な物質です。 それゆえ、生成されると同時にこれは蒸発皿内の水酸化物イオン(OH⁻)と結合し、テトラ ヒドロキシド亜鉛(II)酸イオン([Zn(OH)₄]²⁻)を形成します。
★要チェック ~テトラヒドロキシド亜鉛(II)酸イオン~
・Zn²⁺に配位子として OH⁻が4つ配位結合したことによる錯イオンの一種。 ・なお、配位結合は比較的弱い結合である。
5 コマ目:亜鉛メッキの形成(手順III)
4 コマ目の状態の蒸発皿に銅片(Cu)を投入すると......!?

※上図において、いくつかの物質は省略していま す。また、電子を(e⁻)で表しています。
銅片(Cu)は電流を良く通すため、銅片周辺に電子(e⁻)が多数集結します。 すると、銅片(Cu)表面ではテトラヒドロキシド亜鉛(II)酸イオン中の亜鉛(II)イオン部分が 電子(e⁻)を受け取り(還元され)、銅の表面で銀色の亜鉛メッキが形成されます。 ここまでが、「銅色→銀色」への変化の流れです。
6 コマ目:真鍮(しんちゅう)の合成(手順V) 「実験手順V」において亜鉛メッキされた銅片を熱すると......!?
「亜鉛(Zn)の融点<ガスバーナーの炎の温度」 かつ
「ガスバーナーの炎の温度<銅(Cu)の融点」 であることから......、
銅の表面の亜鉛メッキのみが融けます!
亜鉛は、ナノ粒子と呼ばれる非常に小さい粒子で出来ていま す。そのため、融けた亜鉛(Zn)は銅片内部に入り込み、銅 (Cu)と金属結合して、真鍮(合金の一種、五円玉などに使われる)という金色の金属を合成します。以上が、「銀色→金色」の変化の原理です。
補足説明
化学反応式で一連の反応を表す。
・Zn と NaOH との反応(手順 I,II 相当)
![]()
イオン式で表すと...

・銅片 Cu との反応(手順 III 相当)
![]()
※この反応は銅片の表面上で起こる。
実験上の注意
・水酸化ナトリウムを使用するので、ゴム手袋やゴーグルを着用して実験するのが望まし い。
・亜鉛粉末を拭き取ったキムタオルは自然発火する可能性があるので十分注意すること。
・実験で発生した廃液は重金属 I として処分すること。
参考文献
・2019 年度 海城化学部誌
・滋賀県立河瀬高等学校科学部(2007 年)http://www.kawase-h.shiga-ec.ed.jp/bukatsu/kagaku/kokou/Science%20Club%20Homepage.html/experiment%20c.html
KCC Quiz 錬金術編
Q1.今回の実験の大まかな原理は?正しいものを選べ!
①銅 Cu が怪しい液体につけられ、銀 Ag になり、さらに強く加熱することで
金 Au になった!
②銅の表面を亜鉛が覆い、銀色に見え、さらに加熱して亜鉛と銅の合金が形成され た!
③怪しい錬金術師が、銅片で実験しているように見せて実は銀と金にすり替えた!
Q2.次の本実験についての文章の、空欄部分に入れるものとして、正しいものを選べ!
「亜鉛(II)イオン(Zn²⁺)は不安定な物質であるため、(__ )と配位結合し、錯イオンの状態で存在する。この錯イオン中の亜鉛(II)イオン(Zn²⁺)部分が銅表面で( __)されることによって、亜鉛メッキが形成される。」
①気化 ②酸化 ③水素イオン(H⁺) ④水酸化物イオン(OH⁻)
⑤銅(Cu) ⑥還元 ⑦酸化
Q3.実験の最後に、銅片をガスバーナーで炙ったあと、急冷するのはなぜか? ①音や実験の雰囲気を楽しむため
②ゆっくり冷やすと表面が溶け出して危ないから
③綺麗な金色を出すため
コバルトのワンポット反応班
5年◎柄川 3年 栗林 杉嵜 田中
2 年 井ノ下 落合 谷
概要
コバルトのワンポット反応班
5年◎柄川 3年栗林杉嵜田中 2 年 井ノ下 落合 谷
コバルトイオンに他の物質が結合して起きる様々な変化を、1 つのフラスコ内でお見せします。
実験試薬
溶液 1・塩化コバルト(II)六水和物水溶液(CoCl₂・6H₂Oaq) 4.2×10−2mol/L 10mL
溶液 2・炭酸ナトリウム水溶液(Na₂CO₃aq) 0.1mol/L 4mL
溶液3・水酸化ナトリウム水溶液(NaOHaq) 0.4mol/L 2mL
溶液 4・塩酸(HClaq) 3mol/L 0.5mL
溶液 5・酒石酸カリウムナトリウム水溶液(C₄H₄KNaO₆・4H₂Oaq) 0.9mol/L 11mL
溶液 6・35%過酸化水素水(H₂O⁻₂aq) 5mL
使用器具
2mL ピペット×2、5mL ピペット×1、10mL ピペット×3 200mL 三角フラスコ、スターラー(攪拌機)&攪拌子、湯煎器
実験手順
1.溶液 4 まで入れたフラスコと酒石酸カリウムナトリウム水溶液を湯煎しておく。
2.三角フラスコに回転子を入れ、スターラーにセットする。
3.駒込ピペットを用い、溶液 1〜4 を指定量ずつ、順番どおりに入れていく。 4.湯煎しておいたフラスコと入れ替える。
5.駒込ピペットを用い、溶液 5〜6 を指定量ずつ、順番どおりに入れていく。
原理説明
<経過>(反応の重要な部分を中心に)
溶液 1:ヘキサアクアコバルト(II)イオンのピンク色溶液

の紫色沈殿

の青色沈殿

溶液 4:溶液 1 と同じピンク色溶液
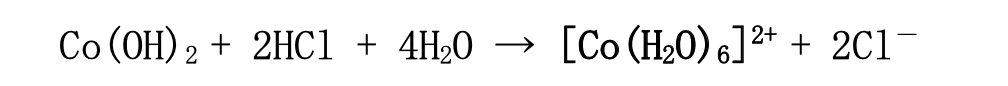
溶液 5:赤色溶液(溶液 4 に酒石酸イオン C₄H₄O₆²⁻などが加わったのみ)
溶液 6:二酸化炭素(CO₂)と酸素(O₂)の泡が発生し緑色になった後赤色溶液に戻る。(詳細後述)

<解説>
本実験で反応が起こる原理は、中心となる金属イオン(ここでは Co²⁺)に水、水酸化物イオン、酒石酸イオンなどの溶液中の粒子が結合し、金属イオンの電子の状態が変わることで溶 液の光の反射の仕方や水への溶けやすさが変化することによるものである(この状態を錯体 という)。銅や鉄など他の金属イオンでも同様の反応が起きる(コバルトを採用したのは、前 班長の好み色がきれいに出るから)。各段階での生成物は経過で記した通りである。どの粒子 が Co²⁺と結合して安定するかは温度・液性など複数の要因で決まるが、説明は割愛する。(ち なみに高校範囲外である。)
最後の泡が出る反応について詳説する。酒石酸イオン(C₄H₄O₆²⁻)は高温で[Co(H₂O)₆]²⁺と反 応し、二酸化炭素を放出して緑色のコバルト―酒石酸塩活性錯体を形成する。活性錯体は、 遷移状態(化学反応が起こる際に必要なエネルギーを持ち、実際に反応が起きようとしている or 起き始めている状態)にあり、非常に壊れやすいため、酒石酸イオンはすぐに過酸化水素 に酸化されてシュウ酸(C₂H₂O₄)となり、コバルトは元の[Co(H₂O)₆]²⁺に戻る。この過程で酸素 が発生する。また、活性錯体が壊れる際の発熱で、反応後のフラスコは非常に高温になり、 場合によっては湯気が出る。反応全体としては、酒石酸イオンは酸化されて減少し、 [Co(H₂O)₆]²⁺の量は変化せず触媒としてふるまう。
なお、実験経過で示したように反応後も未反応の酒石酸イオンが溶液中に残っているた め、過酸化水素水を追加すると、溶液中の酒石酸イオンがシュウ酸に変化しきるまで繰り返 し反応が見られる。ただし、徐々に反応は穏やかなものになってゆく。また、同じ反応をよ り多くの薬品で行うと、泡の出る勢いがかなり激しくなり、細心の注意を払う必要が生じる。
補足説明
1.ワンポット反応とは? ろ過や分離などをせずに、一つの反応器の中で複数の反応を連続して行い生成物を得ること。低コスト・低エネルギーで合成ができ、近年注目されてきている。工業化に向けた触媒 研究などが進んでいて、日本でもインフルエンザ治療薬「タミフル」の合成などが研究され ている。本実験は工業的に役立つものではないが、同じビーカーで次々と反応を起こしてい く点でワンポット反応の一種と言える。
2.なぜ湯煎するの? 原理の解説で記したように、酒石酸―コバルト錯体は高温でないと生成しないので、反応
熱だけで生成するのを待っていると 3〜10 分程もかかり、文化祭での実験として成立しな い。そのため、コバルトイオンを含むフラスコと酒石酸ナトリウムカリウム水溶液の両方を 湯煎して反応を速めている。なお、過酸化水素水は低温にしておかないと分解してしまうた め、湯煎できない。なお、フラスコを入れ替えずに素早い反応ができないか模索中である。
参考文献
・中原勝儼 『色の科学』 培風館
・日本化学会編 『実験による化学への招待』 丸善出版
・海城学園化学部 『白クマの化学』 2005 年
・日本化学会 『環境・安全化学・グリーンケミストリー・サスティナブルテクノロジー ワ ンポット合成反応』 https://division.csj.jp/div-report/18/1820112.pdf ・千葉県教育委員会 『反応度・化学平衡の指導方法の研究』 https://www.chiba-c.ed.jp/shidou/k-kenkyu/H19/k200715.pdf
・日本学術振興会 『KAKEN タミフルのワンポット,ワンフローでの集積化全合成』 https://kaken.nii.ac.jp/ja/grant/KAKENHI-PUBLICLY-16H01128/
KCC Quiz ワンポット反応編
Q1.ヘキサアクアコバルト(II)イオンの「ヘキサ」は「6 個の」と言う意味だが、何語か。
①ドイツ語 ②ラテン語 ③ギリシア語 ④イタリア語
Q2.ワンポット反応は廃棄物を抑えられるため、「グリーンケミストリー」という観点に おいて比較的優れているとも言われる。この考え方を提唱した機関はどれか。
① EPA ②WHO ③UNIDO ④OECD
ルミノール反応
5 年 ◎德山
3 年 坂本 中山 森 2 年 田口 森光
四部合同班は、他の理科4部との合同企画である「科学のるつぼ」という企画に参加してい ます。複数の実験を手掛けていますが、今回はそのうちの一つ、「ルミノール反応」を紹介し たいと思います。
概要
溶液を混ぜることで化学反応を引き起こし、その時に生じたエネルギーで、電気や火を使わ ずに発光させる。
実験試薬
ルミノール(C8H7N3O2)、炭酸水素ナトリウム(NaHCO₃)、炭酸ナトリウム(Na₂CO₃)、 炭酸アンモニウム((NH₄)₂CO₃)、過酸化水素水(H₂O₂)、硫酸銅五水和物(CuSO₄・5H₂O)
使用器具
100mL ビーカー×1、500mL ビーカー×1
2mL ピペット×1
薬さじ×5
実験手順
1. 500mLビーカーに、ルミノール0.04g、炭酸水素ナトリウム6.0g、炭酸ナトリウム 1.0g、炭酸アンモニウム 0.1g、硫酸銅五水和物 0.1g に量りとり、400mL の蒸留水に溶かす。
2. 過酸化水素水2mLと蒸留水100mLを100mLビーカーに入れる。
3. 500mLビーカー内の溶液に100mLビーカーの溶液を加える。
原理説明
この反応は、ルミノール(C₈H₇N₃O₂)が塩基性の中で酸化されることによって発光するとい う性質によるものだった。
まず、触媒(鉄や銅など)と過酸化水素(H₂O₂)の反応によって活性酸素が発生する。この活性酸素は非常に不安定であるため、ルミノールを酸化させるはたらきを持つ。そして、 ルミノールが酸化されると、エネルギーの高い状態(励起状態)の 3⁻アミノフタル酸 (C₈H₇NO₄)が生じる。
反応で生じた励起状態にある 3⁻アミノフタル酸は、すぐにエネルギーの低い基底状態に戻 る。そのときに、励起状態と基底状態の差分のエネルギーを光として放出する。ルミノール の場合、差分のエネルギーの大きさの波長が青色光のエネルギーに相当するため発光する光 の色は青色になる。
以上のようにルミノールは発光する。 反応の流れをまとめたものが下図になる。

今回入れた薬品は6種類であったが、ルミノールを発光させるための酸化剤として過酸化 水素水を、触媒として硫酸銅五水和物(CuSO₄・5H₂O)を用いた。また、塩基性にするため に、炭酸アンモニウム((NH₄)₂CO₃)を使い、さらに反応中の濃度の変化を小さくするため、 炭酸水素ナトリウム(NaHCO₃)と炭酸ナトリウム(Na₂CO₃)を加えた。
参考文献
究37(開成学園理化学部 部誌)
国立大学56工学系学部ホームページ おもしろ科学実験室「化学発光(ケミルミネッセン ス)」
(https://www.mirai-kougaku.jp/laboratory/pages/181012_02.php) 光と色と「ルミノール反応の原理と仕組み|科学捜査に光の目」 (https://optica.cocolog-nifty.com/blog/2012/02/post-52b1.html)
KCC Quiz ルミノール反応編
Q1.ルミノール反応のような、化学反応を伴っておこる発光現象をなんというか。
①化学ルネッサンス ②化学イルミネーション ③化学ルミネセンス
Q2.ルミノール反応が実際に使われる場面はどれか。
①警察の捜査 ②ライブ会場の設営 ③花火大会の最後の一発
Q3.硫酸銅五水和物を用いて結晶作りの実験をすると、何色の結晶ができるか。
①緑色 ②白色 ③青色 ④茶色
編集後記
こんにちは、部誌編集担当の村上です。 何かを提出してほしかったら、ほしい日の一週間前に期限を設定しないと提出が間に合わな いと顧問に脅され、恐れおののいていましたが、結果的には、優秀な班長達が余裕を持っ て、原稿を提出してくれました。私の能力不足で班長陣には迷惑かけましたが、班長をして いない私も少しは役に立てたと思います。編集担当は、変に細かい私に案外向いていたか も?では、化学部を見に来てくれた皆様、ご覧いただきありがとうございました!
KCC Quiz 回答と解説
銀鏡反応編
Q1.④ それ以外は銀を使用していない。
Q2.③ 官能基-choをアルデヒド基と言う。アンモニアはNH₃、水酸化ナトリウムはNaOH、硝酸銀は AgNO₃ なので違う。
Q3.② 現在のところ発見された最古の金属鏡はエジプトの第六王朝、紀元前 2800 年頃のもの。
砂糖の発火編
Q1.① 塩と砂糖の見た目は似ていますが塩には、CもOHも含まれていません(少なくとも大部分には)。
Q2.② 脱水作用を持つのは濃硫酸だけです。
Q3.② 参考 https://www.ipros.jp/monosiri/science/136
小さな雷編
Q1.② 硫酸は強酸で危険なので、そういった危険な薬品がなるべく机に直接かからないようにするため
Q2.全て 比重とは「ある物体の体積あたりの質量が、基準となる密度と比べたときの軽重」である。
① 乾燥剤として使われるが、吸湿性によるものであり、脱水性によるものでは無い。
② 酸化剤である。
③ エタノールはお酒に含まれているので飲めますが、メタノールは影響ありまくりです。飲んだら失明します。
時計反応編
Q1.② 構造中にヨウ素を含む物質はヨウ素デンプン反応をおこす。
Q2.② チオ硫酸イオンが(式4)の反応で消費されきった。
Q3.① チオ硫酸イオンが消費されきるまでの時間が長くなるため。②は律速段階である (式3)の反応速度が上がるため、全体の反応速度も上がる。③は温度が高いほど反応速度は上がるため間違い。④は時間を止めている間は反応が進まないため間違い。
錬金術編
Q1.②
Q2.④、⑥
Q3.③ ②が最もらしいが、化学部のガスバーナー程度の温度では起こらない。急冷することで、より綺麗になる。
ワンポット反応編
Q1.③ 物質名をつける際に「n個の○○」という性質を表す際には、ギリシア語で表すこ とになっている。モノ(1)、ジ(2)、トリ(3)...と続き、ヘキサ(hexa)が「6 個の」を表す。
Q2.① グリーンケミストリーとは、化学製品が生産から廃棄までに生態系に与える影響を抑え、その上で経済的効率の向上を図る動きがあり、それに対してアメリカ環境省(EPA)が用いている用語である。② WHO は世界保健機関、③ UNIDO は国連工業開発機関、④ OECD は経済協力開発機構である。OECD は、生態系の影響の抑制とリサイクルによる資源の節約によって持続成長可能な産業を目指す、「サスティナブルケミストリー」という政策を提唱しており、日本ではグリーンケミストリーとセットで扱われることも多い。
ルミノール反応編
Q1.③ ルネッサンスとイルミネーションも好きですが(個人の感想です)、今回の答えは化学ルミネセンスです。ぜひ調べてみてください。
Q2.① 血液中の鉄を含むヘムという物質を触媒として、ルミノール反応を起こすことができます。ただ、実際には他の物質を触媒としても反応しやすいので、DNA 鑑定などと併用されるようです。
Q3.③ 硫酸銅五水和物は青色です。ちなみに硫酸銅の粉末は白色、塩化銅の粉末は緑色です。
この記事が気に入ったらサポートをしてみませんか?