
構造式【改】
※期間限定無料。本記事は電子書籍出版後に有料記事になります。予めご承知おきください。2021/8月現在
原子間で共有された1組の共有電子対を1本の線で表した化学式を 構造式 といいます。例えば、塩化水素分子HClは、次のように表します。

水素原子は不対電子を1つ、塩素原子は不対電子を1つもっています。よって、共有結合したときは 共有電子対が1組できます。これを1本の線で結びます。これが 単結合 です。単結合 は、1組の共有電子対で結ばれた結合です。
次に、二酸化炭素分子CO2 です。

酸素原子O は、電子対を2組、不対電子を2つもちます。炭素原子C は、不対電子を4つもちます。よって、C 原子とO 原子2つが結びついた時、2組の共有電子対が合計2つできる ことになります。この2組の共有電子対は2本の線で表され、二重結合といいます。二重結合は、2組の共有電子対で結ばれた結合です。
窒素分子N2は、次のようになります。
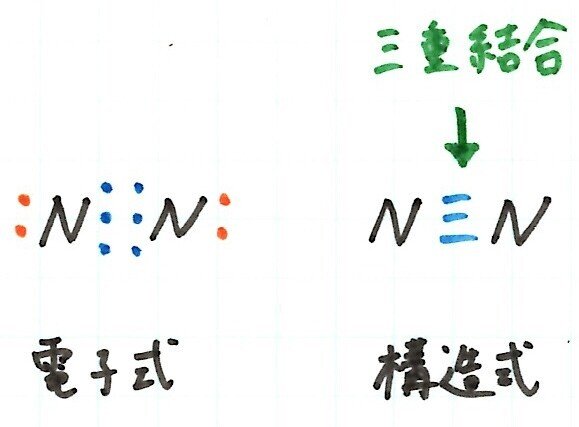
窒素原子N は不対電子を3つ、電子対を1つもちます。N 原子2つが結合したとき、共有電子対は3組できることになります。これを3本の線で表し、三重結合 といいます。三重結合 は、3組の共有電子対で結ばれた結合です。
まとめ
〇構造式・・・原子間で共有された1組の共有電子対を1本の線で表したもの
〇単結合・・・1組の共有電子対で結ばれた結合
〇二重結合・・・2組の共有電子対で結ばれた結合
〇三重結合・・・3組の共有電子対で結ばれた結合
この記事が気に入ったらサポートをしてみませんか?
