
コロナウイルス進化論 (オミクロン以外も変異考察)
以前「オミクロン変異考察」の記事で、新型コロナウイルスオミクロン変異株の変異の入り方は中立進化の法則に従っていないというお話をしました。その後、私は新型コロナウイルスのオミクロンを含む代表的な7つの変異株についてより詳細な解析を行いました。結果わかったのは、S変異が極端に少ないのはオミクロンだけではなく他の変異株でも同様だという事です。この特徴はとりわけ変異株のスパイクタンパクに共通しています。遺伝子解析の上では、新型コロナウイルス変異株は揃って進化の法則に従っていません。つまり、オミクロンだけではなく、解析した新型コロナウイルス変異株の全てが人工ウイルスである事が強く疑われるという事です。以下で詳しくお話ししていきます。
この解析につきましては論文形式としてまとめ、現在プレプリントサーバにアップロードしています。原文をお読みになりたい方は以下からアクセスしてください。
Mutation signature of SARS-CoV-2 variants raises questions to their natural origins.
Hiroshi Arakawa
https://zenodo.org/record/6601991#.YpcWvy0su2w
SARS-CoV-2のいわゆるオミクロン株は、ボツワナで初めて確認され、2021年11月24日に南アフリカから世界保健機関 (WHO) に報告されました。オミクロンはスパイク遺伝子に多くの新規変異を有しています。そしてその新たな変異の多さから、オミクロンは既存のコロナワクチンによる免疫反応を効果的に回避する事が懸念されています。
本来ウイルスの進化に変異はつきものです。しかしオミクロンはあまりにも唐突に多くの変異を獲得しており、一体どのように進化してきたのかが科学者の間で議論となりました。そしてオミクロンの起源に関して、以下のようにいくつかの仮説が立てられました。1) コロナに慢性的に感染している免疫抑制患者で発生した、2) ウイルス監視のインフラがほとんどない地域で数ヶ月かけてゆっくりと進化した、3) オミクロンはヒト以外の宿主で進化し、新しい変異のレパートリーを持って再びヒトに流出した、などです。しかし、どの仮説にもそれぞれ問題点があります。
もし、1) のようにオミクロンが免疫抑制患者で進化したのであれば、他の変異も生じて感染力はむしろ弱くなるでしょう。しかしオミクロンはむしろ感染力が強い事で知られています。また、3) のようにもしオミクロンが新しい動物を宿主として進化したのであれば、やはりヒトからヒトへの高い感染力を説明しにくくなります。さらに、新型コロナウイルスが世界的にじゅうぶん注目されている事を考えると、 2) のようにオミクロンが数ヶ月もの間誰にも発見されずに進化できたような、十分に大きく、かつ調査されていないコミュニティが存在するとも考えにくいのです。
さらに、オミクロンがコロナワクチン接種者の間で高い感染率と感染力を持つ事を考えると、オミクロンの突然変異はワクチンによる免疫を回避するような進化を受けたと考えられます。もしオミクロンが動物や未警戒の地域社会、あるいは免疫抑制された患者の中で進化していたのならば、ワクチンによる免疫を回避するようなウイルスの選択圧はほとんどなかったでしょう。オミクロン変異体がマウスで進化した可能性を示唆する論文も発表されてはいるのですが、マウスに効率よく感染する事を示すような実験による根拠は見当たりません。
オミクロンの起源を調べるには、それが自然な進化の中で発生したものであるかどうかを検証する必要があります。進化論の根幹となる法則は2つ。「ダーウィン進化論」に加え、木村資生が唱えた「中立進化論」です。中立進化とは、分子レベルでの遺伝子の変化は大部分が自然淘汰に対して有利でも不利でもなく (中立的)、突然変異と遺伝的浮動が進化の主因である、とする学説です。
分子レベルでの遺伝子の進化は単純な弱肉強食の「強ければ生き、弱ければ死ぬ」ではありません。塩基配列が変化してもアミノ酸の配列に影響しない場合があります。こうした変異を同義置換 (Synonymous substitution) (またはサイレント変異 (Silent mutation)) と呼びます。ここではS変異と呼ぶ事にします。S変異はアミノ酸配列が同じでも集団内に遺伝的多様性を生み出します。S変異に対して、アミノ酸配列を変化させる変異は非同義置換 (Nonsynonymous substitution) (または置換型変異 (Replacement mutation)) です。ここではN変異と呼ぶ事にします。
タンパクのアミノ酸配列はコンピュータのプログラムのようなものです。そして、それぞれのアミノ酸は3つずつのRNA配列を翻訳してできるもので、それらがタンパク上の「文字」に当たります。プログラムの文字列をランダムに変えてしまった場合、そのプログラムは機能するでしょうか? ましてや改善する事はあるでしょうか? ほとんどの場合、文字の変更はすなわちプログラムの機能を失わせる事になるはずです。この文字を変える事に当たる変異がN変異、同じ文字での置き換えがS変異です。
さて、オミクロンを含むコロナ変異株には、それぞれに変異、欠失、挿入が起こっています。データベースには膨大な数の各変異株の配列が登録されており、最初の問題は、遺伝子解析のためにデータベースの中からどの配列を選ぶかという事です。変異株が出現してから後に蓄積した変異をどう判断するかも難しい問題です。そのため、それぞれの変異株の祖先型の遺伝子を解析する事が理想的となります。
今回の解析にあたり、まずは各変異株の祖先型の配列を定義する事にしました。各変異株について、最も古くに採集されている配列を10ずつGISAIDデータベースからダウンロードしました。そして、それらに共通している配列から、各コロナ変異株の祖先型を同定し、プロトタイプ (原型)、つまり「プロト変異株」と名付けました。

図1は分子系統樹です。横軸は進化的距離で、遺伝子配列の0.1%の違いの長さを併記してあります。分子系統樹からわかるように、それぞれの「プロト変異株」は武漢コロナウイルス、つまりプロト・武漢の子孫です。
まずは、プロト・武漢の配列をSARS-CoV-1、RaTG13と比較してみました。SARS-CoV-1はSARSを引き起こしたコロナウイルスであり、コウモリコロナウイルスRaTG13はSARS-CoV-2の起源の一つであると考られています。
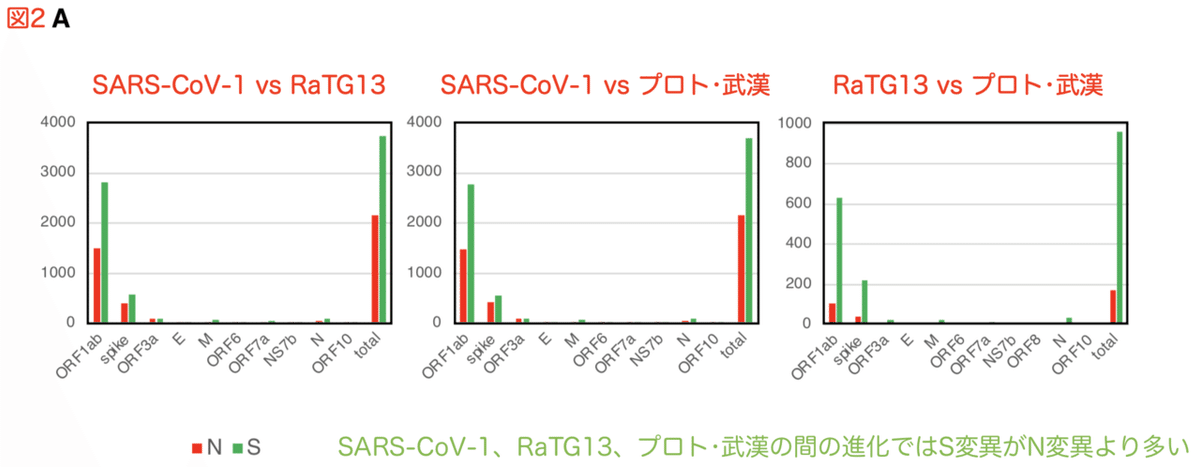
グラフの横軸は遺伝子です。コロナウイルスのタンパクをコードする遺伝子の読み枠 (オープンリーディングフレーム、ORF) は10あります。縦軸は変異の数です。赤はN変異、緑はS変異。それぞれの遺伝子ごとにN変異、S変異の数を数えました。
武漢型はSARS-CoV-1と比較すると、N変異、S変異を合わせて5000以上の変異があります。武漢株の祖先型とされるRaTG13からも武漢型は1000以上の変異が入ってます。ORF1abで変異が最も多く、次にスパイクタンパク (spike) で変異が多い事がわかります。ORF1abが他の遺伝子よりも頻繁に変異しているのは、単純にORF1abの遺伝子サイズが大きいからでしょう。ORF1abは21.3 kbに及ぶ大きなORFであり、SARS-CoV-2ゲノム30 kbの71.2%を占めています。スパイク遺伝子は3.8 kbです。他の遺伝子、M、ORF6、ORF7a、ORF7b、ORF8、Nの大きさは小さいものです。
SARS-CoV-1、RaTG13、プロト・武漢の間の進化では、ほとんどの遺伝子でN変異 (赤) よりもS変異 (緑) の頻度が高いです (図2A)。基本的に突然変異はランダムであり、進化はその結果論です。アミノ酸配列を変化させるN変異の多くは遺伝子の働きを壊すものであり、N変異の多くは競争に負けて取り除かれます。一方、アミノ酸配列を変えないS変異は失敗とはみなされず、変異のトライ&エラーを繰り返すうちに蓄積されていくものです。このように、S変異がN変異よりも多いというのは、一般的に進化の過程で見られる事象です。ちなみに、こうした中立進化は自然な進化だけではなく、機能獲得実験のような人工進化でも同様に起こり得ます。

次にプロト・武漢からの各変異株への変異を見てみましょう。まずはオミクロンです。変異数の縦軸の数字に注目してください。変異が非常に多いとされるオミクロンですら変異は50程度です。私がコロナ変異株の遺伝子解析をした際の第一印象は「変異株の変異自体はむしろ意外にも少ない」でした。
変異のパターンについても見ていきましょう。オミクロンのN変異 (赤) 、S変異 (緑) の入り方 (図2B) は図2Aとは大きく異なっています。オミクロンのスパイクタンパクには30の変異があるのですが、そのうちS変異は1つしかありません。ここまでは以前にも「オミクロン変異考察」の記事内でお話ししました。
オミクロンの別の遺伝子も見てみると、S変異のほとんどはORF1abに集中しています (ORF1abの11個の変異のうち4個がS変異)。ORF1abを別にすると、オミクロンの全変異41個のうちS変異は5つだけです。
![]()

では、他のコロナ変異株ではどうでしょうか。全体的に赤が目立つのが見てとれます (赤 = N変異)。縦軸の数字から分かるように、他の変異株の変異はオミクロンよりは少ないものです。しかし、S変異が極端に少ない傾向は他の変異株でもオミクロンと同様です。
まず一見してわかるのは、変異が全く入っていない遺伝子が多いという事です。S変異はアミノ酸配列を変化させず表現形にほとんど影響しませんので、S変異はウイルス進化の過程で自然に蓄積するものです。S変異すら入っていない遺伝子が多いのは奇妙です。
オミクロンとラムダでは、S変異はスパイク遺伝子上に1つだけ存在しました。各変異株のS変異のほとんどはORF1ab上に位置していました。そこで、各変異株の突然変異量からORF1ab上の変異を除いたものを比較してみました。それぞれのグラフの右端にあります (total-ORF1ab)。ORF1ab上の変異を除くと、N (赤)/S (緑) 比は、それぞれの変異株で非常に高くなりました。特に、プロト・デルタとプロト・ミューは、ORF1ab以外にはS変異がありませんでした。
さて、遺伝子はACGTの数によって大きさは異なります。また、コドンによってはS変異が起きやすい、N変異しか起きない、といった場合もありますので、コドンによってもN変異、 S変異の起こる頻度は異なります。そのため、異なる遺伝子の間で中立進化の度合いを比べるためには、変異を標準化する必要があります。

例えば、LeuコドンTTAを例にして考えてみましょう。LeuコドンTTAに1塩基の置換が起こった場合、どのような変化につながるのか? TTAのうち最初のTの変化が3通り、二番目のTの変化が3通り、三番目のAの変化が3通りの合計9通りです。このうち、7つはアミノ酸配列を変えるN変異、2つはアミノ酸配列を変えないS変異です。このように、コドンTTAの3ヌクレオチドは、7/3ヌクレオチド(=3ヌクレオチド×7/9) のN部位と2/3ヌクレオチド (=3ヌクレオチド×2/9) のS部位からなります 。
変異の頻度はN部位あたりのN変異数 (Ka) とS部位あたりのS変異数 (Ks) の比として標準化する事ができます。KaとKsは、この方法を最初に考案した論文で使われた用語がその後定着したものです。遺伝子の大きさは異なりますし、遺伝子によって使用コドンも異なりますが、Ka、Ksによって標準化する事で、異なる遺伝子のN変異、S変異の率を比較できるわけです。ちなみに、標準化の定義からして、選択圧がなく、突然変異がランダムに導入される場合、KaとKsの比は1になります。

SARS-CoV-1、RaTG13、プロト・武漢間の進化を見てみましょう (図3A) 。Ka、Ksを用いて標準化すると、大きな遺伝子も小さな遺伝子も同じ基準で比較できますし、N変異、S変異の比較がしやすくなるのです。今度は全体的に緑が目立つのが見てとれます。このように、ほとんどの遺伝子でKs (S変異率、緑) がKa (N変異率、赤) よりもはるかに高くなっています。これは中立進化が起こっている根拠となります。上でも触れましたが、アミノ酸配列を変える変化は競争に負ける事が多く、進化の過程で蓄積しやすい変異は圧倒的にS変異の方なのです。
![]()

では、各コロナ変異株ではどうでしょうか。ここで注目すべきはORF1ab、及びスパイクの遺伝子です。ORF1abのKaは、プロト・デルタを除くすべての変種においてKsより一貫して低い値でした。逆に、スパイク遺伝子のKaは、すべてのプロト変種において、そのKsよりもはるかに高いのです。Ka、Ksにより補正する事で、スパイクタンパクの変異の特殊性が浮かび上がってきます。つまり、コロナ変異株のスパイク遺伝子では中立進化は起こっていないのです。
特定の変異株の遺伝子次第ではKs (緑) が高い場合もあります。小さい遺伝子 (M、ORF6、ORF7a、ORF7b、ORF8、N) では、たった1つの変異でもKaとKsの値が大きくなってしまうという傾向があります。言い換えると、小さな遺伝子では時々S変異は起こっているという事です。
また、いくつかの変異株の特徴も見てとれます。プロト・デルタやプロト・ミューではORF1ab以外にはS変異が無いのです。これは進化の過程としては異常です。
では、なぜコロナウイルス変異株のスパイクタンパク遺伝子にはS変異がほとんど見られないのか? 理由を考えてみましょう。
例えば、「新型コロナウイルスのスパイクタンパク遺伝子ではすでにコドンが最適化しており、タンパク翻訳効率が最高レベルになっていた、そのためS変異を避けるような選択圧が働いたのではないか?」という意見。
ー いいえ、そのような事はないでしょう。これはコロナワクチンの遺伝子配列を確認するとわかるのですが、ファイザーとモデルナのRNAワクチンは完全長のスパイク遺伝子をコードしており、2つのプロリン置換を除いてアミノ酸配列は武漢型のスパイク遺伝子と同一です。これらのRNAワクチンでは翻訳効率を高めるために大量のS変異が使われているのです。すなわち変異株のスパイク遺伝子がS変異がほとんどないのは「すでにコドンが最適なものだから」という理由では説明できません。
では、「新型コロナウイルスではそもそもS変異が起きにくいような仕組みがあるのではないか?」という反論はどうでしょうか。
ー いいえ、これもSARS-CoV-1、RaTG13、プロト・武漢の間の進化を見るとわかりますが、これらのウイルス間の進化ではスパイク遺伝子でS変異率が高いのです (図3A)。変異株のスパイク遺伝子にS変異がない事 (図3B) はコロナウイルス進化の特徴とは言えません。
コロナウイルスのスパイクタンパクは細胞への感染を媒介します。スパイクタンパクはACE2受容体に結合した後、膜融合を媒介するフソゲンとして機能します。免疫を回避するためなら、アミノ酸置換は多いほどウイルスにとっては好都合かもしれませんが、フソゲン機能を維持するためにはランダムなアミノ酸変化を受け入れないはずです。
通常、遺伝子の突然変異と選択は段階的に起こります。変異が機能的に選択され、固定された後、次の突然変異と選択が続きます。N変異がタンパク質の機能を向上させる事は稀であり、有害な変異は進化の競争のうちに除去されるため、重要な遺伝子ではN変異の数は減少します。一方、S変異は表現型の変化を引き起こす事がほとんどないため、翻訳効率を極端に低下させない限り、一般にS変異は取り除く選択の対象にはなりません。
このように、S変異は進化の過程で蓄積される傾向があるのです。 S変異の蓄積スピードは異なる遺伝子間でも同程度であるため、S変異は近縁種が分岐してからの進化時間を計る分子時計として利用する事もできます。驚くべき事に、新型コロナウイルス変異株では、S変異はN変異よりも著しく低い頻度で起こっています。これはすなわちコロナウイルスのスパイク遺伝子の進化が進化論の法則に則らずに起こったという事を意味しています。さらに、S変異の分子時計の特徴から、スパイク遺伝子の変異はごく短期間に獲得されたという事もわかります。変異株のそれぞれの変異は、進化時間の上では非常に奇妙な事に文字通り「一瞬のうちに」獲得されているのです。
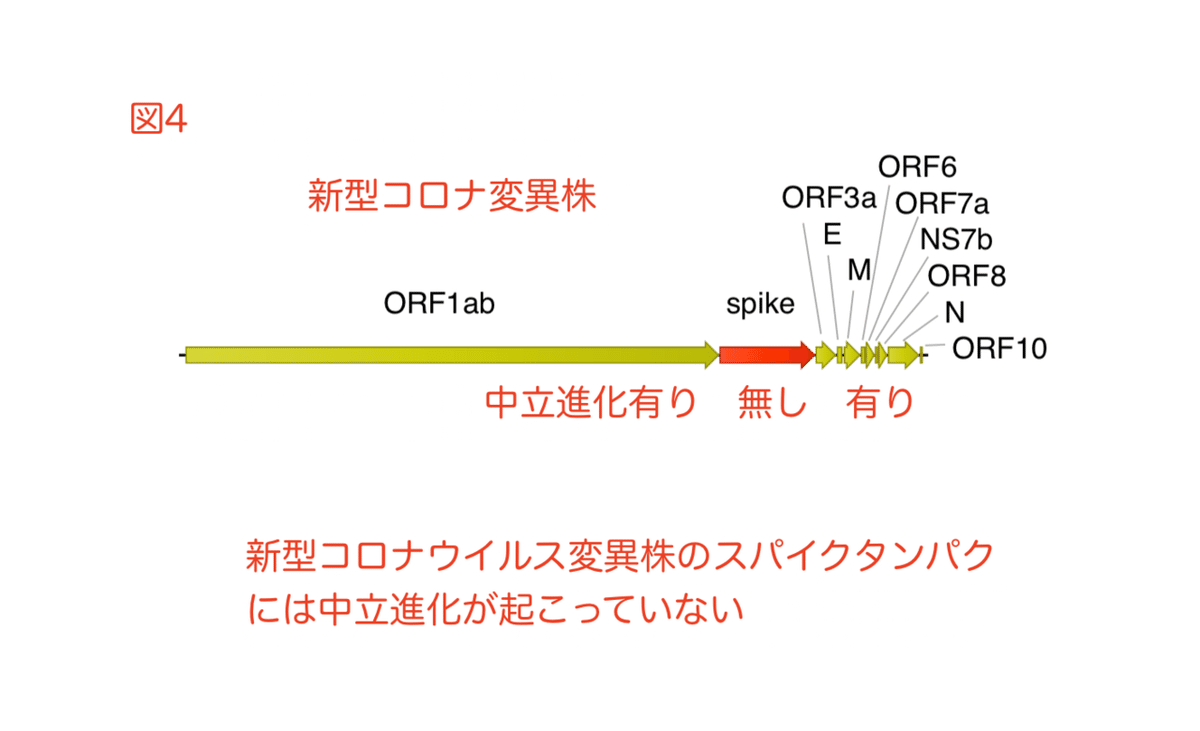
コロナ変異株は、高い感染率を維持しながら短期間に新しいスパイクタンパクを進化させた事になっています。これらの変異株のスパイク遺伝子は、コロナゲノムの他の部分とは対照的に、中立的な進化を受けていません (図4) 。タンパクを構成するアミノ酸は20種類。N変異は20択の選択問題で正解を当てるようなものです。極端な例はオミクロンのスパイク遺伝子であり、一度やり直しただけで (S変異)、つまり、20択の選択問題で29問連続正解 (N変異) を当てているわけです。突然変異はランダムですが、こうも当てずっぽうで連続して正解ばかり引けるものでしょうか。むしろ、特定の変異を持つスパイク遺伝子がウイルスゲノムに「人為的に挿入された」と仮定しないと説明が難しいのです。
プロトデルタとプロトミューの変異が全体的にN変異に偏っているように (図2、3) 、変異株によっては人工遺伝子の可能性があるのはスパイク遺伝子に限りません。専門知識と相応の設備があれば、分子生物学やゲノム編集などの技術で特定の変異を導入する事自体は難しくありません。
コロナウイルスにおける、スパイクタンパクのS変異の有無では変異株と武漢株は対照的です。武漢株には確かに中立進化の跡が見つかるのです。では、それはなぜでしょうか。
武漢株が人工ウイルスであると疑われる理由は実際に複数あります。1つはコロナウイルスが進化の過程でフーリン切断部位を突然獲得した事、さらにはこの配列がモデルナが2016年に特許を出願した遺伝子配列と共通している事も指摘されています。
また、そもそも新型コロナパンデミック発生の経緯自体も非常に奇妙です。2019年12月に新型肺炎の患者が中国の武漢で報道され、その後コロナ騒動が始まりましたが、SARS-CoV-2の塩基配列が決定され、このウイルスが肺炎の原因だとする論文がNature誌に投稿されるのに、最初の患者の発見からわずか1か月。通常だと数年かかってもおかしくないプロセスです。
つまり、武漢株の成立には機能獲得実験による人工進化が使われた可能性が非常に大きいという事です。実験室における人工進化でもランダムな突然変異と機能による選択の組み合わせが必要であり、N変異は競争に負ける一方、S変異は蓄積する傾向があります。ちなみに武漢株では、新型コロナウイルス作成のために人工進化が使われたと考えられますが、他のコロナ変異株では人工進化すら起こっていません。変異株の遺伝子配列上から見えてくるのは、あらかじめ決まった変異を人為的に導入されたものである、すなわち、デザインされたウイルスだと強く疑われるという事です。
機能獲得実験による人工進化の過程で、感染力や毒性を高めるような変異のカタログも作成できます。そうしたカタログを元にデザインされたのがコロナ変異株ではないでしょうか。変異株にもS変異を適当に散りばめる事によって、自然な進化に見せかける事も可能です。しかしその配列には不自然さを隠そうとした形跡すらありません。
オミクロン変異考察の記事内でも書きましたが、もしもこのウイルスが本当に人工のものならば、そもそも各国におけるコロナウイルスの流行すらも自然なものなのかどうかを考えてしまいます。その場合はもはや性善説に基づく常識的な科学や医学の判断だけでは対応できないでしょう。
#コロナワクチン
*記事は個人の見解であり、所属組織を代表するものではありません。
この記事が気に入ったらサポートをしてみませんか?
