
137)慢性炎症は寿命を短縮する
体がみるみる若返るミトコンドリア活性化術137
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【慢性炎症はがんの発生と老化を促進し、寿命を短縮する】
炎症は、生体が外部からの感染や化学物質などの有害な刺激に対して展開する防御反応の一つです。この反応は、病原体の排除、細胞の死や組織の損傷の原因となる要因の除去、そして組織の修復や再生を目的としています。
外傷や感染などに反応して急性炎症反応が起こります。急性炎症の特徴(症状)は白血球の組織への浸潤に伴う浮腫、発赤、発熱、痛みなどで、これらの反応にはアラキドン酸から生成されるプロスタグランジンやロイコトリエンなどの脂質メディエーターが関与します。
これらの物質によって好中球の浸潤や活性化、血管透過性の亢進などの炎症反応が起こります。異物の排除が完了すると炎症反応は速やかに消散し、組織の修復過程に移行します。
通常、急性炎症は数日で収束します。しかし、何らかの原因によって炎症が数ヶ月あるいは数年間続く場合があります。この慢性炎症は、自己免疫疾患、糖尿病、動脈硬化、変形性関節症など様々な原因で起こります。
慢性炎症は体内で活性酸素の産生を増やし、がんや生活習慣病の発生を促進し、さらに老化スピードを加速し、寿命を短縮することガ多くの研究で明らかになっています。

図:体内に慢性炎症が存在すると、活性酸素の産生がふえ、酸化ストレスが亢進して、生活習慣病やがん(癌)の発症を増やし、老化を促進し、寿命を短縮する。
体内の炎症の指標として血液中の白血球数があります。白血球は炎症反応で動員され、血液中に増えます。血液中の白血球数とがん死亡リスクが正の相関を示すことが複数の疫学研究で報告されています。以下のような報告があります。
WBC count and the risk of cancer mortality in a national sample of U.S. adults: results from the Second National Health and Nutrition Examination Survey mortality study.(米国成人の全国サンプルにおける白血球数とがん死亡リスク:第2回国民健康栄養調査死亡率調査の結果)Cancer Epidemiol Biomarkers Prev. 2004 Jun;13(6):1052-6.
この研究では、1976年から1980年までの30〜74歳の7,674人の第2回国民健康栄養調査(NHANES II)の参加者を対象に、1992年12月31日までの死亡率の追跡調査を行なっています。
年齢、性別、人種を調整した後、白血球数の上昇と総がん死亡率のリスクの上昇との間に関連性が観察されました。白血球数が上位4分の1の群と下位4分の1の群のがん死亡の相対リスクは2.23(95%信頼区間:1.53-3.23)でした。
喫煙、身体活動、肥満度指数、アルコール摂取量、教育、ヘマトクリット値、および糖尿病を調整した後でも、白血球数と総がん死亡率との関連は有意のままでした。白血球数が上位4分の1の群と下位4分の1の群のがん死亡の相対リスクは1.66(95%信頼区間:1.08-2.56)でした。
これは米国の疫学研究ですが、以下の論文はオーストラリアからの報告です。
Association between circulating white blood cell count and cancer mortality: a population-based cohort study.(循環白血球数とがん死亡率との関連:人口ベースのコホート研究)Arch Intern Med. 2006 Jan 23;166(2):188-94.
オーストラリアのシドニーの西にあるブルーマウンテン地域での登録時(1992年1月1日から1994年12月31日)でがんのない49歳から84歳の3189人の人口ベースのコホート研究です。主要評価項目は、2001年12月31日時点での全てのがんによる死亡率です。
その結果、循環白血球数が高いほど、すべてのがんによる死亡率が高いことが示されました。
年齢、性別、教育、BMI、ヘマトクリットレベル、アルコール消費量、身体的不活動、喫煙、毎週のアスピリン使用、糖尿病または空腹時高血糖状態、および空腹時血糖値を調整した比例ハザードモデルでは、すべてのがんの死亡率の相対リスクは、循環白血球数が上位4分の1の群(白血球数が7400細胞/ μL以上)と下位4分の1の群(白血球数が5300細胞/ μL以下)を比較した死亡率のハザード比は1.73(95%信頼区間:1.18-2.55)でした。
つまり、循環白血球数が高いほど、その後のがん死亡率が高いということです。循環白血球数は体内での炎症反応のレベルの指標と考えられるので、炎症ががん死亡率を高めることを意味しています。
【シクロオキシゲナーゼが炎症を促進する】
アスピリンやインドメタシンやスリンダクのような非ステロイド性抗炎症剤はシクロオキシゲナーゼ(Cyclooxygenase; COX)活性を阻害することにより炎症惹起性プロスタグランジンの産生を抑えて抗炎症作用を発揮します。
プロスタグランジンはアラキドン酸からシクロオキシゲナーゼ(COX)の働きにより合成される生理活性物質で、炎症の代表的なメディエーターです。
COXにはCOX-1とCOX-2の2種類のアイソザイムが知られています。この2つのCOXは約60%のアミノ酸配列の相同性をもっていますが、それぞれ生体内での役割が異なることが明らかになっています。
COX-1は胃や腸などの消化管、腎臓、卵巣、精嚢、血小板などに存在し、胃液分泌、利尿、血小板凝集などの生理的な役割を担います。
一方、COX-2はサイトカインや発がんプロモーター、ホルモンなどの刺激により、マクロファージ、線維芽細胞、血管内皮細胞、がん細胞などで誘導され、炎症反応、血管新生、アポトーシス、発がんなどに関与しています。(下図)

図:ホスホリパーゼA2(PLA2)の働きで、細胞膜のリン脂質からアラキドン酸が生成される。シクロオキシゲナーゼ(COX)はアラキドン酸からプロスタグランジンを合成するときに最初に働く酵素で、COX-1とCOX-2の2種類がある。COX-1から合成されるプロスタグランジンは生体の生理機能に必要なものであるが、炎症性の刺激でCOX-2から合成される大量のプロスタグランジンは炎症やがん細胞の増殖を促進する。
多くの消炎鎮痛剤にはシクロオキシゲナーゼ阻害作用がありますが、炎症やがんで増加するCOX-2だけでなく、消化管や腎臓や血小板などで生理的な作用をしているCOX-1も阻害するため、がんや老化の予防には使いにくい欠点があります。しかし、COX-2の選択的阻害剤であれば、副作用が少なくがんや老化の予防効果が期待できます。
セレコキシブ(Celecoxib)はCOX-2に選択的な阻害剤です。つまり、COX-1は阻害せず、炎症やがんで誘導されるCOX-2を選択的に阻害します。
1999年に米国でcelebrexという商品名で販売され、日本ではセレコックスという商品名で2007年6月に発売されています。関節リウマチや変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎、手術後や外傷後や抜歯後などの消炎・鎮痛の目的で保険適用されています。

図:炎症性刺激によってホスホリパーゼA2が活性化され(①)、細胞膜のリン脂質からアラキドン酸が生成される(②)。アラキドン酸は炎症刺激によって誘導されるシクロオキシゲナーゼ-2(COX-2)によってプロスタグランジンH2に変換され(③)、さらにプロスタグランジンE2が大量に産生される(④)。プロスタグランジンE2は疼痛や発熱などの炎症症状を引き起こす(⑤)。セレコキシブはCOX-2を阻害することによって、炎症反応を阻止する。
アスピリンなどの通常のNSAIDはCOX-1もCOX-2も両方とも阻害するため、生理的な作用をするために必要なプロスタグランジンの産生も抑制し、消化管粘膜の障害や腎臓障害などの副作用が問題となっていました。一方、炎症や発がん過程において誘導されてくるCOX-2のみを選択的に阻害する薬(celecoxibなど)は副作用が少ないので長期服用が可能なので、がんの化学予防剤として注目されています。
【シクロオキシゲナーゼ-2(COX-2)の活性亢進は老化を促進する】
慢性炎症は老化を促進します。シクロオキシゲナーゼ-2(COX-2)の活性亢進が老化を促進することが報告されています。以下のような報告があります。
Transgenic expression of cyclooxygenase-2 (COX2) causes premature aging phenotypes in mice(シクロオキシゲナーゼ-2(COX2)のトランスジェニック発現は、マウスの早期老化表現型を引き起こす)Aging (Albany NY). 2016 Oct 7;8(10):2392-2406.
【要旨】
シクロオキシゲナーゼ(COX)は、さまざまな生理学的プロセスを調節する脂質シグナル伝達分子であるプロスタノイドの生合成における重要な酵素である。COXのアイソフォームの1つであるCOX2は、さまざまな細胞性および環境性のストレスに応答して発現が誘導される。
COX2発現の増加は、多くの加齢性疾患の病因に関与していると考えられている。
COX2の発現は、老化したヒトやマウスの組織でも増加することが報告されており、これは、COX2が老化プロセスに関与していることを示唆している。しかし、COX2発現の増加が老化の原因なのか、それとも老化の結果なのかは明らかではない。
誘導性COX2トランスジェニックマウスモデルを作成することにより、この問題を検討した。
ここでは、COX2の出生後の発現が加齢に関連する表現型を誘導することを示す。
p16、p53、リン酸化-H2AXの発現はCOX2トランスジェニックマウスの組織で増加した。さらに、COX2トランスジェニックマウスの成体マウス肺線維芽細胞は、老化関連β-ガラクトシダーゼの発現増加を示した。私たちの研究は、COX2発現の増加が老化プロセスに影響を与えることを明らかにし、COX2とその下流のシグナル伝達の調節が加齢性疾患の治療のためのアプローチである可能性があることを示唆している。
慢性炎症は活性酸素の産生を増やして細胞や組織の酸化傷害を引き起こすことが、細胞の老化やがん化を促進する理由の一つです。
【アスピリンは抗がん剤による細胞老化を抑制する】
抗がん剤治療が老化を促進し、寿命を短縮することが明らかになっています。抗がん剤はDNAにダメージを与え、染色体のテロメアが短縮し、遺伝子発現を制御するエピジェネティクスの制御異常を引き起こし、ミトコンドリアの物質代謝やエネルギー産生などの機能を障害します。その結果、細胞の老化を促進し、組織の幹細胞が枯渇し、再生能力が低下し、慢性炎症が起こり、寿命を短縮するということになります。(下図)

図:抗がん剤はDNAにダメージを与え、染色体のテロメアが短縮し、遺伝子発現を制御するエピジェネティクスの制御異常を引き起こし、ミトコンドリアの物質代謝やエネルギー産生などの機能を障害する。その結果、細胞の老化を促進し、組織の幹細胞が枯渇し、再生能力が低下し、慢性炎症が起こり、寿命を短縮する。
抗がん剤は細胞に老化を起こす実験法として使用できます。アスピリンが抗がん剤による細胞老化を抑制する効果が報告されています。以下のような報告があります。
Aspirin ameliorates the long-term adverse effects of doxorubicin through suppression of cellular senescence(アスピリンは細胞老化の抑制を通じてドキソルビシンの長期的な副作用を改善する)FASEB Bioadv. 2019 Sep 9;1(9):579-590.
【要旨】
多くの小児がん生存者は、がん治療の晩期障害として、遅発性の副作用を発症する。小児がんの生存者の数が増え続けるにつれて、この遅発性副作用は小児がんサバイバーの健康関連の問題として重要になっている。
本研究では、ドキソルビシンを投与した幼若マウスの実験モデルを用いて、化学療法の晩期障害に対するアスピリンの効果を調べた。この新しいマウスモデルは、さまざまな長期的な悪影響をもたらし、そのいくつかは早期老化の表現型に似ている。
ドキシルビシンは、老化細胞の組織蓄積とシクロオキシゲナーゼ-2(COX2)発現の上昇をもたらした。しかし、ドキソルビシンを投与した若年マウスへのアスピリンによる治療は、体重増加を改善し、長期的な副作用を改善し、老化マーカーのレベルを低下した。
さらに、アスピリンは、ドキシルビシンで処理されたヒトおよびマウスの線維芽細胞におけるp53およびp21の蓄積を減少させた。
しかし、ドキソルビシン誘発p53蓄積に対するアスピリンの抑制効果はCOX2ノックアウトマウスの胚性線維芽細胞で有意に減少した。さらに、老化した線維芽細胞をアスピリンあるいはCOX2特異的阻害剤のセレコキシブで処理すると、細胞の生存率が低下し、Bcl-xLタンパク質のレベルが低下した。まとめると、これらの研究は、アスピリンが細胞老化の抑制を通じて化学療法の晩期障害を軽減できる可能性があることを示唆している。
以上のような研究から、抗がん剤治療後は、低用量のアスピリン(100mg/日)かセレコキシブ(1日100mgから200mg程度)の服用は、長期的な後遺症(心臓血管疾患や2次がんの発症)や寿命短縮を抑制できる可能性があります。
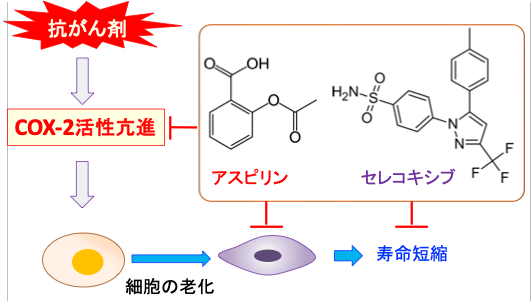
図:抗がん剤は老化細胞の組織蓄積とシクロオキシゲナーゼ-2(COX2)発現の上昇を引き起こして寿命を短縮する作用がある。非ステロイド性抗炎症剤のアスピリンとセレコキシブはCOX-2活性を阻害する作用によって、細胞老化の抑制を通じて化学療法の晩期障害(寿命短縮)を抑制できる。
【DHAとEPAは抗炎症性メディエーターの前駆体になる】
がん治療後の老化促進や発がん予防にアスピリンやセレコキシブを使うのはメリットがある可能性があります。ただ、副作用の心配もあるので、一般の人が老化予防で長期に服用するにはまだ検証が必要です。
魚油に多く含まれるオメガ3系多価不飽和脂肪酸のドコサヘキサエン酸(DHA)やエイコサペンタエンさん(EPA)には抗炎症作用や鎮痛作用があります。プロスタグランジンE2などの炎症を引き起こす物質を生み出すアラキドン酸がDHAやEPAに置き換えられ、炎症物質ができにくくなるのが一つの理由です。オメガ3系不飽和脂肪酸を多く摂取すると、細胞膜中のオメガ3系不飽和脂肪酸が増加してアラキドン酸が減少するので、アラキドン酸由来の炎症促進性物質の産生が低下するという機序です(下図)。

図:食事からω6系不飽和脂肪酸のリノール酸やアラキドン酸の摂取が多いと細胞膜のアラキドン酸(細胞膜の図の青で示す)の量が増え、プロスタグランジンE2の産生量も増え、炎症や老化やがん細胞の増殖・転移が促進される。ω3系不飽和脂肪酸のドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)の摂取量が多いと、DHAやEPA(細胞膜の図の赤で示す)がアラキドン酸と置き換わるのでプロスタグランジンE2の産生は低下し、炎症や老化やがん細胞の増殖・転移は抑制される。
外傷や感染などに反応して急性炎症反応が起こりますが、異物の排除が完了すると炎症反応は速やかに消散し、組織の修復過程に移行します。炎症反応が終了することを「炎症の収束」と言います。
炎症の収束は、これまで起炎反応の減弱化によると考えられてきましたが、最近の研究で、受動的なものではなく、能動的な機構であることが明らかになっています。
炎症の収束過程においては炎症性サイトカインの産生が抑制され、血管透過性が正常に戻り、好中球の遊走阻止や浸出液中のリンパ球の除去や、マクロファージによる死滅した細胞の除去などが起こります。この炎症の収束過程には、EPAやDHAなどのオメガ3系不飽和脂肪酸から体内で生成されるレゾルビンやプロテクチンという抗炎症性メディエーターが関与します。
つまり、DHAやEPAはアラキドン酸と競合することで炎症性ケミカル・メディエーターの産生を阻害するだけでなく、抗炎症性(炎症収束性)の脂質メディエーターを生成することによって積極的に炎症を抑制する作用があるということです。EPAやDHAの抗炎症作用や抗老化作用、がん予防効果、心血管保護作用、脳神経系保護作用など多くの作用に、EPAやDHAから代謝されて生成される抗炎症性の脂質メディエーター(レゾルビンやプロテクチン)が関与していることが明らかになっています。(下図)。

図:オメガ6系多価不飽和脂肪酸のアラキドン酸はプロスタグランジンE2やロイコトリエンなど炎症性メディエーターを産生して炎症や組織のダメージを悪化させる。一方、オメガ3系多価不飽和脂肪酸であるEPA(エイコサペンタエン酸)とDHA(ドコサヘキサエン酸)は代謝されて抗炎症作用を示す多様な脂質メディエーター(レゾルビン、プロテクチンなど)を産生することによって、慢性炎症や組織のダメージを軽減する効果を発揮する。
オメガ3系多価不飽和脂肪酸のDHAやEPA以外に、オリーブオイルや野菜、豆類、果物にも抗酸化作用や抗炎症作用の多い成分が見つかっています。地中海式食事は寿命延長に効果があると報告されていますが、その理由として、地中海料理は抗酸化作用と抗炎症作用のある食品を多く使うからと考えられています。
血液検査で白血球が高めの人は、抗炎症作用のある食品を積極的に摂取するように心がけるのが良いと思います。
この記事が気に入ったらサポートをしてみませんか?
