大腸菌の実験的進化 ~進化の鍵は1か所の変異~ 論文紹介
大腸菌の実験的進化 ~進化の鍵は1か所の変異~
論文名 Single mutation makes Escherichia coli an insect mutualist
一つの変異が大腸菌を昆虫の相利共生細菌にさせる
著者名 Ryuichi Koga, Minoru Moriyama, Naoko Onodera-Tanifuji, Yoshiko Ishii, Hiroki Takai, Masaki Mizutani, Kohei Oguchi, Reiko Okura, Shingo Suzuki, Yasuhiro Gotoh, Tetsuya Hayashi, Masahide Seki, Yutaka Suzuki, Yudai Nishide, Takahiro Hosokawa, Yuichi Wakamoto, Chikara Furusawa and Takema Fukatsu
掲載誌 natura microbiology
掲載年 2022年
リンク doi.org/10.1038/s41564-022-01179-9
カメムシを利用して大腸菌を実験的に進化させた2022年の論文です。
進化は次世代を残すときに様々な遺伝子の変異が起こり、環境などの選択を受けて、生き残った性質が次世代に遺伝していくことです。通常、遺伝子の変異は僅かなものですので、変異がある次世代が生き残ったとしても、その変異が表現型として明らかになることはありません。何世代にも渡って小さな変異が積み重なることで、表現型が変化すると考えられています。このように進化には非常に長い時間がかかります。そのため、実験的に生物を進化させるには、実験を行う側にも非常に長い時間が必要になります。例えば、京都大学では、暗闇の中でショウジョウバエを飼育することでどのような進化、遺伝子変異の蓄積が起きるのかという実験が行われていますが、1954年に実験が開始され、2012年に1400世代目のショウジョウバエを解析した研究結果が発表されています。そのため、進化を実験的に行う、再現することは非常に困難です。
本研究では、大腸菌を実験的に進化させることに成功しています。大腸菌は世代交代(増殖)が早く、低コストで大量に飼育できることから1920年代から実験動物として利用されており、DNAの複製や遺伝情報の発現制御機構などの全生物に共通する分子生物学の基本原理の研究に貢献してきました。もちろん大腸菌ゲノムは解析されており、遺伝子変異の導入などの遺伝子工学的手法を利用することができます。本研究で利用した大腸菌にはDNAミスマッチ修復酵素遺伝子に変異が導入されており、遺伝子変異が修復されないようにしてあります。これにより、進化に必要な遺伝子の変異確率を上昇させています。また、大腸菌は最短で20分で世代交代が起こるため、数千世代、数万世代目を解析することも可能になります。この実験デザインはよく考えられていると思います。
カメムシは共生細菌のための共生器官を持ち、細菌と相利共生関係を持ち、その共生細菌は親から子へと垂直伝播することが知られています(漫画「チャバネアオカメムシと共生細菌」参照)。本サイトでもこれまでにカメムシの共生細菌についての研究を紹介しています(カメムシの共生器官 ~バクテリアの家を作る~ 、ホソヘリカメムシの殺虫剤抵抗性 ~助け合いで生き残る~)。カメムシでは特定の細菌が共生細菌として共生していますが、それらを滅菌して大腸菌を取り込ませると、宿主の成長率が低下し、体色も茶色になるがなんとか生き残り、大腸菌も共生するという状態から、宿主の状態が改善する、つまり大腸菌が宿主との相利共生関係を確立するように実験的に進化させ、その際にどのような遺伝子変異が起こるのかということを明らかにしています。この宿主が死なないが成長が悪い、かつ大腸菌が共生しているという条件が非常に重要で、宿主が死んでしまっても、成長が良くても、大腸菌が共生できなくても実験は成立しません。論文には書かれていませんが、著者たちはこの条件を得るためにいろいろなカメムシを試したかもしれません。
本研究では、たくさん見つかった遺伝子変異のうち、炭素異化抑制経路に関わる2つの遺伝子に注目しています。炭素異化抑制経路ではいろいろな遺伝子の発現を制御しているため、その影響は広範に渡ると考えられます。具体的にどのような機能の変化がチャバネアオカメムシとの相利共生関係を確立させるためには必要なのか、その点については明らかになっていません。ある特定の機能だけに関わる遺伝子変異だけで、共生細菌への進化が起こるのかどうかは気になるところです。また、多数の遺伝子の発現制御に関わるメカニズムにおける変異が進化として一般的であるのかどうかという点も含めて、今後の研究を待ちたいと思います。
短期間で進化を実験的に起こさせることができ、それを解析できるというこの実験系は、進化を分子生物学的に理解する上で非常に有用で、興味深く思います。大腸菌以外の菌でも同じ条件であれば、同じように炭素異化抑制経路に関わる遺伝子に変異が起こり、共生細菌へと進化するのか、また、本研究結果が再現できるのかなど、興味が尽きません。今後の研究で明らかになれば非常に面白いと思います。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
チャバネアオカメムシの共生細菌ではない大腸菌を、チャバネアオカメムシに共生させると成長率の低下と体色の変化が見られたものの、共生は確立された。
DNAミスマッチ修復酵素遺伝子(mutS)の変異大腸菌をチャバネアオカメムシに共生させ、チャバネアオカメムシの成長または体色によって選択を行うことで、宿主であるチャバネアオカメムシの成長と体色に改善が見られた。
宿主の成長と体色の改善がみられた大腸菌では、共生初期の大腸菌とは遺伝子発現パターンが異なっていた。
宿主の成長と体色が大きく改善された前後の大腸菌のゲノムでは、炭素異化抑制経路に関わるアデニル酸シクラーゼ遺伝子(CyaA)やcAMP受容体たんぱく質遺伝子(Crp)に変異が見られた。
CyaAまたはCrpに変異を導入した大腸菌をチャバネアオカメムシに共生させると、成長率および体色が改善された。
CyaAまたはCrpの変異が、大腸菌をチャバネアオカメムシの相利共生細菌へと進化させた。
[背景]
寄生から片利共生を経て相利共生までの広範な関係性を持つ共生微生物は、生物多様性を支える大きな進化的原動力の一つです。しかし、もともとこのような共生微生物は、宿主生物との関わりを持たず、はじめは環境微生物に由来していました。通常の自由生活をしていた微生物が、どのようにして洗練された共生種になったのかは、重要な課題ですが未だ解決されていません。この根本的な問題を解決するために、実験的な進化学的アプローチが貴重な知見を与えてくれる可能性があります。もし、精巧な分子遺伝学的手法と潤沢な遺伝学的情報がある大腸菌のようなモデル微生物が、実験的進化によって宿主生物と相利共生関係を築くことができれば、そのような「モデル実験共生系」は、相利共生に向けた共生の進化過程を理解するために非常に有用なものになります。近年、チャバネアオカメムシは、共生細菌の多様性や進化、腸内共生のメカニズムを調べるための実験的に扱いやすいモデルシステムとして浮上しています。本研究では、大腸菌がチャバネアオカメムシの生存と繁殖を支援する細菌性共生種に進化する実験系を構築し、包括的な転写制御システムの破壊によって共生の進化が非常に容易かつ迅速に進行することを実証しました。
[結果]
大腸菌は潜在的にチャバネアオカメムシに共生することができる
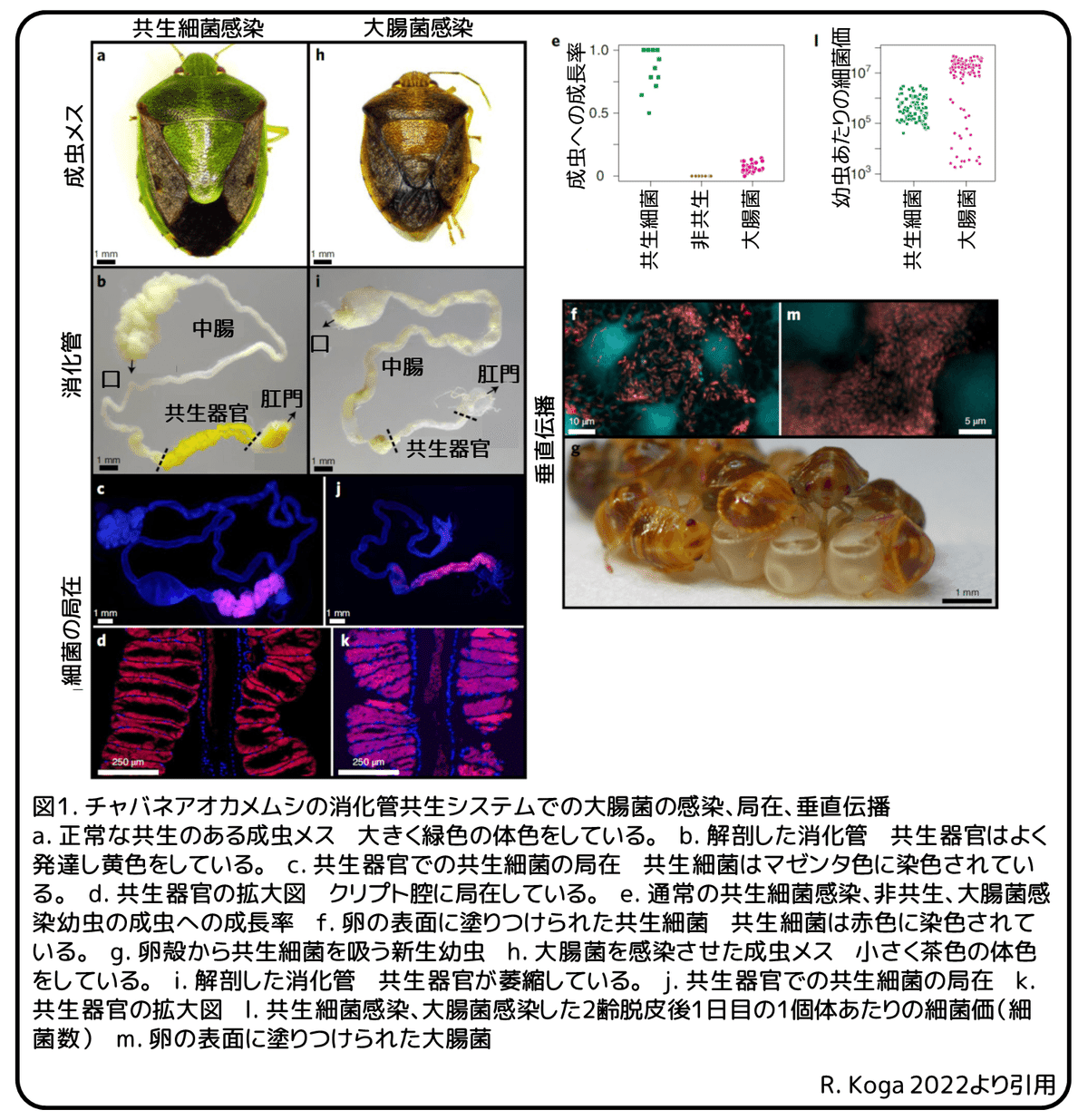
一般的に、植物の汁液を吸う異翅類昆虫は、必須アミノ酸とビタミン類の両方もしくは一方を自身の成長を生存のために提供してくれる特異的な共生細菌を中腸に持っています。チャバネアオカメムシは中腸の後方領域にたくさんのクリプトと呼ばれる特別な共生器官を発達させます(図1a、b)。クリプト腔にはPantoea属の特異的な共生細菌が密集して生息します(図1c、d)。共生細菌は宿主昆虫の成長と生存に不可欠です。非培養性の必須共生細菌であるPantoea sp.Aに感染した通常の昆虫は、70%以上が成虫へと成長し、産卵時に共生細菌を卵に塗りつけることで、ふ化時に幼虫が卵殻を舐めることによって共生細菌が垂直に(親から子へ)伝播します(図1e-g、動画1)。卵の表面を滅菌することで細菌を共生させられない昆虫は、成虫へ成長することなく死にました(図1e)。枯草菌やBurkholderia insecticolaはチャバネアオカメムシに感染し共生を確立することができません。一方で、滅菌した新生幼虫に大腸菌を植え付けたときは、成長の遅れと高い致死率を示すものの、5-10%が成虫へと成長しました(図1e)。成長した成虫は体長が小さく、体色が暗く、早死の傾向がありましたが、一部は生き残ることができ、交配して少数の卵を産みました(図1h)。これらの成虫を解剖し調べたところ、驚くことに、共生器官は退縮していたものの、まさにもともとの共生細菌のように大腸菌がクリプトに局在していることを発見しました(図1j、k)。さらに、大腸菌は卵殻に塗りつけられ、もともとの共生細菌と比較して伝播率と感染力は不安定でしたが、子孫へと垂直伝播しました(図1l、m)。これらの結果から、初期段階ではあるものの、大腸菌はチャバネアオカメムシに対して局所感染、垂直伝播、宿主の生存支援することができると考えられます。大腸菌がもともとの共生細菌であるPantoea属の細菌と同じ腸内細菌科に属していることを考えると、共生の初期段階を確立するための共生細菌の局在と感染にかかわるメカニズムを、大腸菌は利用することができる可能性があります。このような背景から、カメムシ科のカメムシでは、再獲得と置き換えを繰り返しながら腸内細菌科から腸内共生細菌が進化してきたように思われます。
超変異大腸菌を用いた実験的進化
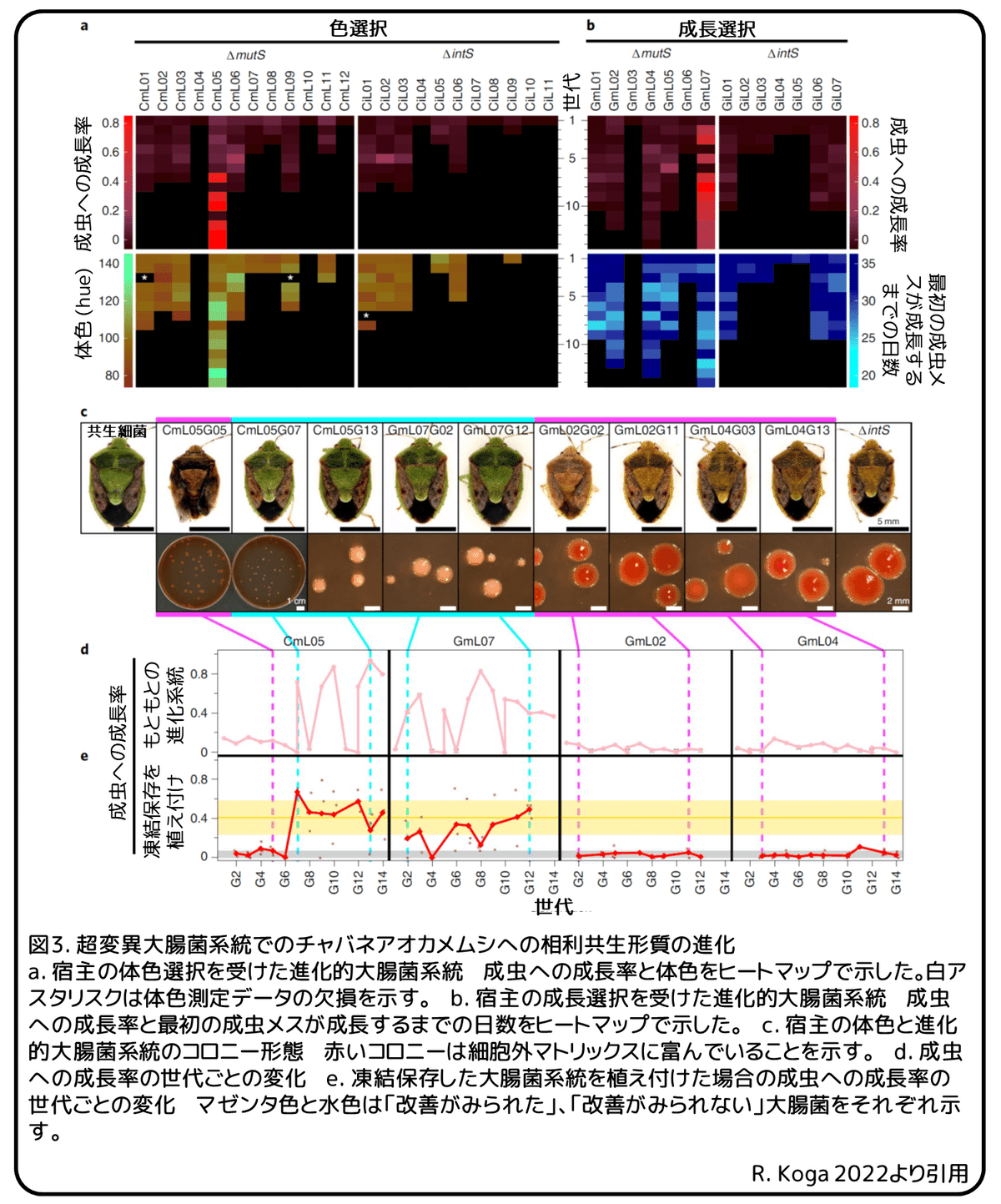
この発見によって、チャバネアオカメムシ-大腸菌間に実験的進化アプローチを行うことができるようになりました。継続的に大腸菌をチャバネアオカメムシに植え付け、それらを維持することで、大腸菌は共生に関連する形質を進歩させ、最終的に共生細菌に似た存在へと進化するのでしょうか?現実的な時間軸で緻密な共生の進化の観察は困難であることが予想されることを考慮して、DNAミスマッチ修復酵素遺伝子であるmutS遺伝子が機能せず、分子進化率が二桁上昇する⊿mutS株の超変異大腸菌を利用しました。同様の遺伝的背景を持ち、表現型に影響することのないインテグラーゼ遺伝子を機能しないようにした⊿intS株を対照群として利用しました。(補足:インテグラーゼは部位特異的組換え酵素のこと。)成長選択と色選択の2つの選択方法を採用しました(図2)。成長選択系統のGmL(超変異⊿mutS株)とGiL(対照群の⊿intS株)では、最初に成虫まで成長した個体から次世代に植え付けるために共生器官を取り出すと同時に冷凍保存しました。色選択系統のCmL(超変異⊿mutS株)とCiL(対照群の⊿intS株)では、最も緑色の成虫個体から次世代に植え付けるために共生器官を取り出すと同時に冷凍保存しました。一連の進化実験では、宿主昆虫を大量に飼育した同血統のチャバネアオカメムシ集団から提供することで、宿主の遺伝的背景は均質化し、大腸菌側の進化的変化のみに焦点を当てました。飼育環境下でチャバネアオカメムシの新生幼虫が成虫になるまでに約1ヶ月かかるため、理想的には1年間で12世代まで実験することが出来ます。しかし、実際は(1)大腸菌を植え付けたチャバネアオカメムシは一般的に高い致死率と成長の遅れを示し、(2)良好な環境下でチャバネアオカメムシを維持するために、密集させないように世話することが必要不可欠なため、進化系統ごとに50から100匹が管理できる限界であり、(3)その結果、世代時間が長くなり進化系統の確率的な絶滅が頻発したため、冷凍保存した大腸菌からやり直さなければならなくなり、約2年かかりました。

相利共生大腸菌の進化
色選択では、CmLで12系統とCiLで11系統、成長選択ではGmLで7系統とGiLで7系統を確立し維持しました(図3a、b)。対照群である⊿intS系統を感染させた系統は継続的に低い成虫への成長率を示しましたが、超変異⊿mutS系統を感染させた系統のいくつかはより多くの成虫への成長率を示し始めました。注目すべきは、色選択のCmL05系統では、成虫への成長率が7世代目に飛躍的に上昇し、その後、高い成長率を維持しました(図3a)。成長選択のGmL07系統では、成虫への成長率が早くも2世代目に改善され、その後、維持されました(図3b)。CmL05系統とGmL07系統では、成虫への成長率の改善と同時に、成虫の体色が暗色から緑色へと改善しました(図3a-c)。さらに、寒天プレートで培養した大腸菌のコロニーの形態が、細胞外マトリックスに富む大きく平坦なものから、細胞外マトリックスの少ない小さく凸状のものへと変化しました(図3c)。凍結保存されたCmL05系統とGmL07系統をチャバネアオカメムシに塗り付けることで、成虫への成長率の改善、緑色の体色、小さく凸状のコロニー形態が再現性を持って観察されました(図3d、e)。これらの結果から、いくつかの超変異大腸菌の進化的系統は、宿主昆虫に対する相利共生形質を持つように進化し、表現型の効果は、進化した大腸菌系統の遺伝的変化に起因することが分かりました。
相利共生大腸菌の形質
寒天プレートでのコロニーの大きさ、形状、細胞外マトリックスに加えて、培養した相利共生大腸菌CmL05系統とGmL07系統は、もともとの大腸菌株と比べて、低い成長率、小さい細胞、鞭毛運動の喪失、そして不安定な細胞の形というはっきりとした形質を示しました(図4a-c、5a-d、動画2-4)。宿主昆虫の体内では、CmL05系統とGmL07系統はもともとの大腸菌株よりも有意に高い感染密度を示しました(図5e)。これらの観察から、相利共生大腸菌系統は確かに様々な「共生細菌的」な形質を進化させたことが明らかになりました。


相利共生大腸菌のトランスクリプトミクス(転写科学)とゲノミクス(ゲノム科学)
色選択をしたCmL05系統の各世代から取り出した共生器官の欠片を使用してRNA配列決定を行い、得られたRNAデータから大腸菌由来の配列を抽出し解析を行いました。興味深いことに、宿主昆虫の表現型が改善した第7-14世代の大腸菌の発現パターンは、改善前の第1-6世代とは分離したクラスターになりました(図6a)。成長選択をしたGmL07系統では、同様に、改善後の第2-12世代の大腸菌の遺伝子発現パターンは、改善前の第1世代とは区別され、宿主昆虫の表現型が改善されなかったGmL02系統とGmL04系統とも区別されました(図6b)。これらの結果から、相利共生大腸菌の進化は遺伝子発現パターンの特異的で包括的な変化を必然的に伴っていると考えられます。
成長選択のGmL07系統と色選択のCmL05系統では、両系統にわたって、宿主昆虫の表現型が改善した前後で発現が下方制御された193遺伝子と上方制御された95遺伝子を調査しました。下方制御された遺伝子には糖や他のマルトース、リボース、ガラクチトール、トレハロース、マンノース、分岐鎖アミノ酸のような栄養素を輸送する遺伝子、グリオキシル酸回路遺伝子、脂肪酸分解遺伝子などの多くの代謝関連遺伝子を含んでいました。注目すべきは、細胞外マトリックス(Curli線毛)産生に関わる中心的な遺伝子が改善後に有意に下方制御されていたことです。(補足:線毛は細菌の細胞外構造体で、細胞外マトリックスからなる。Curli線毛は大腸菌の菌膜形成に関わっている。)これは宿主昆虫の改善と関連する大腸菌のコロニー形態の変化を説明しています(図3c)。
宿主昆虫に改善が見られたCmL05系統とGmL07系統と改善が見られなかったGmL02系統とGmL04系統を使用して、超変異大腸菌系統に多くの変異が蓄積していくことが分かるように、進化過程に沿ってゲノム配列を決定しました。宿主昆虫の改善と相関する候補変異を同定するために、CmL05系統の第7世代に現れ、その後の世代では固定された7つの候補遺伝子の変異と、GmL07系統の第2世代に現れ、その後の世代では固定された9つの候補遺伝子の変異を調査しました。

相利共生大腸菌での炭素異化抑制遺伝子の機能不全
これらの候補遺伝子の中で、CmL05系統での機能不全となったアデニル酸環化酵素(CyaA)に見られたフレームシフト変異とGmL07系統でのcAMP受容体たんぱく質(Crp)の機能的に重要なcAMP結合部位を変化させるロイシンからプロリンへの非同義変異に注目しました(図6c)。(補足:フレームシフト変異は遺伝子配列中に塩基の挿入や欠損がおこり、アミノ酸を指定する三つ組の読み枠がずれてしまう変異のこと。非同義変異は塩基の置換により指定するアミノ酸が変化する変異のこと。)それぞれ独立した進化系統で生まれたにもかかわらず、CyaAとCrpは大腸菌を含む多様な細菌で働く包括的代謝制御システムである炭素異化抑制(CCR)経路の重要な構成因子です(図6c)。大腸菌にとって、一次炭素源としてのグルコースが豊富にある際に、CCRの構成因子はグルコースによって抑制され、CyaAの不活性型である非リン酸化状態となり、細胞内のcAMPは低レベルに維持されます。グルコースが使い切られたときに、グルコースによる抑制はCCR構成因子のリン酸化とCyaA活性化によって解除され、その結果、細胞内cAMPは上昇し、cAMPのCrpへの結合が促進されます。結果的に包括的な転写制御因子であるCrp-cAMPは細菌ゲノム全体にわたって数百のオペロンを活性化または抑制化します。(補足:オペロンは1遺伝子または数遺伝子からなる同じ調節作用を受け同時に発現する遺伝学的調節単位。)これはCrp-cAMPレギュロンと呼ばれ、栄養不足や高密度な細菌環境に適応するために、細菌の代謝経路が他の炭素源を利用するように切り替わります。(補足:レギュロンは共通の転写因子あるいは共通の転写制御メカニズムによって制御される遺伝子の一群で、オペロンとは異なり、遺伝子群が必ずしも近接しているわけではない。)レギュロンのデータベースによると、大腸菌のCrp-cAMPレギュロンは上方制御される約390遺伝子と下方制御される約80遺伝子からなり、例えば、非グルコース糖の輸送体と異化酵素、細菌密度を感知するクォーラムセンシング誘導、細胞外マトリックスの生産の上方制御が含まれます。
CmL05系統のCyaA遺伝子の変異とGmL07系統のCrp遺伝子の変異の両方は、CCR経路を機能不全にします。非常に高密度で共生器官に大腸菌が詰まっていることを考えると(図1k)、少なくとも局所的に宿主昆虫内で栄養素が限定されている環境下にあるように見えます。もしそうであるならば、進化した大腸菌系統では、変異が起こる前にはCrp-cAMP転写制御因子は活性化されていますが、その活性は変異が起こった後には機能していないと予想されます。注目すべきは、CmL05系統のCyaA遺伝子の変異とGmL07系統のCrp遺伝子の変異が起こった後に下方制御された193遺伝子の内、55遺伝子がCrp-cAMPによって活性化されることが報告されていることです。CCR経路の機能不全によって下方制御されたと予想される、非グルコース糖の輸送体、炭水化物代謝遺伝子、クォーラムセンシング遺伝子、細胞外マトリックス産生遺伝子、転写遺伝子といったこれらの遺伝子はCmL05系統とGmL07系統で有意に下方制御されていました。
CCR経路遺伝子の機能不全は大腸菌を相利共生細菌にする
これらの変異が進化した大腸菌系統の相利共生の形質に関与しているかどうかを調べるために、野生型の遺伝的背景でこれらの変異を導入したCyaA遺伝子が機能不全である⊿cyaA株とcAMP結合部位のロイシンをプロリンに置換するよう操作を施したcrp221T>C株を用意しました。両変異大腸菌株は細胞外マトリックスが少ない小さく凸状のコロニーを形成し、成長率がわずかに低く、小さく、鞭毛運動の喪失が見られました(図7a)。これらの形質は宿主昆虫を改善させた進化した大腸菌であるCmL05系統とGmL07系統の特徴を全般的に想起させるものでした(図3c、4a-c、5a、b)。大腸菌の変異株を滅菌されたチャバネアオカメムシの新生幼虫に植え付けると、⊿cyaA株感染虫とcrp221T>C株感染虫の両方で、宿主昆虫を改善させた大腸菌進化系統に匹敵する成虫への成長率の上昇が見られ、対照群である大腸菌株と比較して有意に成長率が高くなりました(図7b)。さらに、⊿cyaA株感染虫とcrp221T>C株感染虫は宿主昆虫を改善させた大腸菌進化系統に匹敵する緑色がかった体色で、対照群である大腸菌株が感染した萎縮して茶色い体色の成虫と明確に区別できました(図7c)。一方で、⊿cyaA株とcrp221T>C株の感染密度は宿主昆虫を改善させた大腸菌進化系統には匹敵しませんでした。これらの結果から、驚くべきことに、CCRの包括的な制御システムを機能不全にする一つの変異が大腸菌を宿主昆虫であるチャバネアオカメムシとの相利共生細菌にすることが明らかになりました。

[考察]
本研究では、本来の共生細菌には匹敵しませんが、モデル細菌である大腸菌が宿主の共生器官に局在し、その子孫に垂直に伝播され、宿主の生存を支援する昆虫-大腸菌共生実験系を構築しました。大腸菌の超変異株を数世代に渡って宿主昆虫に感染させ、継代することで、いくつかの進化系統が急速に成虫の成長率や体色を改善したことから、実験室内で相利共生の反復進化の実現に成功しました。驚くべきことに、大腸菌の昆虫との相利共生細菌への進化は、細菌のCCR経路を集中的に機能不全にする一つの変異に起因していたことから、栄養応答性の包括的な転写制御因子が共生の成立に予想外の関与をしていることが明らかになりました。
この発見は、共生の進化可能性に光を当てるものです。精巧な相利共生は、従来考えられていたよりもはるかに容易かつ迅速に進化することができます。CCR経路の包括的な制御因子の不活性化は、共生の初期段階における極めて重要な進化的ステップである可能性が考えられます。共生器官内に高密度で詰まった共生細菌は、常に栄養不足に陥り、多大な代謝コストがかかり、共生関係が不安定になるCCR経路を恒常的に活性化すると予想されます。このときに、CCR経路の機能不全が共生を安定化させ、利益をもたらすでしょう。この発見は、共生生物ゲノムのサイズ縮小と転写因子の欠如という一般的な進化的傾向にも関連している可能性があります。CCR経路の機能不全は、Crp-cAMPレギュロンの下で活性化されている約400遺伝子の下方制御を引き起こします。これは大腸菌ゲノム全体の約10%を占め、遺伝子破壊、増幅・挿入、ゲノム内組み換え、リダクティブゲノム進化の潜在的な標的になります。(補足:リダクティブゲノム進化は細菌が制限的な状態になることで起こる大規模なゲノムの減少のこと。)推測になりますが、共生生物のゲノム進化の過程で、転写制御因子の不活性化とゲノムサイズの減少がこうして同時に進行した可能性を提案します。
一方で、チャバネアオカメムシのもともとの共生細菌はCCR経路の遺伝子を維持していますが、培養不能でゲノム中に数百の偽遺伝子が蓄積されていることが分かりました。(補足:偽遺伝子は通常の遺伝子に類似した配列を持ちながら発現することのない遺伝子のこと。)進化した大腸菌系統で観察されたCCR回路の機能不全は、チャバネアオカメムシとの共生に向けた複数ある進化の軌跡の一つである可能性があり、より大規模で長期的な進化実験によって他のメカニズムが明らかになると予想されます。
チャバネアオカメムシ-大腸菌間の実験的共生システムは、相利共生の進化過程とメカニズムをリアルタイムで直接観察し解析する手段を提供します。大腸菌は、4,000以上の遺伝子を含む450-550万塩基のゲノムを持ち、そのうち約70%が機能情報を持つ、最もよく理解されている細胞性生物の一つです。このような技術的・遺伝的資源が豊富なモデル細菌を用いた相利共生生物の実験的進化は、これまでアプローチできなかった共生の進化的側面を理解することにつながります。大腸菌はヒトやマウスなど脊椎動物の腸内細菌叢に普遍的に存在することから、昆虫-大腸菌間と無菌マウス-大腸菌間の実験進化システムを組み合わせることにより、脊椎動物と無脊椎動物の腸内共生のメカニズムの違いだけでなく共通性も追求することが可能になるでしょう。
よろしくお願いします。
