流産とスパイクタンパク質の関連性(本文とは別に)
記事
掲載日: 20 April 2021
SARS-CoV-2のスパイクタンパク質がシンシチウムを介したリンパ球の排除を規定する
概要
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)ウイルスは高い感染力を持ち,リンパ球減少症を引き起こすが,そのメカニズムはよくわかっていない。我々はここで、コロナウイルス2019(COVID-19)患者の肺組織では、多核の合胞体の中にリンパ球が入ったヘテロタイプの細胞内構造が広く見られることを示した。SARS-CoV-2のスパイク糖タンパク質の発現は、シンシチウムを生成するための迅速な膜融合(~45.1nm/s)を誘導するのに十分であり、この膜融合は、典型的なセルインセル構造を形成するために複数のリンパ球を容易に内在させることができ、内在した細胞の死につながることが明らかになったからである。この膜融合は、多塩基性のS1/S2切断部位内のバイアルギニンモチーフによって決定される。このモチーフは、ほとんどの高伝染性ウイルスの表面糖タンパク質に頻繁に存在する。さらに、抗ウイルス剤の候補は、スパイクの糖タンパク質のプロセッシング、膜融合、細胞内形成を効率的に阻害することができる。以上のことから、SARS-CoV-2の発症メカニズムの分子的・細胞的根拠を明らかにするとともに、COVID-19治療のための新規ターゲットを特定することができた。
はじめに
現在,コロナウイルス感染症2019(COVID-19)が大流行しており,世界の公衆衛生に多大な脅威を与えています。COVID-19は,重症急性呼吸器症候群コロナウイルス2ウイルス(SARS-CoV-2)[1,2,3]の感染によって引き起こされます。このウイルスは,SARS-CoVと中東呼吸器症候群コロナウイルス(MERS-CoV)という2つのよく知られた危険なヒトウイルスを含むβ型コロナウイルス・クレードの一員です[4]。SARS-CoV-2ウイルスは,SARS-CoVと系統的に類似しており(約76%のアミノ酸同一性),それが名前の由来となっている[1,2,3]。SARS-CoV-2は、SARS-CoVや他のβ型コロナウイルス群と比較して、感染力が非常に高く、特にG614変異体は、D614姉妹変異体よりもさらに感染力が高く、おそらくD614G変異がスパイク三量体の安定性に及ぼす二峰性の影響によるものと考えられており[5,6]、その根本的なメカニズムは、学術的にも社会的にも大きな関心事となっています。2020年11月26日の時点で、世界中で1,600万人以上の人がSARS-CoV-2に感染していることが確認されているが、SARS-CoVとMERS-CoVの患者は合わせて数万人程度しか報告されていない[7, 8]。この病気は、発熱(88%以上)、呼吸器症状(67%以上)に加えて、リンパ球減少(83%)が臨床症状として現れます[9]。COVID-19の臨床的特徴は詳細に明らかにされていますが、COVID-19の発病の分子的・細胞的メカニズムはほとんど解明されていません。
セルインセル(CIC)構造は、他の細胞の内部に1つ以上の生存細胞が存在することを特徴とするユニークな細胞構造の一種であり、幅広いヒトのがん組織で広く記録されている[10, 11]。セルインセル構造の存在は、クローン選択[12]やゲノム安定性[13, 14]を制御し、独立した予後因子として患者の転帰に大きな影響を与えることが実証されている[15, 16, 17]。一連のコア要素によって制御される活発な細胞間相互作用 [18,19,20]は、ホモタイプ(同じ種類の細胞間)および/またはヘテロタイプ(異なる種類の細胞間)のCIC構造を作り出す可能性があり[21,22]、どちらも一般的に酸性化した液胞内で内包された細胞を死滅させる[10,23]。ヘテロタイプのCIC構造の形成は、腫瘍において、Tリンパ球やネイチャーキラー細胞などの機能的な免疫細胞を消費することによる免疫回避のメカニズムを構成していると考えられていたが[24, 25]、感染症の発症など、他の疾患の発症におけるその意味合いについては、まだほとんど分かっていない。
今回、我々は、SARS-CoV-2の感染によって生じたシンシクシャが、浸潤したリンパ球を標的にして内在化し、CICを介して死滅させることで、COVID-19患者のリンパ球減少に寄与していることを明らかにした。さらに、SARS-CoV-2スパイク糖タンパク質の多塩基性S1/S2切断部位にあるユニークなバイアルギニンモチーフが、膜融合とシンシティア形成を指示することにより、このプロセスを制御することが可能であることが確認され、アルビドールのようないくつかの抗ウイルス剤候補によって効果的に阻害することができた。本研究は、これまで認識されていなかったSARS-CoV-2の発症メカニズムを明らかにし、COVID-19治療のための新しいターゲットを提供するものである。
結果
COVID-19肺組織切片における異型細胞間構造の有病率
COVID-19の肺組織6例の切片を調べたところ、E-カドヘリンやZO-1などの細胞間結合分子が陰性で、複数の核を持つ大型細胞の一種である合胞体が、10例に存在し、9例で流行していることがわかった(図1a、補足図S1)。このことは、COVID-19の剖検に関する過去の報告[26,27,28,29]と一致していた。興味深いことに、SARS-CoV-2のスパイク(S)糖タンパク質が陽性であることに加え(図1a)、かなりの数の合胞体が、リンパ球が発現する表面タンパク質であるCD45が陽性の細胞を取り囲んでいることも判明した(図1a-c)。これらのユニークな構造は、形態的には、リンパ球と腫瘍細胞の間に形成されるヘテロタイプのCIC構造に似ている。この病理学的現象は、リンパ球を排除することによる免疫回避の潜在的なメカニズムとして、さまざまなヒト腫瘍で一般的に記録されている[22, 24]。実際、4つの肺組織切片すべてにおいて、4分の3以上のシンシチウムにCD45陽性細胞が含まれており(補足図S1c)、各シンシチウムには平均して3〜4個のCD45陽性細胞が含まれていた(補足図S1d、e)が、これらは単核の非シンシチウム細胞では検出されなかった。さらに、シンシチウムとCD45陽性細胞を含むシンシチウムの両方の量は、患者の末梢血中のリンパ球の量と逆相関していた(図1d-f)。このことは、シンシチウムがリンパ球を内包する傾向があり、COVID-19患者のリンパ球減少に寄与していることを示唆している[9]。

CD45陽性細胞が内在するシンシチウムの代表的な画像(白矢印で示す)。白の破線は標的シンシチウムの形状を示す。
組織は、SARS-CoV-2のSタンパク質に対する抗体(緑)、
E-カドヘリンに対する抗体(赤)、CD45に対する抗体(マゼンタ)で
染色した。スケールバー。左の画像は50μm、中央の拡大画像は20μm、
右のマルチチャンネル画像は20μm。
COVID-19患者の肺標本におけるシンシア形成(b)、
およびCD45陽性細胞を内包するシンシア(c)の定量化。
d 入院中のCOVID-19患者の末梢血中のリンパ球の割合。
COVID-19患者の肺組織において、末梢血リンパ球は、合胞体数(e)
および合胞体に内包されたCD45+細胞によるcell-in-cell構造(f)と
負の相関を示した。紫のライナーのトレンドラインは、
すべての検査対象サンプル(n=14)のデータに基づいて予測したもので、赤のライナーのトレンドラインは、cell-in-cell構造(CIC+)を持つ
サンプル(n=10)のデータに基づいて予測したものである。
SARS-CoV-2のS糖タンパク質を発現させると、シンシチウムが形成される
SARS-CoV-2の感染とシンシチウム形成の因果関係を明らかにするために、SARS-CoV-2ウイルスを、ウイルス培養に日常的に使用されている細胞株であるVero-E6細胞に感染させた。予想通り、ウイルス感染から24時間後のS糖タンパク質陽性細胞では、多核の巨大シンシティアが容易に検出された(図2aおよび補足図S2a)。S糖タンパク質は、コロナウイルスの宿主侵入の決定因子であり、細胞の受容体結合を担うN末端S1フラグメントと、膜融合を促進する機能を持つC末端S2フラグメントに加工される[4]。SARS-CoV-2の感染が膜融合に及ぼす影響を絞り込むために,S糖タンパク質の細胞内受容体であるACE2を安定的に発現させた293 T細胞(293T-ACE2)にS糖タンパク質を発現させたところ,トランスフェクション後12時間で複数の核(最大で60個以上)を含む多数の大型細胞が容易に観察された(図2b)。融合プロセスを追跡するために、S糖タンパク質とLyn-EGFPを共発現させた293T-ACE2細胞を用いてタイムラプスイメージングを行い、細胞膜を標識した。その結果、Lyn-EGFPで標識された細胞膜の消失によって示されるように、隣接する細胞間で頻繁に融合イベントが観察され(図2c、補足動画S1)、最終的には多核のシンシチウムが生じた(図2a、b)。融合過程において、細胞の内在化に伴う融合イベントはほとんど見られなかった。このことから、SARS-CoV-2のS糖タンパク質は、融合促進タンパク質の活性化を介して他のウイルスの宿主侵入に一般的に必須であるエンドサイトーシス過程とは独立して、膜融合を開始することができると考えられる[30]。むしろ、SARS-CoV-2のS糖タンパク質が膜融合を開始するには、細胞表面への受容体の結合で十分である(補足図S2d)。さらに、このS糖タンパク質を介した融合は非常に迅速に起こり、ほとんどの融合は10分以内に終了し(図2d、e)、平均融合速度は45.1nm/s、範囲は9.7nm/sから108.7nm/sであった(図2f)。S糖タンパク質による合体誘導効果は、ACE2を発現させたHela細胞でも同様に確認された(補足図S2b、c)。これらのデータを総合すると、SARS-CoV-2の感染は、S糖タンパク質の発現を介して、エンドサイトーシスに依存しない迅速な膜融合をもたらすことがわかる。
図2:SARS-CoV-2のスパイクタンパク質を発現させると、急速な膜融合が起こる。

シンシクティア形成の代表的な画像。
細胞は抗SARS-CoV-2 S抗体で緑色に染色された。
コントロール:感染なし。スケールバー。
b 外因性SARS-CoV-2スパイク糖タンパク質、
Lyn-EGFP(細胞膜、緑)、H2B-mCherry(核、赤)を
発現させた293T-ACE2細胞で形成された
シンシチウムの代表的な画像。
c 外因性SARS-CoV-2スパイクタンパク質を発現させた
293T-ACE2細胞において、Lyn-EGFPシグナルの消失によって
示される動的な膜融合を示す一連の画像。
黄色の矢印は融合が起こっている場所を示す。
スケールバー:20μm。d 代表的な融合イベントを示す
タイムライングラフ。それぞれの青い線は1つの融合イベントを示す。
青丸は膜融合の開始を示す。赤い星は膜の融合が完了したことを示す。SARS-CoV-2スパイクタンパク質の発現によって引き起こされた膜融合の持続時間(e)および速度(f)の定量化。
シンシクティアがリンパ球を標的にしてセルインセル型の媒介死を起こす
急性T細胞白血病の子どもから分離したヒトリンパ芽球細胞株であるCCRF-CEMをmCherryを安定的に発現するように操作し、SARS-CoV-2のS糖タンパク質を導入した293T-ACE2細胞と共培養した。この共培養のサイトスピン解析から、シンシアは単核の293T-ACE2細胞とは対照的に、複数のCCRF-CEM細胞を容易に内包できることが示された(図3a)(補足図3Sa、b)。また、核数が多いシンクィティアやサイズが大きいシンクィティアほど、CCRF-CEM細胞を内在化させやすく(図3b、cおよび補足S3c-h)、内在化したCCRF-CEM細胞の数は、シンクィティアの核数と正の相関があった(図3d)。また、CCRF-CEMに加えて、これらのシンシアは、急性単球性白血病患者由来の単球細胞株であるTHP-1細胞、急性T細胞白血病患者由来のTリンパ球細胞株であるJurkat細胞、Bリンパ球細胞株であるRaji細胞など、複数の種類の白血球を効率よく内在化することができた。バーキットリンパ腫患者由来のBリンパ球細胞株であるRaji細胞、慢性骨髄性白血病患者由来のヒト赤血球細胞株であるK562細胞、および健康な男性から分離した末梢血単核細胞(PBMC)などが含まれます(図3e、f)。3e, f)。特に、8時間かけてタイムラプス顕微鏡で観察したところ、明らかな変化がなく内部に留まっている細胞や、少数の細胞分裂を起こしている細胞を除いて、内部に取り込まれた細胞は容易に細胞死を起こし、細胞膜マーカーであるLyn-GFPが徐々に失われ(緑矢印)、細胞体が収縮してしわくちゃになり(白矢印)、その後、死にかけている細胞からmCherryが拡散することで死体が分解されることがわかった(赤矢印)(Fig.3g、補足ムービーS2)。内包されたCCRF-CEM細胞の死は、24分から429分の範囲で、平均182分以内に起こった(図3h)。一方、Raji細胞やPBMCのような一部の細胞は、他の細胞よりも早く、高い割合で死滅した(図3h、i)。培養24時間後までに、293T-ACE2スパイク培養では、コントロール培養(293T-ACE2ベクター)と比較して、30%以上のPBMCが除去された(図3j、kおよび補足S3)。3j, kおよび補足S3i)、これはシンシクティア形成と正の相関があった(図3l)。また、体内に取り込まれたPBMCは、ほとんどがCD8陽性であり、CD4はあまり陽性ではなかった(補足図S4a、b)が、このパターンは患者サンプルでも確認された(補足図S4c)。これらの結果は、リンパ球(主にCD8+ T細胞)が合胞体によって効率的に除去されていることを示している。シンシティアを介したCIC形成が抗ウイルス治療の潜在的な標的であるかどうかを調べるため、タイムラプス顕微鏡を用いて、候補となる抗ウイルス化合物がこれらのCIC構造に及ぼす影響を調べた。フリンプロテアーゼの阻害剤(6-D-Arg)、カテプシンB/Lの阻害剤(E64D)、ライソゾームの酸性化の阻害剤(Con A, NH4Cl)、膜融合の阻害剤(Arbidol)など6種類の化合物を調べたほか、化合物ヒドロキシクロロキン(HCQ)についても検証した。図3mに示すように、穏やかな効果を示したE64Dを除いて、これらの化合物はS糖タンパク質によるRaji細胞の内在化を深く阻害し、この知見はPBMC細胞でも確認された(図3n)。これらのデータを総合すると、シンシティアはCICを介した死のためにリンパ球を効率的に内在化させることができ、COVID-19患者のリンパ球減少の一因となっている可能性があり、COVID-19治療としていくつかの抗ウイルス化合物による治療でこれを防ぐことができると考えられる。
図3:シンサイティアがリンパ球に取り込まれ、細胞内で死滅する。
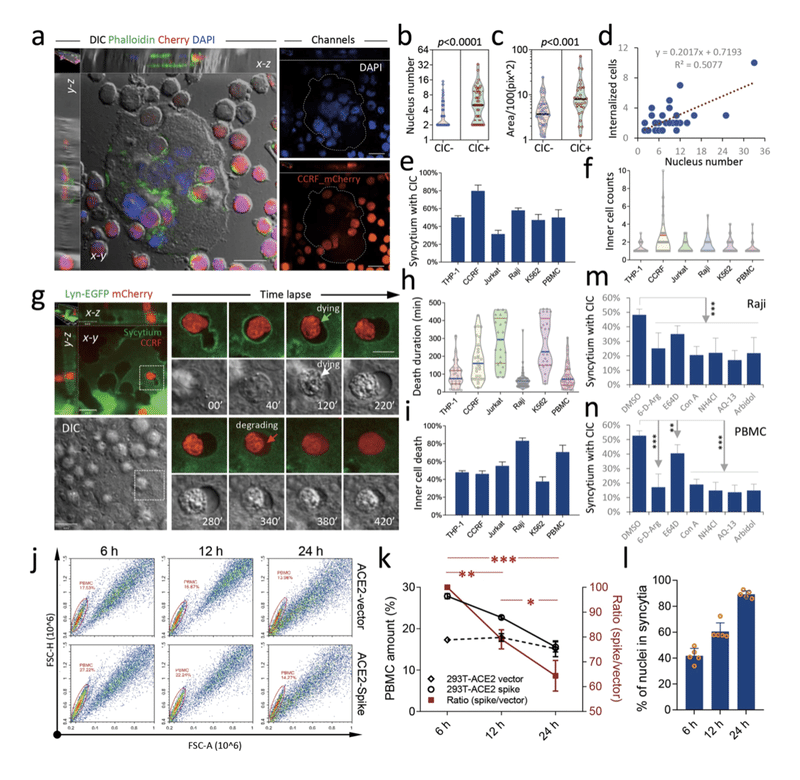
形成しているシンシチウムの代表的な画像。
細胞はファロイジン(緑)とDAPI(青)で染色した。
スケールバー:20μm。CCRF-mCherry細胞を内在化させた
(CIC+, n = 41)またはさせなかった(CIC-, n = 75)
合宿体の核数(b)と面積(c)をグラフで示した。
d 合宿体の核数と内在化したCCRF-mCherryの数には正の相関がある。
解析はスピアマン順位相関で行った。
n = 41。シンシクシャと指示された細胞の間に形成された
セルインセル構造における形成頻度(e)と内在化した細胞(f)の定量化。g シンシチウム内で内在化したCCRF-mCherry細胞が
死滅する様子を撮影した代表的な画像と画像シーケンス。
緑の矢印は内在化したCCRF-mCherry細胞が死滅していく様子を、
赤の矢印は内在化したCCRF-mCherry細胞が分解されていく様子を示す。スケールバー:左画像は20μm、右画像は10μm。hについては、
n(左から右へ)=それぞれ24、28、21、55、24、38。
データは、iについては、それぞれ50個以上の細胞内構造を
分析した10以上のフィールドの平均±SD。j PBMCと
293T-ACE2-ベクター細胞および293T-ACE2-スパイク細胞との
それぞれの共培養についての代表的なFCMグラフである。
k 共培養実験における指示された時間でのPBMCの変化の定量化である。
j 右のY軸は、2つの共培養実験(293T-ACE2-ベクターおよび293T-ACE2-スパイクそれぞれ)の間のPBMC比率である。
データは、3回の実験から得られた結果の平均±SDである。
**p < 0.05, **p < 0.001, ***p < 0.0001.PBMCを
293T-ACE2細胞に添加したのは、empryベクターまたは
スパイクコンストラクトをそれぞれトランスフェクションした
12時間後である。 l PBMC添加後の指示された時点での
293T-ACE2-スパイク細胞における合胞体形成の定量化。
データはそれぞれ5フィールド(20x対物レンズ)の結果の
平均±SDである。注:293T-ACE2-ベクター細胞では、
シンシティアは形成されなかった。
シンシティアとRaji細胞(m)、またはPBMC(n)との間に
形成される細胞内構造物の形成に対する表示化合物の阻害効果。
データは10フィールド以上の平均±SDで、各フィールドについて100個以上のシンサイティアを解析した。**p < 0.001, ***p < 0.0001.
シンシチウム形成における開裂前アミノ酸組成の重要な役割
興味深いことに、SARS-CoV-2のS糖タンパク質とは対照的に、ヒトにSARSを引き起こす遺伝的に隣接したコロナウイルスであるSARS-CoVウイルスによるS糖タンパク質の発現では、293T-ACE2細胞において膜融合とシンシチウムを有意に誘導することができないことがわかった(補足図S5a)。これは、SARS-CoVのS2領域がSARS-CoV-2のS2領域と非常に類似しており(96%以上の類似度、約90%のアミノ酸の同一性)(補足図S6)、トリプシン処理によって効果的に膜融合を媒介することができた(補足図S5b)ことから、膜融合を担うS2領域の違いによるものではないと考えられた。このことから、SARS-CoV-2のS糖タンパク質には、SARS-CoVのS糖タンパク質にはない、膜融合のための「スイッチオン」要素が組み込まれていると考えられた。このスイッチオン要素を特定するために、まず両者のS糖タンパク質のアミノ酸配列を比較した。SARS-CoV-2のS糖タンパク質には、SARS-CoVのそれと比較して4つの主要な挿入があった(補足図S6)。そのうちの3つは、受容体結合を担うドメインであるS1フラグメント内にあり、近縁のコウモリ(RaTG13)やセンザンコウ(PanCoV)のコロナウイルスと共通している。一方、4番目の4アミノ酸の挿入(PRRA)は、S1/S2切断部位の直前にあり(図4a)、SARS-CoV-2に特異的であると思われた(図4aおよび補足図S6)。そこで我々は、「PRRA」の挿入が、SARS-CoV-2のSを介した膜融合のスイッチになっているのではないかと考えた。この仮説を検証するために、RaTG13やPanCoVのS型糖タンパク質に類似した「PRRA」を欠失した変異体(2∆PRRA)を構築し(図4b)、293T-ACE2細胞で発現させた。その結果、「2∆PRRA」変異体は、合胞体を誘導する能力を完全に失っており(図4c、d)、このことは、「PRRA」が膜融合の観点から機能を獲得する挿入であることを示唆していると考えられる。この考えをさらに検証するために、SARS-CoV S糖タンパク質の「VSLL」をPSI-BLASTアルゴリズム(補足図S7a)を用いて予測した8アミノ酸の切断前モチーフ(QTNSPRRA)に置き換えて、「PRRA」を持つSARS-CoV S変異体(wPRRA)を作製した(図4b)。この「wPRRA」変異体は、SARS-CoV-2 Sと同様に効率的に合胞体を誘導することができたが、これにも「PRRA」の挿入が不可欠であり、「PRRA」を欠失させると、SARS-CoV Sの「wPRRA」変異体が獲得したプロフュージョン機能が効果的に消失した(図4c、d)。SARS-CoV-2 Sのプレ融合モチーフ(QTNSPPRA)をSARS-CoV Sの「VSLL」と交差置換した場合も、合胞体を誘導することができなくなった。驚くべきことに、融合促進表現型は、S2特異的抗体で検出された膜融合の実行者であるS2フラグメントの産生[4]と密接に相関していた。これらのデータは、膜融合のスイッチを入れる上で、「PRRA」の挿入が機能獲得の役割を果たしていることを裏付けている。
図4:膜融合は、S1/S2切断部位の前にある
バイアルギニンモチーフによって決定される。

コウモリコロナウイルス (2RaTG13), SARS-CoV-2の
S1/S2切断部位に隣接するスパイクタンパク質の配列を並べたもの。
矢印はS1/S2切断部位を示す。
b 表示された変異体の切断前の配列(青)。
赤字の「RS」はS1/S2切断部位を示す。
c 表示された変異体の発現による細胞融合の代表的な切り出し画像。
スケールバーは100μm。100μm。
示した変異体を発現させた場合のシンシティア形成の定量化(d)、
ウエスタンブロットで検出(e)。f SARS-CoV-2スパイク変異体は、
赤の "A "で示された単一または複合残基の置換、
またはH1N1またはH7N1の表面糖タンパク質からの
プレ開裂モチーフの配列を持つ。矢印はS1/S2切断部位を示す。
緑の影は切断に重要な2つのアルギニンを示す。
示した変異体を発現させた場合のシンシティア形成(g)の
定量化をウエスタンブロットで検出した(h)。
i SARS-CoV-2のスパイク単量体の3次元構造モデルを
2次構造で色分けしたもの。
拡大画像は、SARS-CoV-2スパイク(2S)、
またはH7N1変異体(H7)の切断部位の空間的な
残基パターン(fに示した0-4位)を、
目盛り付きのボールとスティックのスタイルで示している。
上の画像(2S)では、アミノ酸残基を番号で示した。
S1 RBD:S1フラグメントの受容体結合ドメイン、
S1 NTD:S1フラグメントのN末端ドメイン。
スパイクタンパク質の処理(j)およびシンシクティア形成(k)
に対する表示化合物の効果。データは、kについてそれぞれ4-5フィールド(20x対物レンズ)の結果の平均±SDである。
スパイク糖タンパク質のバイアルギニンモチーフがシンシチウム形成を規定する
さらに、前述の表現型の原因となるアミノ酸を特定するために、図4fに示すように、S1/S2切断部位の直前にある「PRRA」挿入部と、それに続くアミノ酸(R)に単独または複合的な変異を加えたSARS-CoV-2 S変異体を作製した。P681A変異体およびR683A変異体は、依然として効果的に合胞体を誘導することができたが、R682A、R685Aのいずれか、または両方を含む変異体は、合胞体を誘導することができなくなり(図4g)、これはS2生成の抑制と相関していた(図4h)。このことから、R683ではなく、R682およびR685がS糖タンパク質の切断と膜融合に必要であることが示唆された。これと一致するように、SARS-CoV-2 SのS1/S2切断部位の3D構造をモデル化したところ(補足図S7bおよびd)、R682とR685の側鎖はいずれもタンパク質の表面にあり、効率的な切断のためにプロテアーゼとの相互作用を促進すると考えられることがわかった(図4i)。一方、R683残基はタンパク質に埋め込まれており、到達する可能性は低かった(図4iおよび補足図S7d)。興味深いことに、SARS-CoV-2のS糖タンパク質に存在する同様のバイアルギニンモチーフ(RxxR)は、RSV、HIV、H5N3およびH7N1インフルエンザウイルスなど、感染力の強い他のウイルスの表面糖タンパク質の切断前部位にも確認されたが、H1N1のような感染力の弱い他の種のインフルエンザウイルスには確認されなかった(補足図S8)。このように、バイアルギニンモチーフは、表面糖タンパク質の切断を媒介することで、ウイルスの伝染性を高めるための保存された分子基盤である可能性がある。この考えと一致するように、H7N1表面糖タンパク質の切断前モチーフをSARS-CoV-2のS糖タンパク質に移植すると、感染力の低いH1N1ウイルスのモチーフとは対照的に、S2の産生とシンシチウムの形成を媒介することもできた(図4f、h)。実際、H7N1の開裂前モチーフの側鎖分布パターンは、SARS-CoV-2のS糖タンパク質の側鎖分布パターンと非常によく似ており(図4i)、一方、H1N1の開裂前モチーフは、RR*2AおよびPRR*3A変異体の側鎖の空間分布に似ていた(補足図S7d)。さらに、6-D-Arg、Con A、NH4Cl、Arbidol、hydroxychloroquine (HCQ)など、試験した抗ウイルス候補化合物のいくつかは、S2の産生とシンシチウム形成を効率的に阻害することができた(図4j、k)。
考察
SARS-CoV-2に感染すると、多核のシンシチウムが産生され、これがリンパ球を標的にして細胞内に取り込まれ、COVID-19患者のリンパ球減少と病因の一因となる可能性があることがわかってきた。これは、SARS-CoV-2のS糖タンパク質のバイアルギニンモチーフからなる「スイッチオン」要素によって決定され、S2融合フラグメントの産生を制御していた(図5)。抗ウイルス剤の候補化合物は、S2の産生、膜融合、リンパ球の内在化を効果的に阻害することができた。これらのデータは、バイアルギニンモチーフを標的とした戦略などにより、表面糖タンパク質の切断を阻害することが、SARS-CoV-2や、おそらくバイアルギニンモチーフを含む他の感染力の高いウイルスが引き起こす病状を緩和するための戦略となる可能性を示唆している。
図5:SARS-CoV-2によって引き起こされた、合胞体を介したセルインセル形成によるリンパ球減少の作業モデルを示したもの。

ウイルスのスパイク糖タンパク質が表面に発現する。
スパイク糖タンパク質は、プロテアーゼによる処理に必要な
バイアルギニンモチーフを持ち、膜融合を制御している。
スパイクタンパク質がその受容体であるACE2と結合すると、
ウイルススパイク糖タンパク質のS2ドメインを介して
隣接する細胞間で膜融合が起こり、多核のシンシチウムが生成される。
このシンシチウムは、リンパ球を標的にして細胞内に取り込まれ、
細胞間で死滅する能力があり、COVID-19患者の
リンパ球減少の一因になっていると考えられる。
PRRA」残基の挿入は,後続のアルギニン(R)とともに,ほとんど実験的証拠がないにもかかわらず,多塩基性のfurin切断部位を形成すると予測されていたことに留意されたい[31]。我々はここで、furin阻害剤である6-D-Argが、他の4種類の阻害剤ほど完全ではないが、S糖タンパク質のS2へのプロセッシングを有意に抑制し、膜融合を阻害することを示し(図4j、k)、SARS-CoV-2感染におけるfurinを介した切断の役割を支持した。一方,COVID-19患者に対するヒドロキシクロロキン治療の有用性については議論の余地があるが[32],その基礎となるメカニズムはほとんど推測されていないにもかかわらず,ヒドロキシクロロキンの抗SARS-CoV-2活性はしっかりと示されている[33, 34]。本研究では、ヒドロキシクロロキンが、S糖タンパク質のプロセシングと膜融合(図4j、k)、およびsyncytiaを介したcell-in-cellの形成(図3m、n)を強力に阻害することが予想外に確認され、COVID-19に対するヒドロキシクロロキン治療の分子的・細胞的根拠が得られた。実際、最近行われた2つのインシリコ研究では、ヒドロキシクロロキンがSARS-CoV-2のS糖タンパク質とその受容体との結合を直接阻害する可能性があると予測されている[35, 36]。これは、受容体との結合がS糖タンパク質のプロセッシングを促進し(図4e)、それがヒドロキシクロロキンによって効果的に阻害される(図4j)という我々のデータとよく一致している。このメカニズムをさらに検証することは、本研究の範囲外であるが、新しい抗SARS-CoV-2戦略の開発に役立つかもしれない。
注目すべきは、この原稿を作成している間に、BragaらがNatureで、COVID-19患者41人の死後サンプルに複数の核を持つ合胞体肺細胞が多く見られることを報告し、これはSARS-CoV-2のS糖タンパク質の融合活性に起因するとしたことである。そして、S糖タンパク質は、塩化チャネルと脂質スクランブラーゼであるTMEM16Fをアップレギュレートし、膜融合を促進することが判明した。ニクロサミドなどの化合物でTMEM16Fを標的的に阻害すると,S糖タンパク質による膜融合とシンシチウム形成を容易にブロックすることができ,COVID-19の治療にも関与していた[37]。彼らの結果は、S糖タンパク質によるシンシチウム形成がCOVID-19の病因の根底にある可能性があり、治療の標的になるかもしれないという本研究での我々の発見とよく一致している。
材料と方法
細胞培養および化合物
293 T、293T-ACE2およびHela-ACE2細胞は、10%牛胎児血清(Kang Yuan Biol, Tianjin, China)および1%Penicillin-Streptomycin(MACGENE Tech Ltd., Beijing, China)を添加したDMEM(MACGENE Tech Ltd., Beijing, China)で維持した。CCRF-CEM、Jurkat、K562、Raji、THP-1およびPBMC細胞は、10%ウシ胎児血清(Kang Yuan Biol、天津、中国)を添加したRPMI-1640(MACGENE Tech Ltd.、北京、中国)で培養した。すべての細胞は5% CO2で37℃で培養した。詳細は,細胞株については補足表S1,化合物については補足表S2を参照されたい。
コンストラクト
SARS Sタンパク質をpSecTag2-Hygro-Aで発現させたコンストラクトは,Cheng Cao博士(Beijing Institute of Biotechnology)からの寄贈品である。コドンを最適化したSARS-CoV-2 S cDNAは、Genscript Biotech Corporation(中国・南京)で合成した。SARS-CoVおよびSARS-CoV-2の野生型S遺伝子とその変異体を、シームレスな相同組換えによりpSecTag2-Hygro-Aにクローニングした。詳細な情報は補足表S3に記載されている。
SARS-CoV-2スパイクタンパク質による細胞融合の誘導
細胞融合アッセイでは、I型コラーゲン(354236、BD Bioscience)をプレコートした6ウェルプレートに1ウェルあたり約6.5×105個の細胞をプレーティングし、24時間培養した。トランスフェクションから24時間後にHoechstで染色した細胞をNikon顕微鏡で5フィールド(20x対物レンズ)の画像を撮影した。核数のカウントは,NIS elements AR software(Nikon, Japan)で行った。融合指数(FI)は、「融合した細胞内の核の割合」として算出した。
膜融合のタイムラプスイメージングのために,ガラスボトムプレート(Cellvis.)上にプレーティングした293T-ACE2細胞に,Lyn-EGFP(膜を標識),H2B-mCherry(核を標識)およびSARS-CoV-2スパイクを発現するコンストラクトを6時間トランスフェクトした後,Nikon Ti-E顕微鏡のUltraview Vox共焦点システム(Perkin Elmer)を用いてZ-スタック上でイメージングした。長さの測定はVolocityソフトウェア(V6.3, Perkin Elmer)のMEASUREMENTSモジュールを用いて行い,融合速度は融合した膜の長さを融合した時間で割って算出した。
PEGによる細胞融合とセルインセルの形成
約1×107個の腫瘍細胞を回収し、無血清DMEMで洗浄した。500μLのPEG 1450(#P7181, sigma)をコーニングチューブに入れた細胞ペレットに加え、続いて37℃のウォーターバスで2分間穏やかに撹拌した。その後、10mLのDMEMを細胞懸濁液に5分間かけて添加し、1分間放置した。PEGを除去するために400gで5分間かけて細胞を回収し、PBSで3回洗浄した。細胞DNAの定量は、Cell Cycle Detection Kit (#KGA511, Keygen)を用いて行った。セルインセル形成のアッセイでは、完全な培地で再懸濁した腫瘍細胞を6ウェルプレートに12時間播種した後、NK細胞と4時間共培養し、セルインセルの定量を行った。
PBMCクリアランスアッセイ
293T-ACE2細胞にSARS-CoV-2スパイクを発現するコンストラクトを12時間トランスフェクトしてシンシチウムを形成させた後、2.5μMのCellTracker Orange(Invitrogen, San Diego, CA, USA)で染色したPBMC細胞と共培養した。PBMCを加えてから6時間後、12時間後、24時間後に、それぞれ共培養した細胞を回収し、フローサイトメトリー解析を行った。データは、NovoCyteフローサイトメーター(Agilent、米国)で取得し、Novoexpress V1.4.1.ソフトウェアを用いて解析した。
ウェスタンブロッティング
細胞は、ホスファターゼ-プロテアーゼ阻害剤(CWBiotech社、北京)を含む冷たいRIPAバッファーを用いて氷上で20分間溶解した後、超音波(出力40%、作業6秒、停止9秒、合計5回)をかけた。12,000rpmで10分間遠心分離した後、上清を回収してSDS-PAGE電気泳動を行い、PVDF膜(0.2μm、Millipore社製)に転写した。5%脱脂乳で室温で1時間ブロックしたPVDF膜に,5%BSA中の一次抗体を4℃で12時間,または室温で4時間ブロッティングし,その後,室温で1時間二次抗体をブロッティングした。使用した一次抗体はACE2(Proteintech, 1:3000, 66699-1-Ig)、SARS-CoV/SARS-CoV2(COVID-19) スパイク(GeneTex, 1:2000, GTX632604)、α-Tubulin(Proteintech, 1:1000, 11224-1-AP)。二次抗体は、抗ウサギIgG HRP (CST, 1:3000, #7074)、抗マウスIgG HRP (CST, 1:3000, #7076)を使用した。抗体の詳細については,補足表S4を参照されたい。
セルインセル形成アッセイ
サイトスピン分析のために、mCherry標識したCCRF-CEM細胞を、SARS-CoV-2 Sコンストラクトを14時間トランスフェクトした293T-ACE2細胞と8時間共培養した。その後、Cytocentrifuge 7620 (Wescor, Logan, UT, USA)を用いて400rpmで3分間細胞質を調製し、4%パラホルムアルデヒドで固定した後、Alexa Fluor®488 Phalloidin (1:200; Life technolgies; A12379)およびDAPIで20分間染色した。細胞内構造は、電動ステージとNeo Vacuum cooled Scientific CMOS Camera(Andor Technology社製)を備えたNikon Ti-E顕微鏡で観察し、「CCRF-CEMを含むシンシクティアの割合」として定量化した。
タイムラプス解析では、ガラスボトムプレート(Cellvis)にプレーティングした293T-ACE2細胞に、まずLyn-EGFP(標識膜)とSARS-CoV-2スパイクを14時間トランスフェクトしてシンシチウムを形成させた後、2.5μM CellTracker Orange(Invitrogen, San Diego, CA, USA)でプレステインしたCCRF-CEM-mCherry、または免疫細胞株を3時間共培養して、細胞接着と初期のセルインセル形成を行った。その後、電動ステージとNeo Vacuum cooled Scientific CMOS Camera(Andor Technology社製)を搭載したNikon Ti-E顕微鏡で広視野イメージングを行った。画像は、20倍のApo対物レンズを用いて、DICチャンネルでは15ミリ秒、mCherryチャンネルでは100ミリ秒、FITCチャンネルでは150ミリ秒の露光量で、10分ごとに12時間にわたって収集した。イメージング中、細胞は5% CO2を供給した加湿室で37℃で培養した。画像シーケンスはNikon NIS-Elements AR 4.5ソフトウェアを用いて確認した。化合物処理については、上記で調製した293T-ACE2細胞に免疫細胞株とともに化合物を添加した。本研究で使用した化合物の詳細については、補足表S2を参照されたい。
ニコンTi-E顕微鏡にUltraview Voxコンフォーカルシステム(パーキンエルマー社製)を装着し、上記の方法で調製した細胞を用いて3Dタイムラプスイメージングを行った。蛍光画像および微分干渉コントラスト画像を10分ごとに12時間にわたって撮影した。
SARS-CoV-2ウイルス感染
ACE2を安定的に発現するアフリカミドリザル腎臓Vero E6細胞株(Vero-ACE2)を、10%ウシ胎児血清(FBS;Gibco Invitrogen)を添加した最小イーグル培地(MEM;Gibco Invitrogen)で、5%CO2の加湿雰囲気下、37℃で維持した。SARS-CoV-2ウイルスの臨床分離株である2019-CoV-2(GenBank ID:MT627325)をVero E6細胞で増殖させ、免疫蛍光法を用いて50%組織培養感染量(TCID50)でウイルス力価を測定した。すべての感染実験は、第二軍医大学微生物学部のバイオセーフティーレベル3(BLS-3)の実験室で行われた。シンシチウム形成のために、96ウェル細胞培養プレート中のVero-ACE2細胞(2×104細胞/ウェル)を、最初に2019-Cov-2(MOI of 0.1)に24時間感染させ、通常の培地で一晩培養した後、先に記載した標準プロトコルに従って抗SARS-CoV-2 S1抗体(1:200, Sino Biological, #40150-R007)を用いて免疫蛍光染色を行った[38]。画像は蛍光顕微鏡で撮影した。
患者の標本と倫理観
COVID-19の死亡時の剖検は、武漢感染症病院の倫理委員会の承認のもと、インフォームドコンセントを得て実施した(KY-2020-15.01)および陸軍医科大学第一付属病院倫理委員会(KY2020298)の承認のもと、中国国家衛生委員会発行の規定およびヘルシンキ宣言に準拠し、中国の「法医学における死体表面の検査(GA/T 149-1996)」および「法医学における剖検(GA/T 147-1996)」の国家基準に基づいて、インフォームドコンセントを得て実施した。バイオセーフティを確保するために、解剖の全過程で液体を発生させないドライオートプシーを採用し、陰圧手術室で法医学病理材料の収集、固定、梱包、送付の方法(GA/T 148-1996)に従って肺組織を採取した。肺組織は,SARS-CoV-2ウイルスを死滅させるため,直ちに10%中性緩衝ホルマリンに7日間浸漬した後,標準的な組織学的手順に従って切片を作成した。その後、染色のために4-5μmの切片を作成した。各標本の詳細な情報は,補足表S5に掲載した.
免疫染色と画像処理
患者組織については、以前に報告されているように、複数の細胞タイプを共染色するために「EML」多重染色法を用いた[22]。脱脂したスライドを、標準的なプロトコルに従って、Opal Multiplex tissue staining kit (Perkin Elmer, NEL791001KT)を用いて、CD45に対する一次抗体(Proteintech, 20103-1-APのウサギpAb)を1:1500の希釈率で最初に染色し、最終的にCD45分子をCyanine 5 fluorophoreでラベルした。スライドは、E-カドヘリン(BD Biosciences社のマウスmAb、610181)またはZO1(Proteintech社のマウスmAb、66452-1-Ig)に対する混合一次抗体と、Dr. Guan Yang(Beijing Institute of Biotechnology)から寄贈されたSARS-CoV Spike S1 Subunit(Sino biological社のウサギpAb、40150-T52)と一緒にインキュベートしました。続いて、Alexa Fluor 568抗マウス抗体(Invitrogen, A11031)およびAlexa Fluor 488抗ウサギ抗体(Invitrogen, A11034)の二次抗体を用いてインキュベートした。
培養細胞やサイトスピンについては,4% PFAで固定した後,0.2% TritonX-100で透過処理を行ってから,5% BSAで1時間,室温でブロックした。一次抗体(抗E-カドヘリン、1:200、BD Biosciences, 610181、抗ZO-1、1:500、Proteintech, 66452-1-Ig、抗CD4、1:200、Abclonal, A19018、抗CD8、1:200、abcam, ab34364)を塗布し、4℃で一晩インキュベートした後、2次抗体(Invitrogen, A11031またはA11034)を1時間インキュベートし、その後PBSで3回十分に洗浄した。
すべてのスライドは、核を示すためにDAPIでカウンターステインし、Prolong Gold antifade reagent(Invitrogen)とカバースリップでマウントした。画像はUltraview Voxコンフォーカルシステム(Perkin Elmer)またはWidefield Fluorescenceシステム(Nikon, Japan)を用いてNikon Ti-E顕微鏡で撮影・処理した。抗体および関連試薬の詳細については,補足表S4を参照されたい。
バイオインフォマティクス
Clustal Omegaソフトウェア(http://www.clustal.org/)またはUniProtのAlignアルゴリズム(https://www.uniprot.org/align/)を用いて配列のアラインメントを行った。Pre-cleavageモチーフは、National Center for Biotechnology Information(https://blast.ncbi.nlm.nih.gov/)の配列「GAGICASYQTQTNSPRRARSVASQSIIAYTMSLGAENSVAYSNNS」で照会されたPosition-Specific Iterated BLAST(PSI-BLAST)アルゴリズムによって同定された。SARS-CoV-2 S糖タンパク質の3D構造モデリングは、RSCB protein data bank (http://www.rcsb.org/)の6vxx.pdbをテンプレートに、SWISS-MODEL (https://swissmodel.expasy.org/)のModelingアルゴリズムで行った。
統計
データは、平均値と標準偏差(SD)で表した。P値は、ExcelまたはGraphPad Prismソフトウェアの両側性Student's t testを用いて算出し、P値が0.05未満の場合は統計的に有意であるとみなした。興味のある因子間の相関を調べるために、スピアマン順位相関分析を行った。
この記事が気に入ったらサポートをしてみませんか?
