
医薬品の製造技術は凄いのか? ー連続生産の管理戦略の話などー
我々の健康と密接に関わっている医薬品.その製造技術について,皆さんはどのようなイメージをお持ちだろうか.少なくとも私は,医薬品製造に関する研究に取り組み始めるまでは,医薬品はとても高度な技術を駆使して製造されていると信じていた.
ポテトチップスにも負ける医薬品の製造技術
ところが,2003年9月3日,The Wall Street Journalにショッキングな記事が掲載された.その記事は次の文で始まる.
The pharmaceutical industry has a little secret: Even as it invents futuristic new drugs, its manufacturing techniques lag far behind those of potato-chip and laundry-soap makers.
製薬業界は確かに未来的な新薬を発明しているが,その製造技術はポテトチップスや洗濯用洗剤の製造技術に大きく遅れをとっているというのだ.
「ポテトチップスにも負ける医薬品の製造技術」
このフレーズが医薬品製造に関わる研究者や技術者の間を駆け巡った.相当にショックだったらしい.私が関連する研究に取り組み始めたのは2006年頃だが,当時,情報収集のために国際会議に参加する度に,自虐ネタとして,ポテトチップスの写真を見せられていた.
この記事の背景には,当時問題化していた多数のリコールと,不良品の再処理と廃棄の問題がある.例えば,製造中に品質の問題で廃棄される半導体は0.0001%であるのに対して,製造される医薬品の5〜10%は仕様を満たしていないと指摘されていた.
このような低生産性が放置されてきたのには理由がある.それは,医薬品の製造と販売には規制当局の承認が必要なことである.ある薬を販売していいかどうかだけではない.どのような原料を使って,どのような装置で,どのように製造して,どのような特性を持つ薬を作るのか,といったことまでが厳しく審査され,承認されなければならない.他の産業なら,継続的な改善の名の下に,原料を見直したり,装置に改良を加えたり,製造条件を変更したりして,生産性の向上に努める.しかし,医薬品の場合,そのような変更を加えるためは,改めて審査を受けて承認を得る必要がある.これが高いハードルとなり,製造技術面での改良が進んでこなかった.
しかし,かつてのように新薬開発が進まなくなり,各国で医療費抑制が政治的課題となる中で,規制当局と製薬企業は,このままではいけないという共通認識に至った.そして,新しい製造技術として取り上げられたのが,プロセス解析工学(Process Analytical Technology: PAT)と連続生産(Continuous Manufacturing: CM)である.
それにしても,ここで紹介した医薬品とポテトチップスの話については,あまりにポテトチップス業界に失礼だという気がする.お菓子を舐めてんのか.
プロセス解析工学(PAT)
2004年9月,WSJの記事からちょうど1年経ったころ,FDA(アメリカ食品医薬品局)が“Guidance for Industry. PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance”を発出した.さらに11月には,ICH Q8と呼ばれる「製剤開発に関するガイドライン」が公開された.その最終版であるICH Q8(R2)は2009年に公開されている.これらの文書を契機に,プロセス解析工学(PAT)を活用する管理戦略が製薬産業で一気に普及することになる.
ICH Q8において,プロセス解析工学(PAT)は「最終製品の品質保証を目標として原材料や中間製品/中間体の重要な品質や性能特性及び工程を適時に(すなわち製造中に)計測することによって,製造の設計,解析,管理を行うシステム」と定義されている.このようにプロセス解析工学(PAT)は製造の管理までをも含む広い概念であるが,狭義には,中間製品品質のリアルタイムな計測技術と捉えられている.
これまで主に使われているのは,近赤外分光法(NIR法)である.近赤外とは,可視光領域と赤外光領域に挟まれた,およそ12,500 cm-1(800 nm)~4,500 cm-1(2,500 nm)の波数(波長)領域の光である.近赤外を対象物質に照射し,各波長での吸光度(吸収スペクトル)を計測することで,その物質の特性を明らかにすることができる.医薬品製造プロセスにおいては,造粒工程における水分含有量や混合工程における成分濃度などの計測に用いられる.
連続生産とその管理戦略
最終製品の品質を確実に保証しなければならないという点で,バッチ生産と連続生産との間に違いはないが,生産方法が異なるため,バッチ生産で実績のある管理戦略をそのまま連続生産に適用できるわけではない.製剤分野では連続生産の経験が乏しいため,何かとても難しいものであるかのように受け止められることもある.しかし,石油化学など昔から連続生産が主流である産業もあり,状態を時々刻々と変化させなければならないバッチ生産に比べて,定常状態の維持が目的となる連続生産の方が,プロセスの理解や運転が容易であると捉えることもできる.重要なのは,バッチ生産か連続生産かにかかわらず,プロセスの特徴を理解し,適切な管理戦略を実装することである.
連続生産の特徴は,その名の通り,原料を連続的に製造プロセスに供給し,中間製品を工程間で貯蔵することなく連続的に次工程に移送し,最終製品も連続的に取り出すことである.このため,ロットごとに中間製品の特性テストを行い,合格したものを次工程に送るという,バッチ生産で実績のあるQuality by Testing (QbT)は,連続生産プロセスの有効な管理方法とはなりにくい.それよりも,近年採用が進んでいるQuality by Design (QbD)が有効な管理方法になると考えられる.つまり,製剤の重要品質特性(CQA: Critical Quality Attribute)と物質特性(MA: Material Attribute)及び工程パラメータ(PP: Process Parameter)との関係を理解し,CQAへの影響が大きい重要物質特性(CMA)や重要工程パラメータ(CPP)を特定した上で,デザインスペースや統計的な手法を用いてCMAやCPPを管理し,「管理できた状態(State of Control)」を保証することが有効なアプローチであると考えられる.
医薬品のバッチ生産におけるQbDについては,既にICH Q8/Q9/Q10としてガイドラインが示されている.連続生産を対象としたガイドラインについては,2018年11月からICH Q13の策定に向けた活動が進められている.
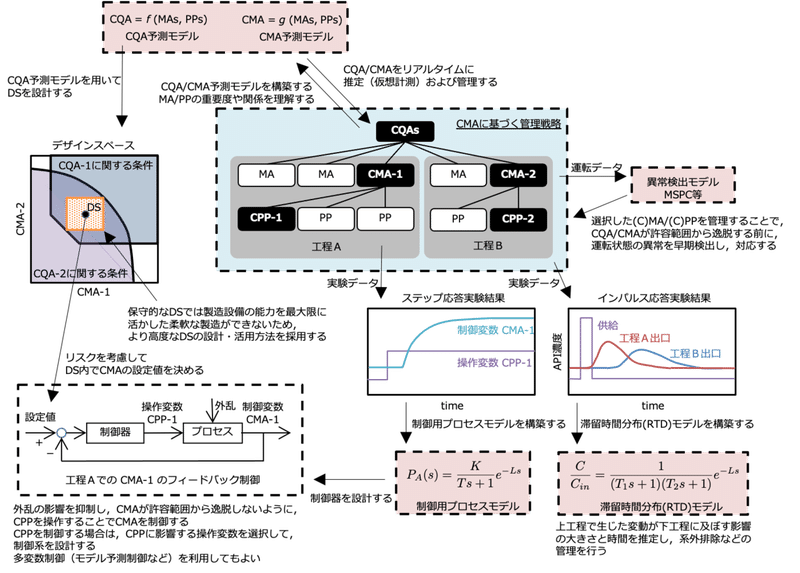
連続生産プロセスの管理戦略構築に役立つであろうデータ解析技術について,その全体像を思い付くままに描いたのが下図である.なお,連続生産で重要視されているポピュレーションバランスモデルについては触れていない.このモデルはデータ解析よりもむしろ物理モデルが基盤になるためである.
医薬品連続生産については,日本医療研究開発機構(AMED) 医薬品等規制調和・評価事業「医薬品の新規開発と製造変更における品質管理手法に関する研究」として,
平成28年度 医薬品の連続生産における品質保証に関する研究 「連続生産に関するPoints to Consider」文書
平成29年度 医薬品の連続生産における品質保証に関する研究「医薬品の連続生産における管理できた状態(State of Control)とは」
が公開されている.また,医薬品医療機器総合機構(PMDA)にて,
「医薬品の連続生産における品質保証に関する研究」のスライド
も公開されている.
この「医薬品の連続生産における品質保証に関する研究」は,AMED松田班によって実施されており,特に,固形製剤連続生産の管理戦略については,最新の検討成果が2報の論文として公開されている.
Approach to Establishment of Control Strategy for Oral Solid Dosage Forms Using Continuous Manufacturing. Chemical and Pharmaceutical Bulletin, 69(2), 211-217 (2021)
CPBに掲載されたこの論文は,主に湿式造粒プロセスを対象として,連続生産の管理戦略についてまとめている.
Control strategy and methods for continuous direct compression processes. Asian Journal of Pharmaceutical Sciences, in press
AJPSに掲載されたこの論文は,連続直打プロセスの管理戦略について,滞留時間分布モデルを中心にまとめている.
私もAMED松田班の一員に加えていただいて,これらの論文の執筆にも関わったので,ここで宣伝しておく.どちらも無料で論文をダウンロードできるので,製薬企業の関係者はもちろん,興味ない人も眺めてみて欲しい.
研究成果(PAT関連)の紹介
最後に,ドサクサ紛れに我々の研究成果(PAT関連)も紹介しておく.
Scale-Free Soft Sensor for Monitoring of Water Content in Fluid Bed Granulation Process. Chemical and Pharmaceutical Bulletin, 68(9), 855-863 (2020)
Setting the process parameters for the coating process in order to assure tablet appearance based on multivariate analysis of prior data. International Journal of Pharmaceutics, 511(1), 341-350 (2016)
Spectral fluctuation dividing for efficient wavenumber selection: Application to estimation of water and drug content in granules using near infrared spectroscopy. International Journal of Pharmaceutics, 475(1), 504-513 (2014)
Verification of model development technique for NIR-based real-time monitoring of ingredient concentration during blending. International Journal of Pharmaceutics, 471(1-2), 264-275 (2014)
Real-time monitoring of lubrication properties of magnesium stearate using NIR spectrometer and thermal effusivity sensor. International Journal of Pharmaceutics, 441(1-2), 402-413 (2013)
Evaluation of infrared-reflection absorption spectroscopy measurement and locally weighted partial least-squares for rapid analysis of residual drug substances in cleaning processes. Analytical Chemistry, 84(8), 3820-3826 (2012)
Estimation of active pharmaceutical ingredients content using locally weighted partial least squares and statistical wavelength selection. International Journal of Pharmaceutics, 421(2), 269-274 (2011)
© 2021 Manabu KANO.
この記事が気に入ったらサポートをしてみませんか?
