
ファクトベースで読み解くドラッグ・ロス
こんにちは、D3 LLC ベンチャーパートナーの長谷部です。今回はいつもと視点を変えて臨床開発、ドラッグ・ラグについての話題です。
2000年代のドラッグ・ラグといえば、日本の当局の審査期間が長いことが原因で話題にとりあげられることが多かったですが、PMDA近藤理事長のリーダーシップのもと、2006年には2.4年だったラグは2016年には1.0年にまで短縮され、一時期紙面からは消えていました。
しかしながら、近年、ドラッグ・ラグに加えドラッグ・ロスという言葉が改めて紙面を賑わせるようになりました。
今回の原因は薬価、あるいは日本の市場性の魅力低下を中心に語られることが多いですが、我々は本質的には日本の臨床開発の生産性が低いこと、および日本が海外、特にEmerging Biopharmaに知られていないことも原因だと考えています。そして、日本の生産性を向上させ海外に周知するためには時間的猶予がないと考えています。
以下、順を追って説明していきます。
1. 治験実施国は市場規模で選ぶわけではない?
市場規模が重要ならば、日本よりも市場が小さな国では日本よりも治験が少ないはずですが、実際には同じアジア圏内でも韓国、オーストラリア等、世界的に見て市場性がない国でも日本よりもピボタル試験が多い国が存在しています
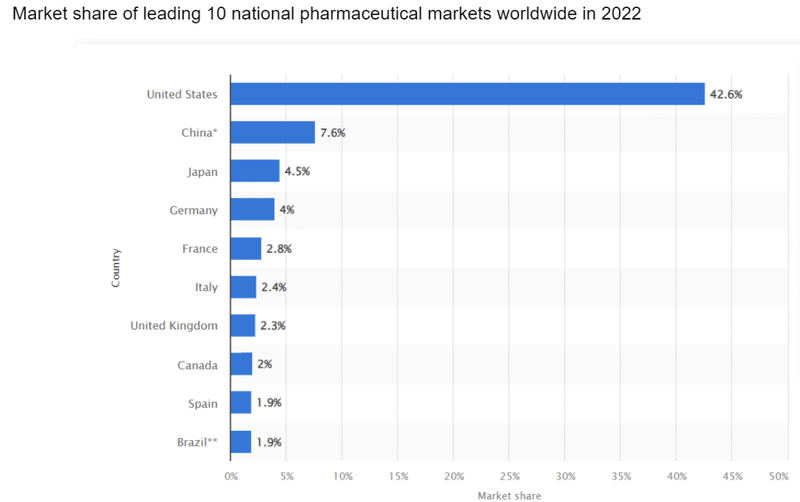
2022年現在の製薬市場Top10はアメリカ、中国、日本とヨーロッパ各国、ブラジルです。一方で、2016-2020年時点でピボタル試験の組入地域を見ると、日本よりも市場規模が小さな国でも日本と同程度、あるいはそれ以上に試験が実施されている国が多くあることがわかります。例えば、同じアジア地域で見ても韓国、オーストラリア等が日本よりも多く試験が実施されています。
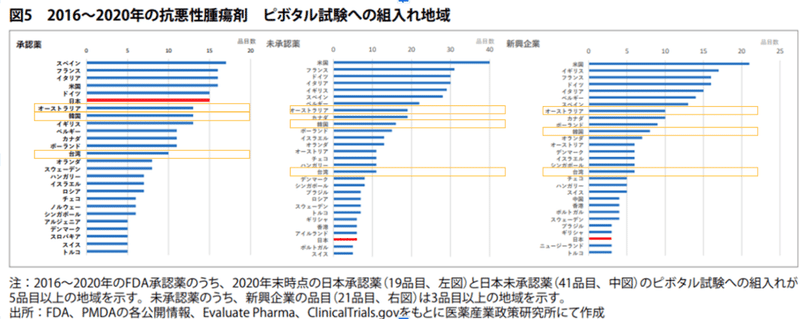
2.日本での治験を避ける理由はコスト?
日本の治験環境、パフォーマンスは改善しつつあるものの依然として高コストであるため、我々が日々情報交換する日系企業の中でも、グローバル試験をする際に日本を試験対象国に含めない例も出てきています。日本の治験のプレゼンスも落ち続けています。

https://www.phrma-jp.org/wordpress/wp-content/uploads/2023/10/phrma_efpiajapan_seminar2023-01.pdf
上記の図を見ると、Qualityの面では良いものの(実はむしろOver qulaity)、Speedとcost面で国際競争力がないことがわかります。結果として、日本のグローバルに占める治験の割合も落ち続けています。
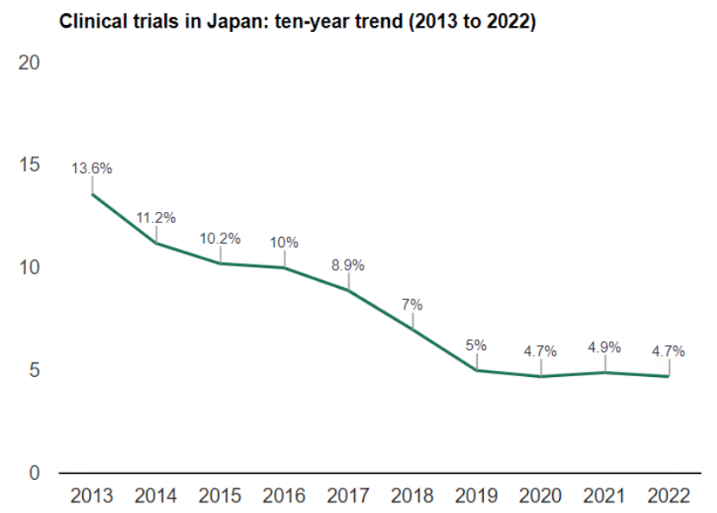
一方で、日本よりも試験の多い国々に関しては、例えば韓国は国を上げて治験環境の整備をしており、2,000床を超えるような大規模施設で集中して治験を実施する体制を敷いているため高い効率性をあげています。
また、オーストラリアは被験者登録スピードは日本と同程度ですが、EBP企業に対して減税措置を設けているため、アメリカに比べて60%試験コストを削減できるとも言われておりコスト競争力を国としてサポートしています。
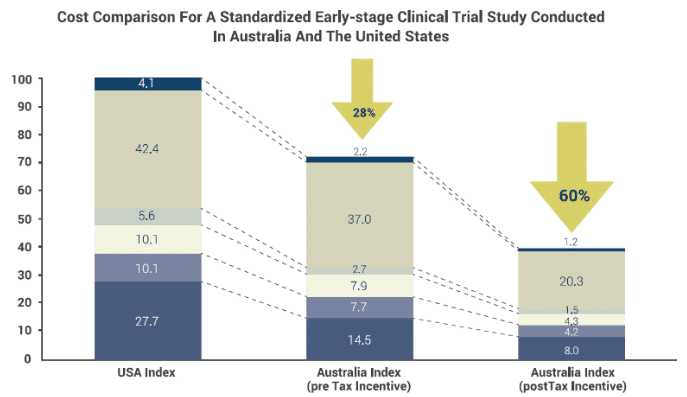
https://www.frost.com/files/6514/7374/3781/Novotech_WP_20160701_v2.1.pdf
3.海外バイオテックはそもそも日本の知識(興味)がない
ドラッグ・ロスを解消するためには新興バイオテク企業(Emerging Biophrma, 以下EBP)が重要ですが、前述の日本の開発生産性が低いことに加え、海外EBPはそもそも日本に関する知識がないため日本を能動的に試験対象国に含めようとしていない可能性があります。
下図の製薬企業のサイズ別のパイプラインの分布が示す通り、直近10年でのEBPの伸びは著しく、今や6割を超えるパイプラインはEBPが占めています。逆に、これまで創薬の原動力だったメガファーマの占める割合は低下しています。

また、過去10年のFDA承認薬を見ると、大手製薬に比べ、EBPの薬剤が日本で承認された割合が低く、近年のドラッグ・ロスはEBPが重要なことがわかります。

https://www.jpma.or.jp/news_room/newsletter/213/pdf/13pc.pdf
海外EBPに関しては下記記事でICON小川社長がおっしゃっているとおり、海外EBPにとって日本はブラックボックスなことが多い、よくわからないから積極的に含めていないというのが正直なところではないでしょうか。私の経験においても、メガファーマの本社ですら日本人Ph1が必要なことを知らない担当者が少なくなく、規模の小さなEBPにおいてはなおさらかと思います。
また、薬価に関しても下記記事内でがんセンター山本先生がおっしゃっている通り、海外EBPは日本の制度自体を知らない場合が多いのではないかと思います。個人的な経験としても海外にて大手Payer調査企業にリサーチをお願いした際に、日本の基本的な薬価制度に関する理解が誤っていたことがあり驚いた経験がありますので、EBPが日本の薬価について知らなかったとしても不思議ではありません。
4.大事なことー臨床開発生産性を高め、海外に周知すること
日本の規制が国内治験を必要としない方向に変化しつつあるため、一刻も早く日本の臨床開発の生産性をあげて海外へ周知していかなければ、日本での治験は更に減少し臨床開発産業が衰退してしまいます。
昨年9月の薬事検討会にて日本人Ph1をせずとも後期相に乗ってもよいことが示されました。本件は日経朝刊1面トップで報じられるなど、世間の関心の高さが伺われました。
また今年2月には更に踏み込んで、希少疾患等で日本で試験の実施が困難な場合、いくつかの条件をクリアすれば日本人データなしに承認申請してもよいとの見解が示されました。
これは難病を患っていて海外既承認の薬剤を心待ちにされている患者さんにとっては朗報である一方で、日本の臨床開発のCapability、産業としては衰退する方向になることを意味しています。特に、Cell&Gene等の新規モダリティにおいては、CMCと臨床現場、KOL等との連携が製品の開発、市販後の拡販においても重要であることから、日本の優れた研究からバイオテク企業を産み出していくという観点においては、治験の減少に伴って早期臨床開発が弱体化することは大きな痛手です。
また、過去何十年と日本人データを要求してきた当局が、直近半年足らずで大きな規制緩和をしたことから、このスピード感で規制緩和が進めば日本での治験があっという間に減少する可能性も考えられるため、一刻も早く日本の臨床開発を改革し生産性をあげ海外EBPに対して周知していくことが求められています。
朗報としては、PMDAがワシントンに事務所を開設するとのことですので、日本の規制や開発の現状をアメリカ当局のみならず、EBPに対しても周知されることが期待されます。
以上、今回はドラッグ・ロスの解消のためには日本の臨床開発が国際競争力をあげる必要があること、そして日本の開発の現状・規制をEBPへ周知する必要があること、この2つの解決策を実施するためには時間的な猶予がないという危機感の共有をさせていただきました。
文責:長谷部(ベンチャーパートナー)
ーーー
投資のご相談その他バイオヘルスケアでのご相談はお気軽にどうぞ:
mail: info@d3growth.com
この記事が気に入ったらサポートをしてみませんか?
