
第9章【反応速度】
●反応速度は奥が深い分野で、熱化学が静的なエネルギー関係を扱うのに対し、速度論では動的、つまり時間のファクターが導入されています。熱力学からは速度論は出てこないので両者は独立した体系ではありますが、互いに矛盾なく理論構築ができる点が面白いところです。
●反応速度論では微分・積分を使った方がよい場面が多く、物理で微分・積分が必須であるのと同様です。簡単な微分方程式も運用できた方が有利です。このあたりは指導要領の枠にとらわれずに学習していただきたいと思います。
●温度依存性は速度論の重要テーマであり、アレニウス型の関数形は高校生も知っておいてよいでしょう。入試ではたいがい誘導が付きますが、活性化エネルギーの理論的根拠として頻出の定式化です。
それでは問題です。
【問題1】
次の問に答えよ。
①素反応の反応速度が各基質(反応物)の濃度に比例するのはなぜか説明せよ。
⓶触媒が正反応と逆反応を同時に加速または減速する理由を説明せよ。
③鉄くぎは空気中で燃えないが、鉄粉は自然発火することがあるのはなぜか説明せよ。
④生成物が複数できる反応では主生成物が平衡で決まる熱力学的支配と反応速度で決まる速度論的支配の場合がある。温度が高いとどちらが優勢になるか説明せよ。
⑤粘度が高い溶液中での反応速度式は気体反応の場合と大幅に異なることがある。この違いの本質的な理由は何か述べよ。
【問題2】
下記の素反応における反応速度を時間tの関数として求めよ。ただし、kは反応速度定数であり、逆反応は無視してよい。初濃度は[A]₀, [B]₀等とし、[A]₀≠[B]₀とする。
(a)一次反応
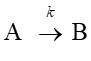
(b)二次反応
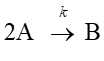
(c)二次反応
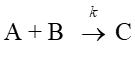
【問題3】
固体表面に気体分子が吸着するとき、吸着サイトが分子で覆われている割合を被覆率という。平衡時における被覆率の圧力依存性を表す関数形を求めよ。ただし、温度は一定とし、気体は容器に密閉されていて、単分子吸着以外は考えなくてよい。
【問題4】
ヨウ素酸イオンと亜硫酸水素イオンは水中で混合して一定の時間が経つと突然にヨウ素を生成する。これはヨウ素時計反応といわれるもので、下記の反応式で表される。
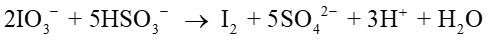
反応機構はいくつかの素反応から成る複雑なものであるため、反応次数は実験によって定める。温度を一定にして基質の初期濃度を変えながらヨウ素をでんぷんで検出し、溶液が無色から紫色に瞬時に変化するまでの時間を測ったところ、次の実験データが得られた。
(a)この反応の反応次数を求めよ。ただし、反応速度は定数kを用いて下記のように定義し、ヨウ素酸イオン、亜硫酸水素イオンそれぞれについての反応次数aとbを求めること。
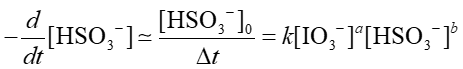
(b)この反応の反応速度定数kを求めよ。

【問題5】
(a) 下記のように分子AとBが中間体ABを経由して生成物Cに至る反応を考える。
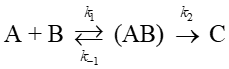
ABの生成は速い平衡反応で、正反応、逆反応の速度定数をそれぞれk₁, k‐₁とする(前駆平衡)。ABからCに至る過程は相対的にきわめて遅く、その速度定数をk₂とする(律速段階)。中間体ABの反応性は高いのでその濃度はほぼ一定とみなせる。このときCが生成する反応速度を表す式を求めよ。
(b) 酵素は一種の触媒であるが、酵素が関与する反応ではその速度が酵素濃度に依存する。酵素をE, 基質をS, 生成物をPとすると反応式は前問と同様に
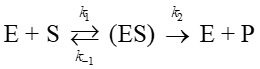
と表されるが、後段の反応がとくに遅いわけではない。中間体ESの濃度を近似的に一定とみなし、酵素の初期濃度を[E]₀として生成物Pが生じる速度を基質濃度[S]の関数として求めよ。
【問題6】
反応速度定数kの温度依存性は絶対温度T, 気体定数R, 活性化エネルギーΔE,頻度因子Aを用いて
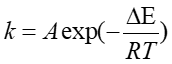
と表されることが多く、これをアレニウスの式という。
(a) 常温付近では温度を10℃上げると反応速度はおよそ2倍になることが多い。この経験則から活性化エネルギーの大きさを概算せよ。
(b) ある分子のエネルギーがEから+dEのあいだにある確率はボルツマン分布に従い、exp(-E/RT)dEに比例する。そのときの比例定数を求めよ。また、分子が活性化エネルギーΔE以上のエネルギーをもつ割合を求め、反応速度定数がアレニウス型の温度依存性を示すことを示せ。
解答・解説は有料にて公開しております。
この記事が気に入ったらサポートをしてみませんか?

