エクスパンションマイクロスコピーを用いた順行性シナプス規定分子機構の解明
脳神経系の情報伝達・貯蔵は神経細胞間の結合部位であるシナプスを介す。過去には様々なシナプス構成因子が特定されてきたが、多くの細胞接着性、または細胞外足場タンパク質がニューレキシンを共通のプレシナプス受容体として持つ。つまり、ニューレキシンはプレシナプス組織のハブとして働くのである。
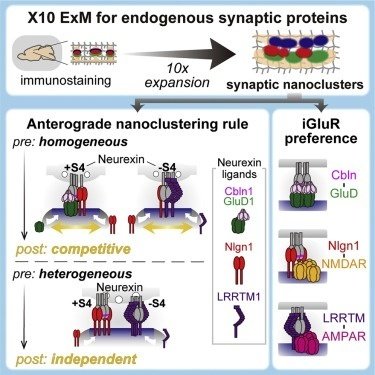
ニューレキシン(Nrxn)は多数のスプライシングアイソフォームを持ち、それによって各分子との親和性が異なることなどが知られていたが、生体内においてどのようにニューレキシンが各シナプスに局在するのかはわかっていなかった。本研究では、エクスパンションマイクロスコピー(ExM)を用いた超解像度イメージングによって、セレべリン1(Cbln1)、ロイシンリッチリピート膜貫通神経タンパク質1(LRRTM1)、ニューロリジン1(Nlgn1)がそれぞれGluD1、AMPA型受容体、NMDA型受容体といったグルタミン酸受容体とナノクラスターを構成することが分かった。また、Nrxnのアイソフォームの組み合わせによりポストシナプスの構成要素が順行性に制御されることを明らかにした。
Nozawa, Kazuya, et al. "In vivo nanoscopic landscape of neurexin ligands underlying anterograde synapse specification." Neuron 110.19 (2022): 3168-3185.
https://doi.org/10.1016/j.neuron.2022.07.027
Introduction
光学的な顕微鏡が試料の像を拡大することで微細構造を明らかにするのに対し、ExMとは試料自体を物理的に拡大することで微細構造を明らかにしようという逆転の発想に基づいている。試料は多孔性のポリマーに埋め込まれ、水を加えることで微細構造の位置関係を保ったまま拡大し、超解像イメージングを可能にすることができる。最近ではExMの応用で、マウスの全脳といった数センチ程度の大きさの組織をナノメートルスケールで可視化することができると報告されている。
また、ExMが開発される契機として、脳の化学的な透明化手法であるCLARITYの開発とそのLimitationがあったという逸話も面白い。CLARITYは脳の透明化により神経回路のつながりなどの詳細な3次元構造を調べることができるが、発表当初は試料が膨張し大きくなるため実際の構造を反映できていないのではないかという批判があったそうだ。Edward S. BoydenはこれをLimitationではなく超解像度を達成する手法として使えると考えてExMが生まれた。
Results
図1は、X10 ExMがシナプス構造の可視化に応用できることを示している。免疫染色を行った後にExM処理を行いシナプス構造を可視化すると(図1A)、Nlgn1がプレシナプスBassoon(Bsn)やポストシナプスPSD-95といったタンパクとナノクラスターを形成することが分かった(図1B)。横からのシナプスと正面からのシナプスに分類して解析すると、海馬においてNlgn1がPSD-95の中央に局在するといった先行研究と一致した結果を得た(図1D)。

図2は、In vivoのシナプスにおいてCbln1とNign1が特定のNrxnアイソフォームをめぐり競合していることを示している。Cbln1をホモで失っている場合に比べてCbln1を持つ場合に、GluD1がPSD-95と共局在する割合が高くなり、HA-Nlgn1が共局在する割合が低くなる(図2B)。

図4は、Cbln1がNlgn1と競合することでNMDARがシナプスで機能することを阻止していることを示している。野生型とCbln1をノックアウトしたマウスの分子層介在神経(MLIs)からホールセルパッチクランプ記録を行うと、WTでは非NMDARアンタゴニストのNBQXによって興奮性シナプス後電流(EPSC)が完全に阻害されるのに対し、Cbln1ノックアウトでは完全には阻害されず、NMDAR依存のゆっくりとした成分が残った(図4A-D)。

図5では海馬においてLRRTM1とNlgn1が共局在すること(図5B,C)が、一方で図6では大脳皮質においてはLRRTM1とNlgn1が共局在しないこと(図6C,D)が示されている。


図7では、このようなポストシナプスの構成要素の局在がどのようにしてプレシナプスのNrxnによって指定されるかが調べられている。Nrxn+S4と-S4の双方のアイソフォームを含む大脳皮質のシナプスに人工的にNrxnと結合するCbln1を加えた場合にLRRTM1がNlgn1と共局在するようになり(図7B-D)、Nrxn-S4を本来含まないvGluT2シナプスに人工的にNrxn-S4を加えると、LRRTM1がNlgn1と共局在しなくなる(図7F、G)ことが示されている。ここでは、Nrxnのアイソフォームとポストシナプスの構成要素との親和性から、Nrxnアイソフォームが1種類しか存在しない場合にはそのアイソフォームを競合してNlgn1とLRRTM1との共局在が起こるが、アイソフォームが2種類存在する場合は、一方のアイソフォームにNlgn1が、もう一方のアイソフォームにLRRTM1がというように独立したナノクラスターが構成されるというモデルが提示されている(図7H)。

図8は、さらに大脳皮質においてプレシナプスとポストシナプスにどのような分子が共局在しているかを調べている。HA-Nlgn1ナノクラスターはAMPARナノクラスターよりもNMDARナノクラスターの近くに存在する(図8A)。AMPARナノクラスターはHA-Nlgn1ナノクラスターよりもLRRTM1ナノクラスターの近くに存在する(図8D)。これらのデータから、ニューレキシンの基質特異性により、Cbln-GluD、Nlgn1-NMDAR、Cav2.1-LRRTM-AMPARといったシナプス構成要素複合体が構成されるとまとめられている(図8I)。ただし、Nlgn1-NMDAR、Cav2.1-LRRTM-AMPARについてはExMの局在の相関データから主に導かれていて、因果関係はわからない点に注意する必要がある。


感想
ExMを応用してシナプスナノクラスターの微細構造を可視化している面白さだけでなく、超解像度顕微鏡を用いた補助データやその形成過程を裏付けるためのノックアウト実験を多数行っているところが素晴らしかった。今後技術の発展に伴いシナプスの解像度での脳の理解が進み、どこまで脳の謎が解けるのかが楽しみである。
参考文献
Expansion microscopy | Science
シナプスの情報伝達は、神経細胞間の接続部位であるシナプスを介して行われ、ニューレキシンがプレシナプス組織のハブとして重要な役割を果たしている。本研究では、エクスパンションマイクロスコピーを用いた超解像度イメージングにより、複数のタンパク質がグルタミン酸受容体とナノクラスターを形成すること、およびニューレキシンのアイソフォームによるポストシナプス構成要素の制御が明らかにされた。また、ExMは試料を物理的に拡大し、微細構造を可視化する技術であり、この研究ではシナプス構造の詳細な解析が可能になった。
サムネイル画像の出典:https://doi.org/10.1016/j.neuron.2022.07.027