IDSAから、抗菌剤耐性グラム陰性菌感染症の治療ガイダンスが出た
今日から、記事の内容を変えて書いていきます。
タイトルのとおり、米国感染症学会 (IDSA)より、耐性グラム陰性菌感染症の治療ガイダンスが公表されました。
本日はこのガイダンスについて読み解いていきます。
なお、本内容は、私の所属している医療機関とは一切関わりがないのでご承知ください。
さて、本文をざっとみましたが、いくつか本ガイダンスを読んでいく上で、抑えるべきポイントがあります。
●本書では米国における抗菌薬耐性感染症の治療推奨に焦点を当てている。
●薬剤のコストは考慮されていない。
●ある病原体群に感染する危険性のある宿主は、通常、他の抗菌薬耐性病原体に感染する危険性があるため、経験的治療の推奨は本ガイダンス文書では提供していない。
●治療期間に関する推奨事項は提供されていないが、より感受性の高い表現型を持つ同じ細菌種による感染症と比較して、それ自体が抗菌薬耐性菌による感染症に対しては、長期の治療コースは必要ないことが臨床家に助言されている。
上記のポイントに注意をして読んでいただければと。
なお、ガイダンスの全体を読んでの感想ですが、日本で入手できない薬剤が多数出てきます。このため、2020年9月現在、日本国内では、このガイダンスにそのまま当てはめての治療は難しいのではないかと思いました。
それでは、下記に本文を和訳したものを示します。
Infectious Diseases Society of America Guidance on the Treatment of Antimicrobial Resistant Gram-Negative Infections.
Published by IDSA, 9/8/2020
A Focus on Extended-Spectrum β-lactamase Producing Enterobacterales (ESBL-E), Carbapenem-Resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with Difficult-to-Treat Resistance (DTR-P. aeruginosa)
Pranita D. Tamma*, Samuel L. Aitken, Robert A. Bonomo, Amy J. Mathers, David van Duin, Cornelius J. Clancy
Introduction
抗菌薬耐性(AMR)の増加は, 世界的な危機であり続けている[1, 2]。併せて, 2019年米国疾病対策予防センター(CDC)の抗菌薬耐性脅威報告書(Antibiotic Resistant Threats Report)によると、2012年から2017年までに米国で年間280万件以上の感染症と3万5,000人以上の死亡を引き起こした抗菌薬耐性病原体を総称して「AMR」と呼ぶ[2]。耐性病原体による感染症の治療に有効な抗菌薬の選択は困難である[3]。近年、耐性感染症に対抗するための新規抗生物質の利用可能性は増加しているが[3]、これらの薬剤の多くに対する耐性が観察されている[4]。3つのグループの抗菌薬耐性グラム陰性菌は、特に治療上の課題となっている。1)extended-spectrum β-lactamase producing Enterobacterales(ESBL-E)、(2)carbapenem-resistant Enterobacterales(CRE)、および(3)Pseudomonas aeruginosa with difficult-to-treat resistance(DTR-P. aeruginosa)である[5]。これらの病原体は、CDCによって緊急または重大な脅威に指定されています[2]。これらの病原体は、米国のあらゆる規模の病院で遭遇し、重篤な罹患率と死亡率をもたらす広範な重篤な感染症を引き起こしています。ESBL-E、CRE、およびDTR-P. aeruginosa感染症に対する治療法は、新しい抗菌薬が承認されたにもかかわらず、依然として限られている。臨床現場での新しい薬剤の正確な役割については、しばしば不確実性がある [6-8]。
米国感染症学会(IDSA)は、2019年戦略計画の中で、臨床実践ガイドラインおよび臨床医向けの他のガイダンス製品の開発と普及をトップイニシアチブとして特定した[9]。IDSAは、AMRのような急速に進化するトピックに対応する能力は、新規または更新された臨床実践ガイドラインの作成に必要な長期的なタイムラインによって制限されていることを認識していた。包括的な臨床実践ガイドラインに代わるものとして、IDSAは、特定の感染症プロセスの治療のために、より絞り込んだガイダンス文書を作成することを支持した。ガイダンス文書は、現在のガイドラインではカバーされていない難治性感染症の特定の臨床上の疑問に対処するものである。この文書は、文献の包括的な(必ずしもシステマティックではない)レビューに基づいて、少人数の専門家チームによって作成される。さらに、GRADE(Grading of Recommendations Assessment, Development, and Evaluation)の枠組みを利用しているIDSAガイドラインとは異なり、このようなガイダンス文書には、エビデンスの正式な等級付けは含まれない。時間の経過とともに、ガイダンス文書はGRADE形式に移行する可能性がある。コンテンツは複数のプラットフォームで配布され、新しいデータが出てくるたびに更新される。抗菌剤耐性グラム陰性菌感染症の治療は、ガイダンス文書の最初のトピックとして選ばれた。
このガイダンス文書の非常に重要な目標は、感染症の専門知識の有無を問わず、ESBL-E、CRE、およびDTR-P. aeruginosaによる感染症に対する抗菌薬治療の選択において、臨床医を支援することである。本文書の将来的な改訂では、その他の耐性病原体にも対応する予定である。著名な臨床試験、耐性メカニズム、感受性検査法について簡単に説明しているが、本ガイダンスはこれらのトピックの包括的なレビューを提供することを意図したものではない。本書は、一連の臨床上の質問に対する回答として構成されており、それぞれが独立したものとなっている。耐性の分子疫学や特定の抗感染症薬の利用可能性には世界的に大きな違いがあるため、本書では米国における抗菌薬耐性感染症の治療推奨に焦点を当てている。
Methodology
この IDSA ガイダンス文書は、耐性菌感染症の治療において臨床および研究の専門知識を持つ 6 名の現役の感染症専門家からなるパネルによって作成されました。一連のウェブベースの会議を通じて、パネルは一般的に遭遇するいくつかの治療に関する質問と、各病原体グループに対応する回答を作成しました。パネルは、臨床経験に加え、公表されている文献の広範なレビューに基づいて、各質問に対する推奨事項についてコンセンサスを得ました。回答には、推奨事項を裏付ける根拠についての簡単な議論が含まれている。各病原体群について、抗菌薬感受性データが判明した後、好ましい治療法と代替的な治療法の推奨を表にまとめた。治療法の推奨は、成人および小児の両方に適用される。成人の抗菌薬耐性感染症患者に対する抗菌薬の推奨投与量は、正常な腎機能および肝機能を想定して、Table 1に示している。
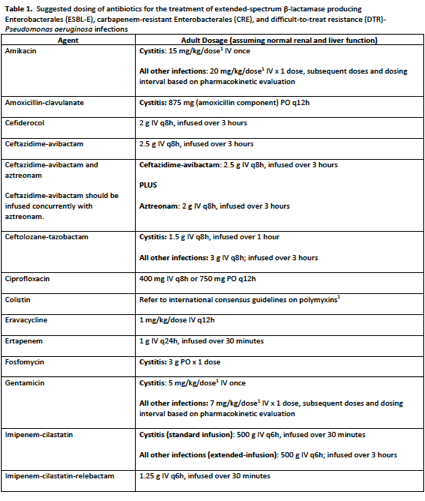

General Management Recommendations
本ガイダンス文書に記載されている望ましい治療法および代替治療法の推奨は、原因菌が特定され、抗菌薬のin vitro 活性が実証されていることを前提としている。薬剤のコストはパネルでは考慮されていない。2種類の抗菌薬が同等の効果と安全性を持つと仮定した場合、特定の薬剤を選択する際には、コストと現地での処方箋の入手可能性が重要な考慮事項となる。パネルは、可能であれば、抗菌薬耐性感染症の患者の管理に感染症専門医が関与することを推奨している。
Empiric Therapy
ある病原体群に感染する危険性のある宿主は、通常、他の抗菌薬耐性病原体に感染する危険性があるため、経験的治療の推奨は本ガイダンス文書では提供していない。経験的治療の決定は、最も可能性の高い病原体の局所的な感受性パターンに基づいて行われるべきである。ある患者に対する経験的治療を決定する際には、臨床医は(1)過去6ヵ月間の過去の病原体および関連する抗菌薬感受性データ、および(2)過去30日間の抗菌薬曝露を考慮すべきである(例えば、ピペラシリン-タゾバクタムの治療期間が最近終了した場合、同等の活性スペクトルを有する別のクラスのグラム陰性薬(例えば、メロペネム)を用いた経験的治療を考慮すべきである)。経験的判断は、患者の重症度と感染源の可能性に基づいて行うべきである(例えば、人工呼吸器関連肺炎と推定される場合は、一般的に膀胱炎と推定される場合よりも広い経験的適用範囲が必要となる)。
Duration of Therapy
治療期間に関する推奨事項は提供されていないが、より感受性の高い表現型を持つ同じ細菌種による感染症と比較して、それ自体が抗菌薬耐性菌による感染症に対しては、長期の治療コースは必要ないことが臨床家に助言されている。抗菌薬感受性の結果が得られた後、不活性抗菌薬治療が経験的に開始されたことが明らかになるかもしれない。これは、治療期間に影響を及ぼす可能性がある。例えば、膀胱炎は典型的には軽度の感染症である。原因菌に対して活性でない抗菌薬が膀胱炎に対して経験的に投与されたにもかかわらず、臨床的に改善がみられた場合、一般的には、尿培養を繰り返したり、抗菌薬レジメンを変更したり、予定された治療期間を延長したりする必要はない[10]。しかし、ここに記載されている他のすべての感染症については、抗菌薬感受性データが潜在的に不活性な薬剤が経験的に開始されたことを示している場合には、全治療コース(活性のある抗菌薬による治療開始日からの日付)の活性レジメンへの変更が推奨される。さらに、あらゆる細菌感染症の治療と同様に、抗菌薬耐性感染症の治療期間を決定する際には、免疫状態、感染源管理能力、および治療に対する一般的な反応に関連する重要な宿主因子を考慮すべきである。
Extended-Spectrum β-Lactamase-Producing Enterobacterales (ESBL-E)
米国におけるESBL-E感染症の発生率は、2012年から2017年にかけて53%増加しており、その大部分は市中感染の増加によるものである[11]。ESBLは、ほとんどのペニシリン、セファロスポリン、アズトレオナムを不活性化する酵素である。EBSL-Eは一般的にカルバペネム系薬剤に対して感受性を維持している。ESBLは、非β-ラクタム系薬剤(例えば、シプロフロキサシン、トリメトプリム-スルファメトキサゾール、ゲンタマイシン)を不活性化しない。しかしながら、ESBL遺伝子を有する生物は、しばしば、広範な抗菌薬に対する耐性を媒介する追加の遺伝子または遺伝子の変異を有する。
どのようなグラム陰性菌もESBL遺伝子を保有する可能性がある;しかしながら、ESBL遺伝子は大腸菌、Klebsiella pneumoniae、Klebsiella oxytocaおよびProteus mirabilisに最も多く存在する [12、13]。CTX-M酵素、特にCTX-M-15は、米国で最も一般的なESBLである [13]。CTX-M以外のユニークな加水分解能力を有するESBLが同定されており、これには、アミノ酸置換を有する狭スペクトルTEMおよびSHV β-ラクタマーゼの亜種が含まれる [14-16]。定期的なEBSL検査は、ほとんどの臨床微生物検査室では実施されていない[17, 18]。むしろ、セフトリアキソンに対する非感受性(すなわち、セフトリアキソン最小阻害濃度[MIC] > 2 mcg/mL)が、しばしばESBL産生の代理として使用される[18]。このガイダンス文書では、ESBL-Eとは、推定または確認されたESBL産生大腸菌、K. pneumoniae、K. oxytoca、またはP. mirabilisを指すものとする。Table 2は、ESBL-E感染症に対する望ましい治療法および代替治療法の推奨事項の概要を示している。ESBL-E感染症に対する治療推奨は、好ましい抗菌薬および代替抗菌薬のin vitro活性が実証されていることを前提としている。

このセクションで扱われている質問は以下の通りです。
1. ESBL-Eによる非合併性膀胱炎の治療に好ましい抗菌薬は何か?
2. ESBL-Eによる腎盂腎炎および合併性尿路感染症(cUTI)の治療に好ましい抗菌薬は何か?
3. ESBL-Eによる尿路感染症以外の感染症の治療に好ましい抗菌薬は?
4. ピペラシリン-タゾバクタムに対するin vitro感受性が証明された場合、ESBL-Eに起因する感染症の治療にピペラシリン-タゾバクタムの役割はあるか?
5. セフェピムに対するin vitro感受性が示された場合、ESBL-Eに起因する感染症の治療におけるセフェピムの役割はあるか?
6. E. coli、K. pneumoniae、K. oxytoca、またはP. mirabilisによって引き起こされた感染症の治療において、確認的表現型ESBL検査が陰性の場合、セフトリアキソンに感受性がない場合に好ましい抗菌薬は何か?
7. このターゲットを含む分子プラットフォームを用いて blaCTX-M 遺伝子が検出されない場合、セフトリアキソン非感受性E. coli、K. pneumoniae、K. oxytoca、またはP. mirabilisによる血流感染症の治療に好ましい抗菌薬は何ですか?
Question 1: What are preferred antibiotics for the treatment of uncomplicated cystitis caused by ESBL-E?
質問1:ESBL-Eによる合併症を伴わない膀胱炎の治療に好ましい抗菌薬は何?
推奨: ESBL-Eによる非合併性膀胱炎に対しては、ニトロフラントインおよびトリメトプリム-スルファメトキサゾールが好ましい治療法である。
根拠:ニトロフラントインおよびトリメトプリムスルファメトキサゾールは、膀胱炎に対する安全で効果的な選択肢であることが示されている[10、19、20]。
フルオロキノロン系薬剤(すなわち、シプロフロキサシンまたはレボフロキサシン)およびカルバペネム系薬剤は、ESBL-E膀胱炎に対して有効な薬剤であるが、他の安全で効果的な選択肢がある場合には、膀胱炎に対するこれらの薬剤の使用は推奨されない。これらの薬剤の使用を制限することは、将来の感染症に対する活性を維持することと、特にフルオロキノロン系薬剤の毒性を制限することの両方を目的としています。
ESBL-E 膀胱炎に対する代替手段としては、アモキシシリン-クラブラン酸塩、単回投与アミノグリコシド、および経口ホスフォマイシンがあります。アモキシシリン-クラブラン酸塩は、無作為化比較試験のデータによると、膀胱炎に対するシプロフロキサシンよりも高い臨床的失敗率と関連していることが示されているため、好ましい薬剤というよりはむしろ代替的な薬剤である [21]。アミノグリコシドは活性型ではほぼ独占的に腎経路で排除される。膀胱炎には単回の静脈内投与が一般的に有効であり、毒性は最小限であるが、堅牢な試験データは不足している[22]。経口ホスフォマイシンは、K. pneumoniaeおよび他のいくつかのグラム陰性菌に内在するfosA遺伝子が薬剤を加水分解し、治療失敗を引き起こす可能性があるため、ESBL産生性大腸菌膀胱炎の治療専用の代替薬である[23、24]。ランダム化比較試験のデータは、非合併性膀胱炎に対する経口ホスフォマイシンの方がニトロフラントインよりも高い臨床不全と関連していることを示している[19]。ドキシサイクリンは、尿中排泄が限られているため、ESBL-E膀胱炎の治療には推奨されない[25]。
Question 2: What are preferred antibiotics for the treatment of pyelonephritis and complicated urinary tract infections (cUTIs) caused by ESBL-E?
質問2:ESBL-Eによる腎盂腎炎や複雑性尿路感染症(cUTI)の治療に好ましい抗菌薬は何か?
推奨: ESBL-Eによる腎盂腎炎およびcUTIに対しては、エルタペネム、メロペネム、イミペネム-シラスタチン、シプロフロキサシン、レボフロキサシン、またはトリメトプリム-スルファメトキサゾールが好ましい治療選択肢である。
根拠:cUTIは、生殖器管の構造的または機能的な異常に関連して発生したUTI、または男性患者のUTIと定義される。カルバペネム系薬剤、シプロフロキサシン、レボフロキサシン、トリメトプリム-スルファメトキサゾールは、臨床経験およびこれらの薬剤が尿中に高濃度になる能力に基づいて、ESBL-E型腎盂腎炎およびcUTIを有する患者に対する好ましい治療法の選択肢である。カルバペネムが開始され、シプロフロキサシン、レボフロキサシン、またはトリメトプリム-スルファメトキサゾールに対する感受性が示された場合は、カルバペネムによる治療を完遂するよりも、これらの薬剤に移行することが望ましい。このような状況でカルバペネムの使用を制限することは、将来の抗菌薬耐性感染症に対する抗菌薬の活性を維持することになる。ニトロフラントインおよび経口ホスフォマイシンは腎実質では十分な濃度に達しないため、上部尿路が感染している場合は避けるべきである [26、27]。ドキシサイクリンは、尿中排泄が制限されているため、ESBL-E腎盂腎炎またはcUTIの治療には推奨されない[25]。
Question 3: What are preferred antibiotics for the treatment of infections outside of the urinary tract caused by ESBL-E?
質問3:ESBL-Eによる尿路外感染症の治療に好ましい抗菌薬は?
推奨: ESBL-Eによる尿路外感染症の治療には、カルバペネムが好ましい。
根拠: ESBL-Eによる尿路外感染症の第一選択薬としてカルバペネムが推奨されているが、これは主に多施設ランダム化比較試験のデータに基づいている[28]。この試験では、ピペラシリン-タゾバクタムと比較して、メロペネムで治療されたESBL E. coliおよびK. pneumoniae血流感染症患者の30日死亡率が減少した [28]。他の部位の感染症については、同等の臨床試験データは得られていない。それにもかかわらず、パネルはESBL-E血流感染症のエビデンスを他の一般的な感染部位、すなわち腹腔内感染症、皮膚・軟部組織感染症、肺炎に当てはめることを推奨している。
ESBL-E非尿路感染症に対する経口ステップダウン療法の役割は正式に評価されていない。しかしながら、適切な臨床マイルストーンが観察された後、抗菌薬耐性菌分離株に起因するものを含むEnterobacterales血流感染症に対しては、経口ステップダウン療法が合理的な治療の考慮事項であることが示されている[29、30]。経口フルオロキノロンおよびトリメトプリム-スルファメトキサゾールの既知のバイオアベイラビリティおよび持続血清濃度に基づいて、これらの薬剤は、(1)経口剤に対する感受性が示され、(2)患者が解熱性および血行動態学的に安定しており、(3)適切な感染源管理が達成され、(4)腸管吸収に問題がない場合、ESBL-E感染症患者に対する合理的な治療選択肢である。
ESBL-E血流感染症に対するニトロフラントイン、ホスフォマイシン、ドキシサイクリン、アモキシシリン-クラブラン酸への経口ステップダウンは避けるべきである。ニトロフラントインとホスフォマイシンは血清中濃度が悪い。アモキシシリン-クラブラネートおよびドキシサイクリンは信頼できない血清濃度を達成し、ESBL-E血流感染症のために推奨されていません。
Question 4: Is there a role for piperacillin-tazobactam in the treatment of infections caused by ESBL-E when in vitro susceptibility to piperacillin-tazobactam is demonstrated?
質問4:ピペラシリン-タゾバクタムに対するin vitroでの感受性が示された場合、ESBL-Eによる感染症の治療にピペラシリン-タゾバクタムの役割はあるのか?
推奨: ピペラシリン-タゾバクタムは、たとえピペラシリン-タゾバクタムに対する感受性が示されていても、ESBL-Eに起因する感染症の治療には使用を避けるべきである。後にESBL-Eと同定された細菌に起因する膀胱炎の経験的治療としてピペラシリン-タゾバクタムが開始され、臨床的に改善が見られた場合には、抗菌薬治療の変更や延長は必要ない。
根拠。ピペラシリン-タゾバクタムは、多くのESBL-Eに対してin vitro活性を示している[31]。しかしながら、ESBL-E血流感染症を対象としたランダム化比較試験では、ピペラシリン-タゾバクタムはカルバペネム療法と比較して成績が劣ることが示されている[28]。浸潤性ESBL-E感染症の治療におけるピペラシリン-タゾバクタムの有効性は、微生物がESBL酵素の発現を増加させる可能性があること、または複数のβ-ラクタマーゼが存在することによって低下する可能性がある[32]。さらに、ピペラシリン-タゾバクタムのMIC検査は、ESBL酵素が存在する場合、不正確であり、および/または再現性が低いかもしれません [33-35]。
Question 5: Is there a role for cefepime in the treatment of infections caused by ESBL-E when in vitro susceptibility to cefepime is demonstrated?
質問5:セフェピムに対するin vitroでの感受性が示された場合、ESBL-Eによる感染症の治療にセフェピムの役割はあるのか?
推奨: ESBL-E に起因する感染症の治療には、たとえセフェピムに対する感受性が示されていても、セフェピムは避けるべきである。セフェピムが後で ESBL-E として識別された微生物によって引き起こされる膀胱炎のための経験的療法として始められ、臨床改善が起これば、抗菌薬療法の変更か延長は必要ではない。
根拠: 観察研究と、侵襲性ESBL-E感染症の治療のためにセフェピムとカルバペネム系抗菌薬を比較した無作為化試験における23人の患者のサブグループ分析では、セフェピムの方が転帰に差がないか、または転帰が悪いことが示された[36-39]。ESBL 酵素が存在する場合、セフェピム の MIC テストは不正確であるかもしれないし、再現性が低いかもしれない [33, 34, 40]。
Question 6: What are preferred antibiotics in the treatment of infections caused by E. coli, K. pneumoniae, K. oxytoca, or P. mirabilis not susceptible to ceftriaxone if confirmatory phenotypic ESBL testing is negative?
質問6:確認的表現型ESBL検査が陰性の場合、セフトリアキソンに感受性のないE. coli, K. pneumoniae, K. oxytoca, or P. mirabilisによる感染症の治療における好ましい抗生物質は何か?
推奨: 抗菌薬治療の選択は、局所的に検証されたESBL表現型検査でESBL産生を示さない場合、感受性検査の結果に基づいて行うことができる。
根拠: 現在、CLSI(Clinical and Laboratory Standards Institute)が承認したESBLの確認検査用の表現型検査法は存在しない[18]。ESBLの表現型検査を実施していない臨床微生物検査室を持つ病院では、セフトリアキソンのMIC > 2 mcg/mLを大腸菌、K. pneumoniae、K. oxytoca、またはP. mirabilisによるESBL産生の代理として使用すべきである [18]。臨床分離株によるESBL産生の可能性を除外するための表現型検査(例えば、ダブルディスクシナジーテスト、ETEST®、自動化された感受性プラットフォームアルゴリズム)は、注意して解釈すべきである。結果は、臨床的な意思決定のために、現地の研究室で検査の妥当性を確認した後にのみ使用すべきである[41, 42]。
Question 7: What is the preferred antibiotic for the treatment of bloodstream infections caused by ceftriaxone non-susceptible E. coli, K. pneumoniae, K. oxytoca, or P. mirabilis, if a blaCTX-M gene is not detected using a molecular platform that includes this target?
質問7:セフトリアキソン非感受性大腸菌、K. pneumoniae、K. oxytoca、または P. mirabilis による血流感染症の治療に好ましい抗菌薬はどれか? このターゲットを含む分子プラットフォームを用いて blaCTX-M 遺伝子が検出されなかった場合の治療に好ましい抗菌薬はどれか?
推奨: blaCTX-M遺伝子が検出されないことは、他のESBL遺伝子の存在を排除するものではないので、セフトリアキソンに感受性のない大腸菌、肺炎球菌、オキシトカ菌、またはミラビリス菌にblaCTX-M遺伝子が検出されない場合には、カルバペネム療法を行うことが望ましい。
根拠: 陽性血液培養物からのβ-ラクタマーゼ遺伝子検出のための市販の分子プラットフォーム(例えば、Verigene® グラム陰性血液培養検査、GenMark ePlex® 血液培養識別グラム陰性パネルなど)は、ESBL の検出を blaCTX-M 遺伝子に限定している。セフトリアキソンに感受性のない大腸菌、K. pneumoniae、K. oxytoca、および P. mirabilis に blaCTX-M 遺伝子が存在しない(すなわち、セフトリアキソン MIC > 1 mcg/mL)ことは、他の ESBL 遺伝子(例えば、blaSHV、blaTEM)の存在を排除するものではありません。したがって、少なくとも初期には、カルバペネム療法が推奨される。
Carbapenem-Resistant Enterobacterales
CRE は 13,000 以上の院内感染を占め、米国では毎年 1,000 人以上の死亡者を出しています [2]。CDCはCREを、少なくとも1種のカルバペネム系抗菌薬に耐性を持つ、またはカルバペネマーゼ酵素を産生するEnterobacterales属のメンバーと定義している[2]。CRE分離株は、一部のカルバペネム系抗菌薬(例えば、エルタペネム)には耐性があっても、他の抗菌薬(例えば、メロペネム)には耐性がない場合がある。CREは、複数の潜在的な耐性機序を持つ異種病原体のグループであり、カルバペネマーゼ産生株と非産生株に大別される。カルバペネマーゼ産生株は、米国における全CRE感染症の約半数を占めている[43-45]。米国で最も一般的なカルバペネマーゼはKlebsiella pneumoniae carbapenemases(KPC)であり、これはあらゆるEnterobacteralesによって産生される可能性がある。米国ですべて同定されている他の注目すべきカルバペネマーゼには、ニューデリーメタロ-β-ラクタマーゼ(NDM)、ベローナインテグロン-エンコードメタロ-β-ラクタマーゼ(VIM)、イミペネム-加水分解メタロ-β-ラクタマーゼ(IMP)、およびオキサシリナーゼ(例えば、OXA-48様)カルバペネマーゼが含まれる[46、47]。CRE臨床分離株がカルバペネマーゼ産生株であるかどうか、および産生株である場合、産生される特異的なカルバペネマーゼについての知識は、治療の決定を導く上で重要である。
修正カルバペネム不活化法およびカルバNP試験などの表現型検査は、カルバペネマーゼおよび非カルバペネマーゼ産生CREを鑑別することができる[48]。分子検査は、特定のカルバペネマーゼファミリーを同定することができる(例えば、KPCとOXA-48様カルバペネマーゼとの鑑別)。カルバペネマーゼ遺伝子を同定するために米国の臨床微生物検査室で使用されている分子プラットフォームがいくつかある(例えば、Verigene® グラム陰性血液培養検査、GenMark ePlex® 血液培養同定グラム陰性パネル、BioFire® FilmArray® 血液培養同定パネルなど)。表現型および/または遺伝子型検査は、すべての臨床微生物検査施設で実施されているわけではありません。Table. 3は、CRE感染症に対する推奨治療法とそれに代わる治療法の概要を示しています。CRE感染症に対する治療推奨は、好ましい抗菌薬および代替抗菌薬のin vitro活性が実証されていることを前提としている。


このセクションで扱われている質問は以下の通りです。
1. CREによる非合併性膀胱炎の治療に好ましい抗菌薬は何ですか?
2. CRE による腎盂腎炎および合併性尿路感染症(cUTI)の治療に好ましい抗菌薬は何か?
3. カルバペネマーゼ検査の結果が得られない、または陰性の場合、エルタペネムには耐性があるがメロペネムには感受性があるCREによる尿路感染症以外の感染症の治療に好ましい抗菌薬は何ですか?
4. エルタペネムとメロペネムの両方に耐性のあるCREによる尿路外感染症の治療のために、カルバペネマーゼ検査の結果が得られないか、陰性である場合に好ましい抗菌薬は何ですか?
5. カルバペネマーゼ産生が認められる場合のCREに起因する尿路外感染症の治療に好ましい抗菌薬はどれか?
6. CREによる感染症の治療におけるポリミキシンの役割は?
7. CREによる感染症の治療における併用抗菌薬療法の役割は何ですか?
Question 1: What are preferred antibiotics for the treatment of uncomplicated cystitis caused by CRE?
1. CREによる非合併性膀胱炎の治療に好ましい抗菌薬は何ですか?
推奨: CREによる合併症を伴わない膀胱炎に対しては、シプロフロキサシン、レボフロキサシン、トリメトプリム-スルファメトキサゾール、ニトロフラントイン、またはアミノグリコシドの単回投与が好ましい治療選択肢である。カルバペネマーゼ検査の結果が得られないか、または陰性である場合には、標準的な注射用メロペネムは、エルタペネムには抵抗性があるがメロペネムには感受性があるCREに起因する膀胱炎に好ましい治療法である。
根拠: CRE膀胱炎に対するほとんどの好ましい薬剤の有効性を評価した臨床試験データは得られていない。しかしながら、これらの薬剤は尿中に高濃度で存在するため、活性があればCRE膀胱炎に有効であると期待される。ESBL-E膀胱炎の代替選択肢として挙げられているいくつかの薬剤は、CRE膀胱炎のための好ましい薬剤として推奨される。これらの薬剤は、より侵襲性の高い感染症に対する活性を温存するために、ESBL-E膀胱炎の治療において好ましくは回避される。これらの薬剤は、これらの感染症に対する治療選択肢が一般に少ないため、CRE膀胱炎に対する好ましい薬剤である。
アミノグリコシドは、活性型ではほぼ独占的に腎経路で排除される。膀胱炎には一般的に単回の静脈内投与が有効であり、毒性は最小限である[22]。個々のアミノグリコシドは、感受性が証明されれば同様に有効である。一般的に、CRE臨床分離株の割合は他のアミノグリコシドよりもアミカシンとプラゾマイシンに感受性が高い[49, 50]。プラゾマイシンはアミカシンに耐性のある分離株に対しても活性を維持している可能性がある。
メロペネムは、メロペネムに感受性のある分離株のほとんどがカルバペネマーゼを産生しないため、CRE膀胱炎に対して好ましい薬剤である[44]。カルバペネマーゼ検査が陽性の場合は、たとえメロペネムに対する感受性が示されていても、メロペネムは避けるべきである。
好ましい薬剤がいずれも有効でない場合、CRE膀胱炎に対する代替選択肢として、セフタジジム-アビバクタム、メロペネム-バボルバクタム、イミペネム-シラスタチン-レレバクタム、およびセフィデロールがある [51-55]。1つの薬剤を他の薬剤よりも有利にするにはデータが不十分である。ある臨床試験では、カルバペネム耐性グラム陰性菌によるさまざまな感染症に対してセフィデロールを用いた場合、最善の治療法と比較して死亡率が増加することが示されたが、これらの知見は尿路感染症には及ばないようである [54, 56]。フォスフォマイシンの使用は大腸菌膀胱炎に限定すべきであるが、その理由は、fos A遺伝子(Klebsiella種、Enterobacter spp.およびSerratia marcescensなどの特定のグラム陰性菌に内在する)がフォスフォマイシンを加水分解し、臨床的な失敗につながる可能性があるからである [23、24]。ランダム化比較試験のデータは、非合併性膀胱炎に対する経口ホスフォマイシンの方がニトロフラントインよりも高い臨床失敗と関連していることを示している[19]。
コリスチンは、上記の薬剤のどれもが選択肢にない場合にのみ、CRE膀胱炎を治療するための代替手段として検討される。コリスチンは尿路で活性型に変換される;臨床家は腎毒性のリスクを認識しておくべきである[57]。ポリミキシンBはCRE膀胱炎の治療薬として使用すべきではない。
Question 2: What are preferred antibiotics for the treatment of pyelonephritis and complicated urinary tract infections (cUTIs) caused by CRE?
2. CRE による腎盂腎炎および合併性尿路感染症(cUTI)の治療に好ましい抗菌薬は何か?
推奨: セフジジム-アビバクタム、メロペネム-バーボルバクタム、イミペネム-シラスタチン-レレバクタム、およびセフィデロールは、エルタペネムおよびメロペネムの両方に耐性のあるCREに起因する腎盂腎炎およびcUTIに対する好ましい治療選択肢である。エルタペネムには耐性があるがメロペネムには感受性があるというCREに起因する腎盂腎炎およびcUTIに対しては、カルバペネマーゼ検査の結果が得られないか、または陰性である場合には、メロペネム徐注療法が好ましい治療法の選択肢である。
理由:cUTIは、生殖器管の構造的または機能的な異常に関連して発生したUTI、または男性患者のUTIと定義される。Ceftazidime-avibactam、meropenem-vaborbactam、imipenem-cylastatin-relebactam、およびcefiderocolは、UTIに対する一般的な比較薬に対するこれらの薬剤の非劣性を示すランダム化比較試験に基づいて、ertaapenemおよびmeropenemの両方に耐性のあるCREに起因する腎盂腎炎およびcUTIに対する好ましい治療選択肢である[51-55]。一方の薬剤を他方の薬剤よりも有利にするにはデータが不十分である。ある臨床試験では、カルバペネム耐性グラム陰性菌によるさまざまな感染症に対してセフィデロールを用いた場合、最善の治療法と比較して死亡率が増加することが示されたが、これらの知見はUTIには及ばないようである[54, 56]。
これらの分離株のほとんどはカルバペネマーゼを産生しないため、メロペネムの感受性が残っているCREによる腎盂腎炎およびcUTIに対しては、メロペネムの持続注入が好ましい薬剤である[44]。カルバペネマーゼ検査が陽性の場合は、たとえメロペネムに対する感受性が示されていても、メロペネムは避けるべきである。
腎毒性の可能性が許容できると考えられる患者では、1日1回のアミノグリコシドによる全治療コースでの投与が代替の選択肢となる。1日1回投与のプラゾマイシンは、Enterobacteralesによる腎炎およびcUTIを有する患者を対象としたランダム化比較試験において、メロペネムよりも非劣性であり、いくつかの分離株が薬剤耐性表現型を示した [58]。個々のアミノグリコシドは、感受性が示された場合には等しく有効である。一般的に、CRE臨床分離株の割合は他のアミノグリコシドに比べてアミカシンおよびプラゾマイシンに感受性が高い [49, 50]。プラゾマイシンはアミカシンに耐性を持つ分離株に対しても活性を維持している可能性がある。経口ホスフォマイシンは腎実質では適切な濃度に達しないため、上部尿路に感染している場合は避けるべきである [27]。
Question 3: What are preferred antibiotics for the treatment of infections outside of the urinary tract caused by CRE resistant to ertapenem but susceptible to meropenem, when carbapenemase testing results are either not available or negative?
3. カルバペネマーゼ検査の結果が得られない、または陰性の場合、エルタペネムには耐性があるがメロペネムには感受性があるCREによる尿路感染症以外の感染症の治療に好ましい抗菌薬は何ですか?
推奨: カルバペネマーゼ検査の結果が得られないか、または陰性の場合、エルタペネムには耐性があるがメロペネムには感受性があるCREによる尿路外感染症に対しては、メロペネムの長時間投与療法が好ましい治療法である。
根拠:CREによる尿路外の感染症で、メロペネムに感受性が残っている分離株のほとんどがカルバペネマーゼを産生しないため、メロペネムの持続注入が推奨される[44]。カルバペネマーゼ検査が陽性の場合は、たとえメロペネムに対する感受性が示されていても、メロペネムは避けるべきである。
Ceftazidime-avibactamは、尿路外のエルタペネム耐性、メロペネム感受性のCRE感染症に対する代替治療法である。しかし、パネルはセフジジム-アビバクタムの活性を維持するため、すべてのカルバペネム系薬剤に耐性のあるCREによる感染症の治療にはセフジジム-アビバクタムを使用することを推奨している。カルバペネマーゼ産生がある場合、感染症はメロペネムMICにかかわらず、原因菌がメロペネム耐性であるかのように治療すべきである。パネルは、CREに起因するエルタペネム耐性のメロペネム感受性感染症の治療に、メロペネム-バボルバクタムまたはイミペネム-シラスタチン-リレバクタムを使用することを推奨しているが、これらの薬剤には、メロペネムの長時間投与療法以上の大きな利点はない。
Question 4: What are the preferred antibiotics for the treatment of infections outside of the urinary tract caused by CRE resistant to both ertapenem and meropenem, when carbapenemase testing results are either not available or negative?
4. エルタペネムとメロペネムの両方に耐性のあるCREによる尿路外感染症の治療のために、カルバペネマーゼ検査の結果が得られないか、陰性である場合に好ましい抗菌薬は何ですか?
推奨: Ceftazidime-avibactam、meropenem-vaborbactam、およびimipenem-cylastatin-relebactamは、カルバペネマーゼ検査の結果が得られないか、または陰性である場合に、ertaapenemおよびmeropenemの両方に耐性のあるCREに起因する尿路外の感染症に対して好ましい治療法である。
根拠:米国では、エルタペネムとメロペネムの両方に耐性を持つCREによる感染症の大部分は、カルバペネマーゼを産生しない菌、またはKPC-カルバペネマーゼを産生する菌によって引き起こされている[44]。Ceftazidime-avibactam、meropenem-vaborbactam、およびimipenem-cylastatin-relebactamは、カルバペネマーゼの状態に関する追加情報がなくても、ertaapenemおよびmeropenemの両方に耐性のあるCRE感染症に対する好ましい治療選択肢である。これらの薬剤は、一般的にポリミキシンベースのCRE感染症の治療に一般的に使用される他のレジメンと比較して、臨床成績の改善および毒性の軽減と関連している [59-63]。
好ましい薬剤間の有効性の比較研究は限られている。CRE感染症患者131人を対象とした観察研究では、セフタジジム-アビバクタムまたはメロペネム-バボルバクタムで治療された患者間で臨床転帰に差がないことが明らかになった[64]。イミペネム-シラスタチン-リレバクタムの臨床情報は、CRE感染症の治療に好まれる他の治療法に比べて著しく少ない。しかしながら、この組み合わせのCREに対するin vitro活性 [65-67]、イミペネム-シラスタチンの臨床経験、およびβ-ラクタマーゼ阻害剤としてのレバクタムの安定性 [68] は、イミペネム-シラスタチン-レバクタムがCRE感染症に有効である可能性が高いことを示唆している。
入手可能なデータによると、それぞれの薬剤に曝露した後のセフタジジム-アビバクタム耐性の出現は、メロペネム-バボルバクタム耐性の出現よりも一般的であることが示唆されている[64, 69-73]。これらの薬剤のそれぞれがより広範囲に使用されるようになるにつれ、耐性および比較有効性に関する追加データが出現することが予想される。
セフィデロールは、カルバペネム系薬剤に対する耐性のメカニズムにかかわらず、CRE感染症の代替治療選択肢である。セフィデロールは、他の方法では高耐性の表現型を持つ分離株を含め、CREに対してin vitroでの信頼性の高い活性を有している[74-76]。臨床試験では、118人の患者におけるカルバペネム耐性グラム陰性感染症の治療において、セフィデロールがコリスチンをベースとしたレジメンで構成されることが多い最善の治療法と比較された;患者の51%がCREに感染していた[56]。28日目の死亡率はセフィデロール群で高かった。これらの所見は肺炎と血流感染症の治療において最も顕著であった。セフィデロールを尿路以外の場所で効果的かつ安全に使用できる患者層を定義するためのデータがより多く得られるまでは、本剤は不耐性や抵抗性のために好ましい薬剤が使用できないCRE感染症にのみ使用することが推奨される。
患者がカルバペネマーゼの状態が不明なCRE株に感染しており、メタロ-β-ラクタマーゼが常在する地域(例:中東、南アジア、地中海)から最近渡航した患者である場合 [77]、セフタジム-アビバクタム+アズトレオナム、またはセフィデロール単剤での治療が推奨される。メタロ-β-ラクタマーゼ産生菌に起因する感染症に対する好ましい治療アプローチは、KPCまたはOXA-48様酵素を産生する細菌に対する活性も提供する。
腹腔内感染症を有する患者では、チゲサイクリンおよびエラバシクリンは許容可能な単剤療法の選択肢である;高用量チゲサイクリンは、表1に記載されているように、複雑な腹腔内感染症にはより有効であるかもしれない[78-80]。これらの活性は、カルバペネマーゼの存在や種類とは無関係である。パネルは、腹腔内感染以外のCRE感染症の治療にはチゲサイクリンまたはエラバシクリンの使用を避けることを推奨している。これらの薬剤は投与後に急速に組織内に分布し、その結果、尿中濃度が制限され、血清中濃度が低い[81]。
Question 5: What are the preferred antibiotics for the treatment of infections outside of the urinary tract caused by CRE if carbapenemase production is present?
5. カルバペネマーゼ産生が認められる場合のCREに起因する尿路外感染症の治療に好ましい抗菌薬はどれか?
推奨: 尿路以外のKPC産生感染症に対しては、Ceftazidime-avibactam、meropenem-vaborbactam、およびimipenem-cylastatin-relebactamが好ましい治療選択肢である。NDMおよびその他のメタロ-β-ラクタマーゼ産生CRE感染症に対しては、セフタジジム-アビバクタムとアズトレオナムの併用療法、またはセフィデロールの単剤療法が好ましい治療選択肢である。セフジジム-アビバクタムは、OXA-48-like産生CRE感染症に対する好ましい治療法である。
根拠: Ceftazidime-avibactam、meropenem-vaborbactam、およびimipenem-cylastatin-relebactamは、米国で最も一般的なカルバペネマーゼであるKPC酵素を産生するEnterobacteralesに対して活性を示す [65、66、82-84]。疾患の原因となるEnterobacteralesがカルバペネマーゼ産生株であるが、特定のカルバペネマーゼ酵素が不明である場合、その株がKPC産生株であるかのように治療するのが妥当である。好ましい薬剤の比較有効性研究は限られている。CRE感染症患者131人を対象とした観察研究では、ceftazidime-avibactamまたはmeropenem-vaborbactamによる治療後の臨床転帰に差は認められなかった[64]。イミペネム-シラスタチン-リレバクタムの臨床情報は、CRE感染症の治療に好まれる他の治療法に比べて著しく少ない。しかしながら、この組み合わせのCREに対するin vitro感受性活性 [65-67]、イミペネム-シラスタチンの臨床経験、およびβ-ラクタマーゼ阻害剤としてのレバクタムの安定性 [68] は、イミペネム-シラスタチン-レバクタムがCRE感染症に有効である可能性が高いことを示唆している。入手可能なデータによると、それぞれの薬剤に曝露した後のセフタジジム-アビバクタム耐性の出現は、メロペネム-バボルバクタム耐性の出現よりも一般的であることが示唆されている[64, 69-73]。これらの薬剤のそれぞれがより広範囲に使用されるようになるにつれ、耐性と比較有効性に関するデータが追加されることが予想される。
メタロ-β-ラクタマーゼ(すなわちNDM、VIM、またはIMP)が同定された場合、好ましい抗菌薬の選択肢には、セフタジジム-アビバクタム+アズトレオナム、またはセフィデロール単剤療法がある [85-89]。これら2つの治療法を比較した臨床転帰データは得られていない。
OXA-48様酵素が同定された場合は、セフタジジム-アビバクタムが好まれ、セフィデロールが代替選択肢となる。メロペネム-バボルバクタムおよびイミペネム-シラスタチン-レレバクタムは、CRE産生のOXA-48様酵素に対する活性は限られているが、全くない。
腹腔内感染症の患者では、チゲサイクリンおよびエラバシクリンの単剤療法が許容可能な選択肢である;Table 1に記載されているように、複雑な腹腔内感染症には高用量チゲサイクリンの方が有効であるかもしれない[78-80]。チゲサイクリンの活性はカルバペネマーゼの存在とは無関係である。パネルは、腹腔内感染以外のCRE感染症の治療にはチゲサイクリンまたはエラバシクリンの使用を避けることを推奨している。これらの薬剤は投与後に急速に組織内に分布し、その結果、尿中濃度が制限され、血清中濃度が低下する [81]。
Question 6: What is the role of polymyxins for the treatment of infections caused by CRE?
6. CREによる感染症の治療におけるポリミキシンの役割は?
推奨: CREによる感染症の治療には、ポリミキシンBとコリスチンは避けるべきである。コリスチンは、合併症を伴わないCRE膀胱炎に対する最後の手段として考えられます。
根拠: 観察的およびランダム化比較対照試験のデータは、ポリミキシンをベースとしたレジメンに関連した死亡率および過剰な腎毒性の増加を示している [59-61, 63]。ポリミキシンの臨床的有効性およびin vitroポリミキシン感受性試験の精度に関する懸念から、臨床検査標準化機構(Clinical and Laboratory Standards Institute)はコリスチンおよびポリミキシンBの感受性カテゴリーを撤廃した [18]。パネルは、CRE感染症の治療には、CRE膀胱炎に対する最後の手段としてのコリスチンを除き、これらの薬剤を避けることを推奨している。
Question 7: What is the role of combination antibiotic therapy for the treatment of infections caused by CRE?
7. CREによる感染症の治療における併用抗菌薬療法の役割は何ですか?
推奨: 抗菌薬の併用療法(すなわち、アミノグリコシド、フルオロキノロン、またはポリミキシンとのβ-ラクタム剤の併用)は、CREによる感染症の治療には日常的には推奨されない。
根拠: CRE感染症のリスクがある患者に対して、少なくとも1種類の有効な治療薬の使用可能性を広げるための経験的な抗菌薬の併用療法は合理的であるが、β-ラクタム系薬剤がin vitroで活性を示した後に併用療法を継続しても、それ以上の有益性が得られるというデータはない[90]。むしろ、第二剤の継続使用は抗菌薬関連の有害事象の可能性を高める [90]。
CRE感染症を治療するための併用レジメンとceftazidime-avibactam、meropenem-vaborbactam、およびimipenem-cilastatin-relebactamを比較した観察データおよび臨床試験では、後者に付加価値があることは示されていない[59-63]。これらの薬剤を単剤療法として、または併用療法の一部として比較したランダム化試験データはない(例:セフタジジム-アビバクタム vs セフタジジム-アビバクタムとアミカシン)。しかしながら、利用可能な転帰データ、臨床経験、およびアミノグリコシド、フルオロキノロンおよびポリミキシンに関連する既知の毒性に基づいて、専門家パネルは、好ましいβ-ラクタム系薬剤に対する感受性が示されている場合には、CRE感染症に対する併用療法を推奨していない。
Difficult-to-Treat Resistance (DTR) Pseudomonas aeruginosa
CDCの報告によると、2017年に米国で入院した患者で32,600例の多剤耐性P. aeruginosa感染症が発生し、2,700人が死亡した[2]。多剤耐性とは、一般的にP. aeruginosaの感受性が期待されるペニシリン系、セファロスポリン系、フルオロキノロン系、アミノグリコシド系、カルバペネム系の少なくとも3つのクラスの抗菌薬に対して、少なくとも1種類の抗菌薬に対して感受性を示さないことと定義されています。2018年には、「難治性」耐性(DTR)という概念が提唱された[5]。このガイダンス文書では、DTRとは、ピペラシリン-タゾバクタム、セフタジジム、セフピム、アズトレオナム、メロペネム、イミペネム-シラスタチン、シプロフロキサシン、レボフロキサシンのすべてに対して非感受性を示すP. aeruginosaと定義されている。Table. 4は、DTR-P. aeruginosa 感染症に対する推奨治療法と代替治療法の概要を示しています。DTR-P. aeruginosa感染症に対する治療推奨は、好ましい抗菌薬および代替抗菌薬のin vitro活性が実証されていることを前提としている。

このセクションで扱われている質問は以下の通りです。
1. DTR-P. aeruginosa に起因する非合併性膀胱炎の治療に好ましい抗菌薬は何か?
2. DTR-P. aeruginosa に起因する腎盂腎炎および合併性尿路感染症(cUTI)の治療に好ましい抗菌薬は何ですか?
3. DTR-P. aeruginosaによる尿路感染症以外の感染症の治療に好ましい抗菌薬は?
4. DTR-P. aeruginosaによる感染症の治療における抗菌薬の併用療法の役割は?
Question 1: What are preferred antibiotics for the treatment of uncomplicated cystitis caused by DTR-P. aeruginosa?
1. DTR-P. aeruginosa に起因する非合併性膀胱炎の治療に好ましい抗菌薬は何か?
推奨: DTR-P. aeruginosaによる非合併性膀胱炎に対しては、セフトロザン-タゾバクタム、セフタジジム-アビバクタム、イミペネム-シラスタチン-レレバクタム、セフィデロール、またはアミノグリコシドの単回投与が好ましい治療法である。
根拠: セフトロザン-タゾバクタム、セフタジジム-アビバクタム、イミペネム-シラスタチン-レレバクタム、およびセフィデロールは、尿路感染症の一般的な比較薬に対するこれらの薬剤の非劣性を示すランダム化比較試験に基づいて、合併症を伴わないDTR P. aeruginosa 膀胱炎に対する好ましい治療選択肢である [52、54、55、91]。いずれかの薬剤が他の薬剤よりも優れているというデータは不十分であり、利用可能な試験には一般的にDTR表現型を持つ病原体に感染した患者が含まれていない。ある臨床試験では、カルバペネム耐性グラム陰性菌によるさまざまな感染症に対して、セフィデロールは最善の治療法と比較して死亡率の増加を示したが、これらの知見は尿路感染症には及ばないようである[54, 56]。
アミノグリコシドの単回投与も好ましい治療オプションである。アミノグリコシドは、活性型ではほぼ独占的に腎経路で排除される。膀胱炎には単回静脈内投与が一般的に有効であり、毒性は最小限であるが、膀胱炎に対するアミノグリコシドの活性を正式に評価するための堅牢な試験データが不足している[22]。他のすべてのアミノグリコシドに対する耐性が証明された場合、プラゾマイシンはDTR-P. aeruginosaに対して増分的な効果をもたらす可能性は低いと考えられています [92]。
DTR-P. aeruginosa 膀胱炎の治療には、ポリミキシンBではなくコリスチンを使用することも考えられるが、コリスチンは尿路で活性型に変換されるため、腎毒性のリスクを考慮しておく必要がある[57]。パネルは、DTR-P. aeruginosa 膀胱炎に対する経口ホスフォマイシンの使用を推奨していないが、これは臨床的に失敗する可能性が高いためである[93, 94]。これは、P. aeruginosaに内在するfos A遺伝子の存在によるものである[23]。
Question 2: What are preferred antibiotics for the treatment of pyelonephritis and complicated urinary tract infections (cUTI) caused by DTR-P. aeruginosa?
2. DTR-P. aeruginosa に起因する腎盂腎炎および合併性尿路感染症(cUTI)の治療に好ましい抗菌薬は何ですか?
推奨: DTR-P. aeruginosaによる腎盂腎炎およびcUTIに対しては、セフトロザン-タゾバクタム、セフタジジム-アビバクタム、イミペネム-シラスタチン-レレバクタム、およびセフィデロールが好ましい治療選択肢である。
根拠:cUTIは、生殖器管の構造的または機能的な異常に関連して発生したUTI、または男性患者のUTIと定義されている。セフトロザン-タゾバクタム、セフタジジム-アビバクタム、イミペネム-シラスタチン-リレバクタム、およびセフィデロールは、これらの薬剤が一般的な比較対照薬に比べて非劣性であることを示すランダム化比較試験に基づいて、DTR-P. aeruginosa膿腎炎およびcUTIに対する好ましい治療選択肢である[52、54、55、91]。いずれかの薬剤を他の薬剤よりも有利にするにはデータが不十分であり、利用可能な試験には一般的にDTRの表現型が含まれていない。ある臨床試験では、カルバペネム耐性グラム陰性菌による様々な感染症に対して、セフィデロールは最善の治療法と比較して死亡率の増加を示したが、これらの知見は尿路感染症には及ばないようである [54, 56]。
腎毒性の可能性が認められる患者では、1日1回のアミノグリコシドが代替の選択肢となる。プラゾマイシンは、他のすべてのアミノグリコシドに対する耐性が証明された場合、DTR-P. aeruginosaに対して増分的な利益を提供する可能性は低い [92]。DTR-P. aeruginosaの腎盂腎炎およびcUTIに対しては、ホスフォマイシンの経口投与は避けるべきである。これは、フォスフォマイシン耐性をもたらすP. aeruginosaに内在するfosA遺伝子の存在、および経口フォスフォマイシンが腎実質で適切な濃度に達しないためである [23, 27]。
Question 3: What are preferred antibiotics for the treatment of infections outside of the urinary tract caused by DTR-P. aeruginosa?
3. DTR-P. aeruginosaによる尿路感染症以外の感染症の治療に好ましい抗菌薬は?
推奨: DTR-P. aeruginosaによる尿路外感染症の治療には、単剤療法としてセフトロザン-タゾバクタム、セフトジジム-アビバクタム、およびイミペネム-シラスタチン-リレバクタムが好ましい治療選択肢である。
根拠: セフトロザン-タゾバクタム、セフタジジム-アビバクタム、およびイミペネム-シラスタチン-リレバクタムは、既知のin vitro活性、観察研究、および臨床試験データに基づいて、尿路外のDTR-P. aeruginosa感染症の治療には単剤療法として好ましい選択肢である [52、63、82、84、95-104]。これらの観察研究および臨床試験データの大半には、DTR-P. aeruginosa感染症の患者は含まれていない。DTR-P. aeruginosa感染症に対するこれら3つの薬剤の有効性を比較した臨床転帰研究は利用できません。
緑膿菌の臨床分離株のうち、ceftolozan-tazobactamに感受性を示す割合は、一般的に比較対象となる薬剤に感受性を示す割合よりも高い。これは、セフトロザンが不活性な薬剤に対する感受性を回復させるために阻害剤に依存しないためであろう(すなわち、セフトロザンはDTR-P. aeruginosaに対して独立した活性を有している)。ceftazidimeもimipenemもDTR-P. aeruginosaに対しては活性がない。アビバクタムおよびリレバクタムは、主にAmpCの阻害を通じてこれらの薬剤の活性を拡大するが、他の複合的な抵抗性メカニズムには影響を与えないと考えられる。セフトロザン-タゾバクタムとセフタジジム-アビバクタムは作用機序が類似しているため[105]、これらの薬剤間で交差耐性が観察される可能性がある[106]。
セフィデロールは代替治療の選択肢である。セフィデロールは、そうでなければ高度な耐性表現型を持つ分離株を含む緑膿菌に対してin vitroでの信頼性の高い活性を有している [74-76]。臨床試験では、118人の患者におけるカルバペネム耐性グラム陰性感染症の治療において、セフィデロールがコリスチンをベースとしたレジメンからなることが多い最善の治療法と比較された;患者の24%が緑膿菌に感染していた[56]。28日目の死亡率はセフィデロール群で高かった。これらの知見は肺炎と血流感染症の治療において最も顕著であった。セフィデロコロールを尿路外で効果的かつ安全に使用できる患者層を定義するためのデータが増えるまでは、本剤は不耐性または抵抗性のために好ましい薬剤が使用できないDTR-P. aeruginosa感染症にのみ使用することが推奨されます。
アミノグリコシド単剤療法(尿路外)は、好ましい治療法がない場合には、合併症を伴わない血流感染症(すなわち、尿路感染源や、感染した血管カテーテルの抜去など、コントロールが可能な他の感染源)に限定すべきである。プラゾマイシンは、他のすべてのアミノグリコシドに対する耐性が証明された場合、DTR-P. aeruginosaに対して増分的な利益をもたらす可能性は低いと考えられています[92]。
Question 4: What is the role of combination antibiotic therapy for the treatment of infections caused by DTR-P. aeruginosa?
4. DTR-P. aeruginosaによる感染症の治療における抗菌薬の併用療法の役割は?
推奨: DTR-P. aeruginosaによる感染症では、第一選択抗菌薬(すなわち、セフトロザン-タゾバクタム、セフジジム-アビバクタム、またはイミペネム-シラサチン-レレバクタム)に対するin vitroでの感受性が確認されている場合、抗菌薬の併用療法は日常的には推奨されない。
根拠。DTR-P. aeruginosa感染症のリスクがある患者に対して、少なくとも1つの有効な治療薬の可能性を広げるための経験的な抗菌薬併用療法(すなわち、β-ラクタム系薬剤にアミノグリコシドまたはポリミキシンを追加すること)は合理的であるが、β-ラクタム系薬剤がin vitro活性を示した後に、β-ラクタム系薬剤の単剤療法よりも付加的な利益をもたらす併用療法を継続することは、データでは示されていない[90]。むしろ、第2剤の継続使用は抗菌薬関連の有害事象の可能性を高める [90]。
薬剤耐性P. aeruginosa感染症に対して通常単剤で投与されるセフトロザン-タゾバクタムとイミペネム-シラスタチン-リレバクタムを併用レジメンと比較した観察データおよび臨床試験では、セフトロザンが付加価値を持つことは示されていない [63, 98]。セフトロザン-タゾバクタム、セフタジジム-アビバクタム、またはイミペネム-シラスタチン-リレバクタムを単剤療法と併用療法の構成要素として比較したランダム化試験データは得られていない(例えば、セフタジジム-アビバクタムとセフタジジム-アビバクタムおよびアミカシンの比較)。利用可能な転帰データ、臨床経験、アミノグリコシドおよびポリミキシンに関連する既知の毒性に基づいて、パネルは、好ましいβ-ラクタム系薬剤に対する感受性が示されている場合には、DTR-P. aeruginosa感染症に対しては併用療法は日常的には推奨されないことに同意する。
好ましい薬剤がDTR-P. aeruginosaに対して活性を示すものがない場合、アミノグリコシド(感受性が示されている場合)は、セフトロザン-タゾバクタム、セフジジム-アビバクタム、またはイミペネム-シラスタチン-リレバクタムのいずれかとの併用を検討し、MICが感受性のブレークポイントに最も近いβ-ラクタム-β-ラクタマーゼ阻害剤を優先的に選択することができる。例えば、DTR-P. aeruginosa分離株に対するceftolozan-tazobactamおよびceftazidime-avibactamのMICがともに128/4 mcg/mLを超え(高耐性[18, 107])、imipenem-cylastatin-relebactamのMICが4/4 mcg/mL(中間カテゴリー[107])であれば、活性アミノグリコシドと組み合わせたimipenem-cylastatin-relebactamが好まれるべきである。このアプローチの有用性を示すデータが不足しており、最後の手段として検討すべきである。同様に、このアプローチが単剤療法または併用療法としてセフィデロールと比較して良好な臨床結果をもたらすかどうかのデータが不足しています。アミノグリコシドがin vitro活性を示さない場合、ポリミキシンBはβ-ラクタム-β-ラクタマーゼ阻害剤との併用を検討することができる。ポリミキシンBは、(1)プロドラッグとして投与されないため、コリスチンよりも信頼性の高い血漿中濃度を得ることができ、(2)腎毒性のリスクが低いため、非尿路感染症ではコリスチンよりも好ましいが、研究の限界により、腎毒性のリスクの差を正確に決定することはできない[108-113]。
Conclusions
AMRの分野はダイナミックで急速に進化しており、抗菌薬耐性感染症の治療は臨床家の挑戦を続けていくことになるだろう。耐性病原体に対する新しい抗菌薬が臨床現場に取り入れられるにつれ、その有効性や耐性化の傾向についてより多くの情報が得られるようになってきている。このAMR治療ガイダンス文書は、新しいエビデンスに基づくデータを取り入れた反復レビュープロセスを経て更新される予定である。さらに、将来のバージョンでは、他の問題のあるグラム陰性病原体を含むように推奨事項を拡大していく予定である。
よろしければサポートお願いします。 サポートいただいた費用で、論文の取り寄せ等に使わせていただき、記事を充実させていきます。
