【熱力学5】エントロピー【熱力学の核心】
これまでは,温度が一定の環境の下での操作しか考えてきませんでした.そのため,異なる温度での自由エネルギーを比較することは今のところできていません.今回は,異なる温度間での自由エネルギーをどのように決定すればよいか考えましょう.そして,この考察から,エントロピーという概念を導入することになります.
復習
一定温度の環境の中にとある系が置かれているとします.この系の外部変数をわずかに操作して,
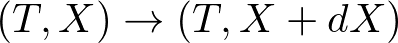
と変化させたとします.これらの自由エネルギーの差が,
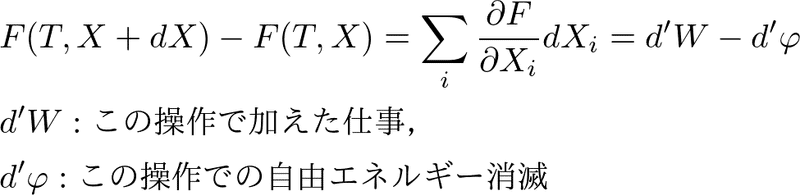
と書けることは前回までの考察でわかっています.最終的な状態が同じであれば,どのような操作をしても自由エネルギーが消滅することで調整されて,結局自由エネルギーの差は変わりません.これは自由エネルギーが操作の方法によらず定義された,状態の関数だからです.
自由エネルギー消滅とエネルギー保存則
ところで,消滅した自由エネルギーはどこへ行ったのでしょうか.エネルギー保存則から考えると,これは環境へと逃げたエネルギーであるといえます.全エネルギーを考えるために,環境も含めて次のような状態空間で考えることにしましょう.(注: 環境にはbathまたはbackgroundの意味で添字を付けました.)
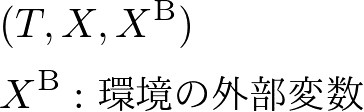
着目系と環境とのやりとり以外ではエネルギーのやり取りはないとします.すると,着目系と環境を合わせた全エネルギーは,ちょうど加えた仕事の分だけ増えなければなりません.したがって,
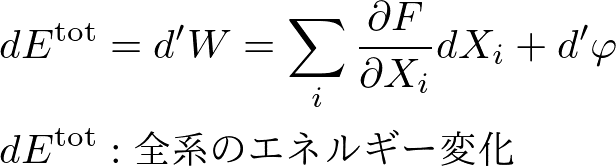
と書けます.この式は単に全エネルギー変化は加えた仕事に等しいと言っているだけですので,一般的に操作によって温度が変化するような場合でも成り立つべきです.
外部変数の操作の結果,
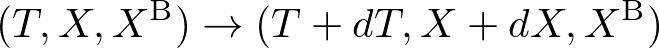
のように温度がわずかに変化したときを考えましょう.(環境のサイズをゼロにして,着目系が熱的に孤立していると考えても別に構わないので,結局,環境の外部変数は以降は書かないことにします.)
温度が少し変わっても,系の操作に必要な仕事はそれほど変わらなさそうです.このことから,自由エネルギーに対して次のことを要請します.
要請4: (自由エネルギーの温度に関する解析的性質)
自由エネルギーは温度について連続,かつ(少なくとも片側で)微分可能である.
この要請を認めると,自由エネルギーの一般の微小変化は,数学的に
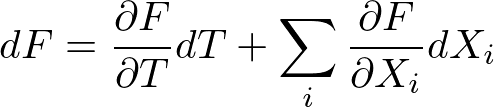
の形に書けます.これを用いると,先ほどの全系のエネルギー変化の式は,
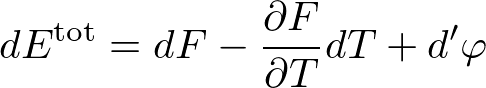
と書けます.ここで,式を見やすくするために,
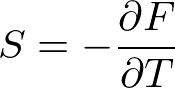
と置きます.これは,今のところただの微分係数ですが,特別にエントロピーと名前を付けておきます.エントロピーを用いて式を書き換え少し整理すると,
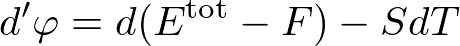
となります.
エネルギーと自由エネルギーの差
ここで,自由エネルギー減少則より,自由エネルギー消滅は非負だったことを思い出しましょう.温度は操作方法によって,上げることも下げることもできます(エネルギーが増えれば温度は上がり,エネルギーが減れば温度は下がります).ということは,温度の変化の向きに応じて,常に右辺全体が非負になるように,右辺の第一項も変化しなければなりません.つまり,
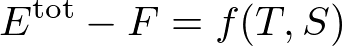
というふうに,エネルギーと自由エネルギーの差は,温度とエントロピーの関数になっていなくてはなりません.
つぎに,エネルギーも自由エネルギーも示量変数なので,それらの差の関数も示量変数です.一方,エントロピーのもとの定義を見直すと、示量変数を示強変数で割った形なので,エントロピーも示量変数です.温度は示強変数でした.このことから,エネルギーと自由エネルギーの差の関数は,エントロピーについて線型になっているはずです.このことと,次元が両辺で合っていなくてはならないことを考えると,この関数は
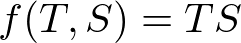
のような形しかありえません.(定数を加えることもできますが,それはエネルギーの原点のとり方で除くことができます.また,定数倍したりマイナスを掛けたりもできますが,それらは温度の目盛のとり方や,温度の高低の向きが入れ替わるだけです.ここでは,このような式になるように選びます.)
というわけで,エネルギーと自由エネルギーの差は
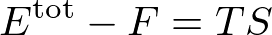
となります.
エントロピーとは
この結果を用いて,自由エネルギー消滅に関する式を書き換えると,
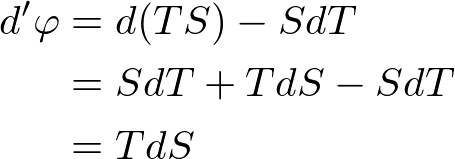
と書かれます.(注: ここでうまく項が打ち消しあったのは,そうなるような温度目盛を用いていたからです.このような温度目盛で測った温度のことを絶対温度と言います.エントロピーは絶対温度によって定義する必要があります.)
または,
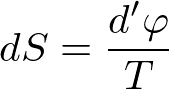
と書けます.この式は,自由エネルギー消滅を温度で割ったものは,エントロピーの増分に対応するという主張です.この(系全体での)エントロピーの増分のことをエントロピー生成と呼びます.自由エネルギー消滅が不可逆性の尺度でしたから,エントロピー生成も不可逆性の尺度として解釈できます.
エントロピーは自由エネルギーの温度での微分係数でしたから,系の状態によってひとつに決まるべきものです.一方で,自由エネルギー消滅は操作に依存する量で,決して状態で決まるような量ではありませんでした.この関係式は,状態の関数とそうでないものを結びつける非自明な関係といえましょう.ただし,導出を思い出すとわかるように,この結果はもとをただせば,自由エネルギー消滅が非負であるという物理的な制約があることから来ているのです.
ここで,温度がゼロをとると,エントロピー生成が無限大となっておかしなことになるので,温度はゼロをまたがないことを要請することにします.
要請5: (温度の下限)
温度はゼロより大きい値をとる.
これを要請すれば,自由エネルギー消滅が非負であることより,
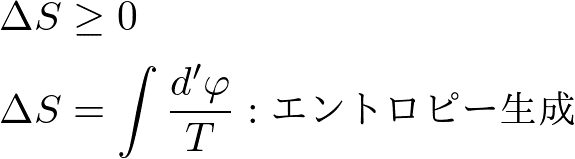
という制限がエントロピーには付くことが言えます.つまり,温度は操作によって上げることも下げることもできたわけですが,全系のエントロピーを小さくすることはできません.これはエントロピー増大則と呼ばれます.または,やはり熱力学第二法則と呼ばれますが,これはエントロピーという状態の関数によって表現されているので,以前導いた自由エネルギー減少則よりも,熱力学の核心を端的にあぶりだしているといえるでしょう.
自由エネルギーの温度依存性
これまでで
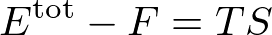
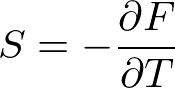
が得られました.この二つの式から,
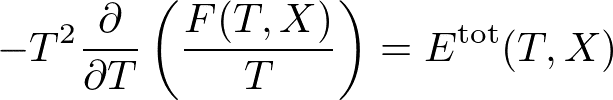
という自由エネルギーの温度変化に関する微分方程式が得られます.この式は,ギブズ・ヘルムホルツ(Gibbs-Helmholtz)の式と呼ばれます.全エネルギーは力学的に定義される量ですから,右辺は状態空間の全体で定義されています.したがって,自由エネルギーの温度依存性は,ギブズ・ヘルムホルツの式を満たすように決めればよい,ということがめでたくわかりました.
エネルギーのほうが自由エネルギーよりも必ず大きく,また,エネルギーは温度の単調増加関数です.これらを合わせてギブズ・ヘルムホルツの式をじっくりと眺めると,自由エネルギーは温度の単調減少関数であり,温度に関して上に凸な関数であることがいえるので確かめてみてください.
今回のまとめ
・エントロピーは自由エネルギーの温度での微分係数として定義される,状態の関数である.
・エネルギーと自由エネルギーの差は温度とエントロピーの積となることが,自由エネルギー減少則から導かれる.
・エントロピー生成は自由エネルギー消滅を温度で割ったものであり,状態間の変化の不可逆性の尺度である.
・自由エネルギーは温度の単調減少関数であり,温度に関して上に凸な関数である.
__________________
更新履歴
Feb. 13 2020 自由エネルギーの関数の形(単調性,凸性)について加筆しました.
Feb. 12, 2020 エントロピー生成の式の間違いを修正
Feb. 9, 2020 絶対温度に関する注を追加しました.
Feb. 8, 2020 執筆,式の間違いを修正
クオリティの高いノートをたくさん書けるように頑張ります!