
7. バイオバーデン(生物学的負荷)を減少させる
医療機関で感染拡大を予防するためには清浄、洗浄、消毒、滅菌が必要なことをこれまで学んできました。医療器材が清潔、消毒済み、滅菌済みのいずれの状態かということは、その器材の清浄レベルの目安となります。
この章では、バイオバーデンを減らすために用いられる物理的、化学的手法について見ていきます。微生物の生存には何が必要なのか、死滅する際に何が生じているのかについても触れることにします。最後に「消毒済み」「滅菌済み」の必要条件についてより詳しく定義していきます。
7.1 バイオバーデンを減らす方法
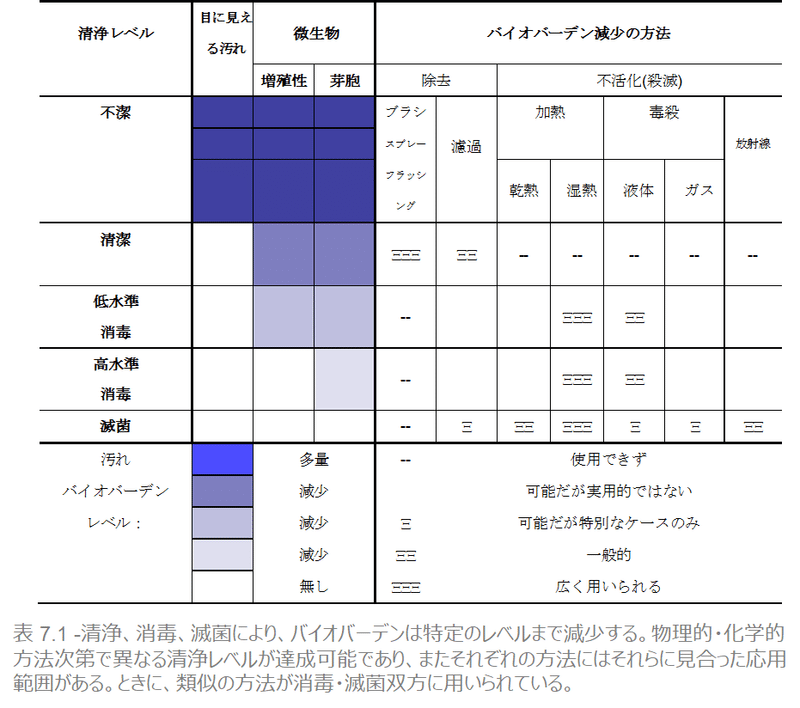
不潔、清潔、消毒済み、滅菌済みはすべて異なる清浄レベルです。生物が一切付着していない器材が、滅菌済みであり、そのレベルに達するまでの方法は問いません。滅菌の媒体は乾熱、湿熱、または化学物質などがありますが、このいずれによって達成されても構いません。バイオバーデンを減らすこのような方法は、消毒にも用いることができますが、必要な条件は緩くなります。バイオバーデンを減らすには以下の方法があります。
●機械的方法により微生物を除去
器材に付着する菌数は、フラッシング、ブラッシング、ブローイングなどにより、ほこりやゴミと一緒に減らすことができます。これが清浄です。清浄の実際的な方法については、第8章を参照してください。液体から微生物を除去するには、極細フィルター(マイクロポアフィルター)を用いる方法もあります。液体がフィルターで濾され、粒子や微生物はフィルターに留まります。
●不活化(死滅させること)
微生物は、物理的、化学的方法によって殺滅することができ、どんな生物をも殺滅する共通のやり方です。それには加熱、毒、放射線照射などの方法があります。
この章では、以下の項目の順に、どのように微生物を不活化させるかをつぶさに見ていくことにしましょう。
●(微)生物が生きるのに必要な条件とは
●微生物が死滅する際、一体何が生じているのか
●殺滅剤に曝露したとき、菌はどのように減ってゆくのか
手始めは、微生物の生と死の特徴についてです。
7.2 生存条件
微生物をどのように殺滅するかを見る前にまず、微生物が生きるための絶対条件を確認しましょう。その条件を知ると、微生物を死滅させる方法がわかりやすくなります。
ここまで見てきたように、微生物は他の生物と実によく似ています。たとえばヒトという生物を見たとき、生きるのに最低限必要なものは以下のとおりです。
●適切かつ充分な栄養
●安全かつ充分な水分
●適度な環境温度
●呼吸できる空気
これらすべての条件は微生物の生存にも必須のものです。空気に関してのみ相違があり、微生物の中にはヒト同様に空気を必要とする微生物(好気性微生物)もいますが、空気との接触を好まない微生物(嫌気性微生物)も存在します。そして、さらに空気のあるなしにかかわらず生存する種も存在します。

7.3 不活化の方法
生物を殺滅するのにさまざまな方法があるように、微生物を殺滅する方法もいろいろです。生きるために必要な条件のうちの1つでも取り除けば、その生物は死に至ります。食事(栄養)を与えない、不適切な食事(栄養)を与える、気温を極端に低く(高く)する、細胞の「機械的構造」を破壊する、などの手段により微生物は死滅します。

消毒または滅菌するのに、微生物を餓死させることは現実的ではありません。微生物が必要とする栄養素の量は極めて少ないので、長時間経過しても微生物が生きている可能性がたいへん高いためです。また、微生物を乾燥させる(水分を与えない)ことも同様の理由により適していません。さらに、芽胞は水分がなくても極めて長期間生き続けます。ゆえに消毒や滅菌には、主に表 7.2にあるような殺滅方法が用いられています。
これらの殺滅剤のいずれかに曝(さら)されると、細胞内にある生命のキャリア(タンパク質)が何らかの形で傷害され、本来の働きができなくなります。これがタンパク質の変性です。生命の基底が破壊されるので、細胞、生命体は死滅します。
このような方法の多くは、消毒と滅菌の両方に用いることができますが、それぞれに適した分野があります。たとえば、医療機器の滅菌には高温蒸気を使った加熱法が最も広く用いられています。次章では、その理由とプロセスにつき説明します。精密な機器の中には熱や高圧に耐えられないものもあり、その場合、他の滅菌方法が用いられます。皮膚、機器、床や壁などの表面の消毒には化学物質が用いられます。
器材を準備する際に、どの方法でバイオバーデンを減らすかは以下の要件を考えて決めます。
●適用部位:低、中、高いずれの感染リスク部位で使用するか
●器材の種類
●器材の素材
●環境リスク
●作業者のリスク
●器材の流通度
●費用
7.4 微生物を殺滅するプロセスのあり方
殺滅剤に充分に曝露されると、微生物は死滅します。殺滅プロセスの本質についてさらに説明するために、微生物のもっとも一般的な殺滅法である加熱法について見てみましょう。
山火事のあと、野は黒く焼け、死の大地と化します。熱から逃れられなかった動物は死に絶えています、また、炎に包まれれば人間も死に至ります。

微生物も熱により死滅します。乾熱(熱風)および湿熱(熱水または高温蒸気)は消毒と滅菌の両方に利用されます。

微生物の死滅
微生物はこれ以上増殖(繁殖)できないとき、死滅したとみなされます。言い換えれば、微生物にとって死とはその状況が変わり、微生物が自己増殖するのに必要なプロセスが停止した状態をいいます。殺滅剤に触れると、微生物は死滅します。微生物の死滅は、増殖できる微生物の数の減少を観察すれば確認できます。
熱で微生物を死滅させるとき、何が起きているのか?
微生物が熱に曝(さら)されると火傷をしたときと同様のことが起きます。まず、熱は生物の「皮膚」、つまり細胞膜を傷害し、その結果タンパク質から成る原形質が直接熱に曝露し、タンパク変性が生じます。こうして、生体を構成する物質が傷害され、生物は死に至ります。後ほど触れますが、湿熱で加熱すると乾熱(熱風)よりも早く菌を殺滅することができます。
-7.4.1 熱で殺滅する2つの方法:凝固と酸化
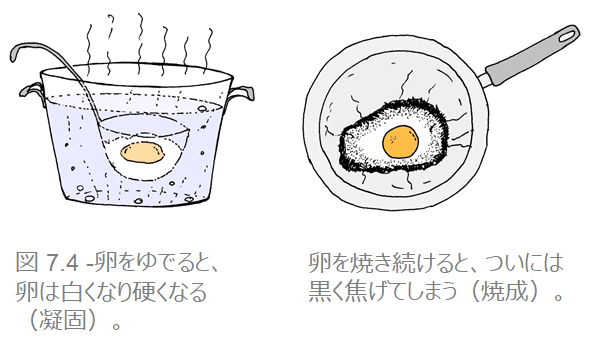
方法によって、加熱による生物の死は2つに分けられます。卵を2つ用意し、1つをゆで卵、1つを目玉焼きにすればその両方の例えがはっきりします。
a. 凝固 (固まること)
水を張った鍋を火にかけます。
そこに卵を割り入れ、何が起きるかを観察すると、水温が上がるにつれ卵が白くなっていくことがわかります。次第に固まり始め、より硬くなっていきますが、これが「凝固」であり、約52℃で始まります。この温度で、原形質のタンパク質の変性がはじまり、卵は死滅します。人体に熱湯をかければ、同じことが体内の細胞内部のタンパク質でも生じます。もちろん、微生物にも同じことが起こります。
b. 酸化(焼成)
もう1つの卵をフライパンで焼いてみます。
卵が次第に白くなっていくのがわかるはずです。ここでも凝固が起きていますが、熱を加え続けると縁が黒くなりはじめ、しまいには焦げてしまいます(焼成)。火にかけたままにすると、卵は全部真っ黒焦げになってしまいます。焼成は、凝固よりもずっと高い温度で起きます。酸化とも呼ばれます。
-7.4.2 湿度が殺滅力に与える影響
殺滅力
湿度は、微生物の殺滅作用に大きく影響します。
微生物を殺滅する力はまた、殺滅力とも呼ばれます。高温の湿熱は高い殺滅力を持ちます。
熱担体としての湿度の生物への影響
湿度が高く蒸し暑い環境にいるとき、私たちは不快に感じ、同じ気温でも湿度が低ければ、不快感は減ります。つまり、私たちは乾熱の影響を受けにくいということが言えます。逆に、熱湯や蒸気で受傷した場合、同じ温度の乾熱に比べてはるかにひどく傷害されることになります。
水、特に蒸気は乾熱に比べて熱伝導率がはるかに高く(その理由については10章で触れます)、微生物もまた乾熱よりも湿熱に影響されるのです。
微生物が湿熱に曝されると、凝固は極めて低い温度で始まります。さらに湿熱温度には通常、上限があり(※23)、湿熱に曝露した時の不活化は主に凝固によるものです。
※23
現行の容器内圧力(標準的なオートクレーブ内)では、沸点は最大でも120~140℃の間です。
乾熱の場合、不活化に要する温度ははるかに高く、特に含水量が低いもの(芽胞)に対して顕著です。乾熱で温度が高い場合、タンパク質はただ燃焼するだけなので、乾熱を用いる際の死滅の主因は酸化となります。

生物内部における水分の影響生物の不活化で大きな働きをするのは、外部から作用する熱の担体だけではありません。生物細胞内部の含水量も大きく影響します。1890年にはすでに、鶏卵のアルブミン(ガラス状の粘液性物質)は含水量が多いときほど早く凝固することをレヴィト(ドイツの化学者Franz Hofmeisterの学生、S. Lewith)が発見していました。微生物も同様に、含水量が多いほど加熱による殺滅が容易となります。芽胞はほぼ完全に乾燥しているので、ほとんど水を含みません。それゆえ、熱を加えてもタンパク質は影響を受けにくいのです。言い換えれば、芽胞は熱に対する耐性が高いということであり、芽胞を殺滅するのが困難であるゆえんです。

また、他の滅菌剤を使うときも一般的に芽胞の不活化がもっとも難しくなります。
-7.4.3 消毒工程と滅菌工程を区別する理由
すでに6.2.3で、細菌性芽胞の特性のため、さまざまな体内の感染リスク部位を区分する必要があることがわかりました。芽胞は不活化するのがとても難しい微生物です。芽胞は特殊な性質があるため、消毒にするか滅菌にするかは明確に区別しなければなりません。
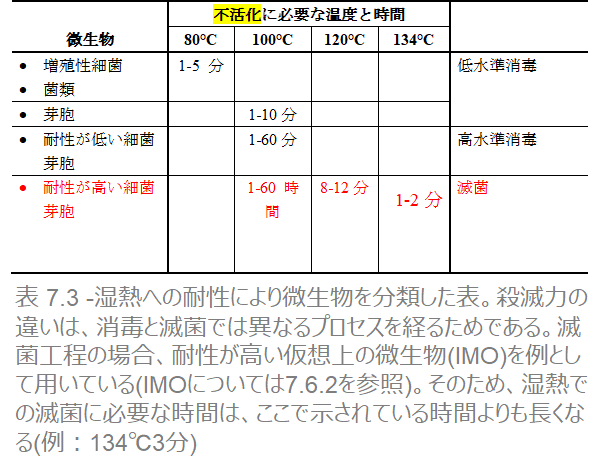
消毒:低リスク部位に触れる器具
低リスク部位に芽胞が存在しても危険ではありません。それゆえ、芽胞を殺滅するには及びません。そのため、増殖型細菌を不活化させるのに足る、極めて簡単で安価な方法を用いれば充分でしょう。たとえば、10分間煮沸するなどです。
滅菌: 高リスク部位に触れる機器
芽胞は湿度が高いと発芽してしまうため、高リスク部位に存在させるわけにはいきません。それゆえ、すべての芽胞を殺滅することができる、コストが掛かっても強力な方法が必要となります。たとえば、121℃の高温蒸気に15分間曝露させるなどです。

※24 バチルス・アトロファエス
古いタクソノミー(動植物の分類学)では「バチルス・サブティリス」と呼ばれていました。2001年に新しい分類法が導入され、この名称に変更されました。
水分:生と死を同時にもたらすもの
水分とは、一方で生命の前提条件であり、他方で不活化を促進するものでもあります。つまり、水分の有無は生と死の双方に大きな影響を与えるのです。芽胞を不活化するのは困難であり、芽胞のまわりに水分があるかどうかが不活化に影響するため、感染リスク部位を区別する必要性があるのです。
●リスク部位を区別する理由:低リスク部位(皮膚など)で芽胞のまわりに充分な水分がなければ、危険は小さくなります。中リスク部位も、芽胞が増殖するには好ましい環境ではありません。しかし、高リスク部位(皮下組織など)で水分があれば芽胞は発芽しやすくなるため、感染の危険性が高まります。
●芽胞を殺滅するのが難しい理由:芽胞内部に水分が存在しないので、不活化が困難なためです。

-7.4.4 百万単位の死滅
手術に使用した器材には、無数の微生物が付着しています。これは、つまりバイオバーデンが高いということです。特に、患者が感染症にかかっていたり、「汚染が激しい」手術(たとえば腸チフスによる腸穿孔の治療)であったりした場合、器材にはおびただしい数の微生物が付着しています。洗浄によりその大半は洗い流されますが、一部は残留してしまいます。
加熱時間を充分に長くとれば、細菌は死滅します。しかし、すべての細菌が同時に死滅するわけではありません。自然界において、1つとして同じものは存在しないからです。動物には強いものも弱いものもいて、ライオンはアンテロープよりも強くて素早く、その強いライオンの中でも最も強いものがいます。また、動物の中では熱耐性の差があり、熱に長時間耐えられる動物もいれば、すぐに死んでしまうものもいます。それぞれが異なる熱耐性をもつともいわれています。同様に、微生物にも同じ種のなかで強い弱いがあります。熱に曝露すると、弱いものはすぐに死んでしまいますが、強いものは長く生き残ります。それゆえ、すべての微生物が同時に死滅するわけではないのです。

微生物の死滅率
微生物が熱に曝露すると、一定時間ごとに、生存する微生物の一定の割合が死滅することが研究でわかっています。たとえば、ある微生物は、120℃の蒸気に曝されたとき1分間でその90% (=10分の9)が死滅します。
表 7.4 は、この種の微生物100万個を一定時間(1分刻み)熱に曝した際に、死滅する微生物数と生存する微生物数を示しています。
この表では、ある時点から生存数が1未満になります。たとえば、7分経過後には、微生物数は0.1個となっています。つまり、7分経った時点で、生存する菌がいる確率は10%(=10分の1)しかない、ということを表しています。言い換えれば、同じ微生物数が付着している器材を10個、7分間滅菌剤に曝露させた場合、そのうち1つの機器に1つだけ微生物が付着しているということです。
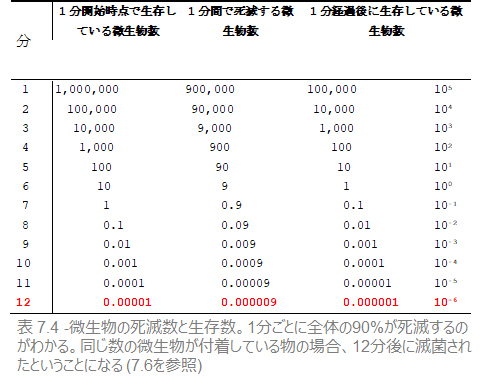
D値(Decimal reduction time=90%死滅時間)
死滅率を示す別の方法が、微生物の90%を殺滅するのに必要な時間を特定することです。その時間が経過すると、元々の菌数の10%(=10分の1)が生き残ります。この時間を、D値(Decimal reduction time)と呼び、D値は微生物ごとに異なります。

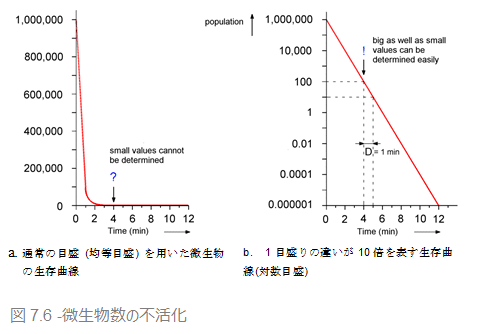
表 7.4 にある微生物の不活化はグラフ化することができます。横軸に滅菌時間、縦軸には残菌数を取り、目盛りごとに数値が与えられています。この目盛りは均等目盛りと呼ばれます。
図 7.6a では、微生物の数が急速に減少することが見て取れます。ほんの数分で、全く生存していないかのように見えますが、図中では実際には残存している微生物がいることを表しています。ゼロに近いかもしれませんが、滅菌という目的のためにはまだ不充分です。 滅菌の効果を表現するにはこのような図表では不充分なので、微生物学上、微生物の減少を表すために別のグラフを用います。図7.6bがそれです。
ここでは、生存曲線の1目盛りの違いが、10倍を表しています。このように、大きい値のものも、量が少なくゼロに近い変化もはっきりと見て取ることができます。100万という値も、0.000001という値も同じグラフ内で両方ともはっきりと識別できます。この「対数」目盛による生存グラフでは、不活化の曲線を直線で表すことができます。このグラフから、D値(=90%死滅時間)が極めて簡単に読み取れます。

対数減少値(log reduction value :LRV)
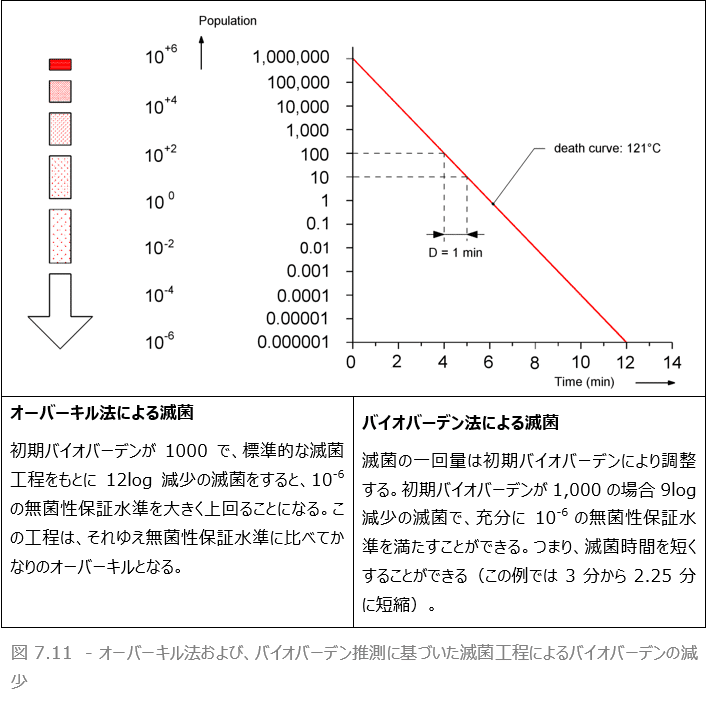
細菌をそのD値分だけ殺滅剤にあてると、生存数は10分の1となります。その減少係数は10 = 101です。これを別の言い方で、1logの減少(※25)があったと表します。生存数が100分の1になった場合(減少係数は100 = 102です)、2logの減少となり、1000分の1にまで減った場合(減少係数は1000 = 103です)は3logの減少となります。言い換えれば、対数減少値(log reduction value :LRV)は、菌数の減少係数のゼロの数と等しくなります。または、減少係数を、10を底として表した時の乗数と等しいとも言えます。 通常、対数減少値は、不活化の工程の特徴の1つといわれます。 オーバーキル法(7.6.3参照)による滅菌工程では、12logが必要とされます。
※25
logは数学用語であるlogarithm(対数)から来ています。x=logb(y)、つまりyのbを底とする対数xは、「bを何乗すればyの数値を得られるか」を表しています。たとえば、log10(1000) = 3です(10を”3”乗すれば1000になる)。
Z値
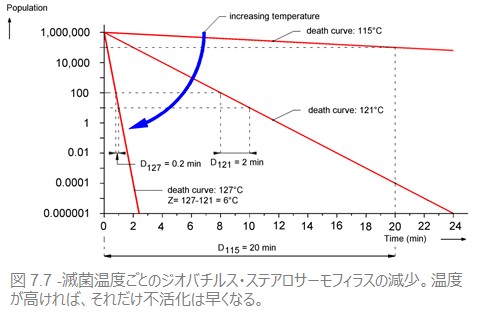
温度が低ければ低いほど微生物を死滅させるのに長い時間がかかるように、微生物のD値も温度が低ければ高くなります(時間がかかる)。温度変化による死滅率の変化の影響を、生物のZ値と呼びます。

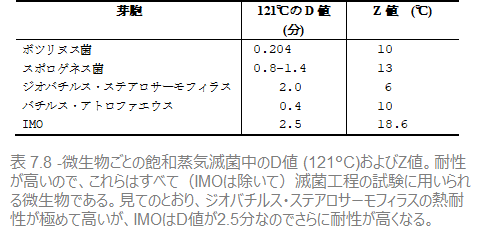
例をあげれば、ジオバチルス・ステアロサーモフィラスは、121℃下でD値は2(分)です。温度が高くなれば生物は早く死滅します。温度をあげて127℃にすると、わずか0.2分で10分の1まで殺滅できるため、127℃でのD値は0.2となります。ジオバチルス・ステアロサーモフィラスのZ値はそれゆえ、127-121=6℃となります。また、Z値は微生物により異なり(図7.7を参照)、用いられる殺滅剤によっても異なってきます。
7.4.5 初発菌数の影響
最初に細菌が大量に付着していると、付着している菌数が少ない場合に比べて、ある一定のレベルまで菌数を減らすのに長く時間がかかります。
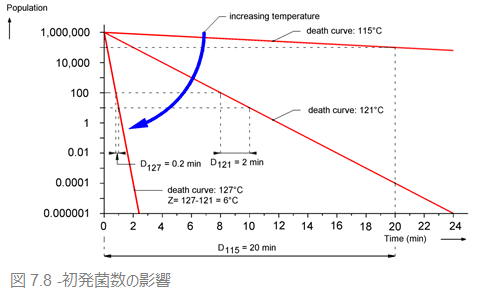
仮に、器材に1つも菌が残らないぐらいのレベルまで滅菌するとしましょう。初発菌数が1000万個のときには、1000個のときとくらべて遥かに長い時間がかかります。ここで滅菌前の処理が極めて重要だということが、改めてわかるはずです。

7.5 消毒前にバイオバーデンを減少させる
消毒に必要なバイオバーデン減少レベルは、滅菌に求められるものよりも低くなります。消毒剤は、特定の種類の微生物に使われる場合が大半です。消毒剤や作業の効果を検証するために、以下の試験が開発されました。
5-5-5試験
この試験は、さまざまな公共医療機関 に採り入れられ、「5-5-5試験」(※26)として消毒工程の検査に用いられています。
確認する点は以下のとおりです。
● 5種類の微生物を
● 5分間で
● 105 (100,000=5 log)減少させることが可能か
換言すれば、5分経った時点で、5種類の微生物の数がもとの数量の10万分の1以下まで減少していなければなりません。精密で高度な機器には、こうした試験が求められます。それゆえ、通常この試験は特別に設備が整った機関で実施されます。製造元より提供された製品を試験機関が試験して、はじめて製品は市場に投入されます。
※26
5-5-5試験は、欧州の標準的なサスペンションテスト(EN1276に規定)
7.6 「滅菌できた」とは?
これまで、微生物は加熱されてもある一定時間ごとに決まった割合が死滅せずに生き残ることを学んできました。ここから導き出されるのは、どれだけ長く滅菌時間をとっても、一定の割合の生物は残存してしまい、少なくとも、微生物が生き残る可能性は完全にはなくならないということです。別の言い方をすれば、すべてが死滅したと100%確信することはできないと言えます。図7.9は、表7.4と同じことを表しています。数値は限りなくゼロに近づいていっても、決してゼロにはならないのです。

滅菌の許容基準は?
完全な滅菌は不可能なので、滅菌工程後に生存する菌の許容数を決定するため、多くの機関が協議してきました。その後、NASA (アメリカ航空宇宙局)とWHO(世界保健機関)の研究結果を基礎に、「滅菌した100万個の滅菌物の中で、菌が1つのみ確認できるレベル」と定義しました。これが無菌性保証水準(SAL)の基準となったものです。
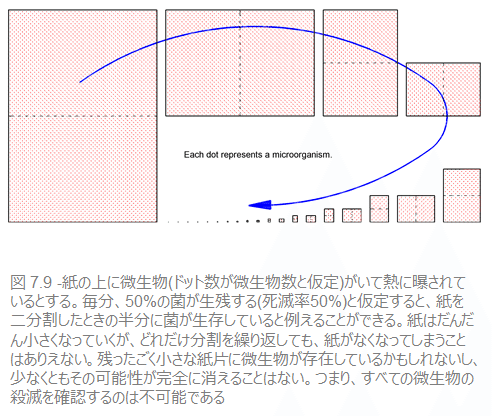

-7.6.1 どれぐらい滅菌するか:滅菌の処量
滅菌性を達成するには、微生物数に見合った分だけ滅菌剤(熱、薬品、放射線、ガスなど)を使う必要があります。その滅菌の処量は、滅菌剤の強さと滅菌時間によって決まります。

滅菌性を達成するための殺滅剤の量を、滅菌の処量と呼びます。必要な滅菌処量は、滅菌物に付着した微生物の耐性と数(微生物数)で決まります。
F値
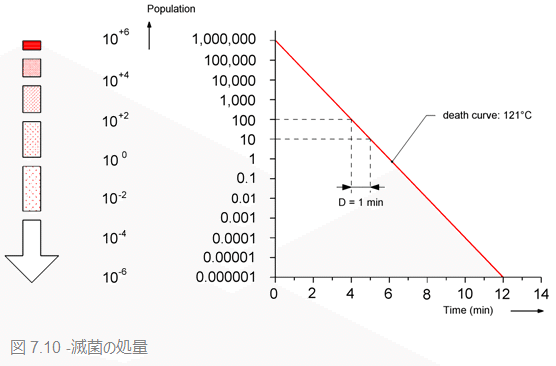
滅菌を達成するには、所定の時間を必要とします。表7.4を参照すると、D値1分の微生物100万個が湿熱に曝露した場合、1分後、その数は10万個に減少、6分後には微生物数は1まで減少します。そして12分後には、無菌性保証水準の10-6を達成します。つまり、この場合滅菌を達成するのに必要な時間は、12×D=12×1=12(分)となります。もちろん、初発菌数が大きければより長い時間がかかります。滅菌を達成するのにかかる時間をF値と呼びます。

滅菌温度121℃のF値はF0値として示されます。
通常、滅菌工程を設計するためには、1つの物品に現実的に考えられる程度の耐性をもつ10万の微生物が付着していると想定します。耐性の高い微生物の数をあまりにも多く想定すると、滅菌に必要なレベルは非現実的なものになりかねません。概して、以下のように言えます。

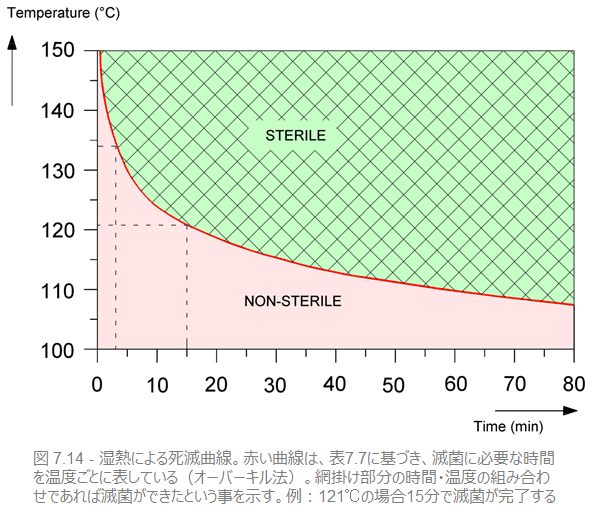
微生物が10分の1まで減少するのにかかる時間がD値です。よって、100分の1減少に必要な時間は2D、1000分の1減少にかかる時間は3Dです。表7.4にある微生物数の場合F値は12×1=12(分)なので、この微生物数が付着した器材は120℃の蒸気に12分間曝露したのち「滅菌済み」となります。バイオバーデン中にいかなる種類の微生物がいる場合でも滅菌を達成するには、最も耐性の高い微生物(特定の芽胞など)が死滅していることを確認しなければなりません。熱耐性がもっとも高い芽胞をもつのは、バチルス・アトロファエウスまたはジオバチルス・ステアロサーモフィラスの芽胞です。これらの微生物が死滅すれば、他の微生物も死滅していると確証できます。そこで、これらの芽胞に対する滅菌の処量が安全な滅菌の最低条件です。
-7.6.2 仮想上の微生物(IMO)という考え方
129°C以上の温度環境の中では、バチルス・アトロファエウスはジオバチルス・ステアロサーモフィラスよりも耐性が強いことが研究結果の結果分かっています。つまり、あらゆる滅菌条件のもとでジオバチルス・ステアロサーモフィラスの死滅によって滅菌保証の確認を行うのは最適な選択ではありません。薬局方 によると、蒸気滅菌の現在一般的な条件は下図のとおりです。

これらの条件を満たす微生物のZ値、D値はZ値=18.6℃、D値=121℃・2.5分 となりますが、この121℃でのD値からわかるように、これはジオバチルス・ステアロサーモフィラスよりも抵抗が高く、D値が0.5のバチルス・アトロファエウスと比べると、遥かに抵抗が高い微生物ということになります(表7.5参照)。また、129℃以上でもこの微生物は前述の2つの生物よりも高いD値を持っています。しかしながら、こうした特徴をもった微生物は存在しないため、仮想上の微生物(Imaginary Micro-Organism:IMO)と呼ばれます。
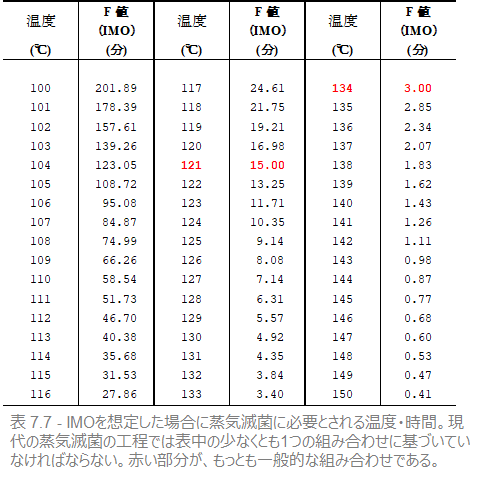
IMOのZ値とD値(121℃)をもとに、すべての温度-時間の組み合わせを計算することができます。その結果が、表7.7と図7.14のグラフです。
ISOおよびCENの滅菌基準はこの表に準拠しています。この表は言うまでもなく蒸気滅菌のもっとも一般的な温度-時間の組み合わせです。
-7.6.3 滅菌のプロセス:オーバーキルとバイオバーデン
滅菌工程を1回行うごとに滅菌対象物は滅菌剤の1回量に曝露します。 効率的な滅菌工程のために、2つのアプローチが現在用いられています。
●オーバーキル法
オーバーキル法に基づいた工程は、従来から医療機関や医療産業の滅菌器に適用されてきました。これは、安全をみて被滅菌物に通常存在すると推測される量よりはるかに多いバイオバーデンを不活化できる滅菌工程とするべきである、という考えに基づいています 。安全マージンのために、通常は滅菌の処量を増やし、最低でも12logの減少が求められます。オーバーキル法では滅菌の処量を多くする必要があります。
滅菌剤が湿熱の場合、滅菌物は高温に長時間曝されますが、多くの器材(手術器材、衣類など)にとってこれは問題ではありません。IMOの考え方に則した工程では、極めて耐性の高い架空の微生物を滅菌することを求められるので、オーバーキル法に基づいた工程と言えます。

●バイオバーデン法
しかしながら、高温や長時間の滅菌に耐性がない器材、無菌液や熱に弱いプラスチック製器具の場合、滅菌により損傷を受ける場合もあります。こうした場合、滅菌の処量はできる限り低く抑えなければなりません。
このような器材の滅菌工程は、一般的にその機器に存在していると推測されるバイオバーデンの量に基づくこともあります。清潔な製造法に従えば、バイオバーデンを低く抑えることはできます。
たとえば、クリーンルーム で製造するなどです。こうすれば、滅菌の処量を減らすことができますが、この(高価な)方法には、バイオバーデンの入念なモニタリングと、細心かつ清潔な製造法が必要です。
この方法は製薬会社や医療機器(使い捨て使用のものが主)の製造の際に用いられますが、普通は医療現場では用いられていません。
7.7 滅菌性能評価
滅菌されたと認められるレベルを設定することで、滅菌工程が安全であったかをチェックするテストができます。旧来からある方法としては、あらかじめ規定数の芽胞を滅菌工程にかけ、生存菌がいるかを確認する方法です。この菌は、滅菌剤に対してもっとも耐性のある芽胞でなければならず、加熱滅菌の場合にはバチルス・アトロファエウスまたはジオバチルス・ステアロサーモフィラスが使用されます。このテストは生物学的インジケーター(BI)テスト と呼ばれます。その他の加熱滅菌工程の試験用具としては、化学的インジケーター(CI)があり、充分な時間、適切に温度が保たれると変色するため、判定が可能となります。CIの一例として、インジケーターストリップや、ボウィー・ディックテスト(空気除去試験)に用いられるテストシートがあります。
近年では、へリックス試験が人気を増しています。これは、長いホロー(管腔)型チューブ内の蒸気浸透性を確認できるシステムです。また電子式の滅菌工程試験システムが市場に登場してきています。滅菌工程の性能を試験する試験器具をPCD(Process Challenge Device=工程試験用具)と呼びます。

パラメトリックリリース
しかしながら、ISOやCENが推奨するオートクレーブの運転状況確認のもっとも一般的な手段は、滅菌工程中の物理的条件(パラメータ)の記録に基づいています。蒸気滅菌器におけるこの条件は、被滅菌物中に飽和蒸気が必要な温度・必要な時間存在することです。毎回の記録は、あらかじめ適切な滅菌工程 と検証された同様 の工程記録と照合されます。そして、記録の突き合せで必要な条件が合致すれば払出が可能となります。この滅菌工程パラメータを確認することで滅菌物を払い出すことを、パラメトリックリリースと呼びます。

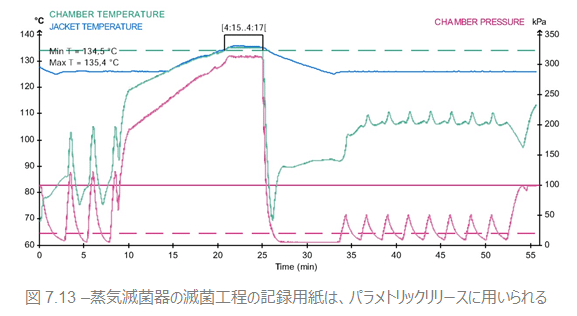
ここで強調したいのは、滅菌では滅菌器・包装・工程・被滅菌物のいずれもが結果に影響を与えるということです。ですから、新たに検証される工程が、参照記録上と同じ滅菌器・被滅菌物・包装を使用した時のみ検証が正しいと言えるのです。

======
内容のお問い合わせ、ご相談はこちらへ。
株式会社名優 広報課
この記事が気に入ったらサポートをしてみませんか?
