ギラン・バレー症候群の治療
ギラン・バレー症候群(GBS:Guillain-Barré Syndrome)の治療について、2024年に11年ぶりに改訂された日本神経学会のガイドラインの内容も参考にしながらまとめてみました。
気管挿管・人工呼吸管理のリスク評価と管理

上記はリスク評価および管理の指標を示したフローチャートであり、実臨床において一般病棟で管理を行うのか、ICUに準ずる病棟で管理を行うのか、気管挿管・人工呼吸管理を行うべきかの判断に役立ちます。気管挿管・人工呼吸管理の判断はGBSの診療上避けては通れない重要事項です。上記のように主に肺活量などの呼吸機能検査所見が参考になりますが、肺活量等のデータが得られない場合は症例の状態を詳細に観察して判断する必要があります。そうした状況下では後述するSingle breath count test(SBCT)なども役立ちます。以下に、フローチャートの内容に関する情報を補足します。
重要リスク因子はGBS722症例中、人工呼吸器が必要となった313例について解析した研究で①入院までの日数が7日以内(オッズ比2.51), ②咳ができない(オッズ比9.09), ③FG≧4(オッズ比2.53), ④上肢挙上困難(オッズ比2.99)もしくは⑤頸部屈筋の筋力低下(オッズ比4.34), ⑥肝逸脱酵素の上昇(オッズ比2.09)の6つの予測因子のうち4つ以上該当で85%以上に人工呼吸管理が必要と予測されます(Crit Care Med 2003;31:278-283)。
Single breath count test(SBCT)は最大努力吸気の後に通常の話し声で、数字をどこまでカウントできるか測定する方法です。カウントは1秒間に2拍のメトロノームに合わせて行います。肺活量と相関しますが、呼吸機能検査と異なりベッドサイドで簡単に行うことができます。20未満の場合は人工呼吸管理の予測因子となることが報告されています(J Crit Care 2014;29:219-223)。

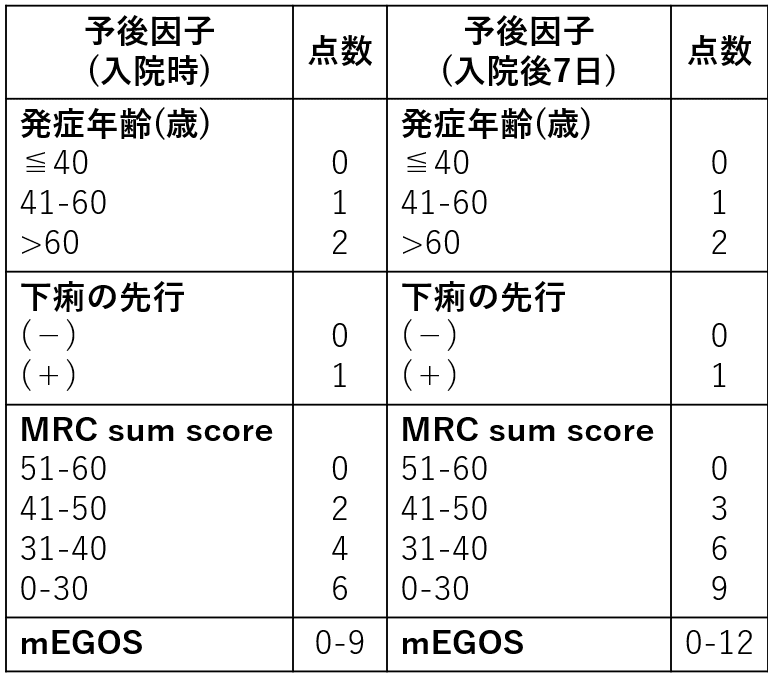
modified EGRISは入院後1日未満, 3日未満, 1週間未満の人工呼吸器管理のリスク予測に有用です。詳細は原著(J Neurol Neurosurg Psychiatry 2023;94:300-308)のFigure3が参考になりますが、例えばスコアが12点未満であればいずれの時点においても人工呼吸器管理のリスクは概ね10%未満と予測できます。
本邦2024GLに記載の指標:①肺活量≦20mL/kg, ②%肺活量≦70%, ③高度の球麻痺があり誤嚥リスクまたは誤嚥が認められる場合などに気管挿管・人工呼吸管理を考慮する。(ギラン・バレー症候群,フィッシャー症候群診療ガイドライン2024)
EAN/PNS2023GLに記載の指標:①努力性肺活量<20mL/kg, ②%努力性肺活量≦70%, ③最大吸気圧<30cmH2O, ④最大呼気圧<40cmH2Oで、特に努力性肺活量≦10mL/kgとなる前に選択的気管挿管を考慮する。球麻痺があり誤嚥リスクまたは誤嚥が認められる場合や努力性肺活量≦10mL/kgで気管挿管・人工呼吸器管理を考慮する。(Eur J Neurol 2023;30:3646-3674)
人工呼吸器管理に至るその他のリスク因子としてフィッシャー症候群様の発症(外眼筋麻痺や運動失調)の後に四肢筋力低下をきたした症例(J Neurol Neurosurg Psychiatry 2009;80:60-65), 上肢から下肢に下行性に麻痺が進行した症例, 高度な自律神経障害合併例(J Assoc Physicians India 2005;53:764-768), 血清コルチゾール高値(Crit Care Med 2009;37:2436-2440), GQ1b抗体, GD1a/GD1b複合体抗体, GD1b/GT1b複合体抗体(Neurology 2004;62:821-824)(Jounal of Neuroimmunology 2007;182:212-218)などが挙げられます。
人工呼吸器設定では現時点で推奨されるものはありません(Respir Care 2006;51:1403-1407)。
抜管の判断に明確な基準はなく、個々の症例で判断する必要があります。指標として、肺活量が挿管直前に比べて4mL/kg以上改善していれば抜管成功確率が高い(感度82%, 特異度90%)(Neurocrit Care 2006;5:230-234)とする報告、挿管当日と12日目のpulmonary function(PF) score(肺活量(mL/kg), 最大吸気圧(cmH2O), 最大呼気圧(cmH2O)を合計したスコア)の比が1以上であれば3週間以内の人工呼吸器離脱が可能で1以下なら有意に長期化するという報告(Muscle Nerve 2000;23:613-616)などがあります。後者は挿管12日目での判断となるため1以下であれば直ちに気管切開、1以上であれば抜管を目指すといった気管切開の判断の根拠としても有用です。
免疫療法
免疫療法のフローチャート
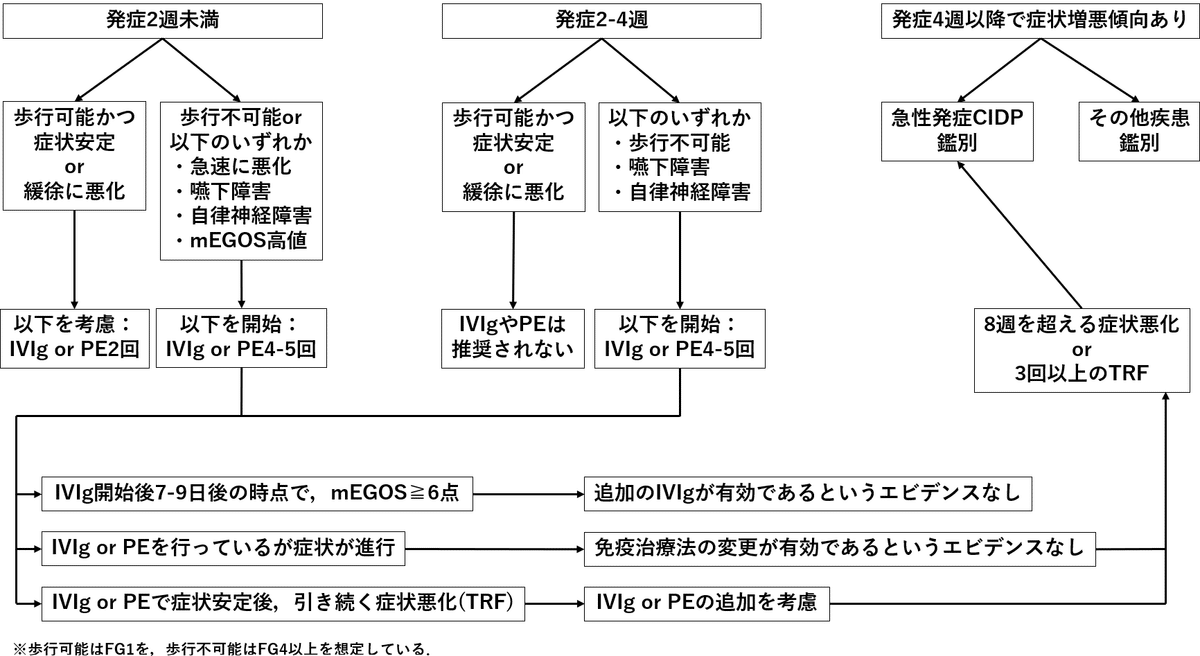
2024GLでは上記フローチャートに基づく免疫療法の実施が推奨されています。免疫療法では血漿浄化療法の1つである単純血漿交換法(PE:plasma exchange)(血漿浄化療法のうちRCTに基づく有効性が示されているのはPEのみ)と経静脈的免疫グロブリン療法(IVIg:intravenous immunoglobulin)が有効とされます。PEの施行回数はフローチャート記載の通りで1回の血漿処理量は3Lを目安とし、置換液にはアルブミン溶液を用いることが推奨されます。IVIgは原則として0.4g/kg/dayを5日間投与します。
PEとIVIgの選択
両者の治療効果は同等とされ(Cochrane Database Syst Rev 2017;2:CD001798)(Cochrane Database Syst Rev 2014;2019:CD002063)、どちらを試行するかは症例毎の事情や医療施設の条件などから総合的に判断します。また、後述する禁忌や有害事象を考慮し、いずれかが該当する場合は他方の治療法を選択する方法をとることも多いとされます。一方でPEとIVIgの治療関連有害事象についての比較検討では治療中断に至った症例がPE群1.28%に比してIVIg群0.18%とIVIg群で有意に少なかった(相対リスク比0.14, 95%CI0.05-0.36)とする報告(Cochrane Database Syst Rev 2017;2:CD001798)もあり、個人的な経験でもより簡便かつ安全なIVIgが選択されることが多いです。
なお、高齢者ではより副作用の少ないIVIgが推奨(日本神経学会.ギラン・バレー症候群,フィッシャー症候群診療ガイドライン2024)され、妊婦でも循環血液量低下などの胎児への影響が避けられる点でIVIgを推奨する意見が多い(神経内科 2004;61:49-55)(日内会誌 2007;96:2046-2053)とされます。
血漿浄化療法の絶対禁忌には循環不全, 重篤な感染症, 出血傾向があり、その他の禁忌事項としてARB服用中(ブラジキニン・ショック誘発, ただし免疫吸着療法), 妊娠, 小児・高齢者(40kg以下の低体重)があります。有害事象には低血圧, 敗血症, 肺炎, バスキュラーアクセスに伴う合併症(穿刺部位の血栓症, 血腫, 疼痛, 神経損傷, 気胸など), 置換液に関連する合併症(低Ca血症, アレルギー反応, 感染症, TRALI(transfusion-related acute lung injury)など、いずれもFFPで生じやすいため置換液はアルブミン溶液を選択することも多い)などがあります。
IVIgの絶対禁忌には過敏症既往があり、その他の禁忌事項としてIgA欠損症, 重篤な肝・腎不全, 脳・心血管障害などの循環不全の既往, 過血清粘稠度(脂質異常症, クリオグロブリン血症, 高γ-グロブリン血症, 糖尿病など), 深部静脈血栓症の既往があります。主な有害事象には頭痛, 発熱, 筋痛, 血圧低下, 髄膜症, 蕁麻疹, 皮疹があり、重篤な有害事象には急性腎不全, 血栓塞栓症, 汎血球減少, ショック, アナフィラキシーなどがあります。GBS620例を対象とした本邦の報告(診療と新薬 2006;43:1175-1190)では有害事象は203例(32.7%)にみられ、頭痛, 悪心, 発疹, 発熱が多く、検査値異常として肝機能障害, 好中球減少, 白血球減少, 血小板減少, 好酸球増加の頻度が多いと報告されています。また、重篤な有害事象26例(32件)であり無菌性髄膜炎(5例), 肝機能異常(5例), 好中球減少(5例), 白血球減少(3例), 代謝性アシドーシス(2例)などの他に脳梗塞, 痙攣, 低酸素症, くも膜下出血, 可逆性白質脳症症候群, 深部静脈血栓症, 肺梗塞などもみられたと報告されています。
IVIgの再施行
2024GLでは”初回治療で効果が不十分である症例”および”治療関連変動(TRF:treatment related fluctuation)を示す症例”でIVIgの再施行を考慮してよいとされます。再施行に際しては初回投与終了後から1週間程度空けるなど血栓症の予防に留意し、治療効果などの観点から発症から4週以内に施行します。
”初回治療で効果が不十分である症例”については、二重盲検RCTであるSID-GBS trialで有効性は確認できずむしろ血栓症の頻度が増加したと報告されています(Nerv Syst 2018;23:210-215)。この報告をもとにEAN/PNSの新GLではIVIg再施行が推奨されていません。一方で本邦の2024GLでは、SID-GBS trialでは予後不良と予測されたGBSのみを対象としていること, 初回IVIg開始日から7-9日後の再施行となったことが試験の結果につながった可能性も考えられるとし、初回投与後から2週間前後でのIVIg施行が有効であったとする報告(Lancet 1997;350:1747)もあることから”考慮してよい”という記載になっています。この判断に際して、近年報告されているΔIgG低値やIVIg開始2週間後あるいは治療前の血清アルブミン低値といった予後不良因子の確認が有用です。ΔIgGはIVIg開始後2週間での血清IgG上昇の程度で、入院時に歩行不能のGBS174症例の6か月間の観察期間において、呼吸不全症例の76%(31例), 自力歩行不能症例の85%(23例)はΔIgGの低い群(≦730mg/dL)であったとする報告があり(Ann Neurol 2009;66:597-603)、特にΔIgGが低い症例ではIVIg再施行を検討し得ます。
“TRFを示す症例”については、IVIgを繰り返すことで病状が安定したとする報告(J Neurol Neurosurg Psychiatry 1991;54:957-960)があり、TRFの病態として疾患活動性が持続する中でPEやIVIgの治療効果が減弱することが想定していることなどから個人的には積極的な再施行を検討しても良いのではないかと考えています。
TRF:⑴発症4週以内にHughesの機能グレード尺度(FG:functional grade)の1以上またはMedical Research Council(MRC) sum scoreの5ポイント以上の改善がみられた後の、FGの1以上またはMRC sum scoreの5ポイント以上の悪化、もしくは、⑵臨床経過が1週間以上安定したあと、FGが1以上またはMRC sum scoreが5ポイント以上悪化した状態と定義されています。
※FGとMRC sum scoreについてはリンク先を参照ください。
PEとIVIgの併用
まず、IVIg後のPEはIVIgの効果を減弱させる可能性があり推奨されません。検証したRCT(IVIg終了からPE開始まで平均3.88-5.56日)(J Clin Neuromuscul Dis 2010;12:55-61)では、退院時のFGはIVIg後PE群よりもIVIg群でより低かったと報告されています。投与したIVIgが十分な薬効を発揮する前に除去されるためとも解釈することができます。また、PE後のIVIgについても症状や予後が改善される根拠は乏しく、2024GLでは推奨されていません。
副腎皮質ステロイド薬の単独療法
無効とするCochraneレビューがあり(Cochrane Database Syst Rev 2016:CD001446)、2024GLでは単独療法を施行すべきではないとされます。一方で免疫チェックポイント阻害薬による副作用であるirAEとしてGBS様の症候が出現した場合は、副腎皮質ステロイド薬が奏功するという指摘があり、米国臨床腫瘍学会のガイドラインではメチルプレドニゾロンパルス(1000mg/日, 5日間)が推奨されています(J Natl Compr Canc Netw 2019;17:255-289)。ただし、そもそもirAEとして発症したGBS様の症候をGBSとして含めるべきかどうか議論の余地があります。
IVIgと副腎皮質ステロイド薬の併用
有効性が議論されており、2024GLでは”有効である根拠が乏しい”と言及があります。特にわが国での多施設後方視的検討では、入院時に機能的予後不良と予測される症例のサブ解析でIVIg1コース施行群よりもIVIg+メチルプレドニゾロンパルス併用群で6か月後のFGが有意に良好であったとする報告(J Peripher Nerv Syst 2017;22:433-439)があり注目されます。一方で症例によっては副腎皮質ステロイド薬の併用は有害である可能性を示す症例対照研究の報告(Medicine(Baltimore) 2015;94:e1898)などもあることから、前述の2024GLの推奨となっています。なお、PEと副腎皮質ステロイド薬の併用については明らかな有効性を示すエビデンスレベルの高い報告はなく、2024GLでも”併用は推奨できない”とされます。
その他の免疫療法
2024年7月現在、血漿浄化療法とIVIg以外にGBSに対する有効性が確立し、推奨される治療法はありません。
注目された最近の話題として、IVIgへのエクリズマブの上乗せ効果が期待されましたが本邦の第Ⅲ相試験では、その効果は示されませんでした(第64回日本神経学会学術大会抄録集Pe-012-1(会議録),千葉,2023)。
その他にIgGをFabとFcフラグメントに切断するシステインプロテアーゼ(IdeS:IgG degrading enzyme of Streptococcus pyogenes)に関して、IVIgへの上乗せ効果をみる第Ⅱ相試験が欧州で実施されています。
支持療法
球麻痺
症例ごとに応じますが、経鼻胃管や胃瘻などでの対応を要し得ます。
自律神経障害
GBSの自律神経障害は自覚障害がなく、何らかの検査で確認できる程度の軽微なものが多い一方で、生命予後を左右する心血管系, 消化器系の障害が生じることもあります。特に徐脈症例で収縮期血圧の日内変動が大きい(85mmHg以上となることも多い)場合は、GBSの自律神経障害の影響を考えます(J Neurol 1999;246:1015-1022)。このような著明な血圧変動や徐脈性不整脈を認める場合はICU管理を考慮し、ヘッドアップなどの介護操作, 喀痰吸引時の血圧変動や不整脈出現などに十分注意します。
血圧変動の大きい症例では、高血圧に対する降圧薬や血圧低下に対する昇圧薬を安易に使用するべきではなく、経時的な血圧モニタリングを行うことが重要です。なお、このような症例では原則としてPEは推奨されません。
頻脈のみでは原則治療不要ですが、特に徐脈性不整脈は死亡に至る症例もあるため注意深いモニタリングおよび一時ペーシング等も検討します。
排尿障害については、重症例では尿道カテーテルによる管理を要することが多い一方で軽症例では自然経過で改善することが多いとされます。
腸管蠕動運動障害については、排便コントロールを行いますが麻痺性イレウスの発症に注意が必要です。
SIADH/低Na血症
重症例で合併が多い傾向があるため重症度の指標になります。SIADHそのものは水制限や経過観察のみで改善することが多いとされます。
遅発性顔面神経麻痺
GBSやFS(Fisher syndrome)で症状のピークまたは回復期に、稀に遅発性の顔面神経麻痺が発症し得ますが基本的には追加治療なしで自然経過による回復が期待できます。
疼痛
GBSやFSの36%に麻痺の出現に先行して疼痛が出現, 66%に急性期の疼痛あり, 38%に1年後も疼痛ありとする前向きコホート研究があります(Neurology 2010;75:1439-1447)。その機序は感覚異常の伴う痛み, 神経根痛, 背部痛, 髄膜症による疼痛, 筋肉痛, 関節痛, 内臓痛など多岐に渡り(Pain 1994;59:159-164)、GBSの神経障害性疼痛の機序として小径線維の障害の関与を指摘した報告(Pain 2010;151:53-60)もあります。
疼痛の治療として2024GLではガバペンチン, カルバマゼピンは有効、プレガバリン, ミロガバリン, 三環系抗うつ薬, デュロキセチンは使用を考慮してよい, 難治例ではオピオイド鎮痛薬も考慮する, 神経根痛が強い症例では短期間の副腎皮質ステロイド薬の使用を考慮してよいとされています。
副腎皮質ステロイド薬については、オピオイド鎮痛薬でも除痛できない重度の腰痛に対する3日間のデキサメタゾン経静脈投与(Muscle Nerve 2002;25:468), 重度の神経根痛に対するステロイドパルス療法(臨床神経 2013;53:543-550), 小児例における重度の神経根痛に対する経口プレドニゾロン療法(Brain Dev 2015;37:897-900)などの報告があり、いずれも迅速かつ顕著な効果を認めています。
薬物療法以外では保温, 冷却, 良肢位保持などが少数例の検討で有効であったとする報告(Pain 1994;59:159-164)があり検討できます。
疲労
100名のGBS患者の検討で、重度の疲労は全患者の60%に認め、女性, 50歳以上の患者に多く、運動障害の程度との有意な関連はなかったとされます(J Neurol 2006;253:1143-1146)。筋力低下では説明のつかない疲労と考えられますが、強い疲労を有する患者は有意に母指球筋の運動単位数が少なく、潜在的な軸索数減少が疲労と関連している可能性が指摘されています(Neurology 2013;81:1827-1831)。適度な運動が疲労を改善すると考えられています。
ワクチン接種
2024GLではワクチン接種によるGBS再発のリスクは極めて少ないと考えられ、ワクチンによる疾病予防のメリットと再発のリスクを勘案して症例ごとに判断するようにと言及があります。一方で海外のExpert opinionとして”インフルエンザワクチン接種後6週以内にGBSを発症した患者では、インフルエンザ感染による合併症のリスクが高くなければ、その後のインフルエンザワクチン接種は避ける”(MMWR Recomm Rep 2010;59:1-62)、”GBS発症1年以内は、ワクチン接種を避ける”(J Neurol Neurosurg Psychiatry 2003;74(Suppl Ⅱ):ii9-ii14)などがあります。
予後
ギラン・バレー症候群の予後
短期的な予後として人工呼吸器装着の有無, 集中治療室入室有無, 長期的な予後として6か月後に自力歩行できるかどうかが予後指標として用いられることが多いです。なお、人工呼吸器装着の可能性の予測にmodified EGRIS(J Neurol Neurosurg Psychiatry 2023;94:300-308)、発症後4週目と26週目において自力歩行ができない可能性の予測にmEGOS(Neurology 2011;76:968-975)がそれぞれ有用とされます。
本邦のGBS177例(96%に血漿浄化療法かIVIgが施行)の予後を後方視的に解析した多施設共同研究では、人工呼吸器装着例が17%(30例), 発症後6か月での独歩可能例(FG≦2)が89%であったと報告されています(J Peripheral Nerv Syst 2017;22:433-439)。
長期予後について、10年間経過を追えたGBS29例の解析で独歩不能例は発症2週目で76%(22例), 2年目で14%(4例), 10年目で10%(3例)であったと報告されています(J Neurol Sci 2012;317:74-79)。
回復が良好であるとされる小児でも、1年後には全員独歩可能であったものの65%に何らかの症状や訴えが残り、30%に神経学的後遺症を認め、日常生活への影響は小さくないものと考えられています(J Peripher Nerv Syst 2014;19:121-126)。
予後不良因子
人工呼吸器装着の危険因子:①筋力低下発症から入院までの期間が短い, ②球麻痺の存在, ③頸部屈筋の筋力低下, ④腸腰筋の筋力低下, ⑤入院時四肢筋力の低下の強さなどがあります。その他にIgG型GQ1b抗体(Neurology 2004;62:821-824)、GD1a/GD1b複合体抗体(J Neuroimmunol 2007;182:212-218)陽性なども挙げられます。
3-6か月後独歩不能の危険因子:①高齢, ②下痢/胃腸炎の先行, ③入院時FGの高値, ④入院時四肢筋力低下の強さ, ⑤CMAP振幅の減少などがあります。その他にIVIg開始後2週間での血清IgG増加分(ΔIgG)<730-1108mg/dL(Ann Neurol 2009;66:597-603)(J Peripher Nerv Syst 2017;22:433-439)、IVIg開始後2週間での血清アルブミン値<3.5g/dL(JAMA Neurol 2017;74:189-196)、入院後7日目のmEGOS≧10点でIgG型GD1a抗体陽性(J Neurol Neurosurg Psychiatry 2020;91:1339-1342)、発症時のIgG型およびIgM型GM1抗体力価が高いことやIgG型GM1抗体力価が持続的に高いこと(Neurol Neuroimmunol Neuroinflamm 2023;10:e200107)なども挙げられます。また、血漿NfL(neurofilament light chain)>319pg/mLで発症1年後の自立歩行不能と、>248pg/mLで発症1年後の走行不能と関連したとする報告があります(※髄液中のレベルも参考になる)(J Neurol Neurosurg Psychiatry 2020;92:70-77)。
この記事が気に入ったらサポートをしてみませんか?
