ギラン・バレー症候群の診断
ギラン・バレー症候群(GBS:Guillain-Barré Syndrome)は代表的な急性発症の免疫介在性多発ニューロパチーで、神経疾患の中でも特に緊急での対応を要する疾患です。今回、11年ぶりに改訂された日本神経学会のガイドラインの内容も参考にしながらGBSの診断についてまとめてみました。
基本事項
76%(Brain 2018;141:2866-2877)に発症前4週間以内の先行するイベント(感染など)を伴う両側性弛緩性運動性麻痺で、腱反射消失や脳脊髄液の蛋白細胞解離等を伴いやすい急性発症の免疫介在性多発ニューロパチーです。単相性の臨床経過であり、症状は4週以内にピークに達し、その後は改善傾向となります。4週を超えても症状が進行する場合は、原則としてその他の疾患を考えます。
症状のピークでは約80%で自力歩行不能となり(Brain 2018;141:2866-2877)、無治療の自然経過では約13%が死亡する一方で67%は12か月後に完全に回復します(J Neurol Neurosurg Psychiatry 1988;51:605-612)。本邦での疫学研究では死亡率0.5-1.1%であり発症6か月後のHughesの機能グレード尺度(FG:functional grade)3点(歩行器または支持があれば5mの歩行可能)以上の重症例は約10%(J Peripher Nerv Syst 2017;22:433-439)と報告されています。
発症は全年齢層にみられますが高齢ほど発症率は高く、男性に好発します(男女比1.78)(Neuroepidemiology 2011;36:123-133)。
約60%(J Neuro inflammation 2021;18:251)に末梢神経に存在する糖脂質に対する抗体が急性期の血清中に検出され、その産生機序の1つに病原体との分子相同性が想定されています。主に抗原抗体反応による補体介在性神経障害が生じます。その他に宿主側の免疫遺伝学的背景も発症に関係しています。
臨床病型
①電気生理学的分類
脱髄型と軸索型に分けられ、前者にはAIDP(acute inflammatory demyelinating polyneuropathy)、後者にはAMAN(acute motor axonal neuropathy)とAMSAN(acute motor and sensory axonal neuropathy)があります。
脱髄型と軸索型の長期予後に差はないものの、AMANは急速回復例と予後不良例に二分化されるとされます(Neurology 1998;51:1656-1660)。
また、AMANは極期に達するまでの期間が短いのに対し、AIDPではより長く、初診時歩行可能→経過で歩行不能になる例が有意に多かったり(Neurology 2003;61:471-474)、人工呼吸管理を要する例(Lancet Neurol 2006;5:1021-1028)や自律神経障害が多くみられるという報告(Acta Neurol Scand 2002;105:44-50)もあります。
現時点で脱髄型と軸索型で治療法を変える必要があるとする明らかなエビデンスはありません。
②臨床症状による分類

2016年の本邦の後方視的研究(日本人患者103名)では、古典的GBS 71%, FS 17%, BBE 3%, PCB 2%, 下肢型 1%, 両側顔面麻痺・四肢感覚異常型 1%, 急性眼筋麻痺 1%, 急性失調性神経障害 1%と報告されています(J Neuro Sci 2016;369:43-47)。
先行イベント
①先行感染
症例の76%(Brain 2018;141:2866-2877)に発症前4週以内の先行するイベントが報告されており内訳として上気道感染症(35%)、胃腸炎(27%)と感染症が多くを占めます。
種々の報告から本邦の2024GLでは約70%で発症前4週間以内に先行感染症状がみられ、約6割は上気道感染で約2割は消化器感染であると言及があります(日本神経学会.ギラン・バレー症候群,フィッシャー症候群診療ガイドライン2024)。
疫学的関連性が確立されているのはCampylobacter jejuni, CMV, Haemophilus influenzae, Mycoplasma pneumoniae, EBV, HEV, A型インフルエンザウイルス, Zikaウイルスで(Lancet 2021;397:1214-1228)、血清学的根拠が示されているのはC.jejuni(30%), M.pneumoniae(10%), CMV(4%), HEV(3%), EBV(1%)とC.jejuniの頻度が高いとされます(Neurology 2022;99:e1299-e1313)。
臨床病型との関連としてはC.jejuni感染が運動優位のAMANと、CMV感染が強い感覚障害と重症例との関連があるものとされます(Lancet Infect Dis 2001;1:29-37)。
COVID-19の原因ウイルスであるSARS-CoV-2との関連も報告されており、発症率は感染者10万人あたり15人であり、感染者では脱髄性GBSのオッズが現代の非感染者や過去の対照に比して増加した(オッズ比3.27, 95%CI 1.32-8.09)とされています(Eur J Neurol 2021;28:3517-3529)。臨床像の特徴としては古典的GBSが約7割を占め、電気生理学的にはAIDPが約7割弱を占めます。
②その他の先行イベント
ワクチン接種, 外傷, 大手術(骨と消化管), ショック, 免疫チェックポイント阻害薬の使用などがその他の先行イベントとして挙げられます。
その多くについてはGBSの発症との関連性を証明することは困難とされますが、診断に役立つ可能性はあります。
遺伝子組換え帯状疱疹ワクチン, SARS-CoV-2アデノウイルスベクターなどでわずかな発症リスク増加が報告されているものの、ワクチン接種の利点はこのリスクを上回ると考えられています(日本神経学会.ギラン・バレー症候群,フィッシャー症候群診療ガイドライン2024)。
診断
①EAN/PNSの診断基準


※EAN/PNS:European Academy of Neurology/Peripheral Nerve Society
上側の表は2023年に作成されたEAN/PNSガイドラインの古典的GBS(運動・感覚型および純粋運動型)の診断基準を示しています。下側の図は同ガイドラインよりGBS診断の手順の概略を示しています。
古典的GBSの診断は症状, 病歴, 神経診察から行うことができ、【診断に疑問を持たせる所見】を複数認める場合は、診断を再考する必要があります。
②臨床症候
症状は発症後4週間以内に極期に達し、その後しばらくして快方に向かいます。
筋力低下(弛緩性運動麻痺):主な症状であり手足のしびれ感が先行することが多いです。原則として左右対称性に出現し、遠位筋優位でも近位筋優位でもあり得て、遠位と近位筋が同時に低下することもあります。重度の場合は完全四肢麻痺となり、呼吸筋麻痺に至ると人工呼吸管理を要します。頸部筋力低下は重症例ほどみられ、軽症例ほど筋力低下が上肢か下肢に限局します。筋萎縮は重症例に多く、急性期にも認め得ます(厚生労働省特定疾患対策研究事業 免疫性神経疾患に関する調査研究班 平成12年度研究報告書, p99-101, 2001)。
腱反射:原則として低下または消失するものと考えます。病初期には正常のこともあり、C.jejuni感染後の軸索型GBSでは経過中に亢進を示す場合もあります(J Neurol Sci 2002;199:89-92)。
感覚障害:原則として運動障害に比して軽度であり、異常感覚のみの場合が多いものの、感覚脱失にまで至る例もあります。また、疼痛を伴うことも多く実臨床における重要事項です(Neurology 2010;75:1439-1447)。
脳神経障害:本邦における全国調査ではFSなどの亜型を除いたGBSのうち約50%の症例で認めており、顔面神経麻痺(34%, 両側性も含む), 球麻痺(29%), 眼球運動障害(13%)で、いずれも重症例ほど多い傾向がありました(厚生労働省特定疾患対策研究事業 免疫性神経疾患に関する調査研究班 平成12年度研究報告書, p99-101, 2001)。その他に稀ですが視力障害の報告もあります(J Peripher Nerv Syst 2005;10:340-341)。
自律神経障害:38%に認め心血管系, 尿路系, 消化器系, 発汗, 瞳孔機能に関する症候に大別され、特に高血圧と洞性頻脈が多いとされます。また、自律神経障害を伴う症例ではSIADH, PRES, 心血管系イベントなどの合併がみられ、ICU入室率(76.1%), 人工呼吸器装着率(50.7%), 死亡率(5.6%)が高いと報告されています(Neurocrit Care 2020;32:113-120)。
③脳脊髄液検査
2024GLでは脳脊髄液検査は推奨されるものの必須ではなく、臨床診断および電気診断が十分に確定的でない症例において、診断確定のための意義があるとされています。
蛋白細胞解離を認めることが多く、その目安としてNINCDSの診断基準では細胞数≦10/μLは診断を支持(≧50/μLでは診断を再考するべき)する所見とされ、Brighton診断基準では細胞数<50/μLおよび蛋白>45mg/dLのそれぞれが診断項目として挙げられています(Vaccine 2011;29:599-612)。
蛋白細胞解離はGBS症例の70%に認めるものの、筋力低下発症後3日以内では52%にしか蛋白上昇はみられなかったとする報告(Neurology 2023;100:e2386-2397)もあり、発症初期では検査結果の解釈に注意を要します。一方で、蛋白細胞解離を認めるその他の疾患の多くは持続的な蛋白上昇を示すことが多く、初回検査値が正常であっても繰り返しの検査で蛋白上昇をみた場合にはGBSの診断的意義が高いと言うことができます。
なお、年齢に応じて脳脊髄液蛋白の正常上限値を調整すべきとするシステマティックレビューもあり、30歳代で54mg/dL, 40歳代で57mg/dL, 50歳代で60mg/dL, 60歳代で63mg/dL, 70歳代で67mg/dLと算出されています(J Neurol 2019;266:616-624)。この数値に従うと発症後第1週での蛋白上昇は45%に限られたとする報告もあります(Neurol Neuroimmunol Neuroinflamm 2019;6:e576)。
蛋白上昇は男性, 脱髄型, 近位優位あるいは全身型の筋力低下を示す例に有意に高頻度で認め、重症度が高い例でより高値を示すとされます(Neurology 2023;100:e2386-e2397)。
細胞数増多は通常はみられないものの、みられたとしてもGBSの診断をただちに否定するものではないと考えられており、本邦の報告で11.8%で細胞数増多を認め、範囲は51±94.5/μLとするものがあります(厚生労働省特定疾患対策研究事業 免疫性神経疾患に関する調査研究班 平成11年度研究報告書, p83-84, 2000)。
IgG indexは約30%で上昇を認める(特に血清糖脂質抗体陽性群で高頻度)ものの、オリゴクローナルIgGバンドは原則として検出されず(Eur J Neurol 2006;13:153-160)、脳脊髄液中での糖脂質抗体測定の診断的意義はないと考えられます。
④血液検査
血清糖脂質抗体:詳細は別記事でまとめます。陰性でもGBSは否定できず、非典型的な症例など診断に迷う場合は測定が有用です。
合併病態に関する項目:低Na血症は合併するSIADHによりみられ得て、重症例や人工呼吸器使用例で有意に頻度が高いとされます(Neurology 2011;76:701-704)。高CK血症は発症後1週間以内に38%でみられ、疼痛を訴える患者で頻度が有意に高く(77% vs 13%, 上昇の程度と疼痛の程度の相関はない)、最高でも上昇幅は正常上限の7倍程度までと報告されています(Arch Neurol 1984;41:511-514)。
鑑別診断に有用な項目
-血清蛋白分画・免疫固定法, MAG抗体, VEGF:免疫介在性ニューロパチー
-ACh受容体抗体, MuSK抗体:MG -VGCC抗体:Lambert-Eaton症候群
-CK, ミオグロビン, CRP, 抗核抗体, 筋炎関連抗体:炎症性筋疾患
-CRP, 抗核抗体, SS-A/B, P-ANCA, IgE, 好酸球:血管炎性ニューロパチー
-腫瘍マーカー, sIL-2R, LD:癌性・悪性リンパ腫性髄膜腫症
-ACE, リゾチーム, Ca:サルコイドーシス -ボレリア抗体:Lyme病
-K, 甲状腺ホルモン:甲状腺機能亢進症, 低K性ミオパチー, 周期性四肢麻痺
-P:低P血症 -Mg:高Mg血症 -VitB1:Wernicke脳症
-ポルフィリン体:急性間欠性ポルフィリア -ChE:有機リン中毒
-鉛, δ-ALA:鉛中毒 など
⑤神経伝導検査
詳細はリンク先記事を参照ください。
初期評価および1-2週間後やそれ以降の経時変化を確認することで、診断や分類および他疾患との鑑別に役立ちます。
予後予測にも役立つ可能性が示唆されており、可能な限り施行が望ましい検査です。
⑥その他の検査
脊髄神経根の造影MRI:検出感度は高く、造影効果には前根のみの造影, 前根の造影が後根より顕著, 前根と後根の同程度の造影の3パターンがあるものとされます。造影効果が強い症例では下肢背部痛の頻度, 下肢近位筋筋力低下の重症度が高いとする報告があります(Neurology 1996;47:813-817)。なお、脊髄神経根, 馬尾の造影効果はGBS急性期に高頻度に認めるもののその他の種々の疾患でも認め、特異的な所見ではありません(J Paediatr Child Health 2014;50:E72-E76)。
神経超音波検査:上肢の神経近位と頸神経根に軽度の肥厚が存在することが多いとされます。
※2024GLではMRIや超音波検査は診断が不確実な場合にのみ考慮され、他の原因の除外に用いられるべきであると言及があります。
神経生検:2024GLでは他の非侵襲的な診断手段があるため、診断的利用は推奨されていません。
CIDPとの鑑別
①A-CIDPとGBSの鑑別
CIDPの一部の症例は急性発症し、A-CIDP(acute onset-CIDP)と呼ばれます。
A-CIDPと脱髄型GBSを初期に鑑別することはしばしば困難ですが、鑑別ができれば治療選択や予後判定に役立つことが期待できます。
GBSに対するA-CIDPの割合は8/170例程度と報告されており(Neurology 2010;74:1680-1686)、その臨床像として先行感染を欠き、感覚障害が目立つ症例が多く、自律神経障害, 顔面神経麻痺, 呼吸不全が少ないこと(Muscle Nerve 2010;41:202-207)や固有感覚障害や運動失調が目立つこと(J Peripher Nerv Syst 2018;23:154-158)が特徴と考えられています。
脱髄型GBSとCIDPの鑑別に髄液IL-8が有用とする報告があり、カットオフ値を70pg/mL(高値はGBS, 低値はCIDPを示唆)とするとGBSの陽性的中率は100%、この傾向はA-CIDPとの比較でも同様であったとされます(Neurol Neuroimmunol Neuroinflamm 2021;8:e1031)。
なお、電気生理学的検査でA-CIDPとGBSの鑑別を行うことは困難と報告されています(Muscle Nerve 2010;41:202-207)。
②治療関連変動・再発性GBSとCIDPの鑑別
血漿交換やIVIg後に一度軽快した症状が再増悪する治療関連変動(TRF:treatment related fluctuation)がみられることがあり、種々の報告から5-10%の頻度でみられるものとされます(日本神経学会.ギラン・バレー症候群,フィッシャー症候群診療ガイドライン2024)。
TRF:⑴発症4週以内にHughesの機能グレード尺度(FG:functional grade)の1以上またはMedical Research Council(MRC) sum scoreの5ポイント以上の改善がみられた後の、FGの1以上またはMRC sum scoreの5ポイント以上の悪化、もしくは、⑵臨床経過が1週間以上安定したあと、FGが1以上またはMRC sum scoreが5ポイント以上悪化した状態と定義されています。
遠位優位, 純粋運動型, GM1抗体陽性, 胃腸症状の先行等の軸索型GBSの背景のある症例ではTRFはみられず、SNAP振幅の低下した症例でTRFが多かったとする報告があり(J Neurol Neurosurg Psychiatry 1998;64:242-244)、リスク因子と考えられます。
●FGとMRC sum score

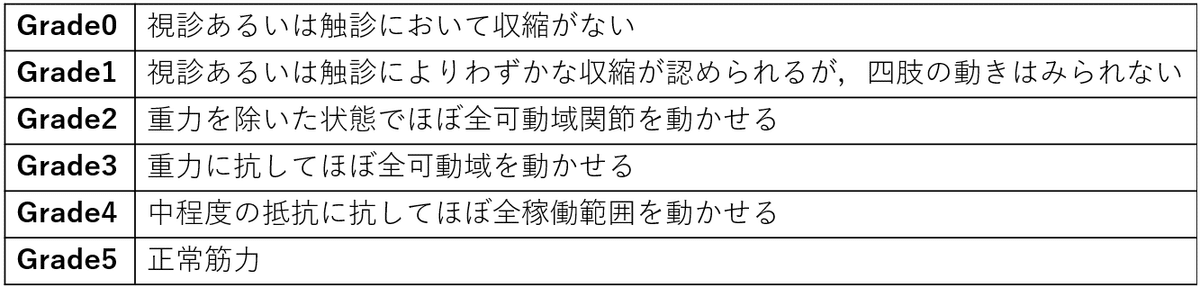
MRC sum scoreでは肩関節外転, 肘関節屈曲, 手関節背屈, 股関節屈曲, 膝関節伸展, 足関節背屈において上記のスケールに沿って筋力評価を行い、その合計点を算出します。
この記事が気に入ったらサポートをしてみませんか?
