
核酸化学講座 #1 核酸の化学合成
こんにちは、カモシカです。
本稿は記念すべき核酸化学講座の第1回ということで、核酸の化学合成法について説明したいと思います。
核酸の化学合成法
これまでに、ジエステル法・トリエステル法・ホスファイト法・H-ホスホネート法・アミダイト法をはじめとした数多くの核酸合成法が開発されています。これらの合成法の中でも、収率・操作性・再現性・実用性に優れるアミダイト法が現在の核酸合成法の主流となっています(1-2)。この手法では、図1に示すサイクルを繰り返すことによりCPGと呼ばれる固相単体上で核酸を1塩基ずつ伸長していきます。
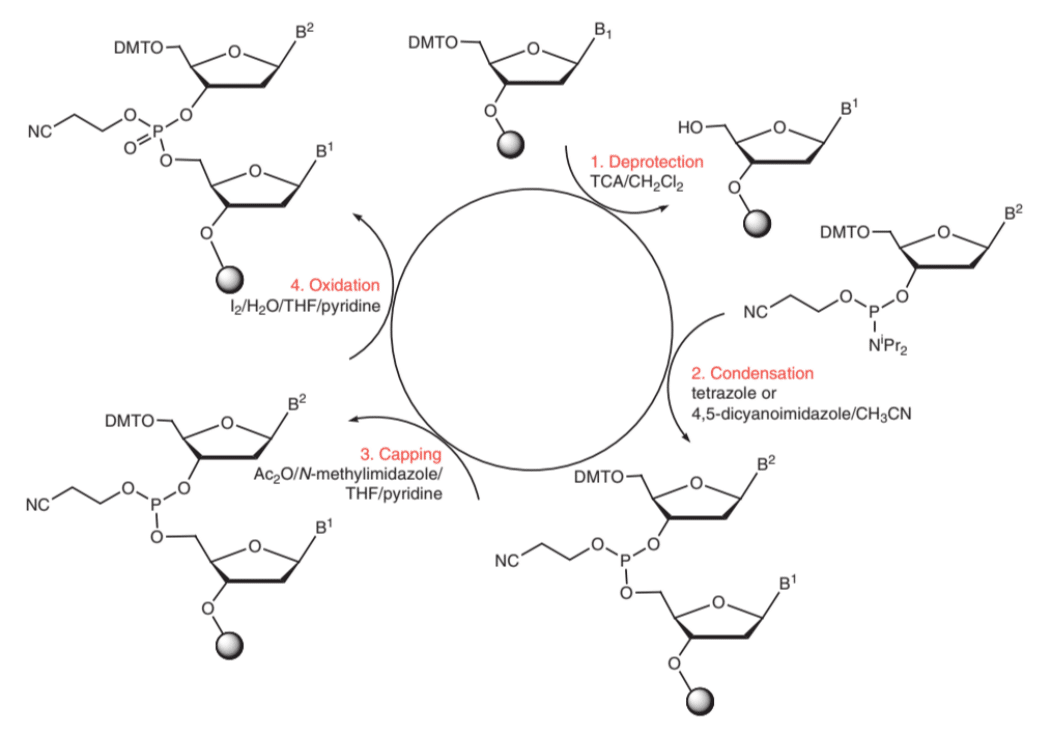
Nucleic acids in chemistry and biology 3rd edition より引用 (3)
Step 1: 脱保護
CPGに担持されたヌクレオシドから4, 4'-ジメトキシトリチル基(4, 4'-dimethoxytrityl; DMTr)を除去することで5'位の水酸基をフリーにする。これにより、CPG上のヌクレオシドがアミダイトと反応できる状態になる。脱保護には1%TFA(トリフルオロ酢酸)や3%TCA(トリクロロ酢酸)などの酸性溶媒が利用される。通常、トリチルカチオンが呈する赤色の発色をもとにカップリング効率が算出される。
Step 2: カップリング
活性化剤を用いて、CPG上のヌクレオシドとアミダイトをカップリングさせる。活性化剤には1H-tetrazoleや5-(benzylthio)-1H-tetrazole (BTT)などが利用される。活性化剤によりテトラゾリウム塩が形成された後に、ヌクレオシドの5'位水酸基からの求核攻撃を受ける。これにより、亜リン酸エステルが形成される。この工程は禁水反応であるため十分な脱水操作が必要である。また、カップリングの反応性は2'位の修飾の影響を受けるため、反応時間や活性化剤を適宜検討する必要がある。
Step 3: キャッピング
カップリング後はキャッピング反応によってフリーの5'位の水酸基を不活性化させる。この操作をしなければ、1塩基欠損型の核酸ができてしまうため高精度に核酸を合成するために重要なステップである。この反応は無水酢酸を用いて5'位の水酸基をアセチル化する。この反応もStep 3と同様に禁水反応であるため十分な脱水反応が必要である。
Step 4: 酸化
酸化剤を用いて、3価の亜リン酸エステルを安定な5価のリン酸エステルに変換する。なお、ホスホロチオエート核酸を合成する場合には硫化剤を用いる。酸化剤には水が含まれているため、脱水操作は不要である。
Step 5: 伸長反応の繰り返し
Step 1- Step 4を繰り返し、任意の長さまで伸長反応を行う。
Step 6: 切り出し・脱保護
伸長したオリゴヌクレオチドをCPGから切り出すと同時に、シアノエチル基と塩基の保護基を脱保護する。通常のDNA合成の場合は、28%アンモニア水中、55~65 ℃, 16時間程度加熱する。ちなみに、CPGからの切り出しやシアノエチル基の脱離は室温下で1時間程度で十分に進行する。このステップの律速段階は塩基の保護基を脱保護する反応である。
※注意点
チューブ開封時にアンモニア水が飛散する恐れがあるため、保護メガネの着用やスクリューキャップの使用など十分に安全に留意すること。
以上になります。
次回はアミダイトについて説明したいと思います。
参考になれば、ぜひいいねお願いします。
参考文献
(1) S. L. Beaucage, M. H. Caruthers, Tetrahedron Lett., 22, 1859, (1981)
(2) S. L. Beaucage, R. P. Iyer, Tetrahedron, 48, 2223, (1992)
(3) G. Michael Blackburn, Michael J. Gait, David Loakes, David M. Williams, Nucleic acids in chemistry and biology 3rd edition, 2006, p152.
この記事が気に入ったらサポートをしてみませんか?
