
認知症新薬(レカネマブ: lecanemab )
認知症新薬(レカネマブ: lecanemab )とは
エーザイ・バイオジェンから認知症新薬の承認申請がFDAに提出されました。迅速承認のステップに入ったとリリースが出ています。
2020年にも、認知症新薬(アデュカヌマブ: aducanumab)で世間を騒がせていましたね。あの時は騒がせておきながら、薬そのものはイマイチで日・欧で承認されず、承認された米国でもFDAとの癒着説や、とある有名神経病センターがバイオジェンMRを一律出入禁止にする、承認に反対していた審査委員(いずれも認知症の高名な研究者)が抗議の辞任をするなど、界隈での抗議行動が目につき、疑惑が残ります。
医薬品はデータがよければ勝手に売れてメガヒット確定です(例えば、モデルナ、ファイザーの新型コロナウイルスワクチン)。注目されているポイントでポジディブデータがあれば必ず公表します。承認申請時点で公表されていなければポジティブデータがないというのが妥当な推測です。
統計は有益な学問領域ですが、見せ方次第でいかようにもデータをメイクアップする(ダマす)ことができます。
残念ながら、有意差を出すツールとして利用されているという側面があります。
・注目されているポイントでデータを公表しているか?
・統計的なダマしはないか?
そんな観点から記事を書きました。
記事に関するディカッションや間違いのご指摘は大歓迎です。
Twitter: @nobu_nikkei225 までDMいただけますと幸いです。
ぜひお願いいたします。
さて、今回の薬はどうでしょう。
レカネマブ: Lecanemab
分子量:147,088
期待される作用機序:アミロイドβ(※1)除去
投与方法:皮下注射(720㎎、週1回)、点滴静注(10㎎/kg、週2回)
・すでにある認知症薬は、内服または貼り薬です。
投与方法では既存薬に劣ります。
現時点(2022/11/22)では、一部のデータのみ公表されています。
わかる範囲で以下に記載します。
・今後の予定
2022/11/29 16:50~(米国太平洋標準時)日本時間11/30 午前9:50~
海外学会で詳細データ公表予定(欧州ではなくて米国の学会です)
LIVE link https://clarityad-ctad.us.chime.live/
2023/1/6 までにFDAの審査結果が公表予定
臨床試験概要
考察は筆者個人の見解です。
【方法】
対象:50-90歳の認知症患者およそ1800人
①プラセボ群
②点滴静注群(10㎎/kg、週2回)
③皮下注射群(720㎎、週1回)
二重盲検試験;被検者、検査者、評価者すべてにどの群に入っているかわからない状態での臨床試験
観察期間は18か月
主要評価項目;臨床試験開始前に決めておかなければいけない評価基準
CDR-SB(18点満点)という認知症の評価スケール、0.5点もしくは1点刻みの伝統的な評価手法だが、現在の臨床現場ではあまり用いられていない。試験参加時にデータを取っているMMSEの方が一般的な検査。
【結果】
治療群(皮下注射群か点滴群か言及なし)と対照群(プラセボ)でCDR-SB(0.5点刻みのスケール)で 0.45点の統計学的有意差(p=0.00005)あり
以下がCDR-SBの評価基準、6項目の合計点で評価する。

【会社リリース】
①認知症の進行に対して効果のある画期的な新薬。
②アミロイドβが認知症の原因であるというアミロイド仮説を証明できた。
【考察】
個人的な見解です。
できるだけ事実と感想を分けて書くように心がけています。
①認知症評価スケールの一つで治療群と非治療群に統計学的有意差がでたことは意義がある。
②用いられた評価スケールのCDR-SBは0.5点刻みの評価方法、それに対して治療群・非治療群の差は0.45点で、評価スケールの0.5点に埋もれてしまい、この方法では評価できない。計算上、統計学的有意差があったのみとも言える。専門家が用いる評価手法(CDR-SB)ですら評価困難な状態を、患者家族が評価できる可能性は極めて低く、使用をしても効果を実感できない(薬を投与してない状態と投与した状態を同一人物で比べることができないため、そもそも効果は実感できない)。会社リリース①は、”進行を遅らせる効果がある”とするのが、より正確な表現。
③病的なアミロイドのアミロイドβ減少が確認された一方で、正常のアミロイドが増加している。
→アミロイドβの減少を認知症の原因とする1対1対応は証明できない。
会社リリース②は論理的に破綻している。
もし基礎研究者がしたら、一生を棒に振るレベルの発言(笑)
出来の悪い大学院生だった私でも絶対にしないレベルです。
煽り屋のみに許される発言でしょう。
④一般的な評価基準であるMMSEを試験開始時に確認しており、データ収集が行われている。こちらの評価スケールで有意差が出た方がはるかにインパクトが大きいにも関わらず、全く言及されてない。
→おそらく有意差が出ていない。が、薬剤への正確な評価のためMMSEについてのサブグループ解析の結果が待たれる。
⑤病的なアミロイドのアミロイドβを減少させる薬効も持つものは10種類以上知られているが、多くは臨床試験で認知症に対する有効性は否定的なデータがある。
もし有効性があるなら、効果が出る合理性が期待できるレカネマブ特異的な作用機序についてきちんと検証されるべき。
⑥投与コスト
現行の治療薬は内服もしくは外用薬と低コスト
薬価に関する情報見当たらず、費用対効果も検証が期待される
⑦専門家の反応
前回のアデュカヌマブ同様に懐疑的、サブグループ解析の結果待ちというのが大勢を占める。
⑧現時点での印象
データ開示の程度からして、たいした効果がない薬と製薬会社サイドは認識していると推察される。一般的な認知症評価基準のMMSEのデータは存在しているのに2022/11/22時点では公表されてない→治療群と非治療群で統計学的な有意差が出なかったと思われる。
試験の組み方(主要評価項目にも副次評価項目にもMMSEが含まれていない)からしても、たいした効果がない薬と製薬会社サイドは認識していると推察される。
その根拠は、現行の治療薬(既存薬)と治療効果を比較していないこと。現行の治療薬であるアリセプト(エーザイ)、メマリー(第一三共)、レミニール(ヤンセンファーマ)、イクセロン(ノバルティスファーマ)のいずれとの比較検討もなされていない。
当然、既存薬に勝る有効性を証明した方が、インパクトがはるかに大きいし、はるかに大きな売り上げが見込める。第2相試験で従来薬に勝る有効性を出せない見込みがあったと推察している。
⑨認知症学会にて(11/27追記)
レカネマブ第2相臨床試験の概要と第3相試験の基礎データ(公開データ)を見る機会あり
【背景因子としてデータを取っているMMSEに関して結果に有意差はあったか?】との質問あり
【認知症の程度において差はなかった】と質問をはぐらかすプレゼンター(エーザイ社員)、詰め寄る質問者に対して、
【MMSEを含んだサブグループ解析の結果は公表予定なし、CDR-SB/MMSE等を加味した複合スケールでの結果を公表する】と聞こえてきました。
【日本認知症学会にて】
上記と重複しますが、レカネマブ第3相試験の基礎データ(すでに公開されているデータ)の発表(エーザイ社員による発表)がありました。
質問:背景因子としてデータを取っているMMSEに関して結果に有意差はあったか?
回答:認知症の程度において差はなかった(はぐらかす)。
質問者がさらに突っ込んだところ、【MMSEについてのサブグループ解析の結果は公表予定なし、CDR-SB/MMSE等を加味した複合スケールでの結果を公表する、複合スケールではいい結果が出た】と聞こえてきました。
複合評価スケールは、製薬企業各社が臨床試験のために開発していて、直後にEli Lillyからも発表がありました。通常の評価スケールではでない差を拾い上げるためのツールです。
下目線ですが、複合スケールでいい結果が出たとの発言が気になりました。
【レカネマブ治験中の死亡例の報道】
レカネマブの臨床試験に参加していた65歳女性の死亡例が報道されました。
抗凝固薬(不整脈や静脈血栓症に対して内服する薬)投与開始後に致命的な脳出血を起こして、亡くなったとのことです。臨床試験は、試験期間中に起きたことをすべて、有害事象として報告する義務があり、総合的に勘案して臨床試験との関連性の有無が判断されます。治験対象者が高齢で他の疾患を併発する可能性があり、併用薬の性質からすると、何らかの原因で脳出血を起こして抗凝固薬のために、出血が致命的な程度まで拡大したと推察されます。レカネマブの効果については懐疑的ですが、この報道内容からレカネマブの副作用である可能性は低いと考えれます。
https://www.bnnbloomberg.ca/biogen-falls-on-report-patient-died-in-partner-s-alzheimer-trial-1.1851898
【今後のスケジュール】
繰り返しになりますが、以下の通りです。
それにあわせて更新していきます。
2022/11/29 16:50~(米国太平洋標準時)日本時間11/30 午前9:50~
海外学会で詳細データ公表予定(欧州ではなくて米国の学会です)
LIVE link https://clarityad-ctad.us.chime.live/
2023/1/6 までにFDAの審査結果が公表予定
【アデュカヌマブの際のリリースと株価動向】
エーザイからのリリースと株価動向を時系列で書きます。
主にアデュカヌマブですが、一部レカネマブ(今回の製品)のリリースも含まれます。
そもそも、アデュカヌマブの臨床第3相試験は中止から一転、EMERGEでのみ主要評価項目を達成しましたが、同一薬剤での2本の臨床試験で主要評価項目の結果が異なり、エビデンスを監督局がどのように評価するかが注目されていました。(https://www.mixonline.jp/tabid55.html?artid=70136)
ENGAGE(301)試験:主要評価項目を達成できず、中止になった際にも達成の見込み無しと判断されていた。開始後に2度プロトコルが変更され、より多くの高用量群の患者を組み込めるようになった。
EMERGE(302)試験:高用量群のみで主要評価項目を達成、中止になった際には達成の見込み無しと判断されていた。開始後に2度プロトコルが変更され、より多くの高用量群の患者を組み込めるようになった。
PRIME(103)試験:アデュカヌマブの臨床試験第1相
※301/302試験の結果が異なることに関して、エーザイ/Biogen社は、遅れて開始したEMRGE試験の方が高用量群に組み込まれる患者比率が高いことが影響しているとコメント。
2019年10月22日(火)
休場中のリリース(10月22日は2019年のみ祝日:即位礼正殿の儀)
第3相臨床試験(ENGAGE/EMERGE)の結果を受けて、FDAと相談の結果、2020年の早い時期にFDAに承認申請予定
※ENGAGE(301)試験は主要評価項目を達成できず、有効性に関して否定的な結果が出ていました。
10月23日(水)ストップ高
10月24日(木)ストップ高
https://www.eisai.co.jp/news/2019/news201979.html
2020年7月8日(水)
FDAにPriority Review(優先審査)申請
7月9日(木) 株価GU
2020年8月7日(金)
FDAから優先審査に指定
8月11日(月)GU
2020年10月30日(金)
欧州医薬品庁に承認申請受理される
(最終結果は各国の監督局への承認非推奨)
11月2日(月)上昇
FDAが11月4日(時刻不明)に、「承認をサポートする有効性についてのエビデンスを提出した」との肯定的な所感を示した。
11月4日(水)GU、上昇
11月5日(木)ストップ高
11月6日(金)GU
2020年11月7日(土)(日本時間;諮問委員会は米国で行われた)
・EMERGE(302)試験の結果(否定的なもの;中止後に再開、高用量群のみで主要評価項目を達成、同薬剤のもう一つの第3相試験では主要評価項目は未達成であると事前に知られていた)独立でのエビデンスとしての意義に関するFDA諮問委員会からの意見
EMERGE(302)試験単独(ENGAGE(301)試験を考慮せずに)でエビデンスとして有用であることには、賛成1、反対8、保留2
※EMERGE/ENGAGE試験はともに主要評価項目達成できない可能性が高いとの中間解析結果から一旦は第3相試験が中止になっており、その後に症例を追加しての解析でEMERGE(302)は高用量群のみで主要評価項目を達成、ENGAGE試験(301)は低用量/高用量群ともに主要評価項目は達成できませんでした。
・PRIME(103)試験がアデュカヌマブの有効性の裏付けとなるエビデンスを示しているかについては賛成0、反対7、保留4
・103試験の結果およびアルツハイマー病の病態生理に対する薬力学的効果に関するエビデンスとともに、301試験および302試験の探索的解析による理解に基づき、302試験をアデュカヌマブのアルツハイマー病に対する有効性に関する主要なエビデンスとみなすことができるかについては賛成0、反対10、保留1
11月9日(月)GD
2020年12月10日(木)
日本におけるアデュカヌマブの承認申請
12月11日(金)大きな動きなし
https://www.eisai.co.jp/news/2020/pdf/news202083pdf.pdf
2021年3月5日(金)
アデュカヌマブおよびレカネマブ(今回の製品)に関するデータを国際学会で発表
3月8日(月)大きな動きなし
2021年6月8日(火)
FDAで上市後に追加データ収集、提出することを条件に承認される
(一般的に製薬会社が自主的に行う第4相:市販後調査に相当するものに関して義務を課した異例の承認)
6月8日(火)ストップ高
6月9日(水)ストップ高
2021年11月4日(木)
米国学会でレカネマブ(今回の製品)の第2相臨床試験の結果を発表
11月5日(金) 大きな動きなし
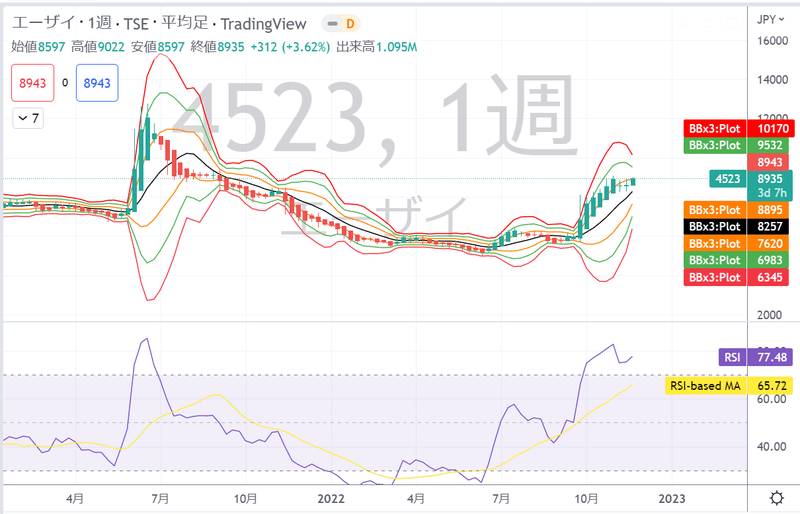
【株価とオシレーター】
2021/6/18 株価12075円 日足RSI:88.9
2022/11/4 株価8821円 日足RSI:79.4
2022/11/22株価9051円 週足RSI:78.2
2022/11/25株価9468円 日足RSI:72.98 週足RSI:79.04


この記事が気に入ったらサポートをしてみませんか?
